68例年龄≥70岁乳腺癌患者术后接受辅助化疗的安全性分析
2022-07-09吕剑虹李俏张金涛侯立杰杨阳冯华超
吕剑虹,李俏,张金涛,侯立杰,杨阳,冯华超
1北京市朝阳区三环肿瘤医院内科,北京 100122
2国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院内科,100021
乳腺癌是严重威胁中国女性生命健康的恶性肿瘤之一,2020年,乳腺癌新发病例已超越肺癌,达230万例,发病率居所有恶性肿瘤首位,约为11.7%[1]。年龄是乳腺癌的最重要危险因素,据统计,超过30%的乳腺癌患者的发病年龄超过70岁,且随着人类平均寿命的增长,老年乳腺癌患者的发病率和病死率日趋升高[2-3]。与年轻患者相比,老年乳腺癌患者的临床症状有其独特之处,如老年乳腺癌的生物学特性较好,雌激素受体(estrogen receptor,ER)和孕激素受体(progesterone receptor,PR)阳性率高,人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)阳性率低,表现为肿瘤进展慢、低增殖、侵袭能力弱等特点。上述因素使临床是否对老年乳腺癌患者进行辅助化疗一直存在较大争议,特别是目前绝大多数辅助化疗相关的临床试验的纳入、排除标准中均排除了年龄≥70岁的患者,因此,有必要对年龄≥70岁患者的辅助化疗资料进行分析和总结,以期指导临床实践。本研究分析年龄≥70岁、术后接受辅助化疗的乳腺癌患者的临床特征以及辅助化疗的耐受性和安全性,现报道如下。
1 资料与方法
1.1 一般资料
选取2011年11月至2020年11月北京市朝阳区三环肿瘤医院收治的年龄≥70岁术后接受辅助化疗的乳腺癌患者。纳入标准:①均经中国医学科学院北京协和医学院肿瘤医院病理科确诊为乳腺癌;②HER2表达阳性指,免疫组化显示HER2(+++)或荧光原位杂交实验证实存在HER2基因扩增;③均为女性,年龄≥70岁;④术后接受辅助化疗;⑤病历资料完整,如一般资料、合并症、实验室检查结果、病理类型、临床分期、受体表达情况、化疗方案及剂量、不良反应发生情况。排除标准:①合并其他原发肿瘤;②合并严重心、肝、肾功能不全;③术前影像学检查结果提示存在可疑远处转移。依据纳入和排除标准,本研究共纳入68例乳腺癌患者,年龄70~79岁,中位年龄72岁。本研究经医院伦理委员会批准通过,所有患者均知情同意并签署知情同意书。
1.2 治疗方案
所有患者均接受手术治疗,其中55例患者行乳腺癌改良根治术,9例患者行保乳手术+前哨淋巴结活检术,3例患者行单纯乳腺切除术+前哨淋巴结活检术,1例隐匿型乳腺癌患者行腋窝淋巴结清扫术。25例患者术后接受放疗,包括5例保乳手术患者,20例乳腺癌改良根治术后合并腋窝淋巴结转移患者(其中3例患者肿瘤直径≥5 cm,16例患者腋窝淋巴结≥4个,1例为三阴性乳腺癌患者且淋巴结转移3个)。所有患者均接受术后辅助化疗,包括蒽环类化疗方案22例,其中环磷酰胺+表柔比星或吡柔比星序贯紫杉醇+曲妥珠单抗1例,环磷酰胺+表柔比星或吡柔比星序贯紫杉醇8例,环磷酰胺+表柔比星3例,表柔比星+紫杉醇10例;非蒽环类化疗方案46例,其中多西他赛+卡铂+曲妥珠单抗3例,紫杉醇/多西他赛+卡铂18例,多西他赛/紫杉醇+环磷酰胺15例,紫杉醇+曲妥珠单抗5例,紫杉醇单药4例,卡培他滨单药1例。41例ER和(或)PR表达阳性患者接受芳香化酶抑制剂治疗。
1.3 不良反应评价标准
采用美国国家癌症研究所常见不良反应事件评价标准(National Cancer Institute common toxicity criteria,NCICTC)4.0评估患者的不良反应发生情况。
1.4 随访
采用电话随访的方式对患者进行随访,随访8~96个月,中位随访37个月,随访时间截至2021年12月,以疾病复发、远处转移、死亡为随访终点,记录患者的生存及复发情况,无失访患者。无病生存期(disease-free survival,DFS)指手术日起至肿瘤首次复发转移时间或因其他原因死亡的时间,疾病复发包括局部复发、区域性复发、远处转移、任何原因导致的死亡,以最先出现的时间为准,复发风险分级根据《中国抗癌协会乳腺癌诊治指南与规范(2021年版)》[4];总生存期(overall survival,OS)指手术当日至任何原因导致死亡的时间或末次随访的时间。
1.5 统计学方法
采用SPSS 19.0软件对所有数据进行统计分析,计量资料以均数±标准差(±s)表示;计数资料以例数和率(%)表示,组间比较采用χ2检验;采用Kaplan-Meier法绘制生存曲线,组间比较采用Logrank检验;以P﹤0.05为差异有统计学意义。
2 结果
2.1 临床特征
68例乳腺癌患者均为女性,年龄70~79岁,中位年龄72岁;美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)体力状况(performance status,PS)评分:0分10例,1分58例;合并症:高血压36例,糖尿病17例,冠心病8例;以乳腺肿物为首发症状58例,体检发现4例,乳腺皮肤呈橘皮样改变3例,乳头溢液3例;病理类型:浸润性导管癌61例,浸润性小叶癌4例,其他3例;美国癌症联合委员会(American Joint Committee on Cancer,AJCC)第 7版临床分期[5]:Ⅰ期 8例,Ⅱ期 22例,Ⅲ期38例;组织学分型:Luminal型41例(其中Luminal B型HER2阳性6例),HER2过表达型9例,三阴性乳腺癌18例;N分期:N0期16例,N1期(1~3个淋巴结转移)22例,N2期(4~9个淋巴结转移)20例,N3期(≥10个淋巴结转移)10例;脉管内癌栓30例;神经侵犯15例;危险程度分级:高危41例,中危27例,低危0例。
2.2 辅助化疗完成情况
68例乳腺癌患者中,按计划完成化疗63例,中断化疗5例(仅治疗1个周期即中断化疗3例,治疗2个周期后中断化疗2例;化疗中断原因:骨髓抑制不能耐受3例,房颤1例,下肢静脉血栓1例)。68例乳腺癌患者化疗周期为1~12个,中位化疗周期6个,按所有化疗周期计算,紫杉醇的标准剂量强度(dose intensity,DI)为每周58.3 mg/m2,实际DI为每周(56.1±2.7)mg/m2,相对剂量强度(relative dose intensity,RDI)为96.2%;多西他赛的标准DI为每周25 mg/m2,实际DI为每周(24.6±1.49)mg/m2,RDI为95.8%;表柔比星的标准DI为每周25 mg/m2,实际DI为每周(24.6±1.49)mg/m2,RDI为95.8%。13例患者因不良反应减量和延迟化疗,其中2例患者因Ⅱ级肝功能减退减量,11例患者因Ⅲ~Ⅳ级骨髓抑制减量;12例患者减量20%,1例患者累计减量40%(2次减量);7例因骨髓抑制延迟化疗,2例因肝功能减退延迟化疗,延迟时间5~7天。
2.3 不良反应发生情况
老年乳腺癌患者辅助化疗导致的血液学毒性主要表现为中性粒细胞减少和白细胞减少,对血小板的影响较小;非血液学毒性主要表现为不同程度的恶心呕吐、肝功能损伤、周围神经毒性和心脏毒性;均未出现非预期的不良反应和不良反应相关死亡。68例患者中9例患者接受了曲妥珠单抗联合化疗,1例患者出现心电图改变,1例患者出现心律失常,无左室射血分数(left ventricular ejection fraction,LVEF)下降﹥10的患者。(表1)

表1 乳腺癌患者术后辅助化疗的不良反应发生情况
2.4 蒽环类化疗方案与非蒽环类化疗方案不良反应发生情况的比较
68例乳腺癌患者中,蒽环类化疗方案22例,非蒽环类化疗方案46例,不同化疗方案患者血液学毒性比较,差异均无统计学意义(P﹥0.05);非血液学毒性方面,蒽环类化疗方案患者Ⅱ~Ⅲ级恶心呕吐、心电图改变发生率均明显高于非蒽环类化疗方案患者,差异均有统计学意义(P﹤0.01)。(表2)
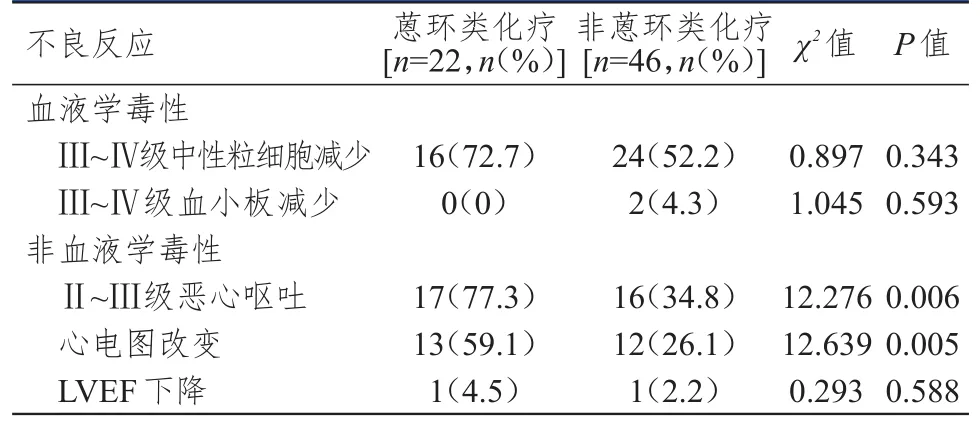
表2 蒽环类化疗方案与非蒽环类化疗方案患者不良反应发生情况的比较
2.5 预后生存情况的比较
68例乳腺癌患者随访8~96个月,中位随访37个月,复发转移19例(1例局部复发;17例转移;1例同时存在局部复发和转移,转移部位按顺序排列);死亡16例,均为肿瘤相关性死亡,所有患者均未达到中位DFS和OS,2年无病生存率、2年总生存率分别为83.5%、94.1%(图1、图2)。中断化疗的5例乳腺癌患者随访期间均未出现复发转移及死亡;13例化疗减量患者中,复发转移3例,死亡3例;化疗未减量的55例患者中,复发转移15例,死亡13例;化疗中断与化疗未中断患者2年无病生存率及2年总生存率比较,差异均无统计学意义(P﹥0.05);化疗减量与未减量患者2年无病生存率及2年总生存率比较,差异均无统计学意义(P﹥0.05)。
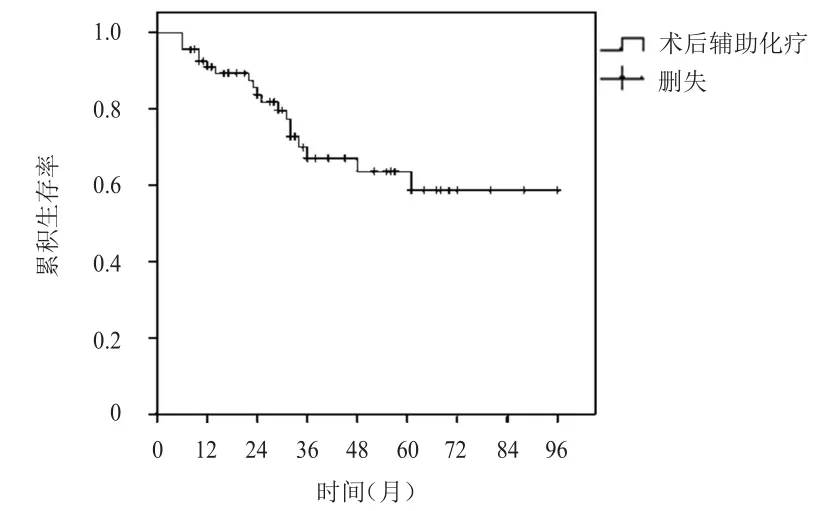
图1 68例年龄≥70岁术后接受辅助化疗的乳腺癌患者的DFS曲线
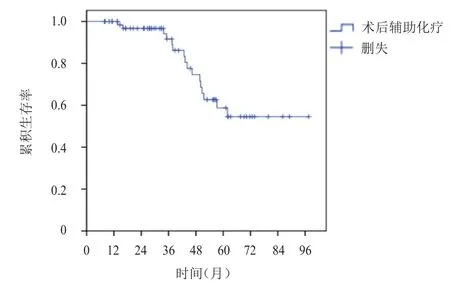
图2 68例年龄≥70岁术后接受辅助化疗的乳腺癌患者的OS曲线
3 讨论
老年乳腺癌患者常合并心脑血管疾病、糖尿病、高血压等基础疾病,对化疗不良反应心存恐惧,对生存的预期下降,且由于经济压力及家庭负担较重,老年乳腺癌患者接受抗肿瘤治疗的意愿较差。但随着年龄的增长,乳腺癌的发病风险显著提高,老龄化使老年乳腺癌的发病例数显著升高[6]。研究显示,30%以上的乳腺癌新发病例为70岁以上的老年患者,与年轻患者相比,老年乳腺癌患者的组织学分级和HER2表达水平均较低,激素受体表达水平相对较高,肿瘤细胞增殖指数较低[7]。但老年患者的治疗意识不强,早诊早治率不高,就诊时肿瘤体积已经较大、临床分期偏晚,老年患者接受规范抗肿瘤治疗的比例降低,使老年乳腺癌患者的病死率更高,预后更差。Reddy等[8]回顾性分析139例≥70岁乳腺癌患者的病历资料,结果显示,腔隙型(Luminal型)、HER2过表达型及三阴性乳腺癌患者的比例分别为79%、12%和9%,其中40%的老年患者腋窝淋巴结阳性,但只有16%的患者接受了术后辅助化疗,35%的HER2阳性患者接受了曲妥珠单抗辅助治疗,因此,尽管所有激素受体阳性患者均接受了内分泌治疗,但辅助化疗和靶向治疗不足也导致老年患者的2年总生存率低于50~69岁患者(86%vs92%,P=0.047)。随着抗肿瘤药物和缓和医疗的发展,化疗的疗效和安全性不断提高,重新评价老年乳腺癌患者辅助化疗的安全性和耐受性,对提高老年乳腺癌患者对治疗的信心、改善预后至关重要。
本研究共纳入68例≥70岁的乳腺癌术后患者,其中36例合并高血压,17例合并糖尿病,8例合并冠心病,但患者一般情况良好,ECOG PS评分均为0~1分,化疗前的血常规和肝肾功能大致正常。紫杉类和蒽环类化疗药物的初始RDI均超过标准RDI的95%,绝大多数患者(63/68,92.6%)完成辅助化疗,仅13例患者因不良反应减量,仅1例患者2次减量,7例因骨髓抑制而延迟化疗,2例因肝功能减退而延迟化疗,5例患者因不良反应而中断治疗。化疗中断的5例患者随访期间均未出现复发转移及死亡;化疗减量的13例患者中,3例患者出现复发转移,3例死亡;未减量的55例患者,15例患者出现复发转移,13例死亡。既往研究表明,减量后化疗剂量RDI的降低会对DFS、OS造成影响[9],本研究发现,化疗中断与化疗未中断患者2年无病生存率及总生存率比较,化疗减量与未减量患者2年无病生存率及总生存率比较,差异均无统计学意义(P﹥0.05),这可能与随访时间短、样本量少有关。本研究结果显示一般状况良好的老年患者即使合并其他疾病,绝大多数患者也可以耐受辅助化疗。
多项研究结果证实,曲妥珠单抗术后辅助治疗1年可以显著改善HER2阳性早期乳腺癌患者的预后,但曲妥珠单抗可以提高心力衰竭的发生率[10-11]。两项针对HER2阳性早期老年乳腺癌患者的回顾性研究显示,接受曲妥珠单抗联合化疗患者的4年无病生存率和总生存率均为99%,心脏毒性仅为3.2%;与多柔比星化疗方案相比,紫杉类化疗方案的不良反应更轻微,患者的耐受性更好[12-13]。本研究68例患者中HER2阳性15例,其中9例患者接受了曲妥珠单抗联合化疗,1例患者出现心电图改变,1例患者出现心律失常,无LVEF下降﹥10的患者,无心脏毒性引起的相关死亡。
本研究中最常见的Ⅲ~Ⅳ级不良反应为血液学毒性,表现为中性粒细胞减少和白细胞减少,非血液学毒性主要为恶心呕吐和心电图改变。所有患者均未出现非预期的不良反应和化疗相关性死亡。本研究结果显示,蒽环类化疗方案患者Ⅱ~Ⅲ级恶性呕吐、心电图改变发生率均明显高于非蒽环类化疗方案患者,差异均有统计学意义(P﹤0.01)。
术后辅助化疗可提高乳腺癌患者的生存率,降低复发率和病死率,但目前尚缺乏大规模随机临床研究来证明化疗在老年患者中的作用,对于老年患者辅助化疗的方案、剂量及疗程也没有明确的指南推荐[2]。SEER的数据显示,辅助化疗可以降低约15%激素受体表达阴性的老年乳腺癌患者的病死率,其中,淋巴结阳性、高分化和肿瘤直径较大的患者从辅助化疗中获益最多,推荐老年患者采用蒽环类和(或)紫杉类药物化疗[14]。本研究68例患者中,Ⅲ期患者约占60%,三阴性乳腺癌患者占比超过25%。说明预后仍是影响患者是否选择辅助化疗最重要的影响因素,患者的2年总生存率为94.1%,不低于文献报道的50~69岁的乳腺癌患者(总生存率为92.0%),表明对于分期较晚及分型较差的老年乳腺癌患者术后接受辅助化疗仍能在一定程度上改善患者的生存情况。
本研究68例患者按危险程度分级,均为中高危患者,包括高危41例,中危患者27例,中危患者中7例为三阴性乳腺癌,6例患者为HER2(+),3例患者为T1CN0M0期、激素受体(+)HER2(-)、Ki-67指数均﹥50%,这3例患者的手术时间为2016—2017年,ER、PR虽有表达但表达率较低(﹤20%),考虑内分泌化疗获益不明显,与患者充分沟通后给予化疗;剩余11例患者均存在1~3个淋巴结转移,肿瘤直径﹥2 cm,部分﹥5 cm,或合并脉管内癌栓、神经侵犯等高危因素,与患者沟通后给予化疗。因本研究为回顾性研究,当时21基因检测等费用或可及性部分患者不能接受,按2021年美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南[15]及中国抗癌协会乳腺癌诊治指南与规范[4],1~3个淋巴结转移的Luminal型患者,若基因检测为低危,可豁免化疗。
综上所述,随着生活及医学水平的提高,老年患者预期寿命不断延长,年龄不应该成为决定老年患者是否接受辅助化疗的关键因素,本研究结果显示一般状况良好的老年患者对术后辅助化疗的安全性和耐受性良好,临床上应根据老年患者的临床特征、复发转移风险、预期寿命、合并的基础疾病等来制订个体化治疗方案,旨在为患者带来临床获益并最大程度地规避治疗风险。
