盐碱土加沙后接种溶磷菌对绿豆根际土壤细菌多样性的影响
2022-07-09周妍王丽娜张美珍王思文刘权殷奎德
周妍,王丽娜,张美珍,王思文,刘权,殷奎德
(1.黑龙江八一农垦大学生命科学技术学院,黑龙江大庆 163319;2.黑龙江省农业科学院大庆分院,黑龙江大庆 163316)
盐碱土中有机质含量少,肥力低,普遍缺磷,导致作物不能生长[1]。中国盐碱土面积约有1亿hm2,占全球盐碱地面积的10%[2]。随着人口数量增加以及耕地面积的减少,盐碱地的治理和改良越来越受到人们的重视。一般来说,土壤中微生物种类和数目与土壤肥力成正相关[3]。土壤微生物作为土壤肥力的重要指标,数量巨大,种类繁多,其与植物根系相互作用、相互促进,与植物的生长、繁殖和代谢活动密切相关,是土壤中最活跃的组成成分,在土壤功能方面发挥重要作用。土壤盐碱化可改变土壤理化性质,直接影响微生物的生存[4],也可以间接影响土壤微生物的生境,使微生物的种群、数量和活性等受到损害,导致土壤微生态失衡,从而影响作物产量。
相关研究表明,根际微生物数量多、生长繁殖快、与根系的相互作用强、代谢活性强,对土壤有机物质的分解、氮素的循环、矿质元素的转换以及植物营养、生长和发育、植物病害等都有重要的影响[5,6]。根际微生物包括原生动物、真菌、细菌等,其中细菌在根际微生物中占有最多的类群,细菌生长快,代谢旺盛,在一定程度上反映了土壤质量及微生物群落的稳定性[7]。细菌是根际土壤的重要组成之一,发挥着重要的生态功能,在维持土壤结构和养分上有着特定的作用。
杨剑芳等[8]在我国不同地区的盐碱土中分离获得48株细菌,耐盐碱能力较强,能够将难溶性元素如P、K转化为植物可以吸收利用的可溶性元素,其代谢产物多糖和有机酸可有效抑制病原菌的生长,应用前景广阔。溶磷微生物不仅能增加土壤中可溶性磷的含量,也能在植物根际周围形成优势菌群,增强植物抗病能力[9]。余旋等[10]研究表明,施用溶磷菌剂能有效提高美国山核桃根际区域的微生物数量,增强土壤磷酸酶及脲酶活性。因此,从土壤中筛选高效溶磷微生物生产生物肥料,可有效促进植物根系生长,减少环境污染,带来更多经济效益以及生态效益。Shi等[11]的研究发现青蒿根际细菌和真菌相互作用可以促进植物生长,同时能影响细菌和真菌的群落多样性。目前,对溶磷菌剂的研究主要集中在对作物生长、营养吸收及产量和品质的影响上,而对根际土壤微生态环境的影响以及菌株耐盐碱方面的报道很少。本研究从盐碱草原上碱草和碱蓬根际土中筛选分离得到3株具有溶磷功能的菌株,并利用盆栽试验探讨其溶磷作用以及对绿豆根际微生物群落多样性的影响,以期为进一步获得高效溶磷菌、研制耐盐碱溶磷生物制剂产品奠定基础。
1 材料与方法
1.1 试验材料
1.1.1 种植土 于2020年7月10日在黑龙江省大庆市龙凤区的草原上取土,植被是羊草,挖取0~20 cm土壤,去除草根等杂物备用。盐碱土碱解氮(AN)、有效磷(OP)、速效钾(AK)含量分别为283.00、20.30、382.00 mg/kg,有机质(SOM)含量32.70 g/kg,可溶性盐(S)含量0.16%,pH=8.70。取河沙用水清洗3遍后烘干,将盐碱土与沙子1∶1等体积混匀装入盆中,每盆混合土7 kg,用于绿豆的种植。
1.1.2 营养液 Hoagland全营养液按照陈超等[12]的方法配制,缺磷营养液是将Hoagland正常营养液中的磷酸铵换成氯化铵,其它成分不变。1.1.3 绿豆品种 试验用绿豆品种为“小明绿”,由国家杂粮工程技术研究中心提供。
1.1.4 菌种来源 试验菌株JC8、JC11和JP8由本实验室前期从大庆盐碱草原上植物根际土筛选获得,菌株JC8为假单胞菌(Pseudomonas sp.),JC11为不动杆菌(Acinetobacter sp.),JP8为微杆菌(Microbacterium sp.),经过前期测定发现JC8、JC11和JP8的溶有机磷量分别达414.18、482.86、428.30 mg/L,经耐盐碱试验发现3株菌均能在pH=11、氯化钠浓度为11%的培养基上生长。
1.2 试验方法
1.2.1 土壤理化性质测定 土壤pH值、碱解氮、有效磷、速效钾、有机质含量参照鲍士旦[13]的方法进行测定。
1.2.2 溶磷菌溶磷能力试验 用盐碱土和沙子混合作为绿豆盆栽用土,盆栽试验共设3个接菌处理和两个对照,接菌组分别为接种JC8(T1)、JC11(T2)、JP8(T3)菌株并浇灌缺磷营养液,对照CK1不接菌浇灌缺磷营养液,对照CK2不接菌浇灌全营养液。每盆种植绿豆30粒,在播种前一天施入菌液和营养液;播种17 d后再施入一次菌液和营养液。菌液制备按照Kwak等[14]的方法进行,菌液接种量为108cfu/g;Hoagland营养液稀释4倍浇灌。置于室外培养,正常浇水,种植35 d后统计植株的各项生长指标。
1.2.3 根际土壤细菌多样性分析 (1)土壤总DNA提取、扩增与测序:根际土壤总DNA提取、PCR扩增以及荧光定量参照向君亮等[15]的方法进行,切胶回收PCR产物,电泳检测后,采用Illumina HISeq平台进行测序。
(2)序列分析:测序完成后,在美吉云平台上进行数据处理,优化后的数据用QIIME进行质控过滤以及OTU聚类,完成后在Silva数据库中比对,对各个样本的OTU在自己分类等级上的群落组成进行注释。样本物种组成分析、Alpha多样性分析、Beta多样性分析等均在美吉I-Sanger云平台上进行。
1.3 数据处理与分析
使用Microsoft Excel 2010和SPSS 19.0软件进行数据分析,方差分析采用Duncan’s新复极差法和LSD法,采用Origin 8.5作图。
2 结果与分析
2.1 接菌后土壤理化性质
如表1所示,接菌后土壤pH 值显著下降(P<0.05));T3处理的可溶性盐含量与CK1相比显著下降(P<0.05);接菌处理均显著(P<0.05)增加了AN、OP、AK和SOM含量。
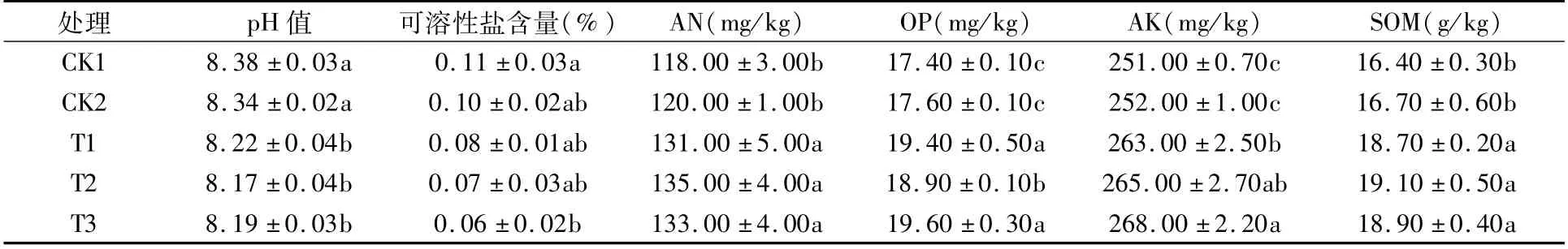
表1 不同处理土壤理化性质
2.2 溶磷菌溶磷作用
绿豆各项生长指标的测定结果如表2所示,接种溶磷菌后,绿豆幼苗的根长、植株干重和鲜重以及根干重和鲜重显著增加;与CK1相比,T1、T2、T3处理根长分别增加1.59、1.85、2.22倍,植株鲜重分别增加1.97、2.39、3.23倍,根鲜重分别增加2.40、2.80、4.60倍;T1、T2、T3处理与CK2相比根长分别增加72.05%、89.39%、1.14倍,植株鲜重分别增加87.76%、1.14倍、1.67倍,根鲜重分别增加2.40、2.80、4.60倍。表明接种溶磷菌后,土壤中难溶的磷酸盐被溶磷菌分解为可被利用的磷,显著改善绿豆在盐碱土中的生长状况,缓解了盐碱胁迫对绿豆生长的抑制作用,增强了绿豆对盐碱胁迫的抵抗能力。
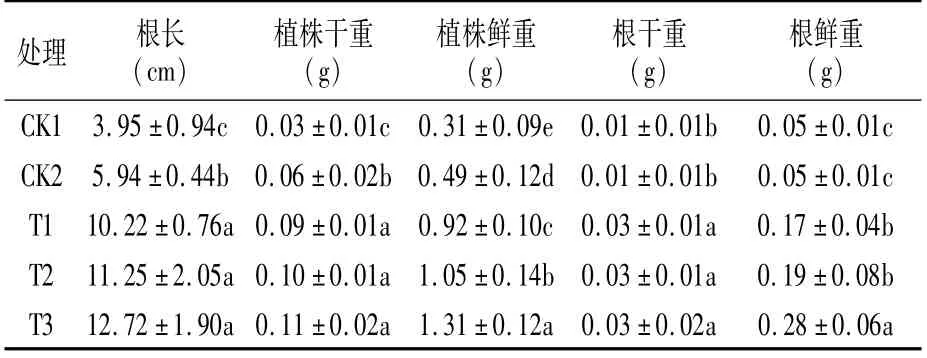
表2 溶磷菌对绿豆植株形态指标的影响
2.3 土壤细菌多样性分析
2.3.1 OTU分析 5组样本的OTU数目为T2>T3>T1>CK2>CK1(图1),说明接菌株JC11的绿豆根际土壤的细菌类群最为丰富,缺磷营养液培养的绿豆根际土壤细菌类群最少;CK1和CK2处理独有的OTU分别为24个和26个,T1、T2、T3处理独有的OTU分别为108、138、116个。综合看来,施用溶磷菌的绿豆根际土壤样品细菌数量同两对照相比差异较为明显。
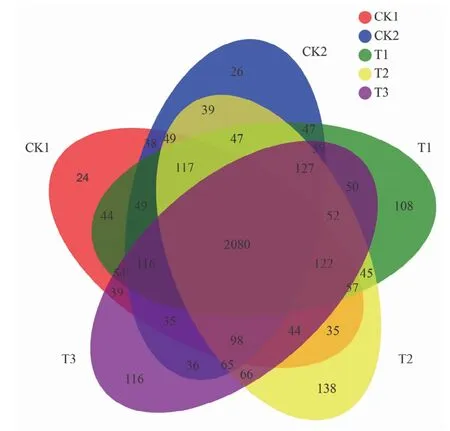
图1 土壤样品细菌OTU数量韦恩图
2.3.2 土壤样品Alpha多样性与Beta多样性 Alpha多样性分析反映微生物群落的丰富度和多样性。群落丰富度指数主要包括Chao 1指数和Ace指数,指数越大代表物种总数越多,丰富度越高。群落多样性指数包括Shannon指数和Simpson指数。Shannon指数反映了在群落中随机选择的个体的不确定性,指数值越高,不确定性越大,多样性越高;Simpson指数反映了优势种在群落中的地位和作用,其数值越大,说明群落多样性越低。
由表3看出,T1、T2、T3处理的Shannon指数均显著高于对照组,Simpson指数均显著低于对照组,说明接菌后物种群落多样性增加;Ace指数和Chao 1指数的趋势与Shannon指数相同,说明接菌处理后物种总数上升,群落丰富度提高。

表3 绿豆根际土壤样品Alpha多样性指数
Beta多样性分析结果(图2a)显示,两个主坐标分别解释了44.62%、25.20%的变异度,5组绿豆根际土壤样本之间距离相对较小,说明各组样本内部菌群结构较为一致;但对照与不同处理组分别在不同的象限,且存在着较大距离,说明对照与各处理在物种组成、相对丰度和系统发育关系上有着较大差异。从聚类分析图(图2b)中可以看出,各组样品分别聚类在一个大的分支上,说明组内样本的物种组成、相对丰度和系统发育相似,而组间差异较大。

图2 不同处理盐碱土中细菌组成PCoA(a)和聚类分析(b)
2.3.3 物种组成分析 门水平下细菌群落组成如图3所示,主要细菌门类有10个,分别为放线菌门(Actinobacteriota)、变形菌门(Proteobacteria)、酸杆菌门(Acidobacteriota)、绿弯菌门(Chloroflexi)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidota)、浮霉菌门(Planctomycetota)、粘球菌门(Myxococcota)、芽单胞菌门(Gemmatimonadota)以及Methylomirabilota。在所有样品中,放线菌门和变形菌门均为优势菌门,相对丰度占20%以上。溶磷菌剂施入增加了变形菌门、放线菌门、酸杆菌门、浮霉菌门、厚壁菌门、绿弯菌门和拟杆菌门的相对丰度,而芽单胞菌门、粘球菌门和Methylomirabilota的丰度下降。
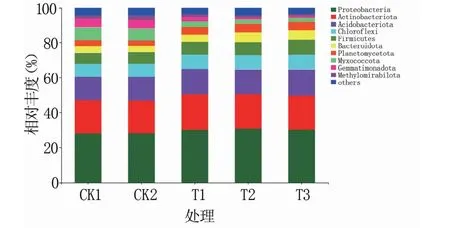
图3 绿豆根际土壤中门分类水平上的细菌群落组成
属水平下细菌群落组成结果如图4所示,共检测到30个属,施入菌剂增加了芽孢杆菌属(Bacillus)的相对丰度;在3个接菌组中发现了假单胞菌属(Pseudomonas)及不动杆菌属(Acinetobacter),而且T1组中假单胞菌属相对丰度较高。
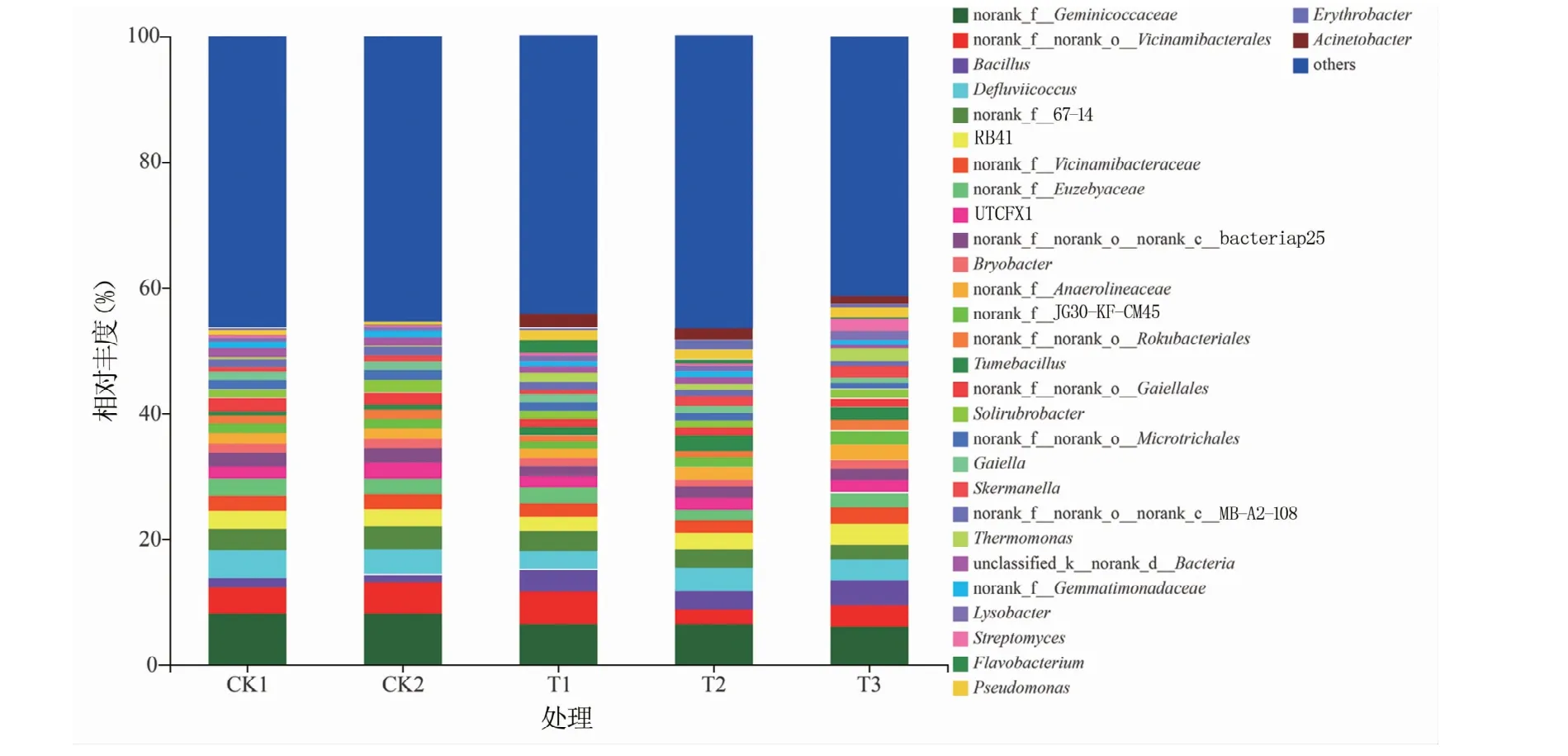
图4 绿豆根际土壤中属分类水平上的细菌群落组成
2.3.4 差异物种分析 LEfSe采用线性判别分析(LDA)检测接种溶磷菌与未接种菌的绿豆根际土壤样品之间丰度具有显著差异的群体或物种。如图5所示,共有65种细菌在不同组土壤样品中表现出明显的差异,LDA阈值为2.2。
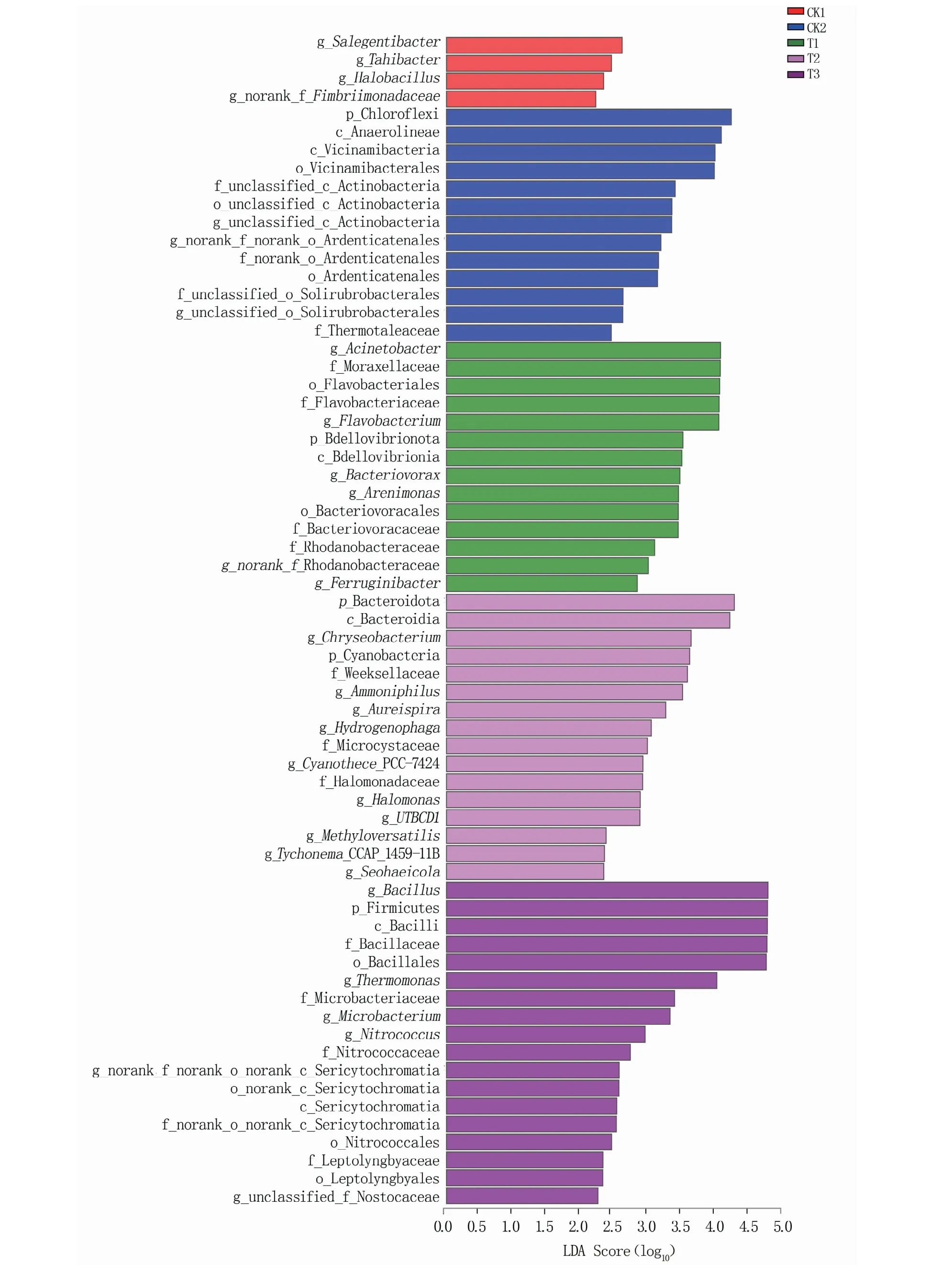
图5 差异物种LEfSe分析及LDA判别结果
在缺磷营养液的土壤中(CK1),共发现4个标志性细菌群落,包括g_Salegentibacter、g_Tahibacter、g_Halobacillus和g_norank_f_Fimbriimonadaceae;CK2处理土壤中发现13个标志性细菌群落,包括p_Chloroflexi、c_Anaerolineae、c_Vicinamibacteria、o_Vicinamibacterales等;接种菌株JC8的土壤中(T1)发现14个标志性细菌群落,包括g_Acinetobacter、f_Moraxellaceae、o_Flavobacteriales、p_Bdellovibrionota等;接种菌株JC11的土壤中(T2)发现16个标志性细菌群落,包括p_Bacteroidota、p_Cyanobacteria、g_Aureispira、f_Microcystaceae等;g_Bacillus、g_Thermomonas、f_Nitrococcaceae、o_norank_c__Sericytochromatia等18个标志性细菌群落在接种菌株JP8的土壤中(T3)聚集。
2.3.5 冗余分析 通过冗余分析(RDA)法研究了细菌群落结构组成与环境因子之间的关系,土壤理化性质包括可溶性盐含量、pH值、碱解氮、有效磷、速效钾和有机质。如图6所示,可溶性盐含量、pH值与碱解氮、有效磷、速效钾和有机质含量呈负相关;3组接菌处理中部分样本与碱解氮、有效磷、速效钾和有机质含量呈正相关,而两个对照组与碱解氮、有效磷、速效钾和有机质含量呈负相关。对环境因子与门水平下相对丰度前5的细菌之间的关系进行分析表明,放线菌门(Actinobacteriota)、酸杆菌门(Acidobacteriota)和绿弯菌门(Chloroflexi)与可溶性盐含量和pH值呈正相关,与土壤肥力指标呈负相关;而厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)与可溶性盐含量和pH值呈负相关,与土壤肥力指标呈正相关。
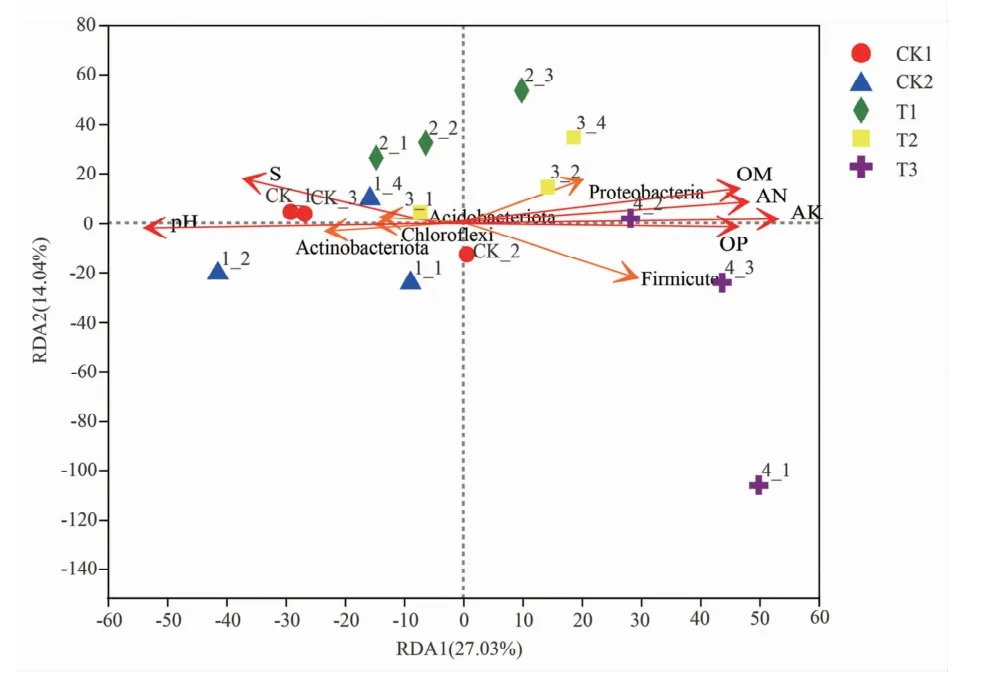
图6 土壤理化性质对菌群结构的影响
3 讨论与结论
盐碱土中的硫酸盐、氯化物、重碳酸盐等成分可对土壤物理结构、化学性质、作物生长等造成严重的不良影响;极大地破坏土壤的团粒密度、结构稳定性及渗透力,并且抑制土壤微生物的呼吸作用及β-葡糖苷酶、碱性磷酸酶等水解酶的活性[16],盐碱化问题已成为目前全球土壤利用最严重的问题之一。许多研究者为改良并合理利用盐碱地开展了广泛研究,施用微生物菌剂被认为是一种可以显著降低土壤pH值和盐含量,并提高盐碱地植物成活率的有效手段[17-20]。
刘环等[21]就耐盐碱菌株YM6对玉米幼苗生长的影响进行了研究,结果发现接种菌株后玉米幼苗地上及地下部分干重、鲜重以及株高均显著大于对照组。Majeed等[22]从小麦根际分离得到多株具有促生功能的菌,接种于植物后发现根长以及地上部生物量均显著增加。本研究在轻度盐碱土加沙混合后种植绿豆,缺磷营养液浇灌条件下接种溶磷菌株后绿豆生长良好,说明溶磷菌具有溶磷作用,并能增强绿豆耐盐碱能力,在盐碱胁迫下,绿豆幼苗根鲜重、干重以及植株干重、鲜重均显著提高。
微生物分泌代谢物可影响土壤结构形成,同时土壤结构的动态变化又间接说明了土壤微生物的活动状况[23,24]。本研究通过土壤接种溶磷菌株后细菌多样性的变化分析溶磷菌对土壤中原生微生物的影响,发现接种溶磷菌的根际土壤细菌群落结构以变形菌门、酸杆菌门和放线菌门为主,与Liu等[25]的结果一致。张智猛等[26]的研究发现不同含盐量的滨海盐土、内陆盐碱土和中等肥力非盐碱土壤样本微生物群落结构在纲水平存在明显差异,以变形菌门和放线菌门为主。Zhou等[27]的研究发现青藏高原退化草原土壤中细菌群落以放线菌门为主,其次是变形菌门。
土壤中变形菌、酸杆菌和放线菌具有重要作用,比如放线菌能产生多种生物活性物质、抗生素及具有潜在用途的极端酶,且能在极端环境中生长;变形菌可用于促进氮肥利用、植物病虫害防治、土壤修复和复杂污染物降解等;酸杆菌在土壤物质循环、活性代谢产物产生及与其它微生物互作中起到非常重要的作用。其它丰度较高的菌门还包括浮霉菌门、厚壁菌门和绿弯菌门等,这些细菌在土壤生态系统中具有重要作用,能够参与碳循环和能量循环等。盐碱土中可供微生物利用的营养物质很少,但寡营养细菌(浮霉菌门和厚壁菌门)却能从大气中摄取营养物质,利用大气中的少量碳源、氮源维持正常生长[28]。这说明寡营养细菌更适合在极端环境下生存。
冗余分析发现可溶性盐含量、pH值与碱解氮、有效磷、速效钾和有机质含量呈负相关,说明高pH值和可溶性盐含量会使土壤中养分含量降低;接菌的3组样本与碱解氮、有效磷、速效钾和有机质含量呈正相关,而两个对照组与之呈负相关,说明溶磷菌株能够分泌一些有机酸,降低土壤中可溶性盐含量和pH值;放线菌门、酸杆菌门和绿弯菌门与可溶性盐含量和pH值呈正相关,与土壤肥力指标呈负相关,说明其更耐盐碱环境,尤其是放线菌门具有较强的DNA修复能力和极端环境下的生存能力;而厚壁菌门和变形菌门与可溶性盐含量和pH值呈负相关,与土壤肥力指标呈正相关,在物种组成中发现接菌后盐碱土壤中的厚壁菌门和变形菌门相对丰度显著增加,说明其能在盐碱土中生长。综上说明土壤理化性质和养分情况是影响微生物群落结构的主要因素。
本研究通过盆栽试验证明3株耐盐碱高效溶磷菌对绿豆均有明显的溶磷促生特性;高通量测序后分析接菌土壤OTU数目、多样性指数、群落组成、差异物种并进行主坐标分析(PCoA)和冗余分析(RDA),发现接种溶磷菌株的土壤细菌群落多样性和丰富度更高,变形菌门和放线菌门是优势菌门,土壤理化性质影响细菌群落组成。
