黑曲霉拮抗细菌的筛选、鉴定和生防条件优化
2022-07-08徐晓裕史学伟
徐晓裕,李 甜,史学伟,王 斌
(石河子大学食品学院,新疆石河子 832000)
霉菌侵染是引起葡萄采后霉变腐烂的主要原因[1−2]。作为世界范围内的果蔬生产大国,我国每年有近8500 万吨果蔬因保鲜技术和设备的落后而腐烂变质,腐烂率高达20%~30%,给我国果蔬产业造成巨大的经济损失[3−4]。因此,在果蔬储存运输过程中采取一些有效的防治手段来延缓腐败变质就显得尤为重要。葡萄在运输、贮藏等过程中的挤压及机械伤口就极易引起黑曲霉(Aspergillus niger)的感染,即黑粉病,导致葡萄果实失去食用和商品价值[5−6]。长期以来,使用化学杀菌剂来防止果蔬的腐败变质一直被认为是最有效的方法,但是该方法存在着农药残留、环境污染和病原菌抗药性等诸多弊端,迫切需要新的安全方法来取而代之。因此,生物防治应运而生。生物防治是指选择对产品及人体不造成危害的微生物,利用微生物之间的拮抗作用来抑制病原菌生长的一种有效防治采后病害的新途径。
在微生物生命活动过程中,通过产生某种拮抗物质或改变自身的生长环境,达到阻碍其他微生物增殖的目的,人们将这类微生物统称为拮抗微生物[7−8]。目前,有研究发现劳伦隐球菌(Cryptococcus laurenii)对苹果采后灰霉病、梨的灰霉病和青霉病具有显著的防治效果[9−10]。高抗甜瓜品种内分离的枯草芽胞杆(Bacillus subtilis)Mg15 对甜瓜白粉病具有显著防治效果[11]。葡萄园筛选的枯草芽孢杆菌对酿酒葡萄灰霉病具有良好抑制作用[12]。寻找到有效的拮抗菌株是防治果蔬采后病害的一种高效、环保、经济的方法,用生物防治技术取代传统的化学药物防治也是目前果蔬病害防治的研究热点[6,13−14]。虽然有研究表明黑粉病是葡萄贮藏过程中产生的主要病害[15],但目前关于生物防治黑粉病的报道还很少。本文旨在通过从新疆葡萄土壤中分离筛选获得对黑曲霉具有抑制作用的拮抗细菌,明确拮抗菌株产抑菌活性物质的最佳培养条件,以期为由黑曲霉引起采后病害的生物防治提供依据。
1 材料和方法
1.1 材料与仪器
黑曲霉(Aspergillus niger)从玛纳斯中信国安葡萄园中的葡萄表皮分离,现保存于石河子大学食品学院葡萄与葡萄酒工程中心实验室;马铃薯葡萄糖琼脂(PDA)培养基 北京陆桥生物技术有限公司;酵母膏胨葡萄糖(YPD)、琼脂培养基(葡萄糖20 g/L、酵母膏10 g/L、蛋白胨20 g/L、琼脂20g/L)、LB 培养基(胰蛋白胨10 g/L、酵母浸粉5 g/L、氯化钠10 g/L)北京奥博星责任有限公司。
MLS-3750 型高压灭菌锅 上海申安医疗器械厂;FX-2000FO 电子天平 济南欧莱博科学仪器有限公司;FE20 基础型 pH 计 上海一恒科学仪器有限公司;SW-CJ 超净工作台 美国伯腾仪器有限公司;CX41RF 光学显微镜 深圳市华显光学仪器有限公司;DNP-9272 型恒温培养箱 上海一恒科学仪器有限公司。
1.2 实验方法
1.2.1 样品采集 用五点取样法在玛纳斯中信国安的葡萄园中采取土壤样品,装入50 mL 无菌离心管中,储存于4 ℃冰箱备用。
1.2.2 拮抗菌的分离及筛选 采用平板稀释涂布法在LB 固体培养基上对土壤样品中的细菌进行分离,30 ℃培养2 d,并挑取不同形态的单菌落采用平板划线法纯化并编号保存备用。
以黑曲霉为指示菌,采用平板对峙法筛选拮抗细菌。抑菌直径(mm)=测量菌落直径(mm)-菌饼直径(mm),每个处理做三个平行[16]。
1.2.3 拮抗菌活体抑菌实验 选取新鲜无病害九成熟的鲜食葡萄,用体积分数为75%乙醇喷洒表面,并用无菌水清洗3 次后取出、晾干后用作反接实验。用灭菌牙签挑取纯化好的黑曲霉菌丝在葡萄果实腰部穿刺,并同时接入浓度为107CFU/mL 浓度的拮抗菌悬液,仅接入黑曲霉菌丝的葡萄果实作为对照,常温保存5 d,观察防治效果[17]。
1.2.4 拮抗菌的鉴定 形态学和生理生化实验:将拮抗菌株接种于LB 固体培养基上,30 ℃培养2 d 后观察菌落的大小、颜色和质地,表面及边缘的形状等菌落特征;再采用革兰氏染色法对其进行染色,在光学显微镜下进一步观察其染色情况和形态。依据《常见细菌系统鉴定手册》中芽孢杆菌属内特征进行生理生化鉴定[18−19]。
分子生物学:使用OMEGA 细菌基因组DNA提取试剂盒对菌株的DNA 进行提取,利用细菌通用引物27F(5′-AGAGTTTGA TCA TGGCTCAG-3′)和1492F(5′-AAGGAGGTGA TCCAACCGCA-3′)进行PCR 扩增。将所有提取的DNA 样品发送到Sangon Biotech 公司(中国上海)进行PCR 的扩增和产物测序。然后将测序所得的16S rDNA 测序结果在NCBI数据库中进行BLAST 序列比对分析以明确该菌株的种属关系,并使用MEGA-X 软件构建系统发育树[20]。
1.2.5 菌株生长曲线的测定 用接种环刮取活化好的单菌落接种于装有60 mL LB 液体培养基的250 mL锥形瓶中,培养温度为30 ℃,160 r/min 的摇床培养,每隔2 h 取样并在OD600nm下测定吸光度值。
1.2.6 发酵条件的优化
1.2.6.1 装液量对拮抗菌株发酵液抑菌活性的影响将拮抗菌的种子液以3%的接种量接种于含有40、60、80、100、120 mL LB 液体培养基的250 mL锥形瓶中,pH 为7,转速设置为160 r/min,置于30 ℃的条件下进行恒温振荡培养30 h 后,取样并测定发酵液的抑菌活性(方法同1.2.2),每个处理做三个平行。
1.2.6.2 接种量对拮抗菌株发酵液抑菌活性的影响将拮抗菌的种子液分别以1%、2%、3%、4%、5%的接种量接种于含有60 mL LB 液体培养基的250 mL 锥形瓶中,pH 为7,转速设置为160 r/min,置于30 ℃的条件下进行恒温振荡培养30 h 后,取样并测定发酵液的抑菌活性,每个处理做三个平行。
1.2.6.3 培养温度对拮抗菌株发酵液抑菌活性的影响 将拮抗菌的种子液以3%的接种量接种于含有60 mL LB 液体培养基的250 mL 锥形瓶中,pH 为7,转速设置为160 r/min,分别置于20、25、30、35、40 ℃的条件下进行恒温振荡培养30 h 后,取样并测定发酵液的抑菌活性,每个处理做三个平行。
1.2.6.4 培养时间对拮抗菌株发酵液抑菌活性的影响 将拮抗菌的种子液以3%的接种量接种于含有60 mL LB 液体培养基的250 mL 锥形瓶中,pH 为7,转速设置为160 r/min,置于30 ℃的条件下进行恒温振荡,分别培养20、25、30、35、40、45、50 h后,取样并测定发酵液的抑菌活性,每个处理做三个平行。
1.2.6.5 初始pH 对拮抗菌株发酵液抑菌活性的影响将拮抗菌的种子液以3%的接种量接种于含有60 mL LB 液体培养基的250 mL 锥形瓶中,pH 分别设定为5、6、7、8、9,转速设置为160 r/min,置于30 ℃的条件下进行恒温振荡培养30 h 后,取样并测定发酵液的抑菌活性,每个处理做三个平行。
1.2.6.6 转速对拮抗菌株发酵液抑菌活性的影响将拮抗菌的种子液以3%的接种量接种于含有60 mL LB 液体培养基的250 mL 锥形瓶中,pH 为7,转速分别设置为100、120、140、160、180、200、220 r/min,置于30 ℃的条件下进行恒温振荡培养30 h 后,取样并测定发酵液的抑菌活性,每个处理做三个平行。
1.2.7 正交试验 根据单因素实验结果,选取三个对抑菌效果影响显著的因素设计L9(34)正交试验(表1),确定最佳的培养条件。
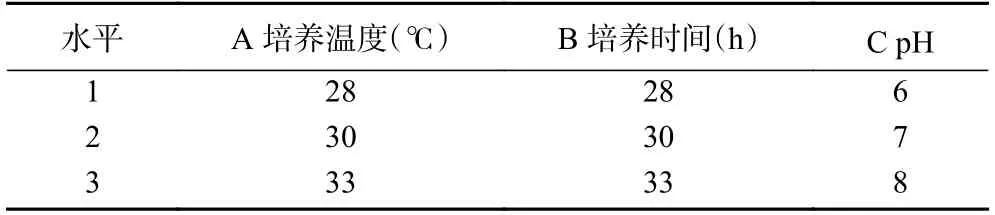
表1 L9(34)正交试验因素及水平Table 1 L9 (33) orthogonal experiment factors and levels
1.2.8 验证实验 采用确定的最佳培养条件对菌株的抑菌直径进行测量,验证其抑菌效果。
1.3 数据处理
采用SPSS 软件进行数据分析和差异显著性检验(P<0.05),采用Minitab 14.0 进行单因素和正交试验方差分析,利用origin 2021 软件作图。
2 结果与分析
2.1 拮抗细菌的分离
从采集到的土壤上共分离获得60 株细菌,14 株细菌对黑曲霉具有拮抗作用(表2),其中,G8 的抑菌直径最大,达28.19 mm(图1)。
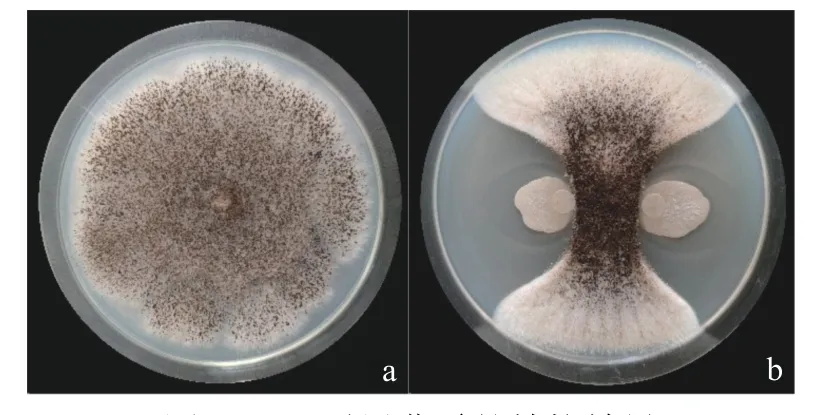
图1 G8 对黑曲霉的拮抗效果Fig.1 The antagonistic effect of G8 on Aspergillus niger
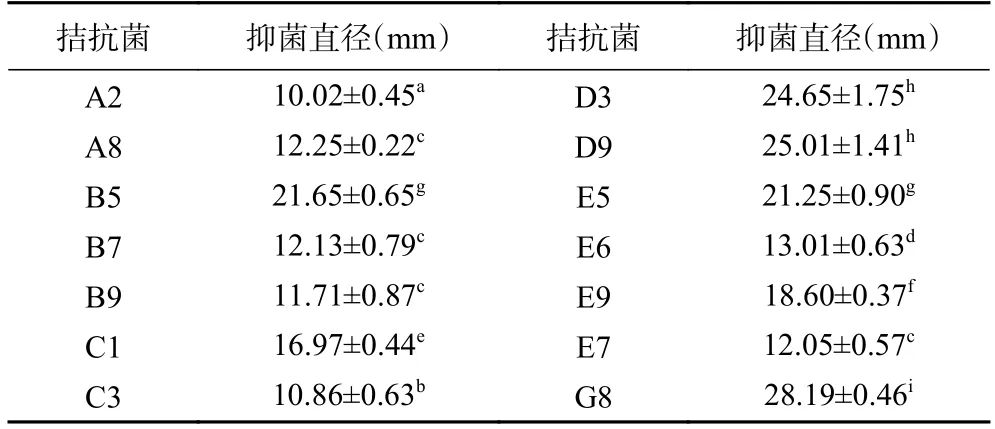
表2 葡萄园土壤拮抗细菌的筛选Table 2 Screening of antagonistic bacteria in vineyard soil
拮抗菌株对黑曲霉的防治效果如图2 所示。未接入拮抗菌株的葡萄果实发生腐烂及褐变,接入拮抗菌株的G8 对于黑曲霉有明显的抑菌效果。接种该菌株的葡萄果实均没有发生明显的黑粉病症状。这可能是由于接种的拮抗细菌迅速繁殖,同时与黑曲霉竞争营养与生存空间,导致病原菌失去营养物质和生存空间,无法生长繁殖以及产生有毒物质,从而抑制了病害的发生[21]。

图2 拮抗菌G8 对黑曲霉的活体拮抗效果Fig.2 The antagonistic effect of antagonistic antibacterial G8 on Aspergillus niger in vivo
2.2 拮抗细菌的鉴定
2.2.1 形态特征 菌株G8 在LB 固体培养基上培养,菌落呈现乳白色,表面稍微隆起,较为粗糙,不透明;经革兰氏染色后呈紫色,杆状(图3)。
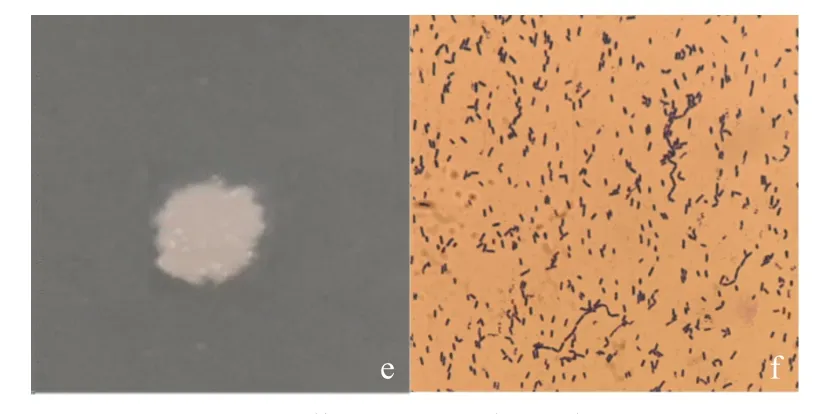
图3 菌株G8 形态学特征Fig.3 Morphological characteristics of strain G8
2.2.2 生理生化特征测定 菌株G8 的生理生化特征显示,该菌株可以利用葡萄糖、木聚糖、山梨醇、果糖、麦芽糖、淀粉、甘露醇等碳源进行生长,并能水解淀粉和明胶,还原硝酸盐。接触酶实验、葡萄糖产气实验、甲基红实验和脲酶实验均呈阳性,能够利用丙二酸盐(表3)。结合形态特征和生理生化特征[22],菌株G8 符合暹罗芽孢杆菌的特性。
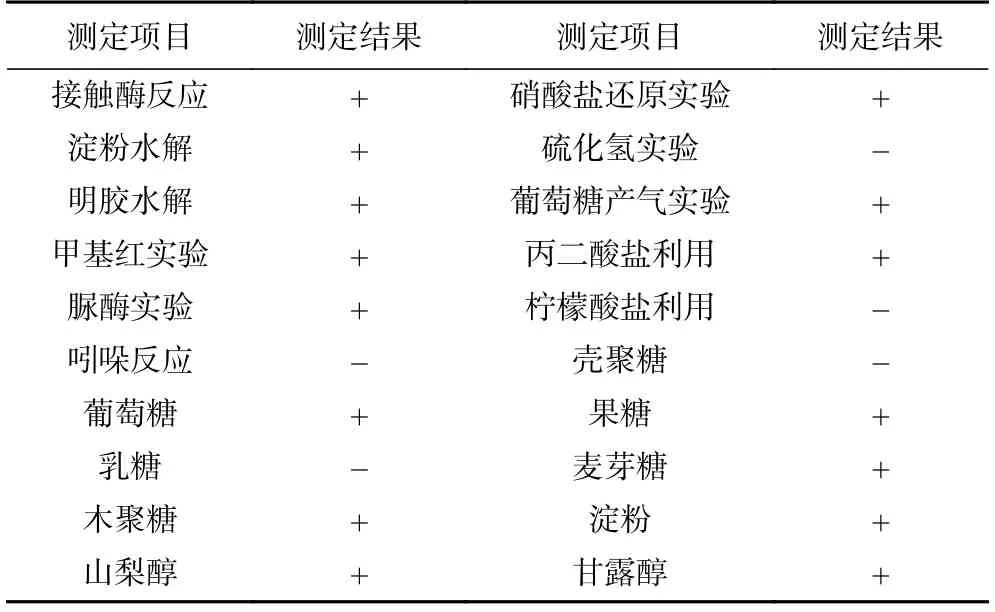
表3 菌株G8 的生理生化特征Table 3 Physiological and biochemical characteristics of strain G8
2.2.3 分子生物学鉴定 将G8 菌株16S rDNA 扩增产物送至生工(上海)有限公司测序,将测序获得的序列与Genbank 中序列进行比对,并用Neighbor-Joining 法构建系统发育树。基于16S rDNA 系统发育分析结果显示(如图4),菌株G8 与暹罗芽孢杆菌的亲缘关系最近,处于系统发育树的同一分枝。结合形态学与生理生化特征,确定菌株G8 为暹罗芽孢杆菌(Bacillus siamensis)。
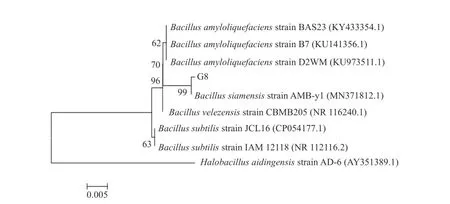
图4 G8 菌株基于16S rDNA 的系统发育树Fig.4 Phylogenetic tree of G8 strain based on 16S rDNA
2.3 拮抗菌G8 生长曲线的测定
菌株G8 的生长曲线如图5 所示。菌株G8 延缓期为4 h,在4~22 h 处于对数生长期,菌体代谢旺盛,繁殖速度快,24 h 后菌株的生物量逐渐趋于稳定。但随着培养时间的延长,菌株在40 h 之后进入衰亡期。
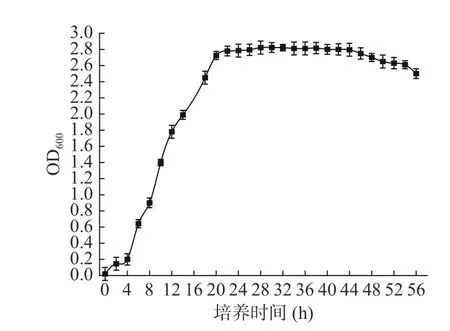
图5 菌株G8 的生长曲线Fig.5 Growth curve of strain G8
2.4 菌株G8 发酵条件的优化
2.4.1 装液量的影响 由图6 可知,不同装液量对抑菌效果的影响很小。当装液量为60 mL/250 mL 时菌株G8 有较大的抑菌直径,为28.26 mm。方差结果显示,不同装液量对抑菌效果的影响并不显著(P>0.05),故不选择装液量作为后续影响抑菌效果的考察因素。
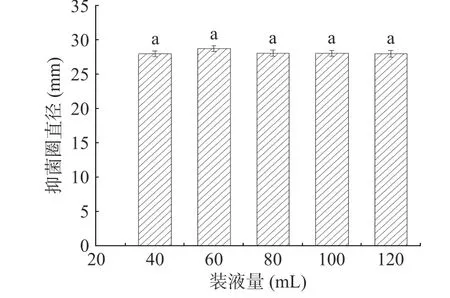
图6 不同装液量对抑菌效果的影响Fig.6 The influence of different liquid volume on theantibacterial effect
2.4.2 接种量的影响 由图7 可知,不同的接种量对菌株的抑菌效果的影响很小。当接种量为3%时,抑菌直径较高,但方差结果显示不同接种量对抑菌效果的影响不显著(P>0.05),这可能是由于抗菌物质是菌体生长到一定阶段,为适应环境变化而产生的,它的合成是受菌体细胞群体感应调节的[23]。虽然试验最开始采用了不同的接种量,但是在发酵24 h 后,各处理菌体生物量基本一致,抗菌肽的活性差异不大,抑菌效果也基本一致。鉴于此,在后续的实验中固定接种量为3%。
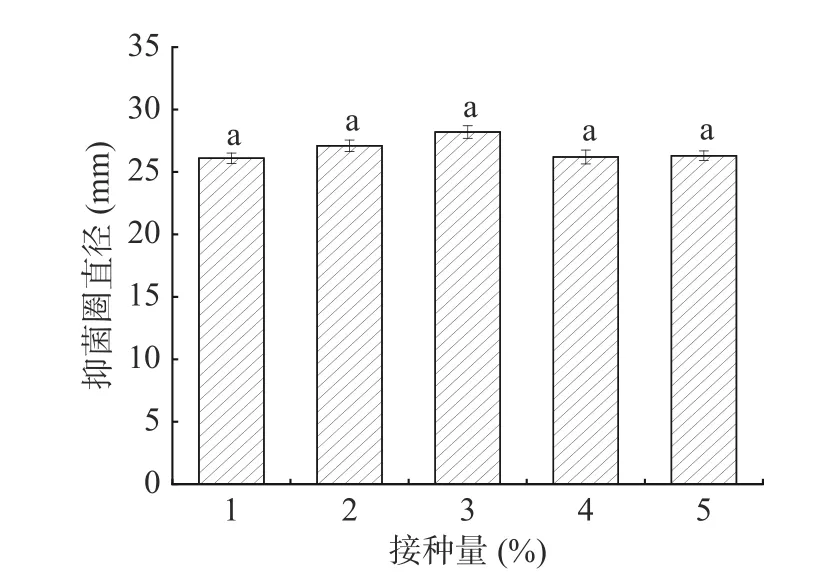
图7 不同接种量对抑菌效果的影响Fig.7 The effect of different inoculum on the antibacterial effect
2.4.3 培养温度的影响 由图8 可知,不同温度对菌株的抑菌效果差异显著(P<0.05)。随着温度的上升,抑菌直径呈现先增大后减小的趋势。培养温度对菌体细胞中的酶、蛋白质、DNA 等大分子的合成与活性会产生一定的影响,培养温度较最适温度高或低,生长速率都会随之下降[24]。当培养温度为30 ℃时,菌株G8 有最大的抑菌直径(28.62 mm)。因此,确定菌株最适生长温度为30 ℃,并选择其作为下一步正交试验的中心试验点。
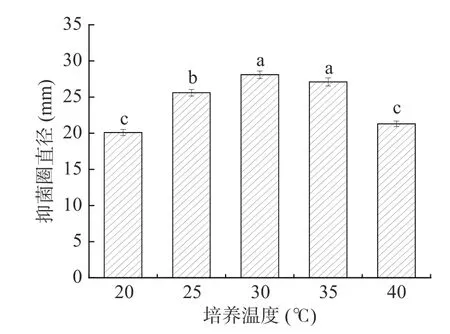
图8 不同培养温度对抑菌效果的影响Fig.8 The influence of different culture temperatures on the antibacterial effect
2.4.4 培养时间的影响 由图9 可知,菌株在20 h已经开始产生了抑菌物质,并随着发酵时间的延长,抗菌活性物质的产量逐渐增大。当培养时间达到30 h 时,菌株G8 的抑菌直径最大(28.64 mm)。但当菌株生长到一定时间时,抗菌活性物质的产量逐渐降低。这可能是由于菌株在生长后期,会发生自溶现象,并释放如蛋白酶、脂肪酶等次级代谢产物降解了部分抗菌活性物质[25−26]。方差分析结果显示不同培养时间对菌株的抑菌效果有显著影响(P<0.05)。因此,确定菌株适宜培养时间为30 h,并选择其作为下一步正交试验的中心试验点。

图9 不同培养时间对抑菌效果的影响Fig.9 The influence of different culture time on the antibacterial effect
2.4.5 初始pH 的影响 由图10 可知,不同初始pH对菌株的抑菌效果影响较为显著(P<0.05)。当发酵pH 在5~7 时,菌株G8 的抑菌效果逐渐增加。当pH为7 时,菌株G8 表现出最大的抑菌直径(28.34 mm)。当后续pH 持续增加时,抑菌效果呈现逐渐下降的趋势,这可能由于不同的酸或碱性条件影响了菌体的生长以及次级代谢产物的分泌[27]。因此,确定菌株G8产生最好抑菌效果的初始pH 为7,并选择其作为下一步正交试验的中心试验点。
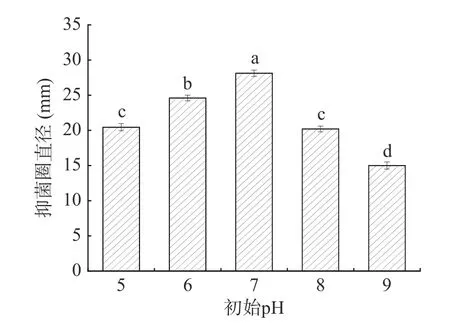
图10 不同初始pH 对抑菌效果的影响Fig.10 The effect of different initial pH on the antibacterial effect
2.4.6 转速的影响 由图11 可知,转速为140、160、180 r/min 时对菌株G8 抑菌效果的影响并不显著(P>0.05)。转速不断升高时,菌株的抑菌效果逐渐增强。当转速为160 r/min 时,菌株的抑菌直径达到了最大值。然而,随着转速的不断升高,菌株的抑菌效果不断下降。因此,确定菌株的产生最优抑菌效果的转速为160 r/min。
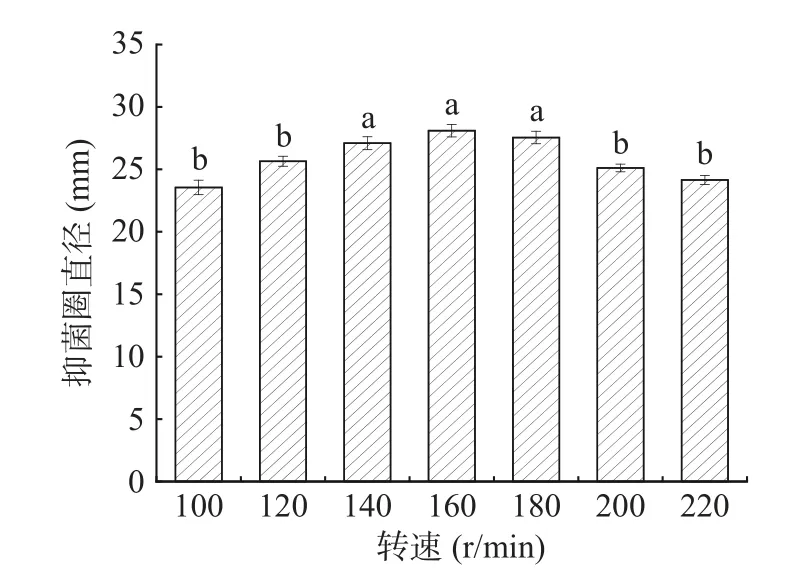
图11 不同转速对抑菌效果的影响Fig.11 The influence of different speeds on the antibacterial effect
2.5 正交试验优化
菌株G8 在发酵条件正交试验设计各处理中产生的抑菌效果如表4 所示。R 绝对值大小代表不同因素对菌体产生抑菌效果的影响程度,R 值越大,说明该因素影响程度越大。因此可以从实验结果中可以看出这三个因素对抑菌效果的影响大小顺序为培养时间> pH>培养温度。经数据分析可得到最优的发酵条件培养参数为B3C2A3,即培养时间为33 h,pH 为7,培养温度为33 ℃。
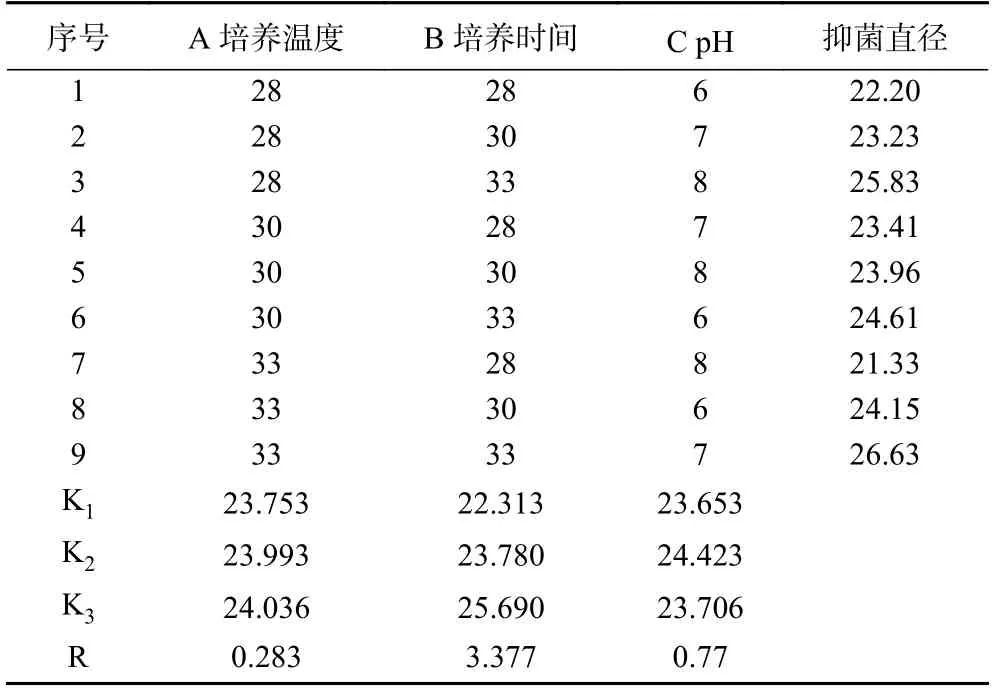
表4 正交试验结果Table 4 Orthogonal experiment results
2.6 发酵条件优化后的抑菌效果测定
使用优化后的发酵条件对菌株G8 进行培养,即装液量为60 mL/250 mL,接种量为3%,培养温度为33 ℃,pH 为7,转速为160 r/min 的条件下培养33 h,得到的发酵液对黑曲霉的抑菌直径达到了28.79 mm。
3 结论
本研究从新疆葡萄园土壤中共筛选出14 株对黑曲霉有抑菌效果的拮抗细菌,其中菌株G8 对黑曲霉的抑菌效果最佳。经鉴定,菌株G8 为暹罗芽孢杆菌(Bacillus siamensis)。在常温下,暹罗芽孢杆菌能显著降低黑曲霉引起的病害问题,有效抑制葡萄果实霉变。其产生抑菌活性物质最适的生长条件为:装液量为60 mL/250 mL、培养温度为33 ℃、培养时间为33 h、接种量3%、pH7、转速为160 r/min。上述研究结果将为暹罗芽孢杆菌在黑曲霉采后病害的生物防治应用方面提供理论依据。本实验室将进一步对暹罗芽孢杆菌G8 所产抗菌物质的纯化、鉴定与抑菌机制等进行深入研究。
