强化鲁氏接合酵母对酱油品质的影响
2022-07-08朱新贵李学伟肖亮琴唐鸿标郑倩望郭丽琼林俊芳
谭 戈,朱新贵,李学伟,肖亮琴,唐鸿标,郑倩望,郭丽琼,,林俊芳,
(1.华南农业大学食品学院,广东广州 510642;2.广东微生态制剂工程技术研究中心,广东广州 510642;3.李锦记(新会)食品有限公司,广东江门 529156)
酱油,是一种历史悠久的传统调味品,以大豆、小麦等为主要原料,经多种微生物及其酶系的作用,水解成多种糖类和氨基酸,再经一系列新陈代谢反应,最后形成具有独特色香味的调味品[1−2]。在对酱油风味研究中,气相色谱-质谱(gaschrom atographymass spectrometry,GC-MS)联用技术是一种较为常规的代谢组学工具,是目前应用广泛的挥发物测定分析技术和方法[3−5]。
从天然发酵酱油,到接种米曲霉纯种制曲,再到接种米曲霉和黑曲霉混合制曲,虽然解决了传统天然发酵酱油发酵体系中酶活力较低、发酵周期长和产品质量不稳定等难题,但由于酱油发酵体系中酶系单一而造成原料无法被充分分解[6]。在现有的技术条件下,多种酶系只能依靠多种菌株来分泌,因此多菌混合发酵是保证酱油质量及其风味的基础。在整个酱油酿造过程中,微生物起着至关重要的作用,其中耐盐风味酵母菌的存在更是为酱油的风味做出了巨大的贡献,使得酿造酱油的醇味和酯味更加浓郁,风味物质更加完善[7−8]。Liu 等[9]以米曲霉和鲁氏接合酵母混合制曲,发现发酵酱油的谷氨酸含量较单一米曲霉制曲对照组提高了46.16%,乙酸乙酯和2-甲氧基-4-乙烯基苯酚等风味物质也得到明显性提升。邹谋勇等[10]发现添加了酵母菌株C.oceani922-1 后,酱油中2-苯乙醇含量较对照组提高了6 倍,风味也得到了明显的改善。Wah 等[11]将季也蒙毕赤酵母接种到酱油中参与发酵,发现其能促进愈创木酚和4-乙基-愈创木酚等风味物质的形成,进而改善了酱油品质。主成分分析(principal component analysis,PCA)是一种无监督的多元变量统计分析手段,是在代谢组学分析中应用广泛的工具[12−13],可用于不同发酵周期[13]、不同加工方式[14−15]、不同品种[16−18]和不同产地[19]样品间进行快速区分鉴定。
本文通过测定JL-02 菌株耐盐性、成曲pH、成曲酶活力和不同酿造酱油工艺酿造出来的两种酱油主要理化指标及挥发性风味物质来研究鲁氏接合酵母的添加对高盐稀态发酵酱油的影响,为酱油企业进行强化酵母菌酿造酱油生产工艺提供思路和技术方法。
1 材料与方法
1.1 材料与仪器
大豆 哈尔滨谷禾商贸有限公司;面粉 拓城县马培中农产品加工经营部;酱油曲精(米曲霉3.042) 玉园生物科技有限公司;鲁氏接合酵母JL-02本实验室保藏菌株;福林酚试剂 北京索莱宝科技有限公司;甲醛、氢氧化钠、盐酸 分析纯,广州化学试剂厂;YPD 培养基:1%酵母抽提物,2%葡萄糖,2%蛋白胨,115 ℃灭菌20 min,固体培养基则添加2%琼脂粉 自行配制;酵母抽提物、葡萄糖、蛋白胨 广东环凯生物科技有限公司;琼脂粉Biofroxx。
TSQ8000 Evo 赛默飞气质联用仪、TG-WAXMX毛细管柱(60 m×0.25 mm×0.25 μm) 赛默飞世尔科技(中国)有限公司;50/30 μm CAR/PDMS/DVB 萃取头 美国Supelco 公司;Bioscreen C 全自动生长曲线分析仪 Oy Growth Curves Ab Ltd;UV-4802S紫外可见分光光度计 尤尼柯(上海)仪器有限公司;LS-35 HD 立式压力蒸汽灭菌锅 江阴滨江医疗设备有限公司;Centrifuge 5804 R 台式离心机 德国艾本德股份公司;PB-10 酸度计 赛多利斯科学仪器(北京)有限公司;SPH-2000 生化培养箱 广州市深华生物技术有限公司。
1.2 实验方法
1.2.1 耐盐实验 挑取JL-02 单菌落接种于YPD 液体培养基中,30 ℃,150 r/min 恒温培养24 h,得到JL-02 种子培养液。将种子培养液按照1%的接种量分别接种于含NaCl 浓度为0%、5%、10%、16%和20%的YPD 培养基(参考某企业酱油产品含盐量而设计的盐浓度梯度,空白YPD 培养基作调零组),30 ℃,恒温振荡培养,用全自动生长曲线分析仪测定其在600 nm 的吸光度。
1.2.2 酱油主要发酵工艺
1.2.2.1 制曲工艺 参考刘晶晶[20]的酱油酿造工艺,并稍作修改,结合图1 酱油制备工艺流程,以质量百分比计算,称取75%黄豆,加1.2 倍润水量(静置浸泡2 h),置于高温蒸汽灭菌锅灭菌,灭菌程序为121 ℃,15 min。将灭菌后的熟料快速冷却至40 ℃,拌入25%面粉(经75 ℃干热灭菌后冷却)。接入0.15%酱油曲精,搅拌均匀,置于生化培养箱中30 ℃恒温培养,在制曲的第8 h 和第16 h 分别翻曲一次,第40 h 时,曲料表面遍布黄绿色菌丝,制曲完成。
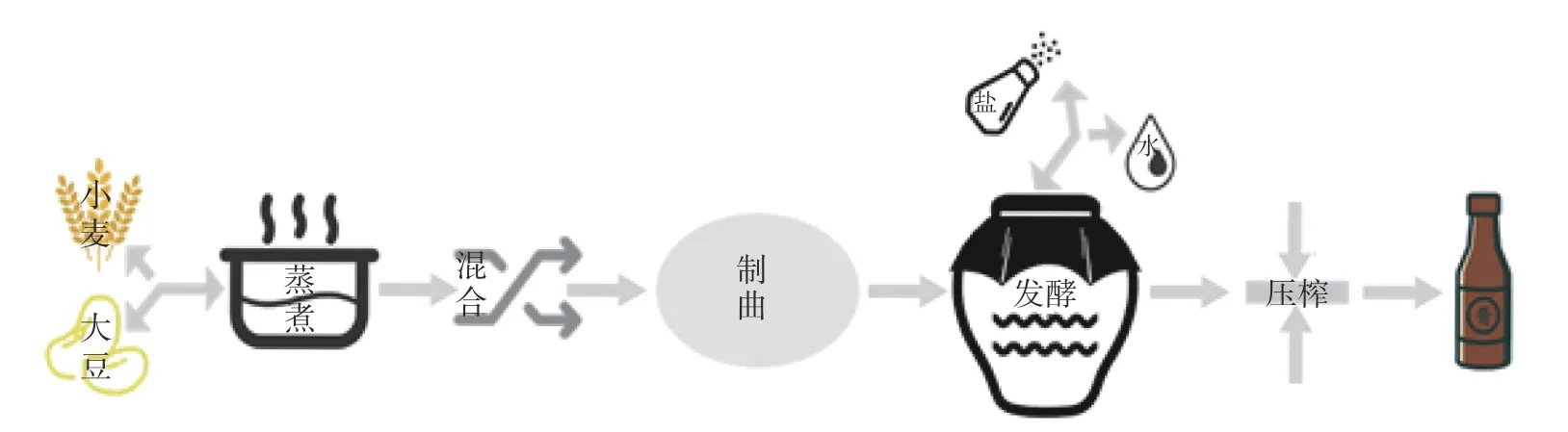
图1 酱油生产工艺流程Fig.1 Soy sauce production process
1.2.2.2 发酵工艺 参考某企业生产参数,配制18 °Bé/20 ℃盐水,以成曲:盐水质量比=1:2.27 的比例混合,搅拌均匀后,置于2 L 发酵坛子中,常温发酵,发酵前两周每天搅拌一次,后面每周搅拌一次,发酵周期为90 d。
1.2.2.3 JL-02 菌株添加方式及时间 采用YPD 液体培养基将JL-02(接种量为4%)培养OD600至1.0 后,量取其发酵液于离心管中进行离心,离心程序为6000 r/min,4 ℃,15 min,收集底部菌体后,用少量酱油进行混匀,加入处于发酵第30 d 中的酱油坛子中,同时设置对照组实验(JL-02 菌株接种量为0)。
1.2.3 成曲酶活、pH 的测定 在制曲结束后,对成曲的pH 和中性蛋白酶酶活力进行测定(另收集部分成曲置于4 ℃保藏,备用),其中,pH 测定参考Feng 等[21]关于酱油pH 的测定方法,酶活力的测定采用福林法[22]。
1.2.4 酱油发酵过程中理化指标的测定 在两组酱油发酵的第0、15、30、45、60、75 和90 d 分别进行采样,-20 ℃保存,试验前进行离心,离心程序为4 ℃,6000 r/min,15 min。对酱油发酵过程中的理化指标变化进行测定。酱油氨基态氮、pH 和总酸指标测定方法参考国标[23],其中氨基态氮含量的测定采用甲醛法,总酸含量测定采用酸度计法,pH 的测定采用精密pH 计测定;还原糖测定采用3,5-二硝基水杨酸法[20]。
1.2.5 GC-MS 测定成曲、两组90 d 酱油挥发性风味成分 进样方法:吸取5 mL 酱油样品(称取混匀后的成曲2 g 置于20 mL 顶空瓶中,加入4 mL 去离子水,搅拌均匀),置于20 mL 顶空瓶中将顶空瓶加盖密封。启动GC-MS 自动进样装置,程序为50 ℃恒温震荡,平衡10 min,萃取头吸附30 min,等待GC进样。
色谱条件:TG-WAXMX 毛细管柱;载气:氦气;载气流速:1.0 mL/min,进样方式:不分流;进样口温度:240 ℃;解吸时间:3 min;程序升温条件:初温45 ℃,保持5 min,以4 ℃/min 升温至230 ℃,保持5 min。
质谱条件:电子轰击离子源:能量70 eV,离子源温度:240 ℃;接口温度:240 ℃;质量扫描范围m/z:33~450 u。
定性方法:仪器设备配置的NIST 谱库(2016),并参考酱油挥发性风味成分的文献报道进行综合鉴定。
定量方法:利用峰面积归一化法,得到各组分的相对含量。
1.3 数据处理
采用Excel 2019 和SPSS 26 等软件对实验数据进行分析处理,结果表示为“平均值±标准差”(所有实验样品数据重复测定3 次)。绘图软件为Origin 2021 和SIMCA 17.0.1。
2 结果与分析
2.1 JL-02 耐盐性
如图2 所示,不同NaCl 浓度的YPD 培养基对JL-02 生长速率影响较为明显。随着NaCl 浓度的增加,处于稳定期的细胞个数浓度逐渐下降。对于JL-02 菌株,当其处于16% NaCl 的环境下时,其对数期的到来较0% NaCl 组延迟约20 h;稳定期时,细胞个数浓度亦较空白对照组略低,基本上能正常生长。当其处于20% NaCl 时,JL-02 基本上一直处于延滞期,说明该菌株并不能耐受20%的盐度环境,但在整个酱油发酵中,其盐水含量接近16%,由此说明该菌株可在酱油发酵体系中生长。
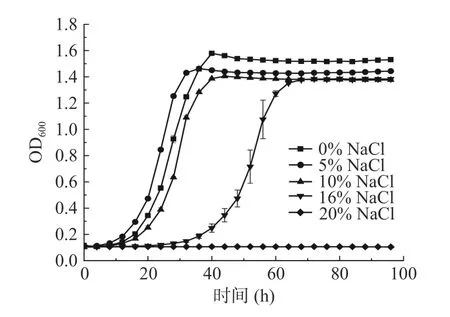
图2 不同NaCl 浓度下YPD 液体培养基中JL-02菌株生长曲线Fig.2 Growth curve of JL-02 strain in YPD liquid medium under different NaCl concentrations
2.2 成曲时pH 和酶活力的测定结果
实验测得成曲中的pH 为6.85±0.08。在整个酱油制曲过程中,温度、湿度等条件比较适宜时,米曲霉占绝对优势时,成曲的pH 通常接近中性。
酱油的酿造过程中,成曲时酶活力的高低对原料的利用率和酱油成品的品质有着重要的影响,故企业在生产时往往将成曲时中性酶活性的大小,作为衡量制曲是否成功的重要标志,也常将提高酶活力作为提高酱油品质的一条重要途径,尤其是蛋白酶活力[24−26]。蛋白酶可以将原料中的蛋白进行分解,生成各类呈味氨基酸,如谷氨酸,对酱油独特的滋味和香气具有重要作用。本次测得成曲中中性蛋白酶活力为(2109.2±45.2)U/g,与樊嘉训等[27]诱变选育的米曲霉H34 的酶活力差距较大,但较其利用米曲霉3.042纯种制曲后的酶活力高出690.1 U/g,制曲结果较为理想。
2.3 酱油主要理化指标的分析
还原糖、氨基态氮、总酸和pH 是反映酱油品质优劣的重要指标,与酱油的发酵有着密切的联系。对酱油发酵动态过程中酱油的还原糖、氨基态氮、总酸和pH 理化指标进行分析,得出添加JL-02 菌株后使酱油的总酸、pH 和还原糖较对照组有明显影响,即添加JL-02 菌株后酱油的总酸含量较对照组明显升高,pH 和还原糖含量较对照组明显下降,而对氨基态氮指标则无明显影响。由图3a 可知,发酵完成后,JL-02 组还原糖含量为(1.06±0.01)g/100 mL,对照组中还原糖是JL-02 组的1.27 倍,这可能是由于JL-02菌株的加入,增加了其对还原糖的利用,进而合成醇类等风味物质,这与钟小廷等[28]、吕变梅等[29]的研究结果较为接近。由图3b 可知,两组实验中的氨基态氮含量在0~30 d 均有较大幅度的提升,这主要是米曲霉的蛋白酶水解蛋白质,使得氨基态氮的含量能迅速提升,后期逐渐趋于稳定[20],最后两组酱油中氨基态氮含量均接近1.0 g/100 mL,达到了特级酱油标准。由图3c 可知,两组酱油在发酵第0~15 d 时,总酸含量迅速上升,在发酵后期呈现出一定的波动性。JL-02组在第30~45 d 时总酸含量有所下降,可能是由于JL-02 菌株的加入产生了较多醇类,与酸类合成了酯类等风味物质,最后总酸含量为(1.14±0.01)g/100 mL。总体而言,对照组总酸较添加酵母JL-02 组稍低,这与权武等[30]的研究结果较为一致。由图3d 可知,两组酱油的pH 随着发酵的开始,都有不同程度地下降,最后pH 趋于5.0 左右(实验组pH 为5.09±0.03,对照组pH 为5.25±0.03),在一定程度上也有利于酱油的防腐[31]。

图3 高盐稀态发酵酱油中理化指标的变化趋势Fig.3 The change trend of physical and chemical indexes in high-salt dilute fermented soy sauce
2.4 成曲、两组90 d 酱油挥发性风味测定结果
由表1 和图4 可知,在制曲完成后,成曲挥发性风味物质种类有15 种,其中,化合物种类排序为醇类(8 种)、醛类(4 种)和酯类(3 种),相对含量占比排序前三为醇类(77.72%±23.02%)、醛类(19.02%±8.79%)和酯类(3.26%±0.32%);在对照组中挥发性风味物质种类有52 种,其中,化合物种类排序前三为酯类(24 种)、醛类(11 种)和醇类(11 种),相对含量占比排序前三为醇类(71.82%±4.47%)、酯类(11.77%±1.17%)、醛类(7.97%±0.99%);在JL-02 组中挥发性风味物质种类有57 种,其中,化合物种类排序前三为酯类(26 种)、醇类(11 种)、醛类(7 种)和酮类(7 种),相对含量占比排序前三为醇类(69.96%±4.66%)、酯类(19.04%±2.50%)和酮类(2.99%±0.41%)。从上述数据得知,制曲完成后挥发性风味物质种类相对较少,在后期酱油发酵过程中,风味物质种类增加明显,约40 种,且添加JL-02 菌株后的酱油所含风味物质种类也得到了一定提高,如酚类、酮类和呋喃类(2-正戊基呋喃、4-甲氧基-2,5-二甲基-3(2H)-呋喃酮和2,3-二氢苯并呋喃),使酱油酿造过程中的风味物质种类发生了一定的转变。
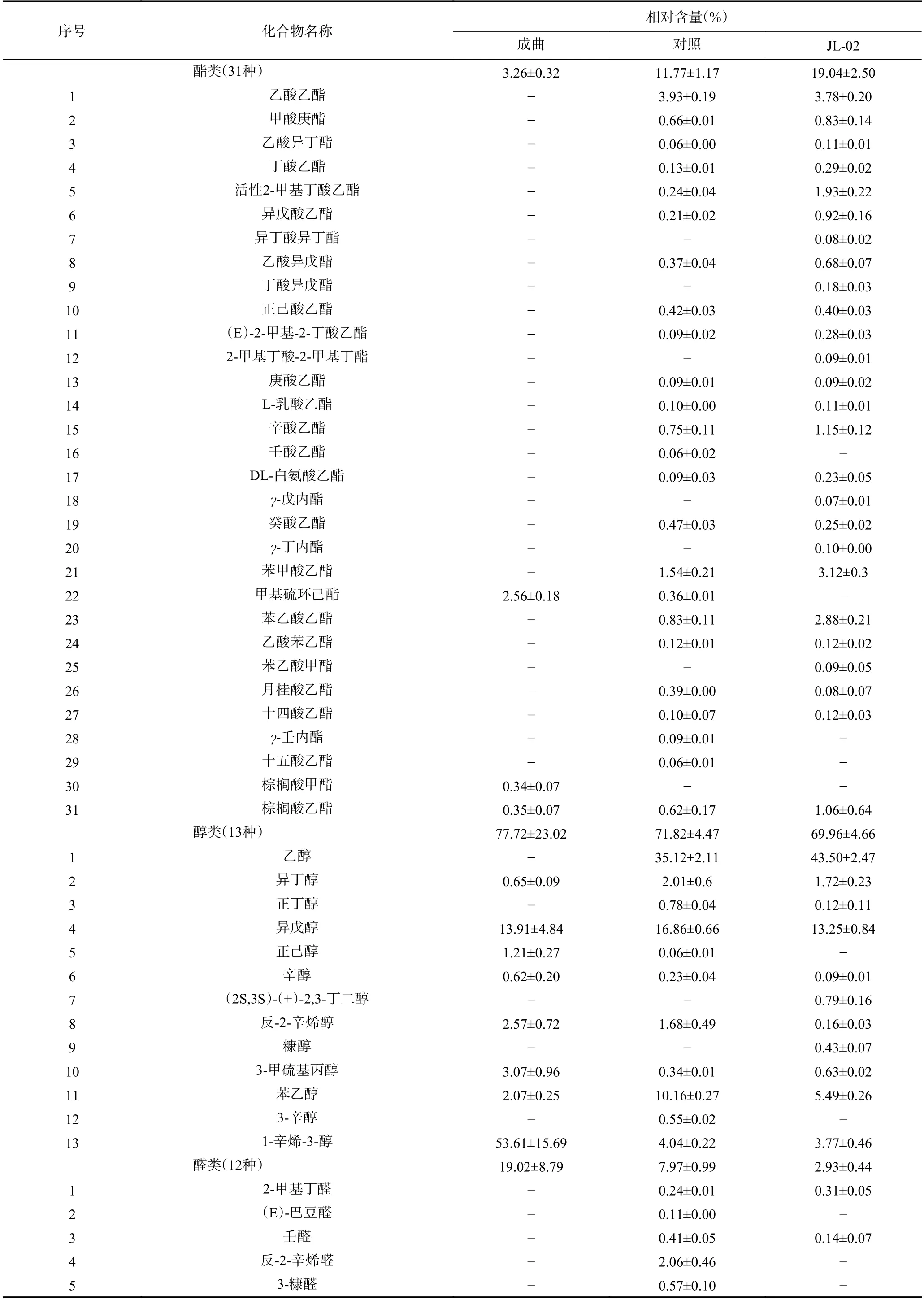
表1 成曲和两组酱油挥发性风味物质相对含量Table 1 Relative content of volatile flavor compounds in koji and two groups of soy sauce
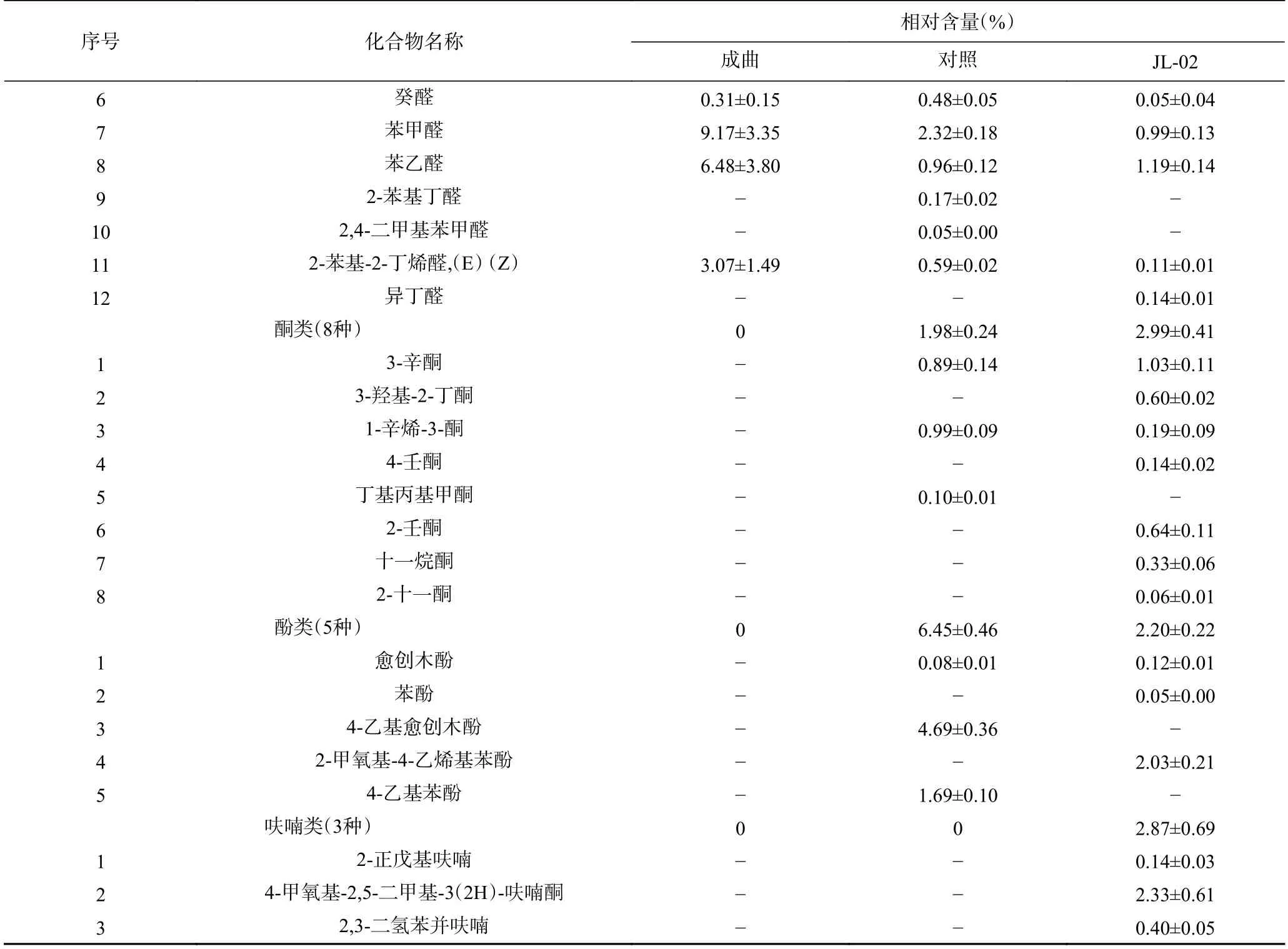
续表1
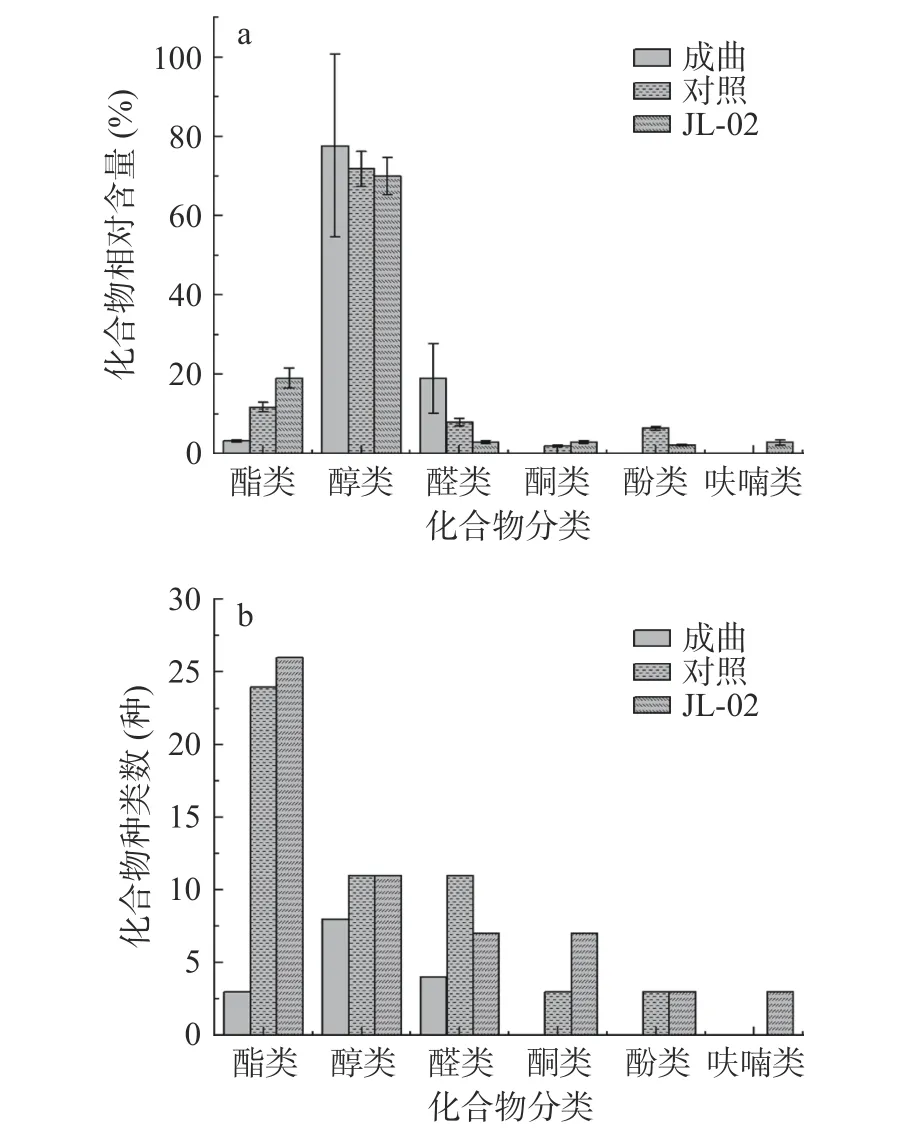
图4 成曲和两组酱油挥发性风味物质相对含量占比及种类Fig.4 The relative content and types of volatile flavor substances in koji and two groups of soy sauce
2.5 成曲、两组酱油中挥发性风味物质代谢组学分析结果
2.5.1 成曲、两组酱油PCA 结果 对成曲和两组酱油进行PCA 主成分分析,结果见图5。在图5 中可看出,在95%的置信区间,PC1 和PC2 分别解释了总方差的49.6%和45.7%,两者贡献率之和为95.3%,表明它们能代表样品中大部分数据。总体而言,成曲和两组酱油具有较明显的区域分布特征且呈现较高的聚类趋势,PCA 结果良好。
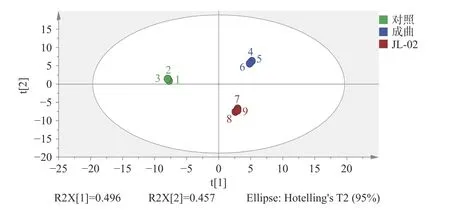
图5 成曲、两组酱油挥发性风味物质PCA 图Fig.5 PCA diagrams of volatile flavor compounds in koji and two groups of soy sauce
2.5.2 成曲、两组酱油Biplot 结果 Biplot 图,可以展示每一种风味物质的相对重要性及风味化合物与样品间的关系。对成曲和两组酱油进行Biplot 图绘制,利用载荷信息找出这三者间的差异物质,见图6。分析图6 得知,成曲组(序号4、5 和6,位于第一象限)主要与棕榈酸甲酯这风味物质关联度较大;JL-02 组(序号7、8 和9,位于第四象限)主要与苯乙酸甲酯、丁酸异戊酯、异丁酸异丁酯、2-甲基丁酸-2-甲基丁酯、γ-戊内酯、γ-丁内酯、十一烷酮、2-十一酮、3-羟基-2-丁酮、2-壬酮、4-壬酮、4-甲氧基-2,5-二甲基-3(2H)-呋喃酮、2,3-二氢苯并呋喃、2-正戊基呋喃、2-甲氧基-4-乙烯基苯酚、苯酚、(2S,3S)-(+)-2,3-丁二醇、糠醇和异丁醛等风味化合物关联度较大;对照组(序号1、2 和3,位于第二象限)主要与2,4-二甲基苯甲醛、2-苯基丁醛、(E)-巴豆醛、3-糠醛、反-2-辛烯醛、苯甲醛、癸醛、辛醇、3-辛醇、反-2-辛烯醇、正丁醇、γ-壬内酯、十五酸乙酯、壬酸乙酯、月桂酸乙酯、4-乙基苯酚、4-乙基愈创木酚、丁基丙基甲酮、1-辛烯-3-酮等风味化合物关联度较大。
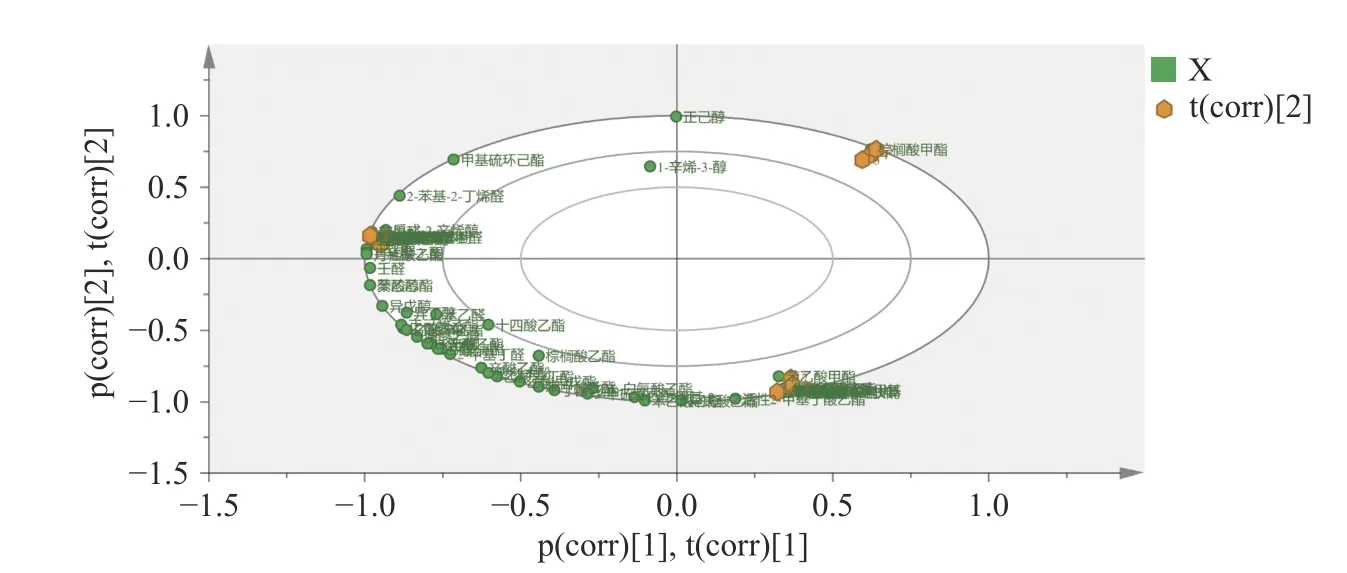
图6 成曲、两组酱油挥发性风味物质Biplot 图Fig.6 Biplot diagrams of volatile flavor compounds in koji and two groups of soy sauce
3 结论
本研究在测定了JL-02 菌株耐盐性、成曲pH和中性酶活力的基础上,围绕着不同工艺酿造的酱油进行了发酵过程主要理化指标的测定,发现两组酱油氨基态氮指标均达到特级酱油(氨基态氮≥0.8 g/100 mL)的标准;强化鲁氏接合酵母后的酱油较对照组总酸含量明显增加,而还原糖含量和pH 明显降低,氨基态氮含量无明显差异;基于GC-MS 对成曲、两组酱油进行了挥发性风味物质的鉴定与分析,得知成曲、对照组酱油和JL-02 组酱油所含风味物质分别为15、52 和57 种,对其进行了PCA 分析,得知样品间聚类趋势和分散结果较好;通过Biplot图可知,成曲中与棕榈酸甲酯关联度较大,JL-02 组中与4-甲氧基-2,5-二甲基-3(2H)-呋喃酮等风味物质关联度较大,同样对照组与4-乙基愈创木酚等风味物质关联度较大。基于上述,可为酱油企业进行强化酵母菌株酿造酱油的生产工艺提供一定的思路和技术方法。
