基于DNA适配体的C反应蛋白SERS磁性生物传感器的研究
2022-07-08张炎李睿李利军
张炎 李睿 李利军






摘 要:利用C反应蛋白(C-reactive protein,CRP)的巯基化适配体修饰金壳磁性颗粒制备了磁性捕获基底Fe3O4@PEI@Au@Aptamer-SH;以拉曼报告分子对巯基苯甲酸(4-MBA)修饰银纳米粒子,并通过酰胺键偶联CRP的氨基化适配体,制备了信号探针Ag@4-MBA@Aptamer-NH2。磁性捕获基底、抗原CRP以及SERS探针形成三明治夹心复合物,磁分离富集后,实现对CRP的SERS检测。在0.1 ng/mL~100 μg/mL浓度范围,SERS信号强度(ISERS)与CRP浓度的对数值呈良好的线性关系。对人血清样品进行加标试验,回收率为93.1% ~109.6%,相对标准偏差(RSD)为2.71%~4.68%(n = 3)。该SERS-磁性生物传感器具有制备相对简单、线性范围宽、特异性强、重现性和稳定性好等特点,在临床检测诊断方面具有一定的应用价值。
关键词:C反应蛋白(CRP);适配体;SERS;生物传感器
中图分类号:TP212.3 DOI:10.16375/j.cnki.cn45-1395/t.2022.03.012
0 引言
Tillet和Francis于1930年在部分急性病患者的血清中發现C反应蛋白(C-reactive protein,CRP)。人体血清中CRP是细菌感染、组织坏死、动脉粥样硬化等疾病的重要标志物,是急性炎症病人血清中可结合肺炎链球菌的荚膜C-多糖蛋白质。正常人血清中CRP含量一般不超过8 μg/mL[1],在感染细菌、组织严重坏死、动脉粥样硬化后的6~8 h,CRP的浓度开始升高,在24~48 h达到高峰,高峰值可达正常值的数倍或数百倍[2],在消除感染后,其含量急剧下降,一周内可恢复正常。目前,CRP已经作为医院急诊常规检测项目[3],和血常规同时进行检测,是诊断全身细菌性感染的重要标志物[4]。动态观察CRP有助于在细菌感染时合理使用抗生素[5]、对疗效进行判断。
目前,有关CRP的检测方法主要有化学发光法[6]、荧光免疫分析法[7-8]、酶联免疫分析法[9-10]和电化学分析法[11]等,这些检测方法具有良好的准确性和重现性,已应用于临床诊断和治疗,但存在操作繁琐、耗时、成本较高等问题。
表面增强拉曼光谱法(surface-enhanced Raman spectroscopy,SERS)因具有灵敏度高、无损、检测快速等优点被广泛应用于定性定量分析[12-13]。适配体(Aptamer)作为DNA或RNA单链的一小段寡核苷酸序列,与抗体相比,具有稳定性好、成本低、容易合成和修饰等优点[14-15]。因此,将SERS技术和适配体结合,构建SERS适配体生物传感器受到广泛关注[16-17]。如Kim等[18]构建了一种CRP的SERS适配体生物传感器,该传感器将Au-Te纳米粒子固定在铟-锡氧化物底物上,然后将巯基化的CRP适配体修饰到底物上,用于CRP的识别,将多功能的DNA 3WJ与PAuNPs偶联,并结合SERS信号放大技术,实现对CRP的检测。该策略制备CRP的SERS传感器在磷酸盐缓冲液中的检测限为2.23 pmol/L,在稀释的人血清中的检测限为3.11 pmol/L。Wu等[8]将固定在磁珠(MBs)上的CRP-Aptamer与AuNPs上的cDNA链杂交,形成MB-dsDNA-AuNP夹心结构,当加入CRP后,由于CRP与适配体之间的强相互作用,导致AuNPs的释放,实现对目标物质的SERS检测,该方法的检测限为2.71 nmol/L。但上述传感器的制备较为繁琐,灵敏度不高。
纳米Au修饰的磁性粒子对复杂生物体系中的目标物质不仅具有分离富集的作用,而且还能产生更多的“热点”,进一步增强SERS信号[19]。聚乙烯亚胺(PEI)呈正电性,易吸附到呈负电性的磁性Fe3O4纳米颗粒表面,形成包覆层,带正电荷的包覆层容易吸附呈负电性的金纳米粒子,可为制备金壳提供金种子位点[20]。本文在磁性Fe3O4纳米颗粒表面包覆PEI,以PEI作为中间夹层制备金壳磁性颗粒,再修饰上巯基化的CRP适配体,作为CRP的磁性捕获基底;在AgNPs表面修饰4-MBA,再通过酰胺键偶联氨基化的CRP适配体作为SERS信号探针,构建了CRP的SERS-磁性适配体传感器。对磁性捕获基底、SERS信号探针分别进行了表征,并考察了该传感器的相关性能。结果表明,该生物传感器具有制作相对简便、重现性好、准确度高、线性范围宽等特点。
1 实验部分
1.1 仪器与试剂
实验仪器及实验试剂分别如表1和表2所示。
1.2 SERS探针Ag@4-MBA@CRP-Aptamer的制备
AgNPs的制备参考Wang等[21]的方法。将90 mg AgNO3 溶解于500 mL水中,置于装有回流装置的三口烧瓶中,加热至沸腾,保持沸腾15 min,排出O2,快速加入10 mL 1%的柠檬酸三钠水溶液,在沸腾条件下反应20 min,关闭加热开关,余温反应1 h后,4 ℃保存。
取1 mL AgNPs,加入100 μL乙醇溶液(含 1 mmol/L 4-MBA),在室温下混合超声30 min。分别用去离子水和无水乙醇洗涤3次,除去未反应的4-MBA,得到4-MBA标记的AgNPs(Ag@4-MBA),然后将其重新分散到1 mL PBS(pH 7.4)中。加入NHS(10 μL,100 mmol/L)和EDC(5 μL,100 mmol/L)活化4-MBA的羧基末端。随后将200 μL 10 μg/mL 的氨基化CRP-Aptamer加入溶液中,在室温下孵育1 h,通过酰胺键偶联4-MBA与CRP-Aptamer。最后加入10 μL 50 g/L BSA,室温超声反应30 min,阻断其余活性部位。经过洗涤离心后,得到SERS检测探针(Ag@4-MBA@CRP-Aptamer),分散于1 mL PBS中,待用。
1.3 磁性捕获基底Fe3O4@PEI@Au@Aptamer-SH的制备
参照Li等[22]提出的溶劑热合成法:将2.7 g Fe3O4·6H2O溶于80 mL乙二醇溶液中,磁力搅拌30 min使其完全溶解。称取5.4 g乙酸钠和2 g PEG 4000加入上述混合溶液中,继续搅拌1 h,使其溶剂完全混合均匀。将混合溶液转移至高压反应釜内(聚四氟乙烯内胆),并置于210 ℃鼓风干燥箱中反应12 h,得到的黑色沉淀用去离子水和乙醇分别清洗3次,置于真空干燥箱内60 ℃烘干备用。
将20 mg Fe3O4磁性颗粒溶于10 mL去离子水后,超声10 min使其完全分散。Fe3O4磁性颗粒溶液与PEI溶液(5 mg/mL)按1∶1的体积比混合后超声30 min。外加磁场富集分离,用去离子水清洗5次,除去多余的PEI,得到Fe3O4@PEI磁性颗粒,分散保存在5 mL去离子水中,待用。
制备胶体金种子:首先配制200 mL氯金酸溶液(0.25 mmol/L),加入2 mL 1%柠檬酸钠溶液;在剧烈搅拌下,加入6 mL新鲜配置的硼氢化钠溶液(0.1 mol/L),继续搅拌2 h,获得胶体金种子溶液,避光保存,备用。将5 mL Fe3O4@PEI磁性颗粒投入到100 mL胶体金溶液中,剧烈超声反应0.5 h。外加磁场富集分离,用去离子水洗涤2次,得到Fe3O4@PEI-Au seed微球,用5 mL去离子水重悬,在4 ℃冰箱中保存备用。
将1 mL Fe3O4@PEI@Au seed溶液加入100 mL去离子水中,超声10 min使其完全分散;向上述溶液中加入200 mg PVP粉末和50 mg盐酸羟胺,超声5 min,使加入的固体粉末完全溶解;快速加入150 μL 氯金酸(1%),继续超声反应5 min后,外加磁场富集分离,用去离子水清洗3次,除去多余的PVP,得到金壳磁性颗粒Fe3O4@PEI@Au。随后将200 μL 10 μg/mL的Aptamer-SH加入到溶液中,孵育1 h后,外加磁场富集分离,洗涤去掉没有结合的Aptamer-SH,最后加入10 μL 50 g/L BSA ,室温超声反应30 min,阻断其余活性部位。得到磁性捕获基底Fe3O4@PEI@Au@Aptamer-SH,经过洗涤离心后,再分散于1 mL的PBS中,待用。
1.4 血清样品及CRP的SERS检测
本工作所用血清样品未经任何稀释。将CRP标准品溶解在PBS(0.1 mol/L,pH 7.4)中配置100 μg/mL的CRP标准溶液;按需要用PBS溶液稀释至所需的浓度。将不同浓度的CRP样液加入1 mL Fe3O4@PEI@Au@Aptamer-SH 捕获基底中,孵育 1 h后用PBS清洗3次,洗涤掉未结合的CRP后,用1 mL PBS重悬;再加入1 mL Ag@4-MBA-@Aptamer-NH2 SERS探针,室温孵育1.5 h,利用外加磁场分离富集夹心复合物,用PBS缓冲溶液洗涤3次,除去未结合的SERS探针后,重悬于1 mL PBS中。然后,取不同浓度的夹心复合物20 μL滴加到玻片上(玻片置于磁铁上进行磁场组装),自然晾干后,检测拉曼信号,每个样品采集3次拉曼 光谱。
2 结果与讨论
2.1 CRP检测原理
CRP检测原理如图1所示。利用CRP-Aptamer对CRP的特异性结合能力,磁性捕获基底Fe3O4@PEI@Au@Aptamer-SH识别并捕获样液中待测的抗原CRP,加入拉曼信号探针Ag@4-MBA@CRP-Aptamer后,与磁性捕获基底上的CRP结合,形成磁性捕获基底、目标物质和SERS信号探针的夹心结构复合物,通过外加磁场分离富集,洗涤去掉游离的SERS信号探针,进行SERS检测,SERS信号强度与一定范围内的CRP浓度的对数值呈线性关系。
引入磁性捕获基底,可方便地捕获目标物质,并从复杂的血清样液中分离富集目标物质,避免了复杂的样品预处理。拉曼信号探针Ag@4-MBA-@-Aptamer-NH2中的纳米银对4-MBA拉曼信号具有增强作用,磁性捕获基底Fe3O4 @PEI@Au@Aptamer-SH中金壳也具有拉曼增强效应,因此,纳米银和金壳对4-MBA拉曼信号具有协同增强效应,利于提高检测灵敏度。
2.2 磁性捕获基底Fe3O4@PEI@Au的表征
图2(a)—图2(d)分别为纳米Fe3O4、Fe3O4 @-PEI、Fe3O4@PEI@Au-seed和Fe3O4@PEI@Au的SEM和TEM图像。由图2(a)可以看出,纳米Fe3O4颗粒具有较好的分散性和均一性;由图2(b)可明显观察到PEI包覆层,亲水性的PEI不仅起到保护层的作用,还可改善磁性颗粒的分散性,避免团聚现象;由图2(c)可以明显看出,Fe3O4@PEI颗粒表面变得粗糙,有小颗粒粘附其表面,说明Fe3O4@PEI@Au-seed制备成功;由图2(d)可看出,粘附在表面的颗粒明显变大,表明Au种子介导法使还原的Au吸附其表面,证明Au层沉积成功。
图3(a)表示制备的Fe3O4、Fe3O4@PEI、Fe3O4@PEI@Au-seed、Fe3O4@PEI@Au的磁滞回线,磁化强度分别为81.2 emu/g、 73.1 emu/g、 67.8 emu/g、 52.5 emu/g。由于PEI与AuNPs为非磁性物质,所以随着PEI、AuNPs逐层包覆在磁性颗粒的外围,导致磁力强度逐渐降低[23],但基底(Fe3O4@PEI@Au)仍然具有较强的磁性,所制备的磁性基底可采用外加磁场的方法进行磁富集分离。
对制备的材料进行XRD表征,结果如图3(b)所示。由图3(b)可知,Fe3O4纳米粒子分别在2θ为30.2°、35.5°、43.2°、53.6°、57.1°、62.7°处出现衍射峰,分别对应Fe3O4晶型的(220)、(311)、(400)、(422)、(511)、(440)晶面,与粉末衍射文件数据库标准卡片一致。Fe3O4@PEI中未见有新的衍射峰出现,这是因为PEI为有机聚合物,无晶型结构。Fe3O4@PEI@Au-seed显示,在2θ值为38.2°处出现新的衍射峰,对应金的(111)晶面,这与粉末衍射文件数据库标准卡片一致,说明金种子成功地包裹在Fe3O4@PEI的表面。由Fe3O4@PEI@Au可看出,在38.2°处的衍射峰的强度明显增强,表明金种子变大,磁性颗粒包覆了一层金壳。
对制备的材料进行EDS表征,结果见图3(c)。Fe3O4@PEI在Fe3O4基础上出现了N元素,说明PEI包覆在Fe3O4颗粒表面;Fe3O4@PEI@Au-seed出现Au元素,表明Fe3O4@PEI表面有Au种子沉积,Fe3O4@PEI@Au-seed制备成功;Fe3O4@PEI@Au的Au峰强度明显增强,表明通過种子介导的金壳包覆成功。图3(c)中每个样品都出现了Cu元素的峰,由于进行TEM检测时,选择了铜网作为样品的载体,出现了Cu信号。在对样品进行扫描时,将铜网与样品视为一个整体,所以EDS光谱中的Cu信号来自于铜网。
2.3 SERS探针制备条件的优化与表征
2.3.1 4-MBA用量和时间优化
分别将1 mmol/L不同体积(50 μL、100 μL、150 μL、200 μL、250 μL、300 μL)的4-MBA加入1 mL AgNPs溶液中,在室温下孵育30 min后,各取20 μL于载玻片上进行SERS检测。结果如图4(a)所示,随着4-MBA用量的增加,SERS信号强度逐渐增强,4-MBA用量为200 μL时SERS信号强度最大;当超过200 μL时,SERS强度呈下降趋势。因此,4-MBA的较佳用量为200 μL,用于后续的试验。为优化4-MBA与AgNPs的孵育时间,将200 μL的1 mmol/L 4-MBA与AgNPs溶液孵育不同的时间(15 min、30 min、45 min、 60 min、75 min、90 min)后进行SERS检测,结果如图4(b)所示,随着时间的不断推移,在60 min时,1 598 cm-1 处的SERS信号强度达到最高值;超过60 min后,SERS信号强度呈下降趋势。因此,确定60 min为最佳反应时间,用于后续的试验。
2.3.2 AgNPs@4-MBA与Aptamer-NH2的用量以及反应时间的优化
为了优化AgNPs@4-MBA与Aptamer-NH2的用量及反应时间,首先将NHS(10 μL,0.1 mol/L)和EDC(5 μL,0.1 mol/L)加入AgNPs@4-MBA溶液中,并在等体积的AgNPs@4-MBA溶液中加入不同体积(50 μL、100 μL、150 μL、200 μL、250 μL、300 μL)的Aptamer-NH2(10 μg/mL),孵育30 min。AgNPs@4-MBA上的4-MBA的羧酸经过活化后与适配体上的氨基形成酰胺键,通过偶联形成SERS探针AgNPs@4-MBA@Aptamer-NH2。如图5(a)所示,当Aptamer-NH2的体积从50 μL增加到200 μL时,1 598 cm-1处的SERS信号不断增强;当体积超过200 μL时,SERS强度呈下降趋势。因此, 200 μL为Aptamer-NH2的最佳用量。SERS信号强度还与Aptamer-NH2、AgNPs@4-MBA两者孵育的时间有关,为此将200 μL Aptamer-NH2加入同体积的AgNPs@4-MBA溶液混合,反应不同的时间(15 min、30 min、45 min、60 min、75 min、90 min)后检测SERS信号,结果如图 5(b)所示,SERS信号强度在15~60 min逐渐增强,超过60 min时,其强度又逐渐降低。因此,确定最佳反应时间为 60 min。
2.3.3 SERS探针的表征
图6(a)为AgNPs的扫描电镜和透射电镜图像。结果显示,制备的AgNPs具有良好的分散性和均一性。图6(b)分别为AgNPs、Ag@4-MBA、Ag@4-MBA@Aptamer-NH2的紫外可见吸收光谱图,由图可知,AgNPs在413 nm处有一个较强的吸收峰,是AgNPs的等离子共振吸收峰(SPR);Ag@ 4-MBA的SPR吸收峰红移至430 nm处,表明通过Ag-S键4-MBA修饰在AgNPs的表面上;Ag@ 4-MBA@Aptamer-NH2的SPR吸收峰红移至440 nm,表明适配体成功结合到AgNPs的表面。
2.4 CRP标准溶液的定量检测
CRP标准溶液检测结果如图7所示。图7(a)标出的1 598 cm-1、1 089 cm-1 2个峰位置是4-MBA的2个主峰,选择1 598 cm-1进行定量分析是因为 4-MBA在1 598 cm-1的拉曼峰强度高于1 089 cm-1处的拉曼峰强度,有利于灵敏度的提高。对不同浓度的CRP标准溶液进行分析检测,在0.1 ng/mL ~ 100 μg/mL范围内,随着CRP浓度的不断增大,在1 598 cm-1处的SERS信号强度逐渐增强,SERS信号强度与浓度的对数值呈现良好的线性关系(图7(b)),线性方程为ISERS = 629.06x+650.5,相关系数R2 = 0.954。R2 = 0.954对于SERS技术是可以接受的,如文献[13]设计的SERS传感器,用于CRP定量检测,其R2 = 0.891 3;Anh[24]设计的SERS传感器用于CRP的定量分析,R2 = 0.97。比较近几年CRP的定量检测方法,结果如表3所示。由表3可知,本法具有较强的特异性,同时线性范围宽、稳定性好、检测限低。
2.5 SERS-磁性適配体传感器性能的研究
考察传感器的选择性和特异性。分别对100 μL 10 μg/mL的C反应蛋白(CRP)、牛血清白蛋白(BSA)、羧酸酯酶(hCE)、免疫球蛋白G(IgG)、甲胎蛋白(AFP)、癌胚抗原(CEA)以及100 μL PBS溶液进行SERS检测,结果如图8(a)、图8(b)所示。除CRP以外的干扰物均产生相应的SERS信号,但信号较弱;目标物质CRP所产生的SERS信号最强,远大于其他物质的信号,表明传感器对CRP具有较好的选择性和特异性。
考察传感器检测的重复性和均一性。对1 μg/mL CRP标准溶液进行检测,采集同一点的SERS信号10次,汇总其SERS光谱图如图9(a)所示。经过多次对同一点的激光照射,其1 598 cm-1处的SERS峰强度略微有所下降,其相对标准偏差RSD为7.51%(n =10)。对100 ng/mL CRP的标准溶液进行检测,采集10次不同点的SERS信号,汇总其SERS光谱图如图9(b)所示,其相对标准偏差RSD为6.43%(n =10)。综上所述,传感器的SERS信号具有较好的重复性和均一性。
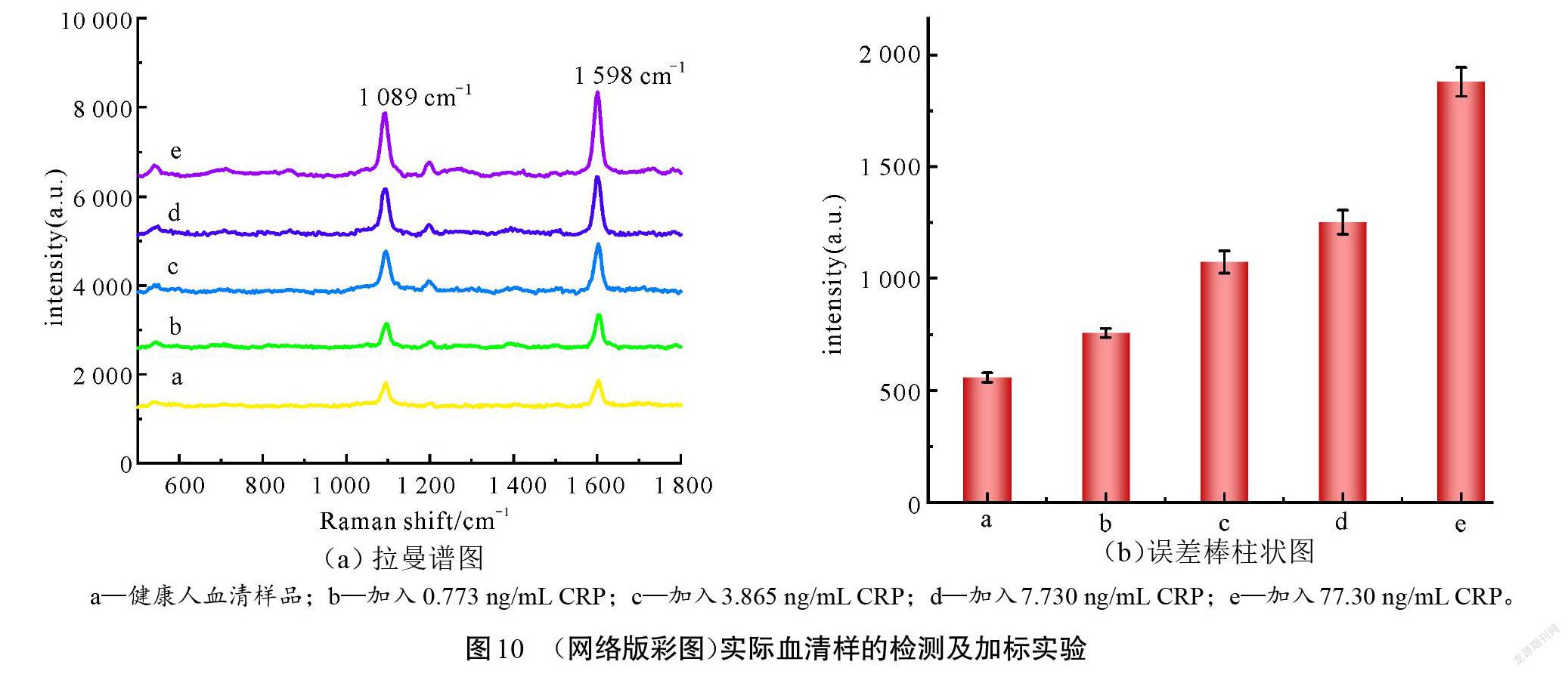
该传感器对实际血清样进行检测,并进行加标试验,结果如图10所示。由图10可知,随着加标量的增加,其SERS强度也逐渐增强。加标前,检测100 μL正常人血清,以1 598 cm-1处拉曼峰强度和标准曲线拟合方程计算出血清中CRP的含量为0.773 ng/mL,这与健康人血清中CRP含量相符[29]。以100 μL不同质量浓度CRP(0.773 ng/mL、3.865 ng/mL、77.300 ng/mL)进行加标试验,结果如表4所示。由表4可知,回收率为93.1% ~109.6%,相对标准偏差RSD≤ 2.39%(n = 3)。结果证明传感器具有较好的准确性,可用于实际血清中CRP的检测。
考察传感器的稳定性。对10 μg/mL CRP的标准溶液进行检测,将制备好的磁性基底和SERS探针置于4 ℃条件下,分别放置1 d、3 d、5 d、7 d、10 d后,进行SERS检测(n = 3),检测结果如图11所示。由图11可知,样品放置的时间越长,SERS信号强度有逐渐降低的趋势,超过7 d后,SERS强度下降明显,表明该传感器稳定时间在7 d以内。
3 结论
本文分别制备了磁性捕获基底Fe3O4 @P EI@Au@Aptamer-SH和信号探针Ag@4-MBA @Aptamer-NH2,成功地构建了CRP的SERS-磁性适配体传感器。对人血清样进行检测和加标试验,取得了令人满意的结果。该传感器具有制备相对简单、特异性强、线性范围宽、准确度高、重现性好等优点。通过改变适配体,该方法也可用于构建其他蛋白质的SERS传感器,因此,具有一定的普 适性。
参考文献
[1] 唐铭擎,毛旭华,龚易昕悦,等.C反应球蛋白分析方法的研究进展[J].分析化学,2020,48(9): 1121-1130.
[2] ANSAR W,GHOSH S. C-reactive protein and the biology of disease[J]. Immunologic Research,2013,56(1):131-142.
[3] 杨芳谊,汤水平.新生儿医院感染败血症病原菌特点及PCT、WBC和CRP表达的临床意义探讨[J].贵州医药,2021,45(12):1878-1879.
[4] CHEN Y T,SHEN J R,YANG H,et al. Serum procalcitonin and C-reactive protein levels as diagnostic markers for distinguishing bacterial infections from lupus flares in systemic lupus erythematosus: a systematic review and meta-analysis[J]. International Immunopharmacology,2021,101(B):108304.
[5] REYNOLDS I S,BOLAND M R,REILLY F,et al. C-reactive protein as a predictor of anastomotic leak in the first week after anterior resection for rectal cancer.[J]. Colorectal Disease: the Official Journal of the Association of Coloproctology of Great Britain and Ireland,2017,19(9): 812-818.
[6] MIAO W,BARD A J. Electrogenerated chemiluminescence. 80. C-reactive protein determination at high amplification with [Ru(bpy)3]2+-containing microspheres[J]. Analytical Chemistry,2004,76(23):7109-7113.
[7] HEO Y,LEE S,LEE S W,et al. Single C-reactive protein molecule detection on a gold-nanopatterned chip based on total internal reflection fluorescence[J]. Bulletin of the Korean Chemical Society,2013,34(9):2725-2730.
[8] WU B,CHEN N,WANG Q,et al. A simple label-free aptamer-based method for C-reactive protein detection[J]. Analytical Methods,2016,8(21):4177-4180.
[9] SHIELDS M J,SIEGEL J N,CLARK C R,et al. An appraisal of polystyrene-(ELISA) and nitrocellulose-based (ELIFA) enzyme immunoassay systems using monoclonal antibodies reactive toward antigenically distinct forms of human C-reactive protein[J]. Journal of Immunological Methods,1991,141(2):253-261.
[10] MARTINEZ J A,COLL J M. Preliminary clinical studies of C-reactive protein quantified by enzyme-linked immunoassay[J]. Clinical Chemistry,1987,33(12):2185-2190.
[11] WANG X,ZHANG J,ZHENG Z,et al. Label-free detection of C-reactive protein using ZnO tetrapods modified quartz crystal microbalance system[J]. Sensor Letters,2013,11(9):1617-1621.
[12] SUN Y,SHI L,MI L,et al. Recent progress of SERS optical nanosensors for miRNA analysis[J].Journal of Materials Chemistry B,2020,8(24):5178-5183.
[13] KIM J,SIM K,CHA S,et al. Single-particle analysis on plasmonic nanogap systems for quantitative SERS[J]. Journal of Raman Spectroscopy,2021,52(2):375-385.
[14] LI X,FIGG C A,WANG R,et al. Cross-linked aptamer-lipid micelles for excellent stability and specificity in target-cell recognition[J]. Angewandte Chemie,2018,57(36):11589-11593.
[15] ZHANG Q,QIU H,TANG F,et al. Aptamer-based dry-reagent strip biosensor for detection of small molecule ATP[J]. Chemistry Letters,2016,45(3):289-290.
[16] MUHAMMAD M,HUANG Q. A review of aptamer-based SERS biosensors:design strategies and applications[J]. Talanta,2021,227:122188.
[17] AMBARTSUMYAN O,GRIBANYOV D,KUKUSH-KIN V,et al. SERS-based biosensors for virus determination with oligonucleotides as recognition elements[J]. International Journal of Molecular Sciences,2020, 21(9):3373-3373.
[18] KIM S M,KIM J,YIM G,et al. Fabrication of a surface-enhanced Raman spectroscopy-based analytical method consisting of multifunctional DNA three-way junction-conjugated porous gold nanoparticles and Au-Te nanoworm for C-reactive protein detection[J]. Analytical and Bioanalytical Chemistry,2022,414(10):3197-3204.
[19] YUAN H,LIU Y,FALES A M,et al. Quantitative surface-enhanced resonant Raman scattering multiplexing of biocompatible gold nanostars for in vitro and ex vivo detection[J]. Analytical Chemistry,2013,85(1): 208-212.
[20] LIU T,LI D,YANG D,et al. An improved seed-mediated growth method to coat complete silver shells onto silica spheres for surface-enhanced Raman scattering[J]. Colloids and Surfaces A-Physicochemical and Engineering Aspects,2011,387(1-3):17-22.
[21] WANG Z Y,LI W,ZHOU Z Q,et al. Experimental indication of chemical effects in surface enhanced hyper Rayleigh scattering using dye-adsorbed Ag nanoparticles[J]. Optical Materials,2011,33(6):920-923.
[22] DENG H,LI X,PENG Q,et al. Monodisperse magnetic single-crystal ferrite microspheres[J]. Angewandte Chemie,2005,44(18):2782-2785.
[23] LEI L,KE Y,ZHANG Z,et al. Facile methods for synthesis of core-shell structured and heterostructured Fe3O4@Au nanocomposites[J]. Applied Surface Science,2012,258(22):8521-8526.
[24] ANH H N,YESOL S,SANG J S,et al. Development of SERS substrate using phage-based magnetic template for triplex assay in sepsis diagnosis[J]. Biosensors and Bioelectronics,2016,85:522-528.
[25] YANG X S,LIU X X,GU B,et al. Quantitative and simultaneous detection of two inflammation biomarkers via a fluorescent lateral flow immunoassay using dual-color SiO2@QD nanotags[J]. Mikrochimica Acta,2020,187(10):570-570.
[26] LI M,XIA X J,MENG S,et al. An electrochemical immunosensor coupling a bamboo-like carbon nanostructure substrate with toluidine blue-functionalized Cu(ii)-MOFs as signal probes for a C-reactive protein assay[J]. RSC Advances,2021,11(12):6699-6708.
[27] RUSSELL S M, DE LA RICA R. Paper transducers to detect plasmon variations in colorimetric nanoparticle biosensors[J]. Sensors and Actuators:B. Chemical,2018,270:327-332.
[28] LIU X,YANG X,LI K,et al. Fe3O4@Au SERS tags-based lateral flow assay for simultaneous detection of serum amyloid A and C-reactive protein in unprocessed blood sample[J]. Sensors and Actuators B:Chemical,2020,320:128350.
[29] 馬小星.血清降钙素原和超敏C反应蛋白水平的变化与炎症性皮肤病伴细菌感染的相关性[J]. 中国现代医生,2020,58(34):126-128.
DNA aptamer-based SERS magnetic biosensor for C-reactive protein
ZHANG Yan1,2, LI Rui1,2, LI Lijun*1,2
(1.Guangxi Key Laboratory of Green Processing of Sugar Resources (Guangxi University of Science and
Technology), Liuzhou 545006, China; 2. School of Biological and Chemical Engineering, Guangxi University
of Science and Technology, Liuzhou 545006, China)
Abstract: A magnetic capture substrate Fe3O4@PEI@Au@Aptamer-SH was prepared by modifying gold-shell magnetic particles with the sulfhydrylated aptamer of C-reactive protein (CRP); a SERS probe Ag@4-MBA@Aptamer-NH2 was prepared by modifying silver nanoparticles with the Raman reporter molecule p-mercaptobenzoic acid (4-MBA) and coupling the aminated aptamer of CRP by amide bond. The magnetic capture substrate, the antigen CRP and the SERS probe formed a sandwich
