FAD核酸适配体生物传感器的制备及其葡萄糖检测的应用
2022-07-07辛嘉英孙立瑞关桦楠
王 艳,王 悦,张 帅,赵 宁,辛嘉英,孙立瑞,关桦楠
(哈尔滨商业大学 食品科学与工程重点实验室,黑龙江 哈尔滨 150076)
葡萄糖作为食品中重要的营养成分之一,其浓度对人体自身的生理活动有很大的影响。浓度过低容易导致中风或其他血管疾病,浓度过高会导致肥胖、糖尿病、肾病、心脏病和神经损伤等。人们通过控制日常膳食中葡萄糖的摄入量,降低患有相关疾病的风险极具现实意义。当前,采用将葡萄糖氧化酶修饰在电极表面制备葡萄糖生物传感器的方法较为普遍,然而,修饰电极过程中需要对酶进行纯化,使成本增加。而且生物酶本身不稳定,受温度、湿度以及pH值等环境条件的影响下易失活,同时葡萄糖氧化酶的生产复杂且成本昂贵。因此,极大地限制该方法在生产实践中的应用。通过将对特定靶标具有识别和结合特性的短链核酸(适配体)与靶分子之间的识别和结合作用转化为灵敏的电化学的检测信号建立的生物传感技术简称为核酸适配体生物传感器,具有性质稳定、反应灵敏、便宜且易于操作等特点,在分析检测领域得到了广泛关注。到目前为止,已经建立了不同的核酸适配体传感器如用于检测蜂蜜中四环素、鱼肉和鹅肉中氯霉素、牛乳中致病菌及微量有害物质等,并且在检测食品中酶毒素和重金属离子具有显著成效。查阅相关文献,当前还没有建立一种检测食品中葡萄糖的核酸适配体生物传感器。因此,本研究将为今后研发核酸适配体生物传感器在食品检测中的应用提供参考。
纳米金(gold nanoparticles,AuNPs)是最早出现的纳米材料,与其他纳米材料相比,具有制备方便、性质稳定、表面易于修饰等优点。近期研究发现,AuNPs具备葡萄糖氧化酶活性,但将其直接用于催化葡萄糖的氧化存在催化活性不足,稳定性差等瓶颈问题。甲烷氧化菌素(methanobactin,Mb)是甲烷氧化细菌分泌的一种功能性小肽,其结构中赖氨酸基团上的—SH或—NH可与单质金形成金硫键(Au—S)或金胺键(Au—NH),可将Mb强力的固定在AuNPs颗粒上,防止AuNPs发生聚集沉淀。黄素腺嘌呤二核苷酸(flavin adenine dinucleotide,FAD)被用作某些氧化还原酶的辅助基团,能够在生物氧化过程中传递氢(H)。其结构中—NH可与游离的—COOH结合形成酰胺键(—CONH—);Behling等将吡咯喹啉醌通过结构中的—NH与FAD结合形成吡咯喹啉醌/FAD单层,并接合葡萄糖氧化酶制备出葡萄糖氧化酶生物传感器。FAD中的异四氧嘧啶环作为氧化还原活性成分,容易接受和捐赠电子,在电解液和电极表面之间进行有效的电子传递。同时,纳米粒子表面结合了FAD可以增强其对葡萄糖的捕获活性,提高选择性,使该核酸适配体生物传感器响应时间缩短,灵敏度提高。
本实验设计的机理如图1A所示,首先,利用AuNPs颗粒大的比表面、强的吸附能力,将Mb包裹于纳米颗粒上,形成稳定的Mb-AuNPs结构体;采用滴涂法将Mb-AuNPs结构体修饰于裸金电极表面。再借助Mb结构中的—COOH与FAD牢固结合(图1B),将FAD引入Mb-AuNPs结构体上,提高对葡萄糖的识别能力。最后,利用巯基试剂中的—SH和Au形成稳定的Au—S键,形成由自组装单层膜紧密包裹的有序体系,该体系比纯物理吸附体系更加稳定。制备了一种价格低廉、制备简单、灵敏度高、易于操作的新型核酸适配体生物传感器。
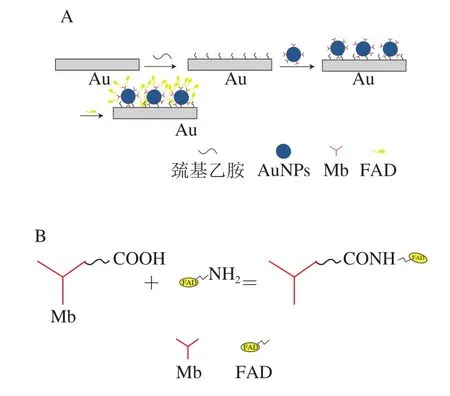
图1 生物传感器制备机理图(A)、Mb与FAD结合机制图(B)Fig. 1 Mechanism of biosensor preparation (A), and Mb-FAD binding mechanism (B)
1 材料与方法
1.1 材料与试剂
毛桃 市购。
甲基弯菌OB3b、NMS培养基俄罗斯科学院催化研究所;Diaion HP-20大孔树脂 日本三菱化工公司;无水乙醇(≥99.7%) 天津富宇精细化工有限公司;氯金酸 国药集团上海试剂公司;葡萄糖、黄素腺嘌呤二核苷酸二钠盐(≥97%)、-巯基乙胺、硫酸、过氧化氢(30%)、铁氰化钾、亚铁氰化钾、氯化钾(均为分析纯) 天津市天力化学试剂有限公司;配制溶液的水均为去离子水,实验用水为二次蒸馏水。
1.2 仪器与设备
CHI630电化学工作站、金电极(=3 mm)、铂丝电极、Ag/AgCl电极 上海辰华仪器公司;UV-2550紫外-可见分光光度计 日本岛津公司;F-7000型傅里叶红外吸收光谱仪 日本日立公司;JEM-2100F场发射高分辨透射电镜 日本JEOL公司。
1.3 方法
1.3.1 FAD核酸适配体生物传感器的制备
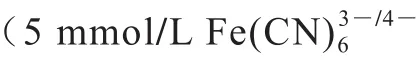
1.3.2 FAD核酸适配体生物传感器表征
将制备好的FAD核酸适配体生物传感器置于6 mL葡萄糖溶液(1 mmol/L葡萄糖溶液与pH 7.2~7.4的0.1 mol/L磷酸盐缓冲溶液(phosphate buffer saline,PBS)1∶2)中进行CV法扫描(-0.2~0.6 V),扫描速率为0.05 V/s,然后结合交流阻抗法及透射电镜对FAD核酸适配体生物传感器进行结构表征。
1.3.3 FAD核酸适配体生物传感器构建条件优化
1.3.3.1 Mb与AuNPs物质的量比对响应电流的影响
用滴涂法将Mb、AuNPs按1∶1、1∶2、1∶4、2∶1和4∶1物质的量比配制,分别滴涂在打磨好的金电极上,冰箱内静置至形成薄膜。取5 mL 5 mmol/L铁氰化钾溶液于容器中,先采用CV法(-0.2~0.6 V)扫描激活电极,再将电极置于6 mL葡萄糖溶液中CV法进行测定 。
1.3.3.2 FAD浓度对响应电流的影响
黄素腺嘌呤二核苷酸二核苷酸二钠盐按1.6×10、2.0×10、2.4×10、2.8×10、3.2×10mol/L和3.6×10mol/L配制,取2 μL同其他混合溶液分别滴涂在打磨好的金电极上,冰箱内静置至形成薄膜,再取5 mL(5 mmol/L)铁氰化钾溶液于底液槽中,采用CV法扫描激活电极,再将电极置于6 mL葡萄糖溶液中进行测定。
1.3.3.3 交联剂(-巯基乙胺)浓度对响应电流的影响
用滴涂法将-巯基乙胺试剂按4.0×10、8.0×10、12.0×10、16.0×10、20.0×10mol/L和24.0×10mol/L浓度配制,同其他混合溶液分别滴涂在打磨好的金电极上,冰箱内静置至形成薄膜,再取5 mL铁氰化钾溶液于底液槽中,采用CV法扫描激活电极,再将电极置于6 mL葡萄糖溶液中进行测定。
1.3.3.4 构建时间对响应电流的影响
用滴涂法将上述混合溶液分别滴涂在打磨好的金电极上,冰箱内分别静置4、6、8、10、12 h和14 h。取出电极CV法(-0.2~0.6 V)分别在铁氰化钾溶液和葡萄糖溶液进行扫描测定。
1.3.4 FAD核酸适配体生物传感器检测葡萄糖性能
1.3.4.1 检测温度对葡萄糖检测响应的影响
用滴涂法将3 μL-巯基乙胺、2 μL FAD同Mb、AuNPs混合溶液分别滴涂在打磨好的金电极上,冰箱内静置至形成薄膜。将6 mL葡萄糖溶液放置于15、20、25、30、35 ℃和40 ℃水浴锅中加热2~3 min后取出。将电极置于该体系CV法进行测定,考察温度对葡萄糖体系检测的影响。
1.3.4.2 缓冲溶液pH值对葡萄糖检测响应的影响
用滴涂法将3 μL-巯基乙胺、2 μL FAD同Mb、AuNPs混合溶液分别滴涂在打磨好的金电极上,冰箱内静置至形成薄膜。配制pH 6.4、6.8、7.2、7.4、7.8的PBS,与1 mmol/L葡萄糖溶液1∶2混合后用于测定。将模拟酶电极置于该体系CV法(-0.2~0.6 V)进行测定,考察不同pH值的PBS对葡萄糖检测体系的影响。
1.3.5 模拟葡萄糖氧化酶特性
在最适质量浓度、修饰时间、检测温度下将制备好的核酸适配体生物传感器,放入5 mL铁氰化钾溶液于底液槽中,采用CV法(-0.2~0.6 V)扫描激活电极,再将其置于葡萄糖溶液进行CV法测定。结合时间-电流曲线法在恒定的电压下每隔20 s连续向0.1 mol/L PBS溶液(pH 7.2)中加入0、10、50、100、200 μmol/L的葡萄糖进行表征。
1.3.6 实际样品检测
样品(毛桃)的预处理:毛桃去皮去核,切成小块装入榨汁机中,加入30 mL去离子水,榨成均匀液态,然后用布氏漏斗过滤2 次,再转移至100 mL容量瓶定容,混匀后用0.45 μm的滤膜过滤1 次,最后转移至100 mL容量瓶中待用。加入不同浓度的葡萄糖标准液,重复测定3 次,考察检测体系的加标回收率,并评价检测体系的精确度和重复性。
1.4 数据处理
每组数据均重复3 次,利用Origin 8.0软件处理数据作图,采用Excel 2016软件对数据进行分析。
2 结果与分析
2.1 FAD核酸适配体生物传感器的构建机制
2.1.1 FAD核酸适配体生物传感器的光谱分析
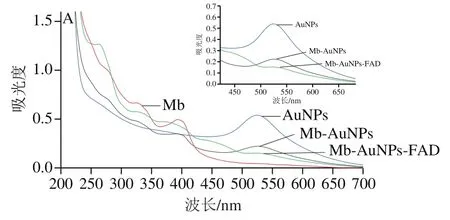
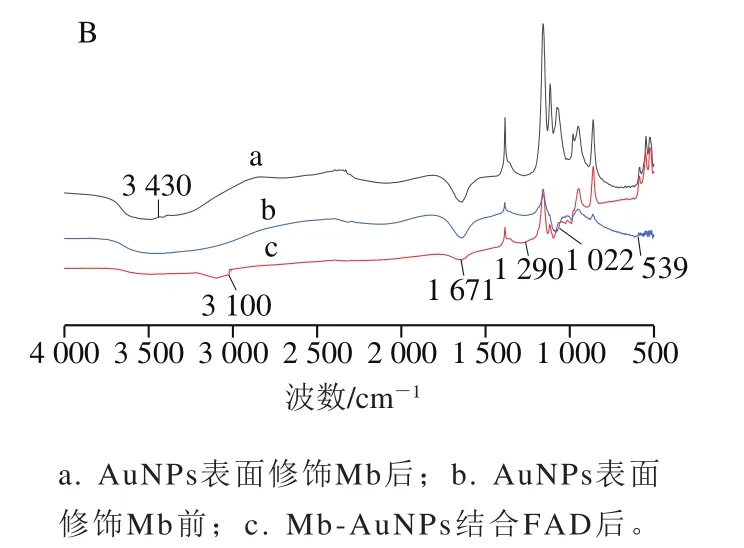
图2 AuNPs中加入Mb及FAD的紫外-可见扫描图谱(A)、AuNPs表面修饰Mb前后以及Mb-AuNPs结合FAD后的傅里叶变换红外光谱(B)Fig. 2 UV-visible spectra of AuNPs with Mb and FAD (A), and Fourier transform infrared spectra (B) of AuNPs before and after surface modification with Mb and Mb-AuNPs-FAD
首先在200~800 nm波长范围内对AuNPs中逐渐加入Mb及FAD过程进行紫外-可见分光光度计检测。如图2A所示,Mb在282、340 nm和394 nm处出现3个特征峰。柠檬酸钠法制备的AuNPs溶胶在520 nm左右出现一个特征峰,此峰为AuNPs粒子的共振吸收峰。向AuNPs中添加Mb,Mb分子中二硫醚S与Au具有强相互作用力,形成稳定的Mb-AuNPs结构体。修饰Mb前后AuNPs的特征峰位置未发生改变,但520 nm处的吸光度降低;同时282、340 nm和394 nm处的吸光度也显著下降,证实Mb已经吸附在AuNPs粒子表面。向体系中加入FAD后,放置3~4 min测定。520 nm处的吸光度继续下降,而340、394 nm处的吸光度显著升高并趋于稳定,说明吸附在AuNPs粒子表面的Mb通过—CONH—与FAD结合;并且FAD可激活Mb部分活性位点。
在500~4 000 cm范围内对AuNPs、Mb-AuNPs及Mb-AuNPs-FAD分别进行红外光谱检测。如图2B所示,曲线b是柠檬酸钠法制备的AuNPs溶胶的红外光谱图,曲线a是经Mb修饰AuNPs的红外光谱图在3 430、1 671、1 022 cm和539 cm的振动带,均能证实Mb分子的存在。3 430 cm带是由酰胺II的N—H和氢键伸缩振动引起。1 676 cm振动带是羧基和酰胺基C=O伸缩振动的结果。1 022 cm和539 cm处的谱带是通过C—S和S—S伸缩振动产生,C—N拉伸振动引起1 385 cm周围的振动谱带发生变化。Mb与AuNPs结合后,位于539 cm处的S—S伸缩振动和1 676 cm处酰胺I带峰减弱。表明Mb内的二硫醚与Au存在较强的相互作用,通过形成Au—S键与AuNPs粒子结合。曲线c是向Mb修饰的AuNPs中加入FAD的红外光谱图,随着FAD的加入,在1 700~1 640 cm的范围内显示C=O基团的伸缩振动带。在3 475~3 150 cm范围内观察到N—H的伸缩振动。在3 100 cm和1 290 cm左右的地方出现酰胺基(—CONH—)的特征吸收峰。该结果与图3紫外光谱结果一致,可清晰地表明FAD结构中的—NH已成功地与Mb中的—COOH形成稳定的酰胺键,并结合到纳米粒子的表面上,使得其表面电子转移速率增强。
2.1.2 FAD核酸适配体生物传感器的透射电镜分析

图3 AuNPs(A)、Mb-AuNPs(B)和Mb-AuNPs-FAD(C)的透射电镜Fig. 3 Transmission electron microscopic images of AuNPs (A),Mb-AuNPs (B) and Mb-AuNPs-FAD (C)
透射电镜下观察,AuNPs颗粒(图3A)粒子分散性较好,呈圆球形,形态分布均一。当AuNPs与Mb结合形成Mb-AuNPs结构体后(图3B),Mb阻止了AuNPs颗粒之间的团聚,改善了颗粒的分散性,但颗粒之间的间距均匀性欠佳。当FAD通过与Mb结构中的—COOH与Mb紧密结合(图3C),AuNPs颗粒的分散性进一步增强可使其催化活性增加,且颗粒分布的均匀性得到显著改善。
2.1.3 FAD核酸适配体生物传感器的电化学分析
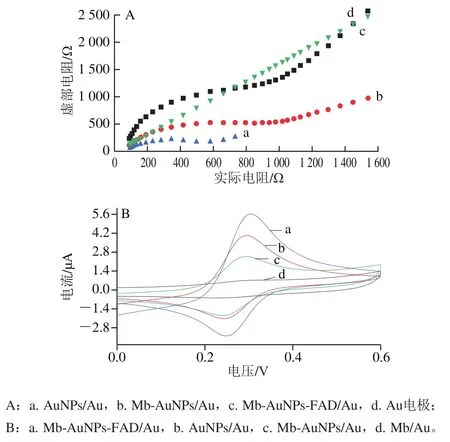
图4 不同生物传感器在电解液体系的交流阻抗图(A)及在葡萄糖体系的循环伏安图(B)Fig. 4 AC impedance plot of different biosensors in the electrolyte system (A) and cyclic voltammogram in the glucose-sugar system (B)
交流阻抗谱法可以更加深入地研究电极电阻的变化,阻抗图中圆弧半径越大表明电极表面阻抗值增大。电极的阻抗值随着每一种物质的加入而增大,表明材料已经成功的修饰在电极上。由于裸金电极不与电解液发生氧化还原反应,如图4A曲线d所示,交流阻抗曲线几乎为一条直线。带有负电的AuNPs粒子与不带电的裸金电极接触形成Au—Au键,通过静电吸附力AuNPs被吸引、贴附在裸金电极表面。如图4A曲线a电极表面电流阻抗值也随之发生变化,说明其异向电子阻碍作用较小。修饰在电极表面的AuNPs可以催化体系中的葡萄糖发生氧化反应,因而产生一对较强的氧化还原峰如图4B曲线b(=0.307 4 V,=4.02 μA;=0.222 0 V,=-2.124 μA)。
将Mb滴加在金电极表面,AuNPs表面的空隙进一步减少,Fe(CN)转移到电极表面受到的阻力增大。如图4A曲线b表明电极表面阻抗值增大,说明Mb已经紧密吸附在AuNPs粒子表面。由于Mb不具有氧化酶(催化)活性,单独修饰在金电极表面,电极上无氧化还原物质产生,如图4B曲线d表示Mb在反应体系中不发生氧化还原反应。将Mb与AuNPs混合修饰在金电极表面,固定在AuNPs颗粒上的Mb会降低纳米粒子传输电子及催化葡萄糖氧化的能力,如图4B曲线c氧化还原峰电流稍微降低(=2.251 μA;=-1.821 μA)。FAD通过结构中的—NH与Mb中的—COOH形成稳定的酰胺键,修饰在金电极表面,如图4A曲线c阻抗值明显增大证明该体系不断形成更加致密的自主装膜,使电极表面与电解液的电子传输阻碍加剧。由于FAD可以在溶液和电极表面传输电子,进一步催化葡萄糖反应;如图4B曲线a氧化还原峰电流都明显的增加(=0.307 V,=5.621 μA;=0.246 V,=-1.885 μA);该核酸适配体生物传感器的葡萄糖氧化酶活性显著提高,证实FAD可加速体系中葡萄糖氧化。
2.2 FAD核酸适配体生物传感器的优化
2.2.1 Mb-AuNPs物质的量比对响应电流的影响
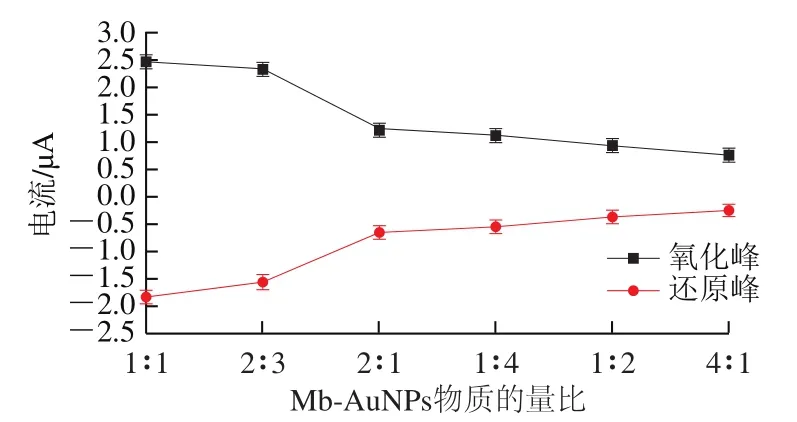
图5 Mb-AuNPs物质的量比与响应电流的关系Fig. 5 Relationship between molar ratio of Mb to AuNPs and response current
Mb-AuNPs物质的量比决定模拟葡萄糖氧化酶催化活性及核酸适配体生物传感器稳定性好坏。如图5所示,当Mb-AuNPs物质的量比为1∶2、2∶3和1∶4时,氧化峰的响应电流值降低。可能是大量的AuNPs易发生粒子团聚现象阻碍电流传递,导致生物传感器催化性能降低,当Mb-AuNPs物质的量比为4∶1时,由于AuNPs表面被大量的Mb紧密包围,AuNPs粒子的催化活性位点减少,并且Mb本身不具备传递电子的作用,导致FAD核酸适配体生物传感器模拟酶葡萄糖氧化酶的活性降低,氧化还原峰的响应电流值到达最低。因此,本实验选择1∶1为Mb、AuNPs的最佳物质的量比。
2.2.2 FAD浓度对响应电流的影响
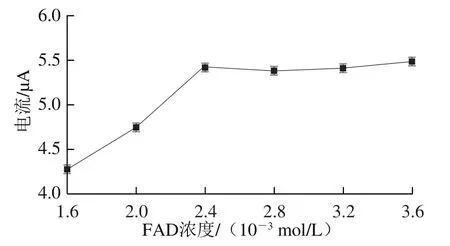
图6 FAD浓度与响应电流的关系Fig. 6 Relationship between response current and FAD concentration
FAD在核酸适配体生物传感器催化葡萄糖反应过程充当氧化还原的电子载体,主要起到传递氢的作用。本实验考察1.6×10~3.6×10mol/L FAD构建的FAD核酸适配体生物传感器,并在1 mmol/L的葡萄糖溶液中检测响应电流。如图6所示,当FAD浓度在1.6×10~3.6×10mol/L时,氧化峰电流值持续上升,适量的FAD可以增强其对葡萄糖的捕获活性,提高选择性,使生物传感器响应时间缩短,灵敏度提高。FAD浓度过高其Mb结合位点接近饱和,造成浪费;同时在2.4×10~3.6×10mol/L范围内,体系反应速率变缓,基本已经达到最优的反应效果。因此,本实验选择2.4×10mol/L为FAD的最佳浓度。
2.2.3-巯基乙胺浓度对响应电流的影响
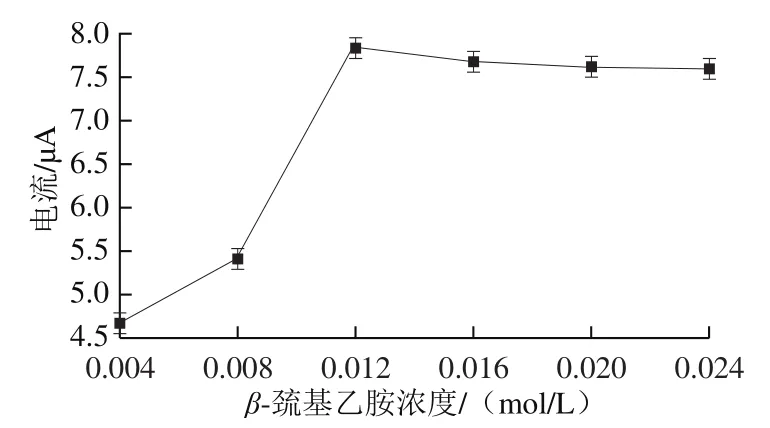
图7 交联剂浓度与响应电流的关系Fig. 7 Relationship between concentration of cross-linker and response current
以交联剂-巯基乙胺作为Mb-AuNPs结构体负载在金电极上的黏结剂,它起到防止Mb-AuNPs结构体泄露的作用。本实验考察0.004~0.024 mol/L的-巯基乙胺构建的核酸适配体生物传感器,并在1 mmol/L葡萄糖溶液中检测响应电流。如图7所示,-巯基乙胺浓度在0.004~0.012 mol/L时,氧化峰响应电流值逐渐升高。适量的-巯基乙胺可以有效调整Mb-AuNPs结构体在裸金电极表面的空间分布,使得Mb-AuNPs结构体拥有更好的分布密度和取向。当-巯基乙胺浓度在0.012~0.024 mol/L时,氧化峰响应电流值缓慢降低。-巯基乙胺本身不导电,过量的巯基乙胺会影响金电极的导电性,进而影响Mb-AuNPs-FAD结构体在电极表面表达生物活性,导致核酸适配体生物传感器催化性能降低,因此,本实验选择0.012 mol/L-巯基乙胺为交联剂浓度。
2.2.4 构建时间对响应电流的影响
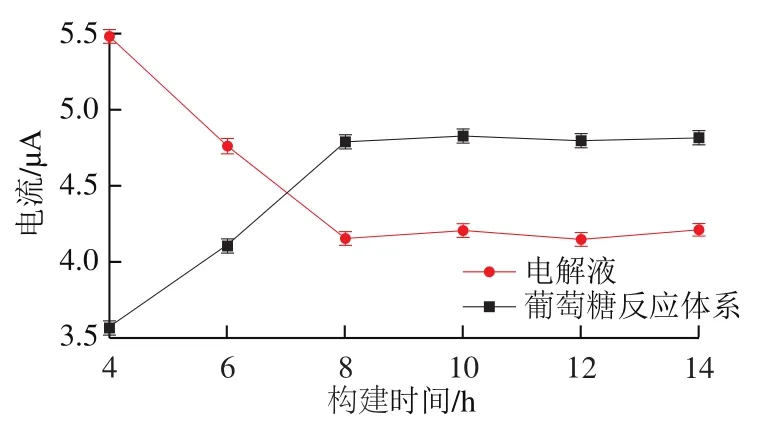
图8 生物传感器构建时间与响应电流的关系Fig. 8 Relationship between biosensor construction time and response current
影响生物传感器催化性能的关键因素是构建时间。本实验考察0~14 h,核酸适配体生物传感器在电解液及葡萄糖体系中响应电流的变化情况。如图8所示,在电解液体系中构建时间在4~8 h氧化峰电流值呈下降趋势,8~14 h氧化峰电流值缓慢下降。构建时间为8 h时,氧化峰电流达到最低值。在葡萄糖体系中构建时间在4~8 h氧化峰电流值成上升趋势,8~14 h氧化峰电流值缓慢上升。构建时间为8 h时,氧化峰电流达到最高值。结果表明:构建时间过短时,交联剂和Mb-AuNPs-FAD结构体形成的薄膜未能与电极表面紧密贴合,催化葡萄糖反应过程中易脱落。构建时间过长时,AuNPs和Mb在空气中长时间暴露易被氧化导致Mb-AuNPs结构体生物活性降低。当构建时间为8 h时,检测体系反应效果基本达到最优,因此本实验选择8 h为FAD核酸适配体生物传感器最优的构建时间。
2.3 检测参数对核酸适配体生物传感器性能的影响
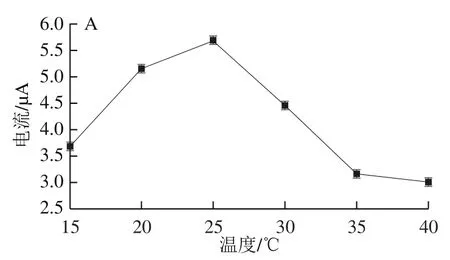
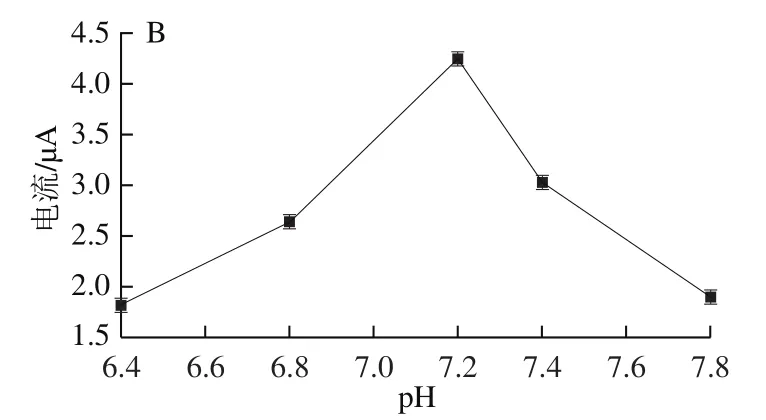
图9 检测温度(A)、缓冲溶液pH值(B)与响应电流的关系Fig. 9 Relationship between detection temperature (A), buffer solution pH (B) and response current
如图9A所示,考察15~40 ℃不同温度与氧化峰响应电流的关系。温度由15 ℃上升至25 ℃时,FAD核酸适配体生物传感器催化葡萄糖反应的速率加快,该温度段氧化峰响应电流升高,在25 ℃时,响应电流值达到最高值。表明在15~25 ℃范围内,FAD核酸适配体生物传感器模拟葡萄糖氧化酶活性具有较好的催化效果。温度由25 ℃继续升高至40 ℃,氧化峰响应电流逐渐降低,推测可能持续的高温导致Mb活性降低从AuNPs表面脱落,从而使FAD结合量减少,导致核酸适配体生物传感器对葡萄糖的捕获活性活性降低。考虑到核酸适配体生物传感器其实用性,反应温度过高不利于对实际样品检测,同时在20~25 ℃范围内,体系反应速率变缓,基本已经达到最优的反应效果,本实验选择25 ℃为最佳检测温度。
为了优化核酸适配体生物传感器的催化性能,对检测体系的pH值进行了优化,分别为pH 6.4、6.8、7.2、7.4和7.8。如图9B所示,pH 6.4~6.8时,AuNPs在酸性条件下粒径变大催化活性降低,间接影响核酸适配体生物传感器的检出限、灵敏度等。pH 7.4~7.8时,氧化峰电流迅速下降,推测在碱性条件下,Mb易失活从电极表面脱落,导致FAD结合量减少,FAD核酸适配体生物传感器的模拟葡萄糖氧化酶的活性降低。当pH 7.2时,氧化峰电流值达到最高,FAD核酸适配体生物传感器对葡萄糖的检测效果最佳,更符合实验所需pH值条件。
2.4 模拟葡萄糖氧化酶特性
2.4.1 循环伏安法分析
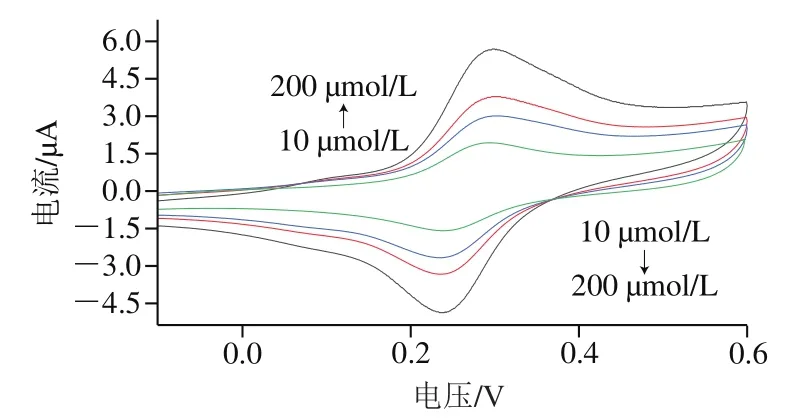
图10 FAD核酸适配体生物传感器在葡萄糖溶液体系中的循环伏安图Fig. 10 Cyclic voltammogram of FAD aptamer-based biosensor in glucose solution
在优化实验条件下,向5 mL 0.1 mol/L PBS中加入不同浓度葡萄糖,CV法进行测定。循环伏安曲线随着不同浓度葡萄糖溶液的加入出现显著变化,如图10所示,氧化峰电流由1.926 μA增加到5.662 μA,氧化峰电位由0.289 V增加到0.298 V。还原峰电流由-1.592 μA增加到-4.866 μA,还原峰电位由0.244 V增加到0.266 V。结果表明,FAD核酸适配体生物传感器在葡萄糖体系中对葡萄糖有明显的响应信号。在10~200 μmol/L时葡萄糖浓度与氧化峰电流之间呈现良好的线性关系。
2.4.2 时间电流法分析
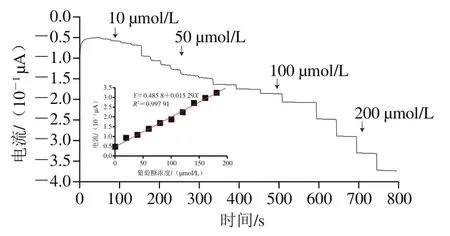
图11 FAD核酸适配体生物传感器对葡萄糖的时间电流响应(0.1 mol/L PBS,pH 7.2)Fig. 11 Time-current response of FAD aptamer-based biosensor to glucose (in 0.1 mol/L PBS at pH 7.2)
在优化体系条件下,每隔20 s连续向0.1 mol/L PBS溶液(pH 7.2)中加入0、10、50、100、200 μmol/L的葡萄糖,采用时间电流法进行测定。考察FAD核酸适配体生物传感器对葡萄糖的电流响应,结果如图11所示,该传感器还原峰值随着葡萄糖浓度的增加逐渐递增。葡萄糖在10~200 μmol/L浓度范围内与该核酸适配体生物传感器的响应电流呈良好的线性关系=0.485 8+0.015 29,相关系数=0.997 91,检出限为4.22×10mol/L,与图10循环伏安法结果一致。与之前的AuNPs催化葡萄糖检测方法相比具有显著优势。
2.5 稳定性、重复性实验结果
使用同一根FAD核酸适配体生物传感器测定葡萄糖样品溶液,重复测定5 d。如图12所示,平均峰电流为4.027 μA,相对标准偏差为0.45%,表明该核酸适配体生物传感器的重复性良好。再将制备好的电极在冰箱中放置7 d,然后进行检测。氧化峰电流为3.447 μA,与第5天的酶电极峰电流相比无显著差异(>0.05),表明该核酸适配体生物传感器的稳定性良好,使用寿命长,可以进行实际应用。
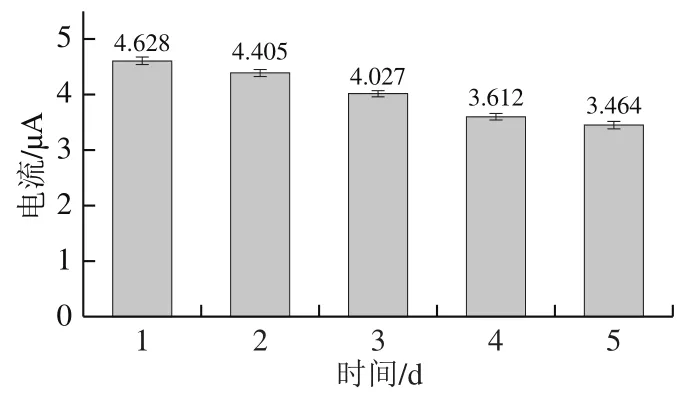
图12 重复性实验结果Fig. 12 Results of repeatability test
2.6 实际样品检测结果
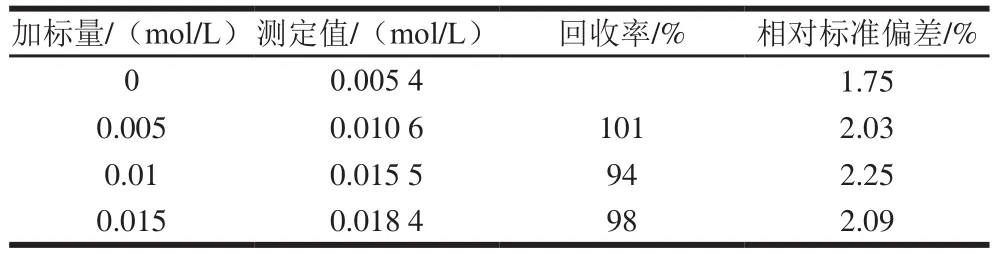
表1 毛桃样品中不同浓度葡萄糖含量的回收率Table 1 Recoveries of different concentrations of glucose in spiked actual samples
对4 只试管内葡萄糖含量进行测定,结果如表1所示。FAD核酸适配体生物传感器在其所允许的误差范围内,对毛桃中葡萄糖含量的加标回收率均在94%~101%之间,相对标准偏差在1.75%~2.25%之间。表明该核酸适配体生物传感器检测体系准确可靠,具有良好的精确度和重复性。
3 结 论
利用AuNPs颗粒较强的吸附能力,将Mb包裹于纳米颗粒上,形成稳定的Mb-AuNPs结构体。采用滴涂法将Mb-AuNPs结构体修饰于裸金电极表面,借助Mb结构中的—COOH与FAD牢固结合,再将FAD引入Mb-AuNPs结构体上,提高对葡萄糖的识别能力,从而构建具备葡萄糖氧化酶活性的新型核酸适配体生物传感器。通过循环伏安法及时间-电流曲线法探讨了其应用于葡萄糖检测的可行性。研究结果显示,核酸适配体生物传感器最佳构建时间为8 h,Mb与AuNPs最佳物质的量比为1∶1,FAD最佳浓度为2.4×10mol/L,巯基试剂浓度为0.012 mol/L。在25.0 ℃、pH 7.2时,葡萄糖浓度在10~200 μmol/L与该核酸适配体生物传感器的响应电流呈现良好的线性关系为0.997 91。新型核酸适配体生物传感器检出限为4.22×10mol/L,相对标准偏差为0.45%,具有制备简单,检测效果灵敏,使用寿命长,稳定性良好等特点。本研究将为今后核酸适配体生物传感器在食品检测中的应用提供参考。
