原发性下腔静脉平滑肌肉瘤15例诊治分析
2022-07-06田腾正周嘉乐吴小荣陈勇辉黄吉炜黄翼然
田腾正,周嘉乐,吴小荣,孔 文,陈勇辉,张 进,黄吉炜,薛 蔚,黄翼然
(1.山东第一医科大学第二附属医院泌尿外科,山东泰安 271000;2.上海交通大学医学院附属仁济医院泌尿科,上海 200120)
原发性下腔静脉平滑肌肉瘤(primary leiomyosarcoma of the inferior vena cava,PIVCLS)是起源于血管内膜平滑肌的罕见间叶细胞肿瘤[1]。出现临床症状时,肿瘤往往已累及肝、肾甚至心脏等重大脏器,肿瘤切除后将造成大段血管缺失,手术难度大[2-4],且手术切除后患者预后仍然不佳。目前为止,对于下腔静脉平滑肌肉瘤的研究多数是短期随访的孤立病例报告,部分小样本回顾性研究表明,经根治性手术切除的下腔静脉平滑肌肉瘤患者的5年生存率为31%~66.7%[5-8]。在此,我们报告本中心15例下腔静脉平滑肌肉瘤病例及预后情况,总结影像学特点,并对该疾病的诊治进行文献回顾及探讨。
1 资料与方法
1.1 一般资料本组患者共15例,平均年龄为56.3岁,其中男性3例,女性12例,5例为体检发现腹膜后肿块至我院就诊,其余10例因腹部疼痛、消瘦或下肢水肿等症状就诊。15例患者均行计算机断层扫描(computed tomography,CT)或核磁共振(magnetic resonance imaging,MRI)检查。15例影像学检查均提示为腹膜后病变。
1.2 影像学检查术前6例患者行CT平扫+增强检查,9例行MRI平扫+增强检查。分别应用Philips Brilliance iCT、GE Discovery MR750 3.0 T完成检查。3例患者在完成增强CT或增强MRI的基础上行下腔静脉造影检查。
1.3 手术方法15例患者手术方式均为经腹开放手术,均完整切除肿瘤,其中14例行肿瘤切除后下腔静脉缩窄缝合,1例患者在术前行下腔静脉造影明确存在良好的侧枝循环的基础上,行肿瘤切除后下腔静脉缝扎。15例手术患者中有10例因累及右肾行肾脏切除,其中2例同期切除右侧肾上腺。
1.4 随访以电话询问或门诊复诊的形式进行。
2 结 果
2.1 CT、MRI及下腔静脉造影15例患者中6例行CT平扫+增强检查,9例行MRI平扫+增强检查。CT或MRI表现为下腔静脉走行区软组织肿块,肿瘤最大径5~10 cm不等,平均最大径7.3 cm。3例肿瘤以下腔静脉腔内生长为主,12例以下腔静脉腔外生长为主。以血管腔内生长为主肿瘤表现为下腔静脉内软组织肿物,以血管壁为较为清楚的边界,CT平扫表现为低密度影,MRI平扫表现为T1WI呈稍低信号,T2WI呈稍高信号,在注入对比剂后表现为较为明显的边缘强化和延迟强化,在动脉期开始出现轻度边缘强化,静脉期边缘强化明显,肿瘤中心区域在对比剂衬托下呈明显的囊性或液化坏死表现。以血管腔外生长为主肿瘤表现为腹膜后软组织肿物,体积较大,边界欠清,可呈分叶状,CT平扫表现为不均质低密度影,MRI平扫表现为T1WI呈稍低信号,T2WI呈高低混杂信号,注入对比剂后不均匀斑片状强化。15例中有1例可见较为明显的钙化。15例患者中6例存在较为明显的肿瘤远心端下腔静脉扩张,1例存在较为明显的肿瘤远心端下腔静脉萎缩,其余8例肿瘤远心端下腔静脉内径无明显变化。所有病例均可见较为明显的侧枝静脉扩张,以腰静脉扩张最为明显。本组病例中部分患者的影像学图像资料见图1。

A、B :增强CT动脉期及静脉期,可见肿瘤边缘在动脉期呈轻度强化而在静脉期呈明显强化(白箭头所示),中心区域呈低密度区并可见一处钙化点(黑箭头所示);C:增强MRI动脉期可见肿瘤呈分叶状,呈斑片状不均匀强化;D :增强MRI静脉期可见肿瘤远心端下腔静脉明显萎缩变细;E: 增强MRI静脉期可见侧枝循环形成,箭头所示腰静脉明显增粗;F: 增强MRI动脉期可见肿瘤呈分叶状,呈斑片状不均匀强化。图1 下腔静脉平滑肌肉瘤患者影像图片
2.2 病理
2.2.1大体 本组15例术后大体标本见肿瘤自下腔静脉壁生长,肿瘤标本最大径5~10 cm,平均7.3 cm,切面可见肿瘤呈实性,鱼肉状,灰白色或灰黄色。3例以下腔静脉腔内生长为主,另外12例以下腔静脉腔外生长为主;4例剖开可见出血坏死;10例肿瘤侵犯右肾,肾脏结构均被严重破坏,其中2例同时侵犯右侧肾上腺,大体标本可见肾上腺正常形态消失。13例患者切缘阴性,2例患者切缘阳性。见图2。
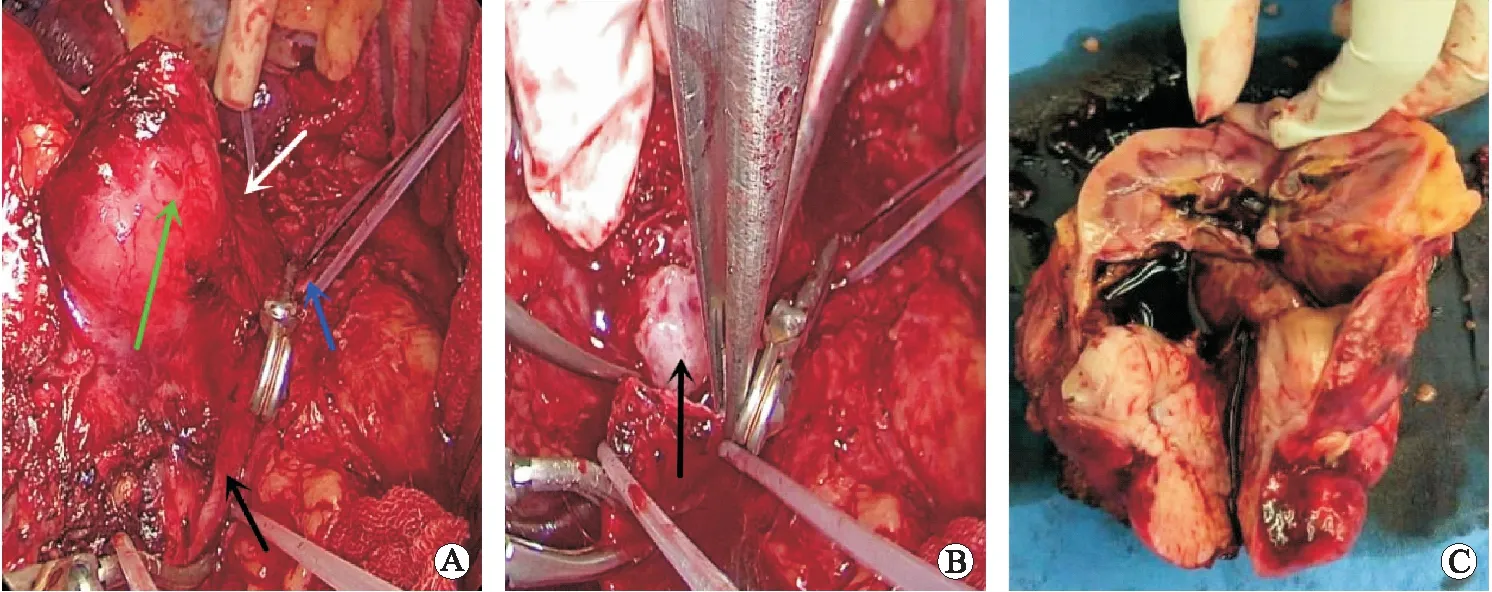
A:术中见肿瘤(绿色箭头所示)累及右肾,显露下腔静脉及左肾静脉,并阻断肿瘤上、下方下腔静脉(白色及黑色箭头所示)以及左肾静脉(蓝色箭头所示);B:术中剪开下腔静脉显露肿瘤(黑色箭头所示);C:术后大体标本,可见肿瘤以血管腔外生长为主,侵及肾脏,剖面成灰黄色,鱼肉状,可见肿瘤内出血坏死。图2 下腔静脉平滑肌肉瘤患者术中所见及大体标本
2.2.2镜下(HE及免疫组化) 镜下观察可见梭形细胞交错生长,存在许多有丝分裂,部分细胞类似平滑肌细胞,但具有中重度异形,细胞核大、浓染,核分裂像多见,可见病理性核分裂和多核瘤巨细胞。免疫组化:15例患者中13例可见肌间线蛋白Desmin呈阳性,12例平滑肌肌动蛋白SMA呈阳性。部分病例CD34和CD117呈局灶性阳性。见图3。
2.3 术后辅助治疗2例切缘阳性患者术后行全身化疗加局部放疗。13例切缘阴性患者中11例行全身化疗,其余2例术后未行辅助治疗。
2.4 随访结果本组15例患者随访时间4~69个月,中位随访时间33个月。7例死亡,均死于术后肿瘤复发或转移。中位生存时间46个月。其中2例切缘阳性病例分别于术后19个月和26个月死亡。 现存活的8例患者中4例处于无瘤存活状态,1例发现局部复发,3例出现肿瘤远处转移。
3 讨 论
下腔静脉平滑肌肉瘤是一种罕见的恶性肿瘤,起源于静脉壁平滑肌,可以在腔内或腔外生长或者是混合生长,以一种模式为主,以腔外生长更为多见[9]。本病可发生于任何年龄,但中老年女性患者居多,男女比例约为1∶5,中位发病年龄54岁[10]。本病症状隐匿或不典型且无特异性肿瘤标志物[11]。本研究病例中3例肿瘤以腔内生长为主,12例以腔外生长为主;男性3例,女性12例,平均年龄56.3岁,与文献报道基本相符。
CT多表现为腹膜后软组织肿块,肿块一般较大,呈圆形或类圆形,常伴有分叶状,坏死、囊变比较常见,出血及钙化可发生但较少见[12]。MRI被认为是目前最理想的无创性检查方法,肿块多表现为 T1WI等或稍低信号T2WI等高混杂信号,增强扫描肿瘤呈不均匀强化,MRI下腔静脉成像可清楚显示病灶全貌及肿瘤累及范围,可纵向观察到截断征象或充盈缺损,而且可以显示侧支循环形成的程度。本研究中3例以下腔静脉腔内生长为主肿瘤表现为典型的中心囊性变,增强CT或增强MRI表现为中心相对于于边缘呈明显的低密度或低信号,边缘强化较为明显,且静脉期强化程度明显高于动脉期,强化模式呈典型的边缘强化和延迟强化,这与SESSA[13]报道相符合;12例以下腔静脉腔外生长为主肿瘤表现为腹膜后软组织肿物伴有斑片状坏死或囊性变,分叶多见,增强CT或增强MRI表现为斑片状不均匀强化,动脉期即表现为较为明显的强化,静脉期强化更为明显。两种不同类型的强化模式可以被初步总结为PIVCLS的影像学特点。与CT相比,MRI可以提供更准确的关于肿瘤的位置、范围、侧支血管和邻近结构的信息,具有优越的软组织分辨率、更安全的造影材料,并且可以使患者避免暴露于电离辐射。T2加权黑血序列和高浓度造影剂可以克服CT的局限性,清晰地显示下腔静脉和侧支血管的血管壁和管腔[14]。由于肿瘤的压迫,在增强CT检查过程中肿瘤周围静脉或穿行于肿瘤内的静脉可能因为造影剂不能得到良好的填充而无法得到理想的显示,而在MRI T2加权黑血序列可以更好的显示静脉管壁和管腔。在本研究中,对于受累肾静脉以及侧枝静脉的的显示,增强MRI的表现优于增强CT,可以起到更好的对手术的预见和指导作用;特别在肿瘤切除的过程中对于临近血管的处理,通过增强MRI可以得到更准确的信息,进而做出更准确的选择。
显微镜下PIVCLS由梭形细胞组成,嗜酸性细胞质排列成片状,多数细胞呈交叉状排列,分化较好的细胞亦可呈平行束状排列,细胞核大浓染,核分裂像多见,有丝分裂多见,分化差的肿瘤细胞可见病理性核分裂和多核瘤巨细胞;平滑肌肌动蛋白、肌间线蛋白在70%以上的病例中呈阳性,CD34、S100和CD117可呈局灶性阳性[15],少数病例也可表达 AE1 /AE3,更多标志物阳性则更支持PIVCLS的诊断。本组病例平滑肌肌动蛋白和肌间线蛋白阳性率分别为86.7%与80%,略高于文献报道,有 5例灶性表达 CD34,4例灶性表达 CD117,与文献报道相符。
目前,对于下腔静脉平滑肌肉瘤的治疗仍然以开放手术为主,亦有应用腹腔镜技术成功完成手术的病案报道[16]。对于肿瘤的切除方法,需要充分的静脉阻断,包括下腔静脉上下端、肾静脉、腰静脉、肾上腺中央静脉等,使得术中打开腔静脉后视野更加清晰。对于肿瘤累及一侧肾门,必要时需要进行单侧肾切除,若手术造成大段血管缺失,需要行血管重建手术恢复血流通畅,不过CHZHAO等[17]研究提示部分病例肿瘤生长速度较慢,下腔静脉梗阻为渐进性,存在充足的时间建立静脉侧枝循环,下腔静脉节段性切除后不一定需要血管重建,具体血管重建与否可根据术前静脉造影具体情况进行评估。HIGUTCHI等[18]研究发现,由于肿瘤切除以及血管重建手术造成的巨大创伤以及术后的各种并发症,手术并不能延长患者的生存期,但是血管重建可以减轻水肿的症状以及改善患者近期生活质量。本研究中,14例采用肿瘤切除后下腔静脉缩窄缝合重建,其中4例术前存在下肢水肿,术后水肿均出现不同程度缓解;另外1例采用肿瘤切除后下腔静脉缝扎,该病例术前及术后均未出现下肢水肿,下腔静脉造影提示侧枝循环良好,与CHZHAO等报道相符合。
目前对于PIVCLS的辅助治疗方案争议不断,JEONG等[19]研究显示对切缘阳性的患者肿瘤切除术后接受放疗能明显延长患者生存时间,而且术后辅助放疗可降低局部复发的发生率 。 KULAYLAT等[20]研究表明术前以及术后化疗可以有效延长患者无瘤生存期。但是XU 等[21]研究显示化疗并不能使PIVCLS患者从中获益,并认为新辅助治疗为可能有效的治疗手段。
PIVCLS总体预后较差,WACHTEL等[22]对377名患者进行了汇总分析,研究病例中位生存期为23个月,1年生存率为92%,5年生存率为55%,生存相关危险因素包括,年龄、肿瘤位置、体积、切缘阳性、再次手术等;其中,手术切缘阳性是对预后影响最大的危险因素,其次,肿瘤位置是第二位的危险因素,肿瘤位于肝上的病例中位生存期更短。因本研究病例均为以腹膜后肿瘤收治于泌尿外科,肿瘤位置均位于肝下,13例术后标本切缘阴性,仅2例标本切缘阳性,中位生存期46个月,明显长于上述汇总分析中的中位生存期,考虑与较低的切缘阳性率和肿瘤位置均位于肝下相关。
总之,PIVCLS是一种临床上较为罕见的下腔静脉原发肿瘤,女性发病率高于男性,恶性程度高,预后差,术前影像学检查对诊断有辅助作用,确认依赖术中所见及术后病理结果。在目前放化疗等辅助治疗效果未能明确的前提下,对原发病灶积极的手术切除,术后严密随访,及早发现复发、转移病灶并对病灶及早切除,可能对患者的生存有积极的影响。
