新型鸭呼肠孤病毒σB蛋白单克隆抗体的制备及其抗原表位的鉴定
2022-07-05华炯钢叶伟成朱寅初
华炯钢,叶伟成,倪 征,陈 柳,朱寅初,云 涛,张 存
(浙江省农业科学院畜牧兽医研究所,浙江 杭州 310021)
鸭呼肠孤病毒(Duck reovirus,DRV)分为两种基因型,即Ⅰ型和Ⅱ型[1-2]。基因Ⅰ型为经典鸭呼肠孤病毒(Classical DRV,CDRV),即番鸭呼肠孤病毒(Muscovey duck reovirus,MDRV),主要感染番鸭和半番鸭,引起鸭坏死性肝炎(俗称番鸭“白点病”或“花肝病”),以肝脾等脏器组织出现大量粟状坏死灶为病理特征,该基因型自1997 年以来在我国广东、广西、福建、浙江和江西等省流行[3]。基因Ⅱ型为新型鸭呼肠孤病毒(Novel DRV,NDRV),可引起番鸭、半番鸭、北京鸭和鹅等发病,特征性病变为肝脾出现严重坏死和出血(俗称“出血性坏死性肝炎”),NDRV 最早发现于2000年,此后开始在我国江苏、浙江、福建、广东、河北、山东等省暴发与流行[2,4-5]。目前,NDRV 已成为我国流行的优势基因型[1-2,6]。
NDRV 基因组由10 个节段的双链RNA 构成,全长23 419 bp。病毒粒子由二十面体对称的双层衣壳组成,直径70 nm,无囊膜。根据SDS-PAGE 电泳结果,将NDRV 基因组分为3 个群,分别是:L 组群(L1、L2、L3)、M 组群(M1、M2、M3)和S 组群(S1、S2、S3、S4)[2-3,5-6]。其中S3 节段编码的σB 是NDRV 衣壳的主要组分和外衣壳蛋白,其功能与哺乳动物呼肠孤病毒(Mammalian reovirus,MRV)的σ3蛋白、鸡呼肠孤病毒(Avian reovirus,ARV)及CDRV的σB 蛋白类似,均能够诱导宿主机体产生群特异性中和抗体[7-8]。ARV 与CDRV 的σB 蛋白存在保守的群特 异 性 抗 原 表 位[9-10]。NDRV 与CDRV 为DRV 不 同 的基因型,且DRV 与ARV 均属于禽正呼肠孤病毒(Avian orthoreovirus,ARVs)成员;NDRV σB 蛋白与ARV及CDRV σB 蛋白的氨基酸序列同源性约为60%和70%[2-3,6]。目前NDRV σB 蛋白的抗原表位及其是否存在群特异性抗原表位尚不清楚。因此,本实验利用原核表达的NDRV σB 蛋白作为免疫原,通过免疫小鼠筛选并制备了该蛋白的单克隆抗体(MAb),并对其识别的抗原表位进行鉴定,为进一步建立NDRV 特异性检测方法及研发表位标记疫苗奠定基础。
1 材料与方法
1.1 细胞、病毒株及实验动物骨髓瘤细胞(SP2/0)、鸡胚成纤维细胞(DF-1)、ARV S1133株均由浙江省农业科学院畜牧兽医研究所禽病研究室保存;NDRV ZJ00M 株和CDRV ZJ2000M 株由浙江省农业科学院畜牧兽医研究所禽病研究室分离鉴定与保存[2,6];大肠杆菌DH5α 和BL21(DE3)感受态细胞购自北京全式金生物技术有限公司;pET-28a-SUMO 载体由浙江省农业科学院畜牧兽医研究所禽病研究室构建、保存。6 周龄~8 周龄BALB/c 小鼠购自上海斯莱克实验动物有限责任公司。
1.2 主要试剂HRP标记的山羊抗鼠IgG(IgG-HRP)、弗氏完全佐剂、弗氏不完全佐剂、PEG4000、次黄嘌呤-氨甲蝶呤-胸腺嘧啶核苷(HAT)、次黄嘌呤-胸腺嘧啶核苷(HT)均购自Sigma 公司;MAb 亚类鉴定试剂盒购自赛默飞公司;ECL 化学发光检测试剂盒购自Thermo Fisher Scientific 公司;Ni-NTA kit 购自Novagen 公司。
1.3 重组质粒pET-28a-SUMO-σB 的构建、蛋白表达及纯化利用Oligo6.0 软件,以NDRV ZJ00M 株S3 节段全序列(KF154118)编码的σB 基因ORF 为靶区域设计引物:SigB-F: 5'-CGCGGATCCATGGAGGT GCGTGTGCCAAAC-3'(BamH I)/SigB-R:5'-GCACTC GAGTTACCACCTACACTCCAGGAAG-3'(XhoI),扩增片段大小为1 104 bp,引物由Invitrogen 公司合成。提取NDRV ZJ00M 株RNA 并作为模板,采用上述引物经RT-PCR 扩增σB 基因片段,用BamH I/XhoI 分别双酶切目的片段σB 和载体pET-28-SUMO,经T4 DNA 连接酶连接,构建重组质粒pET-28-SUMOσB,并经BamH I 和XhoI 双酶切及测序鉴定。将鉴定正确的重组质粒pET-28-SUMO-σB 转化宿主菌BL21,经IPTG 诱导表达,离心,超声破碎,分离上清液和沉淀。通过SDS-PAGE 检测表达情况。利用Ni-NTA 试剂盒对重组σ 蛋白(rσB)纯化后通过SDSPAGE检测其纯度,并利用核酸蛋白仪测定rσB浓度。
1.4 小鼠的免疫选取6 周龄~8 周龄的BALB/c 小鼠,将纯化的rσB 与弗氏完全佐剂等体积混合乳化后,采用颈背部皮下多点注射免疫(100 μg/只)。间隔2 周免疫一次,共免疫3 次。第二次和第三次免疫时用rσB 与等体积弗氏不完全佐剂乳化。三免7 d 后尾部采血,分离血清,2 倍倍比稀释,利用纯化的rσB 作为包被抗原,通过间接ELISA 方法[11]检测血清抗体效价,选择血清效价最高的小鼠,于融合前3 d再用rσB(100 μg/只)加强免疫,利用PEG4000 将小鼠脾细胞与SP2/0 细胞按常规方法融合[12]。
1.5 细胞融合及MAb 的制备细胞融合7 d 后,取杂交瘤细胞培养上清液经1.4 中的间接ELISA 方法检测以筛选阳性杂交瘤细胞,以1.4 中获得的NDRV rσB 的小鼠阳性血清为阳性对照,以未融合的SP2/0细胞上清液为阴性对照。采用有限稀释法对检测的阳性杂交瘤细胞进行3 次克隆纯化,直至筛选结果100%为阳性。对筛选出能够稳定分泌MAb 的杂交瘤细胞按常规方法制备腹水[12],采用亲和层析方法纯化腹水MAb,通过上述间接ELISA 方法检测杂交瘤上清液和纯化的腹水MAb 效价。
1.6 MAb 亚类鉴定利用MAb 亚类鉴定试剂盒鉴定MAb 的亚类。
1.7 MAb 反应原性的western blot 鉴定将NDRV ZJ00M 株以MOI 0.01 感染DF-1 细胞,以不感染病毒的DF-1 细胞作为空白对照。72 h 后收获DF-1细胞,煮沸裂解后离心,取上清液,以制备的MAb(1∶5 000)为一抗,羊抗鼠IgG-HRP(1∶5 000)为二抗,通过western blot 检测MAb 与天然表达的σB 蛋白的反应性。
1.8 MAb 交叉反应性的间接免疫荧光试验(IFA)分别将NDRV ZJ00M 株、CDRV ZJ2000M 株和ARV S1133株均以MOI 0.01感染DF-1细胞,培养48 h后固定细胞,分别以制备的MAb(1∶2 000),1.4 中获得的小鼠rσB 阳性血清(1∶100)和未免疫小鼠血清(1∶100)作为一抗,羊抗鼠IgG-FITC(1∶1 000)为二抗,经IFA鉴定本研究制备的MAb 对CDRV、ARV 是否有交叉反应性。
1.9 MAb 抗原表位的肽扫描法鉴定将σB 蛋白截短成长度为15 个氨基酸、相互重叠5 个氨基酸的多肽,由南京金斯瑞生物科技有限公司合成,共37 条(表1),将多肽用DMSO 溶解后,分别以1 μg/孔包被ELISA板,以制备的各MAb(1∶5 000)为一抗,羊抗鼠IgG-HRP(1∶5 000)为二抗,经ELISA筛选各MAb的抗原表位,以1.4中制备的rσB高免小鼠血清为一抗作为阳性对照,以未免疫小鼠血清为一抗作为阴性对照。
将37 条σB 蛋白多肽中与各MAb ELISA 检测呈强阳性的多肽继续以2 个氨基酸为步移,从N 端和C 端再分别逐步截短并合成,共合成8 条多肽(表1)。将这8 条多肽分别包被ELISA 板,采用上述ELISA 方法继续筛选各MAb 的抗原表位。

表1 根据σB蛋白氨基酸序列合成的重叠多肽序列Table 1 Overlapping peptides synthesized according to the amino acid sequence of σB protein
1.10 抗原表位的保守性分析从GenBank 选取不同年代、不同地域且具有代表性的NDRV 与CDRV 分离株,以及鹅呼肠孤病毒(GRV)、新型鹅呼肠孤病毒(Novel GRV,NGRV)、ARV 和火鸡呼肠孤病毒(Turkey reovirus,TARV)等ARVs 成员的代表性病毒,对各病毒中的σB 蛋白氨基酸序列进行比对分析,以确定抗原表位的保守性。
2 结 果
2.1σB 蛋白的原核表达、鉴定及纯化结果重组质粒pET-SUMO-σB 经BamH I 和XhoI 双酶切鉴定及测序鉴定结果显示,σB 基因正确插入pET-28a-SUMO 载体中。将鉴定正确的重组质粒pET-SUMO-σB转化BL21(DE3)中,经IPTG 诱导表达后经SDSPAGE 检测结果显示,重组蛋白主要以包涵体的形式表达,分子量约为55 ku,与预期大小相符;经Ni-NTA His 柱纯化后获得了单一目的条带(图1)。表明,rσB 获得了表达,且纯化效果较好。经计算该蛋白纯度约为85%,经核酸蛋白仪测定该蛋白浓度为1 mg/mL。
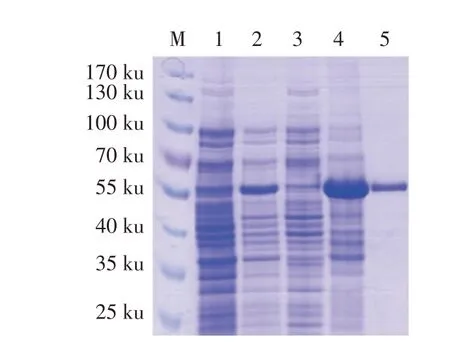
图1 rσB表达与纯化的SDS-PAGE检测结果Fig.1 Detection results of expression and purification of recombinant σB protein by SDS-PAGE
2.2 McAbs 亚类鉴定及腹水效价的测定结果将小鼠脾细胞与SP2/0 细胞融合后,经间接ELISA 方法筛选,对筛选获得的阳性杂交瘤细胞株经过3 次克隆纯化,最终获得3 株稳定分泌NDRV σB 蛋白MAb的杂交瘤细胞株,其分泌的MAb 分别命名为10-A5、A1-G9 和B7-E5。间接ELISA 检测结果显示,3株杂交瘤细胞上清液中的抗体效价均为1∶1 280,腹水中的MAb 经纯化后效价均为1∶240 000。抗体亚类鉴定结果显示,3 株MAb 均为IgG1,分泌的抗体轻链均为κ。
2.3 MAb 反应原性的western blot 鉴定结果将NDRV 感染DF-1 细胞72 h 后收获细胞,通过western blot 鉴定上述3 株MAb 的反应原性。结果显示,3 个MAb 均在41 ku 处出现特异性条带,而阴性对照DF-1 细胞无该条带(图2)。制备的10-A5、A1-G9 和B7-E5 均能够与NDRV 感染DF-1 细胞的σB 蛋白发生反应,表明3 株MAb 均能够识别NDRV 天然表达的σB 蛋白,反应原性较强。
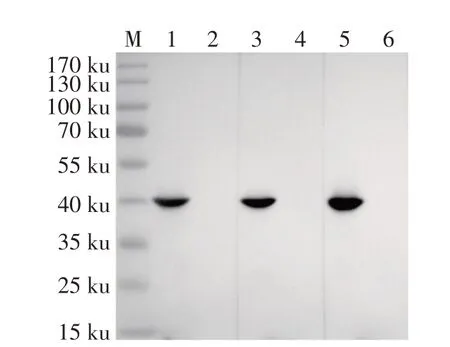
图2 MAb反应原性的western blot 鉴定Fig.2 Identification of MAbs reactivity by western blot
2.4 MAb 交叉反应性的IFA 鉴定结果分别将NDRV、CDRV 和ARV 感染DF-1 细胞,并设相应的对照,经IFA鉴定MAb的交叉反应性。结果显示:分别以3 株MAb 及小鼠阳性血清为一抗时,感染NDRV的DF-1 细胞均出现了亮绿色荧光;而感染CDRV 和ARV的DF-1细胞均无绿色荧光;而以小鼠阴性血清为一抗时,所有病毒感染的细胞均无绿色荧光(图3)。表明这3 株MAb 的特异性较强,与其他相关病毒均无交叉反应性。

图3 MAb与NDRV、CDRV和ARV交叉反应性的IFA鉴定结果(200×)Fig.3 Identification of cross-reactivity of MAbs with NDRV,CDRV,and ARV by IFA
2.5 MAb 抗原表位的鉴定结果将人工合成的37条多肽分别包被ELISA 板后,再分别以3株MAb为一抗,经间接ELISA 鉴定其识别的抗原表位。结果显示,3株MAb 10-A5、A1-G9和B7-E5 及小鼠σB蛋白阳性血清均与SigB-4多肽呈阳性反应,而与其余的多肽及小鼠阴性血清均呈阴性反应(图4A)。SigB-4多肽的氨基酸序列31LWDIEEFHTPDVIRV45即为MAb的抗原表位。将呈阳性反应的SigB-4 多肽从N 端和C 端分别以2 个氨基酸为步移截短合成的8 条短多肽包被ELISA 板,再 分 别 以10-A5、A1-G9 和B7-E5 为 一抗,进一步经ELISA 鉴定其识别的抗原表位。结果显示,将SigB-4 多肽从N 端截短2 个氨基酸和从C 端截短2 个氨基酸后的短多肽(分别对应SigB-4-1 和SigB-4-5)均与10-A5、A1-G9 和B7-E5 3 呈强阳性反应。阳性对照与阴性对照与上述结果一致(图4B)。表明,上述3 株MAb 识别的最小抗原表位的氨基酸序列均为33DIEEFHTPDVI43。
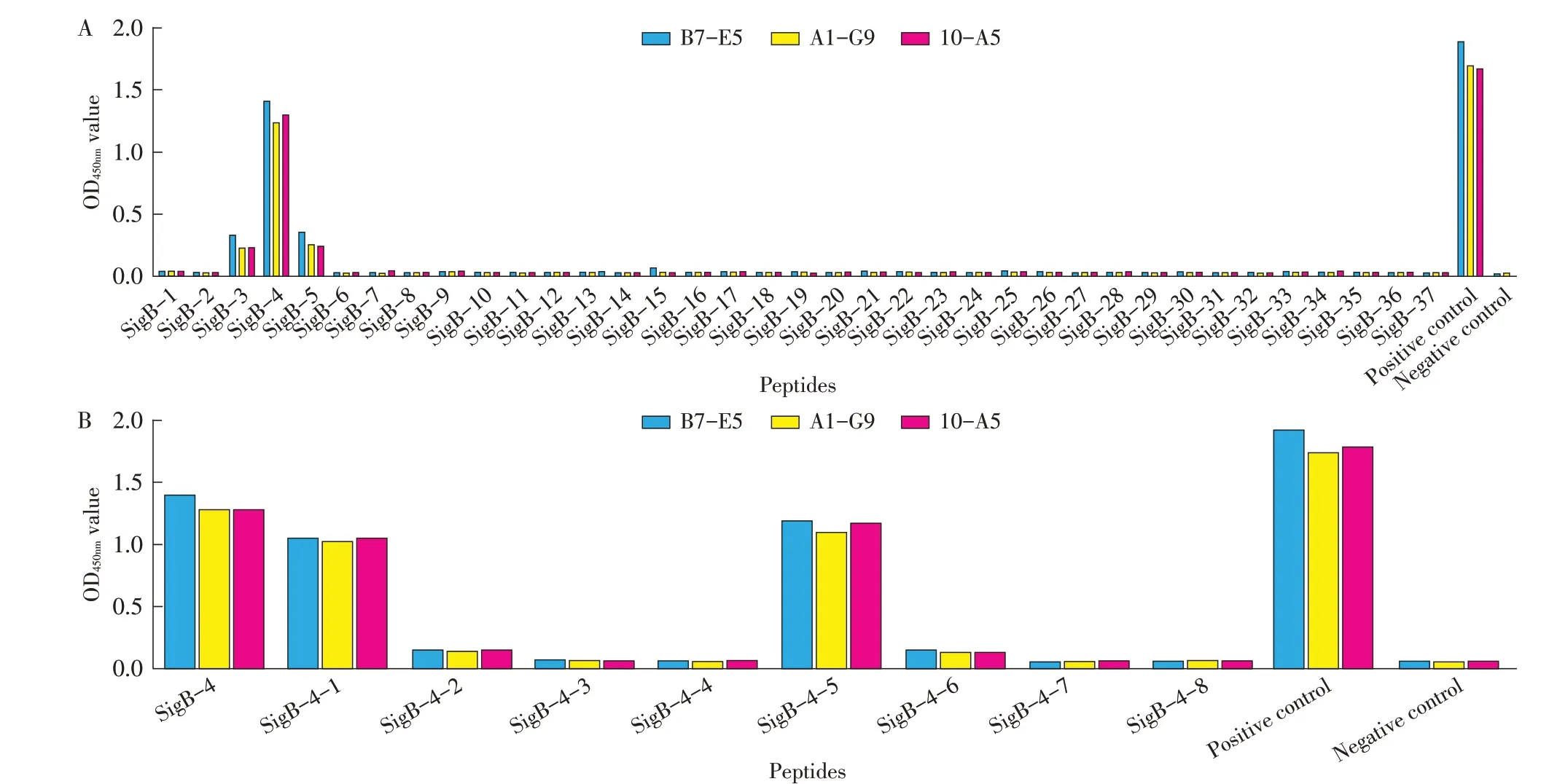
图4 各肽段(A)及SigB-4各截短肽段(B)经ELISA扫描鉴定MAb识别的抗原表位Fig.4 Epitopes recognized by MAbs were identified by ELISA scaning of overlapping peptides(A)and sigB-4 truncated peptides(B)
2.6 抗原表位的保守性分析参照NCBI 数据库中相关序列,利用BLAST 对已鉴定的线化抗原表位aa31~aa45 的保守性分析结果显示,该抗原表位序列与不同地域和不同宿主来源的NDRV 和NGRV 分离株σB 蛋白对应氨基酸序列的同源性均为100%;而与ARVs 其他成员CDRV、GRV、ARV 和TARV 不同分离株的相对应蛋白氨基酸序列的同源性为53.3%~73.3%(表2,但数值未在该表中展示)。结果表明该抗原表位(aa33~aa43)在不同地域及不同来源的NDRV分离株中保守性很高,而在ARVs其他成员CDRV、GRV、ARV和TARV 中差异较大。
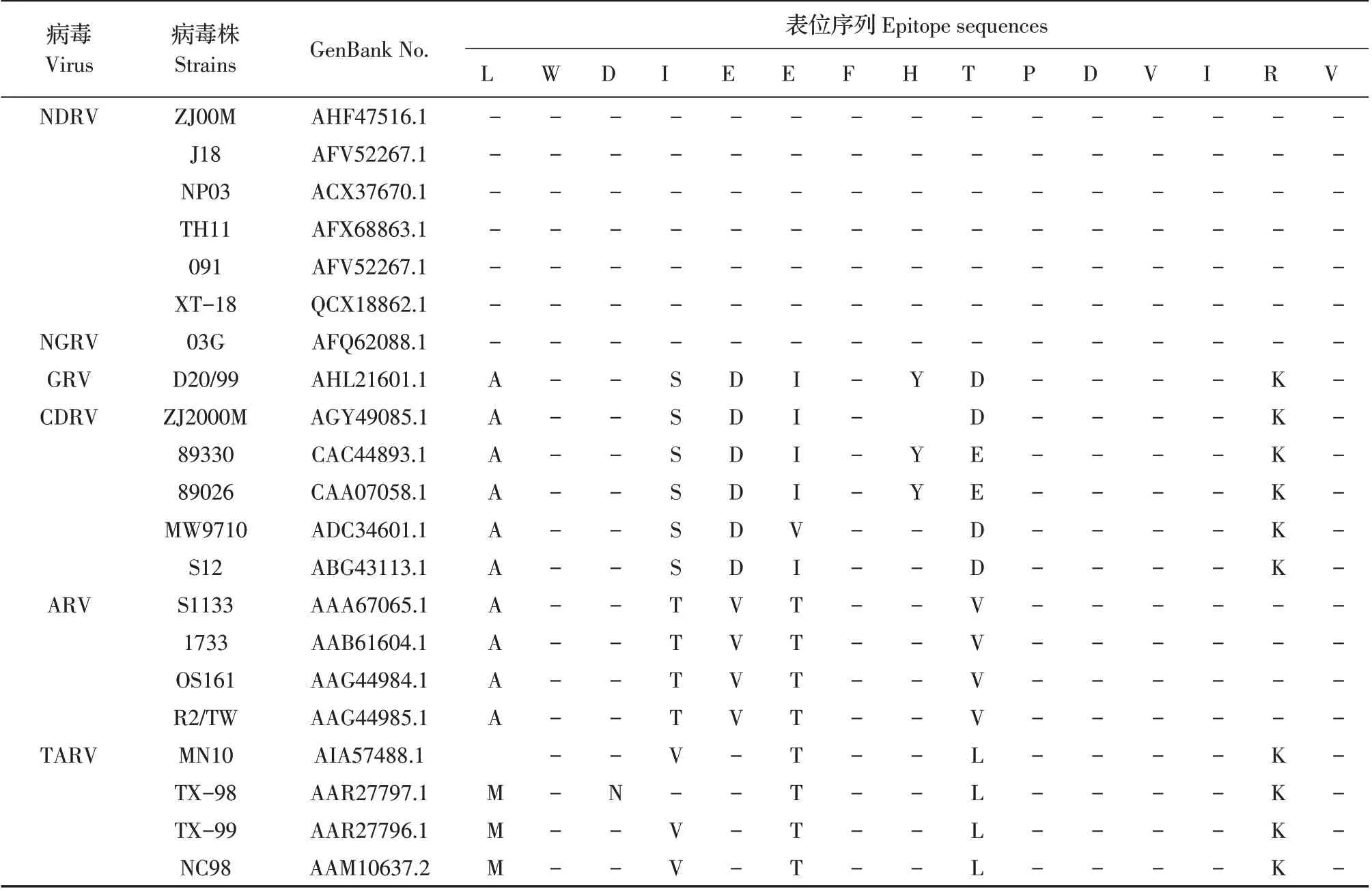
表2 3株MAb抗原表位保守性分析Table 2 Conservation analysis of antigenic epitopes of three MAbs
3 讨 论
σB 是ARV 和DRV 主要的外衣壳蛋白,能够诱导机体产生群特异性中和抗体[8-9]。对σB 蛋白抗原表位的精确定位为解析σB 介导的免疫保护机制,研发多肽表位疫苗及建立特异性检测方法具有重要意义。MAb 是由单一B 细胞克隆产生的免疫球蛋白,具有特异性强、敏感性高、均质性好、效价高等优点,已成为研究抗原的结构与功能、开发诊断试剂和抗原表位多肽疫苗的强有力工具[13-14]。由于NDRV 是水禽DRV新发的基因型,其σB 的MAb 及MAb 的抗原表位未被解析。为此,本研究制备了3 株鼠源抗NDRV σB蛋白的MAb(10-A5、A1-G9 和B7-E5),并对3 株MAb 的抗原表位进行了鉴定。
抗原表位又称抗原决定簇,是引起宿主免疫应答的物质基础。可分为T 细胞抗原表位和B 细胞抗原表位。B 细胞表位是由抗原表面的亲水性氨基酸组成,易接近B 细胞受体和抗体分子并被识别,能够诱导宿主产生体液免疫反应。为了探究NDRV σB 蛋白的B 细胞抗原表位,本研究利用B 细胞杂交瘤技术制备并获得了3 株NDRV σB 蛋白的MAb,且鉴定了各MAb 的抗原表位。常用的抗原B 细胞表位鉴定方法主要有噬菌体展示肽技术、肽扫描技术以及生物信息学方法预测技术等[15]。本研究根据NDRV σB蛋白序列合成37 条长度为15 个氨基酸、且相互重叠5 个氨基酸的多肽,利用肽扫描技术结合ELISA 方法,筛选各MAb 的抗原表位。该方法相较于噬菌体展示肽技术更简便、快速,但其缺点是仅能鉴定出线性抗原表位[16]。
研究发现,ARV、CDRV 和TARV σB 蛋白的保守氨基酸序列主要位于N 端(aa1~aa113)[10,17]。对于ARV σB 蛋白,已鉴定出两个抗原表位:21KTPACW26和32WDTVTFH38,位于σB 蛋白N 端aa21~aa38,且这两个抗原表位为ARV 特异性B 细胞线性表位[10];而对于CDRV σB 蛋白,也已鉴定出两个抗原表位,即抗原表位A(65TDGVCFPHHK74)和表位B(19YIRAPACWD27),位 于σB 蛋 白N 端aa19~aa74,且 表 位B 是ARV 和CDRV 的群特异性表位,表位A 是CDRV 的特异性表位[17]。本研究鉴定出的NDRV σB 蛋白的最小抗原表位(33DIEEFHTPDVI43)也位于其N 端,但位点不同。对3 株MAb 识别抗原表位的保守性分析表明,该表位在不同基因型DRV(即CDRV 与NDRV)之间的保守性比较低(同源性小于54.5%),仅为NDRV的特异性表位。这一结果与不同基因型DRV 之间仅能与各自基因型的血清高度中和,而与异源血清仅有弱的交叉中和作用的结论一致[18]。因此,本研究制备的3 株MAb(10-A5、A1-G9 和B7-E5)均可作为鉴别检测NDRV 和CDRV 感染的候选抗体。
NDRV 是目前中国流行鸭呼肠孤病毒病的主要基因型,至今还未有NDRV B 细胞抗原表位的相关报道,本研究首次通过制备针对NDRV σB 蛋白的MAb 对其抗原表位进行了鉴定,为NDRV 的型特异性检测方法及其表位标记疫苗的研究奠定了基础。
