伪狂犬病毒对小鼠肝脏线粒体氧化应激和细胞凋亡影响的研究
2022-07-05刘杉杉王世达王靖飞董彦强
孙 伟,刘杉杉*,周 佳,王世达,王靖飞,董彦强
(1.铜仁职业技术学院,贵州 铜仁 554300;2.中国农业科学院哈尔滨兽医研究所动物病原与病理形态学创新团队,黑龙江 哈尔滨 150069;3.阿坝职业学院,四川 阿坝藏族羌族自治州 623200)
猪伪狂犬病病毒(Pseudorabies virus,PRV)是一种DNA 病毒,属于疱疹病毒科,α 疱疹病毒亚科成员,是引起伪狂犬病(Pseudorabies,PR)的病原体[1]。PRV 可感染多种哺乳动物,主要包括反刍动物、草食动物和啮齿动物。研究发现,在基因水平上,人可能是PRV 的潜在宿主[2],而猪是PRV 的唯一自然宿主,PRV 感染后临床症状与猪群年龄密切相关[3]。近年来PRV 给养猪业造成巨大的经济损失。
在病毒感染过程中,病毒相关基因表达和先天抗病毒反应体系的激活可导致活性氧(Reactive oxygen species,ROS)和能量代谢的有毒副产物增加[4-5]。ROS 和体内超氧化物歧化酶(Superoxide dismutase,SOD)过氧化氢酶系统(Catalase,CAT)、谷胱甘肽(Glutathione,GSH)和谷胱甘肽过氧化物酶体系(Glutathione peroxidase,GHS-Px)等抗氧化酶之间的不平衡会导致机体出现氧化应激,出现细胞死亡,从而引起组织和器官损伤,在此机制中线粒体对细胞凋亡信号通路的激活起重要作用[6]。线粒体是真核细胞中物质代谢和能量代谢的主要细胞器,当线粒体呼吸受到抑制甚至中断后,线粒体产生的ROS 可直接导致线粒体损伤并引起细胞受损,甚至死亡[7]。ROS 和由此产生的细胞氧化还原状态的改变成为细胞凋亡的诱因之一。现已证实,线粒体在细胞凋亡过程中起着重要作用[8]。
研究表明,与PRV 同属成员人单纯疱疹病毒1型(Herpes simplex virus 1,HSV-1)可通过促进胶质细胞ROS 生成,造成神经系统损伤[9]。肝脏是PRV作用的靶器官之一,其富含线粒体,PRV 对肝脏线粒体氧化应激和细胞凋亡的影响尚未见报道。因此,本研究以小鼠为模型,研究PRV 对肝脏线粒体氧化应激相关因子及肝细胞凋亡的影响,为PRV 致病机理相关研究提供基础数据。
1 材料与方法
1.1 主要实验材料PRV-HLJ 株(MK080279.1)由中国农科院哈尔滨兽医研究所动物病原与病理形态学创新团队提供,并由本实验室保存。6 周龄SPF级BALB/c 小鼠,购自成都达硕实验动物有限公司。ROS 检测试剂盒(88-5930-74)购自美国Thermo Fisher 公司;线粒体提取试剂盒(M0020)购自北京索莱宝科技有限公司;Annexin V-FITC/PI 细胞凋亡检测试剂盒、线粒体膜电位MitoScreen 检测试剂盒(JC-1,551203)购自美国BD公司;2×SYBR Green PCR Mastermix(RR820A)、反转录试剂盒(RR047A)购自TaKaRa 公司;组织RNA提取试剂盒(B518621)购自上海生工生物工程技术服务有限公司;T-SOD(A001-1-2)、丙二醛(Malondialdehyde, MDA)(A003-1)、GSH(A006-2)、GSH-Px(A005)和CAT(A007-1)等检测试剂盒,均购自南京建成生物工程研究所。
1.2 实验分组设计将36 只BALB/c 小鼠随机分成4 组(对照组18 只,3 组各时段感染组各6 只),实验组每只小鼠经皮下接种200 μL(1×103TCID50/100 μL)PRV,对照组小鼠注射等量PBS 溶液。分别于感染后48 h、72 h 和96 h 迫杀对应组小鼠,取其肝脏组织用于后续试验。每个时间点于对照组中随机迫杀6 只小鼠取其肝脏组织,作为相应对照。
1.3 各组小鼠肝脏线粒体ROS 水平检测取各时间点各组小鼠100 mg~200 mg新鲜肝脏组织,利用线粒体提取试剂盒提取小鼠肝脏线粒体,分别吸取300 μL,利用ROS检测试剂盒检测各组小鼠肝脏线粒体ROS水平。
1.4 PRV 对线粒体氧化应激相关因子影响的检测采集1.2 中各组小鼠各时间点肝脏组织100 mg 加入到1 mL 预冷的PBS 溶液中,采用机械研磨法制备成10%的组织匀浆,2 500 r/min 离心10 min 后,取上清液,采用相应试剂盒检测细胞氧化应激相关因子MDA、SOD、GSH、GSH-Px、CAT 变化。
1.5 PRV 对线粒体膜电位影响的检测吸取100 μL 1.3中各组小鼠各时间点提取的线粒体悬液,加500 μL JC-1 染色液,采用线粒体膜电位MitoScreen 检测试剂盒测定线粒体膜电位变化,所得结果采用Kaluza2.1 软件分析。
1.6 PRV 对氧化应激相关酶转录水平影响的检测提取1.4 各时间点各组小鼠肝脏匀浆总RNA,反转录为cDNA后作为模板,以β-actin 为内参基因,采用荧光定量PCR 方法(qRT-PCR)分别检测抗氧化物酶CAT、GSH-Px和SOD基因的转录水平变化。qRTPCR 引物序列分别为CAT: F5'-AGGTGTTGAACGAG GAGGAGAGG-3'/R5'-AGCGTTGTACTTGTCCAGAAGA GC-3';GSH-Px:F5'-CACAGTCCACCGTGTATGCCTT C-3'/R5'-ACCGAGCACCACCAGTCCAC-3';SOD:F5'-ACGCCACCGAGGAGAAGTACC-3'/R5'-GCTTGATAGC CTCCAGCAACTCTC-3'。扩增反应体系为10 μL:2×SYBR Green 染料5 μL,各基因上下游引物0.4 μL,模板1 μL,RNAase Free 补加到10 μL。扩增条件为95 ℃30 s;95 ℃5 s、60 ℃30 s,40 个循环。
1.7 PRV 对肝细胞凋亡影响的检测取1.2 中各时间点各组小鼠新鲜的肝脏组织,剪成1 mm3小块,采用机械研磨法制备组织匀浆,经300 目滤网过滤后,离心、重悬制成肝细胞悬液,调整细胞浓度为1×106个/mL,利用Annexin-V-FITC 细胞凋亡检测试剂盒检测PRV 对小鼠肝细胞凋亡的影响。
1.8 数据分析数据采用SPSS 21.0 软件中的oneway ANOVA 模块进行组间多重比较分析。最终结果以“±s”的形式表示。与对照组比较,*P<0.05 表示差异显著,**P<0.01 表示差异极显著。
2 结 果
2.1 PRV 对线粒体ROS 水平的影响分别于PRV感染小鼠后48 h、72 h 和96 h 采集肝脏组织,利用试剂盒检测线粒体ROS 的生成情况,结果显示,与对照组相比较,随着感染时间的延长,线粒体中ROS 生成水平从均值6.01%逐渐增加至26.18%,差异极显著(P<0.01),并呈现时间依赖性(图1)。表明PRV具有促进潜在的诱导线粒体氧化应激的作用。
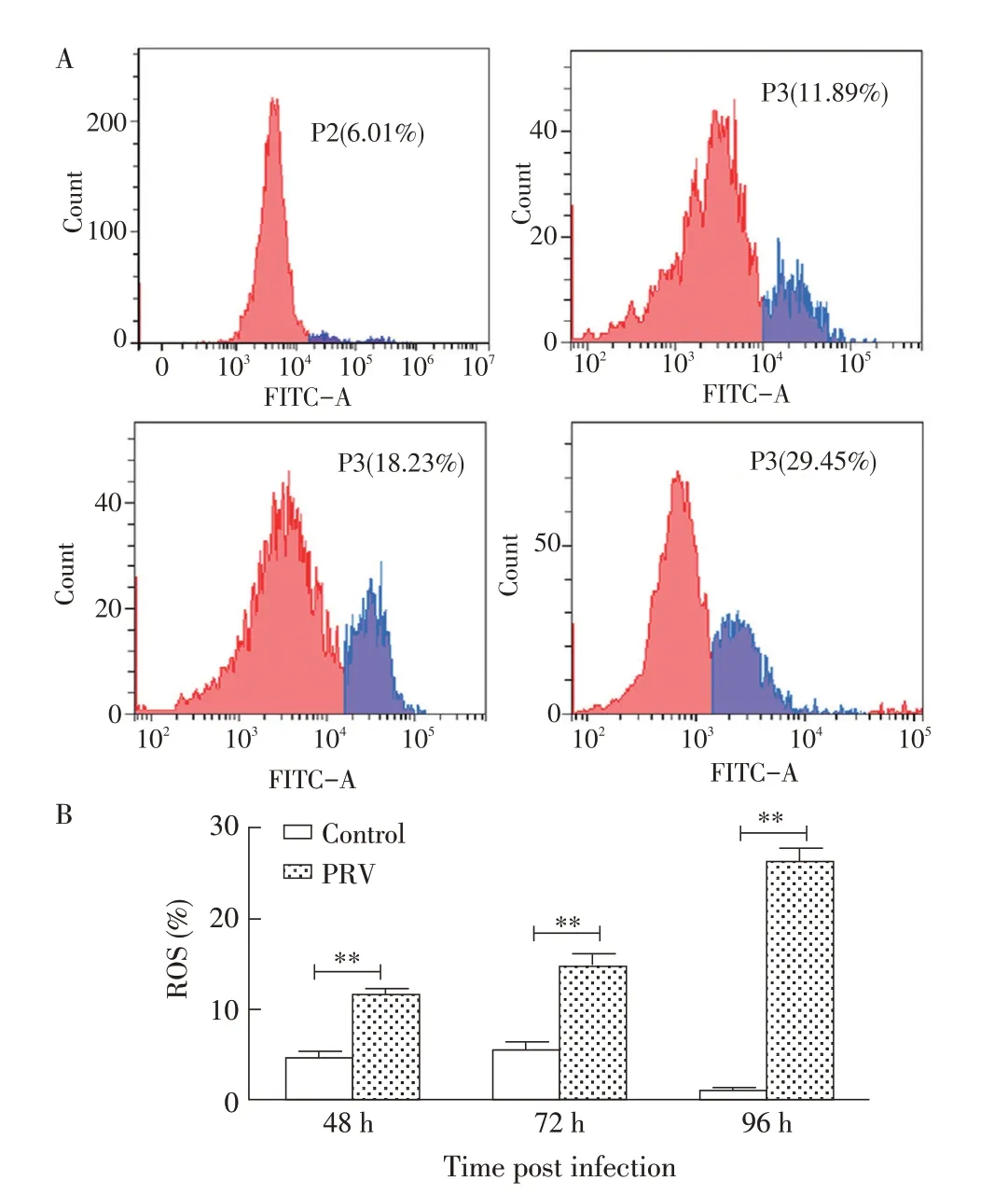
图1 PRV感染后对线粒体ROS生成的影响Fig.1 Effect of PRV infection on ROS production in mitochondria
2.2 PRV 感染对线粒体氧化应激相关因子的影响利用相应的检测试剂盒检测PRV 感染后各时间点各组小鼠线粒体氧化应激相关因子的变化情况,结果显示,与对照组相比较,PRV极显著促进肝脏线粒体MDA 生成,随着时间的延长,从1.12 nmol/mg prot升高至1.84 nmol/mg prot,差异极显著(P<0.01);但肝脏线粒体中的SOD、CAT、GSH 和GHS-Px 水平均随着感染时间的延长呈明显下降趋势,分别下降至58.43 U/mg prot、32.81 U/mg prot、2 047.06 μmol/g prot和409.08 μmol/g prot,与对照组比较差异极显著(P<0.01,图2)。进一步表明,PRV 可通过影响氧化应激相关因子生成而促进肝脏线粒体氧化应激产生。

图2 PRV感染对线粒体氧化应激相关因子的影响Fig.2 Effect of PRV infection on mitochondrial oxidative stress related factors
2.3 PRV 对线粒体膜电位的影响采用线粒体膜电位MitoScreen 检测试剂盒检测各时间点小鼠线粒体膜电位的变化,结果显示,与对照组相比较,PRV 感染小鼠肝脏线粒体膜电位平均值从2.60%逐渐增加至75.85%,差异极显著(P<0.01,图3),且随着感染时间的延长,线粒体去极化程度逐渐增强。表明PRV 感染可损坏线粒体正常膜电位。

图3 PRV感染对线粒体膜电位的检测结果Fig.3 Detection of mitochondrial membrane potential inPRV infected hepatocytes
2.4 PRV 感染对线粒体氧化应激相关因子转录水平的影响利用qRT-PCR 检测各抗氧化物酶基因的转录水平,结果显示,与对照组比较,实验组小鼠肝脏线粒体中抗氧化物酶GHS-Px、CAT和SOD基因在转录水平上也呈现明显的下降趋势,相对转录水平分别下降至0.43、0.44 和0.19,差异极显著(P<0.01,图4)。进一步表明,PRV 感染打破小鼠肝脏线粒体氧化/抗氧化系统平衡,诱导ROS 和MDA 生成,引起氧化应激,并随着感染时间的延长,氧化应激程度逐渐增强。
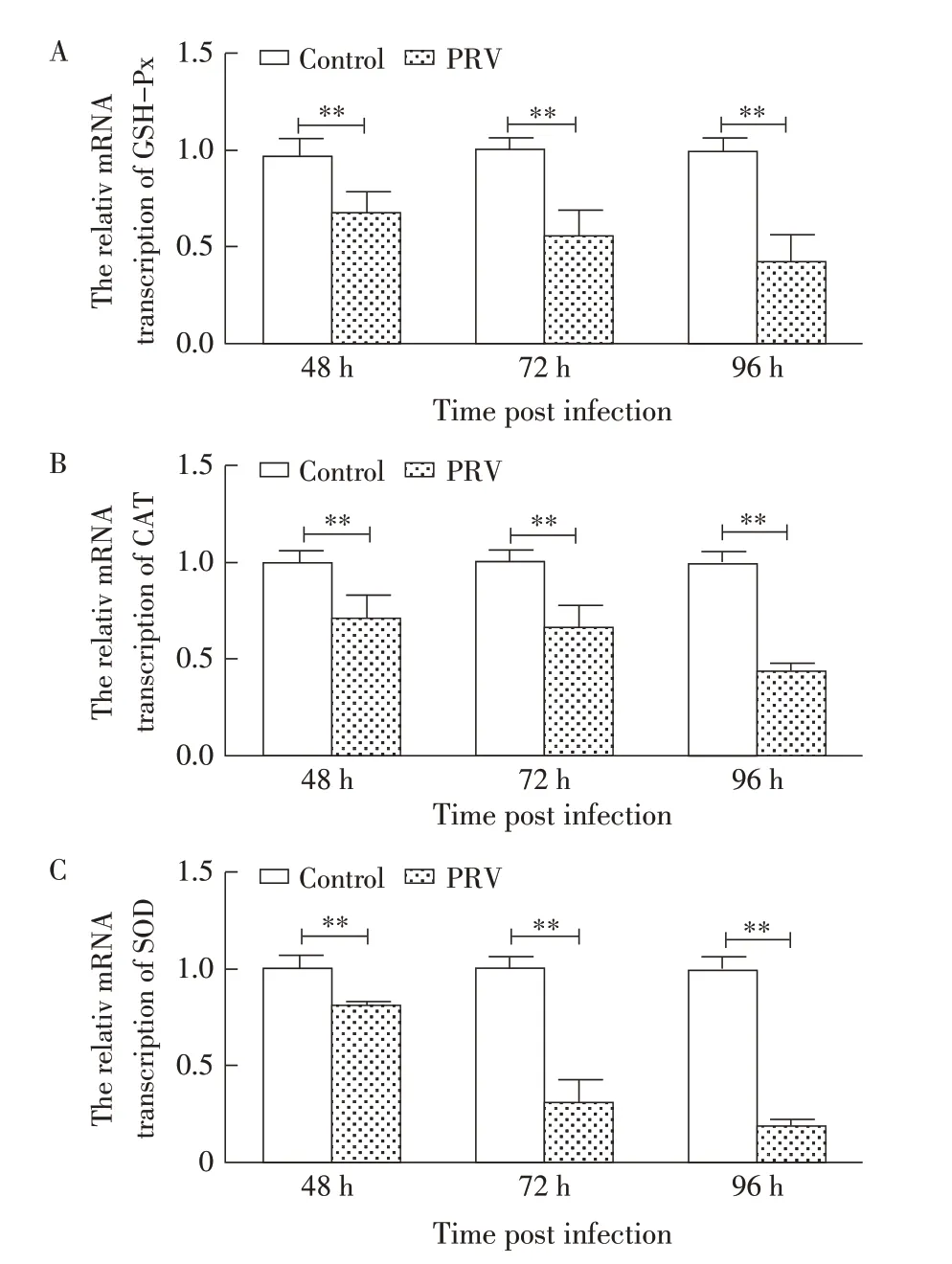
图4 PRV感染对氧化应激相关酶基因转录水平的影响Fig.4 Effect of PRV infection on the transcriptional of oxidative stress related enzymes
2.5 PRV 对肝脏细胞凋亡的影响利用Annexin-V-FITC 细胞凋亡检测试剂盒检测各组小鼠肝细胞凋亡的变化,结果显示,与对照组比较,PRV 感染48 h 时,凋亡肝细胞中早期凋亡细胞从1.53%增加到7.21%,极显著增加(P<0.01),晚期凋亡细胞从5.01%增加到9.33%,差异显著(P<0.05,图5),且随着感染时间的延长,PRV 感染96 h时早、晚期凋亡的肝脏细胞分别增加至19.83%和15.24%,差异极显著(P<0.01)。表明PRV 可诱导小鼠肝脏细胞凋亡。

图5 PRV感染后对肝细胞凋亡的影响Fig.5 Effect of PRV infection on the percentage of apoptotic hepatocytes
3 讨 论
PR 是一种烈性的接触性传染病,临床症状主要以神经症状、繁殖障碍为主。PRV 可造成脑、肝脏、脾脏、肾脏等实质性器官出现炎症以及坏死等病理变化,不同病毒株对脏器的损伤程度有所差异[3]。小鼠是研究PRV 常见的实验动物,当PRV 感染小鼠时,PRV 进入外周神经元并传播到中枢神经系统,导致脑损伤,出现与新生仔猪相似的临床症状[4]。因此,本实验选取小鼠作为PRV 动物感染模型进行试验。
肝脏是PRV 作用的主要实质器官之一,PRV 感染后肝脏主要病变为出现微小的白色凝固性或溶解性坏死灶[10]。研究表明,PRV 激活p38 MAPK 和JNK/SAPK 信号通路,诱导肿瘤坏死因子-α(TNF-α)基因表达,并促进TNF-α 分泌,从而诱导细胞凋亡[11]。体外实验发现,PRV 感染PK15 细胞后,ROS大量生成,引起DNA 损伤,从而诱导细胞凋亡[12]。肝脏是线粒体丰富的实质器官,线粒体是ROS 产生的主要来源,同时也易受到ROS 的损伤。ROS 具有促进脂质过氧化生成的作用,其中MDA 是重要标志物之一[13]。氧化剂和抗氧化物之间的失衡所产生的氧化应激,是多种病毒感染性疾病的重要特征[14]。研究表明,HSV-1可导致GSH消耗,增加ROS和脂质过氧化水平。在细胞和动物模型上均发现PRV同属成员HSV-1 可通过氧化应激引起宿主损伤[15]。本实验将PRV经皮下接种小鼠后发现,PRV可促进小鼠肝脏线粒体ROS 和MDA 的生成,降低非酶物质GSH 的生成,同时下调抗氧化酶CAT、SOD、GSH-Px基因转录水平,表明PRV 可打破肝细胞氧化因子和抗氧化因子之间的平衡,诱导肝细胞的氧化应激。
研究表明,ROS 过度生成可激活线粒体依赖的细胞凋亡信号通路,促进细胞色素C 释放,导致线粒体膜电位降低,引起细胞呼吸功能受损,造成能量代谢失衡,最终诱导细胞凋亡[16]。细胞凋亡与线粒体膜电位改变有必然的联系,线粒体膜电位下降是细胞出现凋亡的重要标志性事件[17]。本实验发现PRV 感染小鼠后其肝脏线粒体膜电位去极化程度增加,随着感染时间的延长线粒体膜电位下降趋势显著;同时也发现早晚期凋亡的肝细胞比例显著增加,这与线粒体膜电位以及抗氧化应激因子降低的结果基本一致。
PRV 感染导致氧化应激和DNA 损伤,从而影响促凋亡信号分子以及细胞周期关键调节分子表达[12]。氧化应激与病毒感染导致的包括细胞凋亡在内的多种细胞死亡过程有关。乙型肝炎病毒(HCV)可通过X 蛋白(HBX)C-端与线粒体结合,造成线粒体DNA 损伤,同时过表达SIRT-1 基因,促进ROS 生成,诱导氧化应激生成[18-19]。丙型肝炎病毒(HBV)引起宿主细胞线粒体损伤和氧化应激,受损伤线粒体通过细胞自噬依赖的途径方式被清除[20]。本研究发现,PRV-HLJ 株可引起小鼠肝脏线粒体氧化应激,从而诱导肝细胞凋亡以及线粒体膜电位降低。胡薇等发现,PRV Bartha 株在促进小鼠脑组织促炎性细胞因子生成的同时,上调表达LMP2、LMP7 和LMP10 等免疫相关的蛋白酶亚基[21]。PRV GXLB-2013 株感染小鼠后,脑、脾脏和肺脏均出现了炎性反应,并促进免疫器官指数、ROS 和NO 水平升高,活化COX-2和iNOS 因子,促进IL-1β 等在主要促炎性细胞因子生成[4]。由此表明,PRV 引起免疫反应与机体组织处于氧化应激状态存在一定的联系,而具体机制尚不明确,有待于进一步研究。
有关PRV 致病机理的研究尚未完全明确,而线粒体在受到病毒攻击后导致ROS 过度生成引起的氧化应激,这与PRV 感染后机体组织损伤密切相关。本研究以小鼠为模型动物,从PRV 对肝脏氧化应激相关因子及细胞凋亡的影响为切入点,首次证实PRV 感染可导致宿主肝脏线粒体氧化应激,从而诱导肝细胞凋亡。本研究对进一步探究PRV 致肝脏损伤及其致病机理提供一定的科学数据。
