抗菌肽LL-37体外抗猪链球菌活性的研究
2022-07-05金明洁张会会梁思宇张跃灵刘思国
金明洁,张会会,梁思宇,张跃灵,谢 芳*,刘思国*
(1.东北农业大学动物医学学院,黑龙江 哈尔滨 150030;2.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/动物细菌病创新团队,黑龙江 哈尔滨 150069)
猪链球菌(Streptococcus suis,SS)是一种人兽共患病病原菌,革兰氏染色阳性、兼性厌氧,其血清型众多、抗原结构复杂。SS 感染猪会导致败血症、脑膜炎、淋巴结脓肿[1],感染人会引起败血症、脑膜炎甚至死亡,临床表现会根据细菌侵入部位不同有所差异。猪链球菌病一般病程较快,死亡率高,带菌和病死动物为主要传染源,会在猪群水平和垂直传播。人感染SS 多发生在北欧和南亚这些养殖和食用猪肉的地区,主要与猪链球菌2 型(Streptococcus suistype 2,SS2)有关。我国曾发生两起SS2 感染人的公共卫生事件,患者表现为中毒性休克和多器官功能障碍,又称猪链球菌中毒休克样综合征(STSLS)[2]。SS 给养猪业和人类健康带来严重的威胁,因此研发有效的抗菌药物以对抗SS 感染显得尤为重要。
抗菌肽又称宿主防御肽,是一类由12 aa~100 aa组成的小分子多肽,具有广谱抗菌活性和免疫调控功能[3]。LL-37 是唯一的人源cathelicidin 家族抗菌肽,带有6 个静正电荷,分子呈双亲性螺旋结构,具有抗细菌、抗病毒、抗真菌、抗肿瘤等多种功能。研究发现,LL-37 能破坏表皮葡萄球菌、铜绿假单胞菌、鲍曼不动杆菌等的细胞膜结构,从而发挥抗菌作用[4],被认为是潜在的新型抗菌药物。本研究测定了LL-37 对SS2 的抑菌活性和杀菌活性;借助显微成像技术,证实LL-37 对SS2 细胞膜的损伤作用;检测了其抗SS2 生物被膜(Bacterial biofilm,BF)形成的活性。本研究为猪链球菌病新药的研发提供参考依据,为抗菌肽类药物的临床应用奠定基础。
1 材料与方法
1.1 主要实验材料抗菌肽LL-37(氨基酸序列:LLGDFFRKSKEKIGKEFKRIVQRIKDFLRNLVPRTES)由吉尔生化(上海)有限公司经固相化学合成法合成,通过反相高效液相色谱法纯化,纯度≥98%,经蛋白质谱仪检测,分子质量正确(4 493.74);SS2 05ZYH33 株、449 株、S3 株、H6 株 均 为 临 床 分 离株,由中国农业科学院哈尔滨兽医研究所动物细菌病研究团队保存。
Tryptical Soy Broth(TSB)培养基、Tryptical Soy Agar(TSA)培养基购自英国OXOID 公司;LIVE/DEADTMBacLight 细菌活力检测试剂盒购自Thermo Fisher Scientifi 公司;戊二醛、锇酸、丙酮、柠檬酸铅均购自Sigma-Aldrich 公司;结晶紫购自北京索莱宝科技有限公司;96 孔聚苯乙烯超细纤维板购自美国Corning 公司。
1.2 LL-37 最小抑制浓度(MIC)的测定将SS2 05ZYH33 株、449 株、S3 株、H6 株在含10%马血清的TSA 平板上划线培养12 h,挑取单菌落,接种于TSB 液体培养基,于37 ℃ 5% CO2培养至OD600nm为0.6,用培养基将菌液浓度调整至1×107cfu/mL。在无菌96 孔细胞培养板上用培养基2 倍倍比稀释LL-37(16 μmol/L~1 μmol/L),每孔90 μL,再加入10 μL菌液,于37 ℃5%CO2孵育16 h,每组3 个重复。液体清亮的孔中最低浓度即为LL-37 的MIC。
1.3 LL-37 对SS2 增殖的影响取过夜培养的SS2 05ZYH33 株,按1∶100(V∶V)转接于10 mL TSB 液体培养基,实验组加终浓度为1 μmol/L 的LL-37,对照组不添加LL-37,各组于37 ℃5% CO2静置培养。每隔1 h 取样检测OD600nm值,每次3 个重复,计算每小时OD600nm平均值,绘制SS2 的生长曲线,分析LL-37作用下SS2 的生长情况。
1.4 LL-37 杀菌活性检测将SS2 05ZYH33 株于TSB 液体培养基中培养至对数生长期,以3 500 r/min离心5 min,弃上清,用10 μmol/L PBS(pH7.4)清洗3次,重悬菌体,调整菌液浓度至2×106cfu/mL。用PBS 在1.5 mL EP 管2 倍倍比稀释LL-37(16 μmol/L~1 μmol/L),每管500 μL,再加入500 μL 菌液,以500 μL PBS 混合500 μL 菌液为对照组。37 ℃5%CO2静置2 h 后,10 倍倍比稀释为3 个浓度,涂板统计剩余活菌数,分析LL-37 的杀菌活性。
1.5 激光共聚焦显微镜(CLSM)观察LL-37 对SS2的杀伤作用将SS2 05ZYH33 株于TSB 液体培养基中培养至对数生长期时,以3 500 r/min 离心5 min 收集菌体,PBS 清洗两次,将菌液浓度调整至OD600nm约为0.2,按照LIVE/DEADTMBacLight 细菌活力检测试剂盒操作说明处理菌液。实验组在共聚焦小皿中加入终浓度为2 μmol/L 的LL-37,对照组加等体积PBS,每个小皿加含染料的菌液1 mL,于37 ℃5%CO2静置3 h 后,利用激光共聚焦扫描显微镜(Zesis 800 型)观察并拍摄。
1.6 透射电镜观察LL-37 作用下SS2 的形态将SS2 05ZYH33 株单菌落接种于TSB 液体培养基,培养至对数生长期。3 500 r/min 离心5 min,弃上清,菌体用10 μmol/L PBS(pH7.4)洗3 次,调整菌液浓度为2×108cfu/mL。实验组加入终浓度为2 μmol/L 的LL-37,对照组加入等体积PBS,在37 ℃孵育1 h。离心弃上清加2.5%戊二醛4 ℃过夜,100 μmol/L PBS(pH7.2)漂洗3 次,1%锇酸4 ℃静置2 h,0.1 mol/L PBS(pH7.2)漂洗3次。在4 ℃条件,分别用双蒸水配置的50%、70%、90%、100%丙酮脱水,每次10 min,100%丙酮需重复脱水3 次。加入Epon812 树脂,室温包埋过夜后,将样品置于70 ℃聚合48 h,再用UC6 超薄切片机制成65 nm~70 nm 厚的切片。用3%醋酸铀和1%柠檬酸铅染色,室温干燥后在透射显微镜下观察LL-37 作用下SS2 的形态。
1.7 LL-37 抑制SS2 BF 形成能力的测定SS2 05ZYH33株单菌落接种于含200 μL TSB 液体培养基的96 孔聚苯乙烯超细纤维板,实验组加入终浓度为1 μmol/L~8 μmol/L 的LL-37,对照组不加LL-37,空白对照为不加菌的TSB 液体培养基,上述各组于37 ℃5%CO2培养36 h 后,洗涤,加入200 μL 无水甲醇,固定15 min后弃去,置于37 ℃晾干。加入100 μL 0.2%结晶紫染色8 min,洗2 次。加100 μL 33%冰醋酸混匀,测定OD490nm数值,取3 次测定数值的平均值作为结果。分析LL-37 抑制SS2 BF 的形成能力。
1.8 统计学分析实验结果用SPSS 17.0 软件进行数据统计和处理,用±s表示,利用GraphPad Prism 9软件做图。采用Student'st检验方法分析各组之间的差异性,P<0.05 表示差异显著。
2 结 果
2.1 LL-37 对SS2 MIC 值的测定结果本研究采用96 孔板法检测LL-37 对SS2 的MIC 值。结果显示,当LL-37 浓度为4 μmol/L 与8 μmol/L 时,培养基为淡黄色清亮液体,无浑浊无沉淀;而2 μmol/L 和不加LL-37 组的液体浑浊有沉淀。以肉眼观察96 孔板上液体清亮、无浑浊和沉淀的最低药物浓度即为LL-37 的MIC,测得LL-37 对SS2 05ZYH33 株、449 株、S3 株的MIC 值 均 为4 μmol/L,对SS2 H6 株 的MIC 值 为8 μmol/L。表明,当LL-37 浓度≥8 μmol/L 时,能够完全抑制SS2 的生长,且LL-37 对本试验中4 株SS2临床分离株均有良好抑菌效果。
2.2 LL-37对SS2生长影响的测定结果以SS2培养时间为横坐标,菌液OD600nm值为纵坐标,绘制SS2 生长曲线。结果显示,SS2 在接种后0~4 h 为迟缓期,增殖较慢;4 h~8 h 为对数生长期,SS2 快速大量增殖;8 h后进入平台稳定期,增殖减少。在1 μmol/L LL-37的作用下,在接种早期(0~4 h)SS2能够正常生长,但从接种5 h开始,添加LL-37的实验组与对照组相比,细菌数量减少,细菌生长缓慢(图1)。从对数生长期到平台期,实验组菌数均低于对照组菌数。表明LL-37在1 μmol/L浓度即对SS2的增殖有抑制作用。

图1 SS2在LL-37作用下的生长曲线Fig.1 Growth curve of SS2 after treated by LL-37
2.3 LL-37 对SS2 杀菌活性的测定结果为了进一步探究LL-37在不同浓度下对SS2的杀菌效果,本研究将SS2分别在0~16 μmol/L LL-37条件下共孵育2 h后,10 倍倍比稀释涂板,计算剩余存活菌数。结果显示,SS2 在4 μmol/L~16 μmol/L LL-37 作用下均无菌落生长,2 μmol/L 和1 μmol/L LL-37 与对照组相比,也表现出良好的杀菌效果,且差异极显著(P<0.001)(图2)。表明4 μmol/L LL-37 能完全杀灭SS2,杀菌效果良好,是潜在的抗菌药物。

图2 LL-37对SS2的杀菌活性Fig.2 Bactericidal activity of LL-37 against SS2
2.4 CLSM 观察LL-37 对SS2 的杀伤作用碘化丙啶(Propidium iodide,PI)是一种释放红色荧光的DNA染料,不能通过活细胞膜,因此只能穿过破损的细胞膜染死菌。绿菁(SYTO 9)是一种释放绿色荧光的核酸染料,具有细胞膜通透性,常用于染活菌。本研究将LL-37 作用后的SS2 与上述两种染料共孵育,通过CLSM 观察可见,SS2 呈链状排列,2 μmol/L LL-37 作用下SS2 被PI 染红,而对照组仅被染绿(图3)。表明LL-37 在2 μmol/L 浓度下能够破坏 和杀伤SS2 的膜结构。

图3 LL-37作用SS2的CLSM图像Fig.3 CLSM images of SS2 after treated by LL-37
2.5 透射电镜观察LL-37作用下的SS2形态为进一步探究LL-37 对SS2 形态的影响,本研究用2 μmol/L LL-37 作用SS2,经固定、脱水、包埋、聚合、切片、染色后,利用透射电镜进行观察。结果可见,LL-37作用后的SS2 失去了原有的椭圆形态,膜结构破坏、内容物流出,细胞崩解死亡(图4)。这一结果进一步证实LL-37对SS2的杀伤源自其对膜结构的破坏。
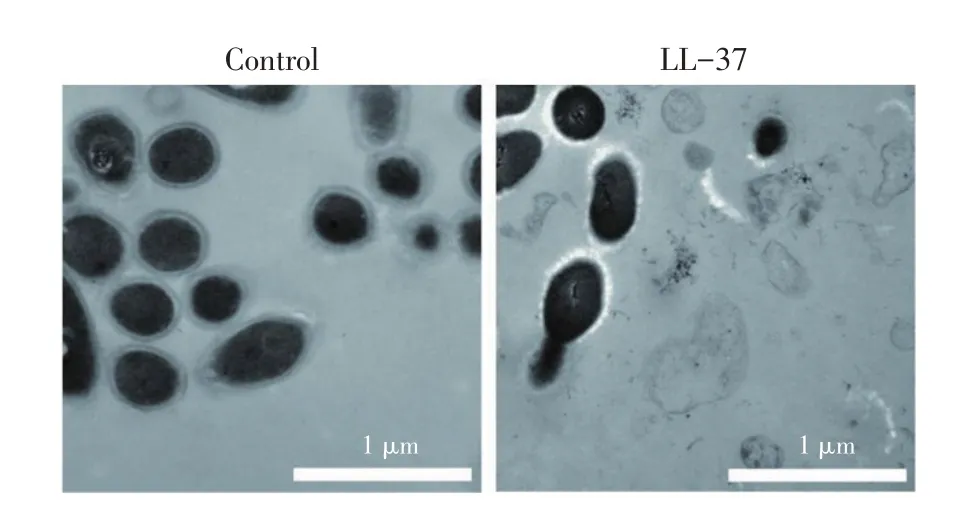
图4 LL-37作用后SS2的透射电镜图像Fig.4 TEM images of SS2 after treated by LL-37
2.6 LL-37 抑制SS2 BF 形成的检测结果本研究通过不同浓度LL-37 作用SS2 BF,结晶紫染色后冰醋酸溶解,检测OD490nm值。结果显示,与对照组比较,2 μmol/L LL-37 能够显著降低SS2 BF 的形成(P<0.05),4 μmol/L~8 μmol/L LL-37 能够极显著降低SS2 BF 的形成(P<0.001)(图5),表明LL-37 能够抑制SS2 BF 的形成,抑制效果随其剂量的增加而增强,呈剂量依赖性。
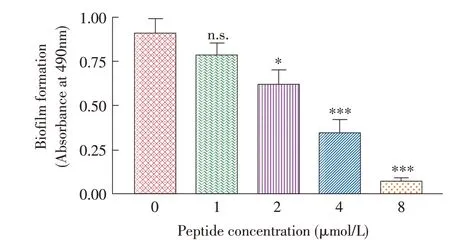
图5 LL-37对SS2 BF形成能力影响的测定结果Fig.5 The biofilm formation of SS2 under LL-37
3 讨 论
SS 经由上呼吸道感染,会在鼻腔、扁桃体定植,这给防范该菌感染造成一定的难度。现临床已有SS 疫苗,但SS 血清型多达33 种[5],不同血清型之间没有交叉保护性。即使同一血清型的SS,其毒力差异也较大:目前普遍认为胞外因子(Extracellular factor protein,EF)和溶菌酶释放蛋白(Muramidase released protein,MRP)是SS 重要的毒力因子,但加拿大分离的SS2 致病株大多为MRP-和EF-表型[6]。SS众多的血清型和毒力因子分布的差异性往往会影响SS 疫苗的免疫保护效力。因此,能有效对抗SS 的新型药物研发十分必要。本实验探究了抗菌肽LL-37对SS2 的体外抑菌作用,结果发现LL-37 具有良好的杀菌活性,4 μmol/L 的浓度就可以有效地抑制和杀灭SS,并且1 μmol/L 浓度也会抑制细菌的生长,是一种潜在的抗SS 药物。
抗生素的作用靶点单一,如β-内酰胺类药物特异性结合细菌细胞膜上的青霉素结合蛋白(Penicillin-binding proteins,PBPs),从而阻碍细菌细胞壁的合成[7]。一旦靶点结构或位置发生变化,药物与细菌亲和力降低,便丧失了其抗菌效能。不合理地使用抗生素或长期药物刺激,极易造成细菌耐药性。在一项150 株SS 临床分离株对8 种常见药物耐药性的实验中,检出29 株耐青霉素的SS,16 株为8 重耐药菌[8]。而抗菌肽的抗菌作用是凭借其携带的正电荷特异性吸附带负电荷的细菌细胞膜,从而改变膜的通透性使细菌内容物流出,导致细菌崩解死亡。相较于抗生素的“靶点”变“把柄”,抗菌肽更不易产生耐药性[9]。本研究通过CLSM和透射电镜观察,证实了抗菌肽LL-37 对SS2 的杀伤源自其对细胞膜的破坏。
BF 是一种包裹在细菌产生的胞外聚合物基质中的微生物聚集体,其成分复杂且表面致密光滑,不易被机体吞噬细胞摄取和杀灭[10-12]。临床上常用青霉素类、头孢类抗生素对抗SS 感染,但上述药物均属于增殖期杀菌剂,而形成BF 的细菌氧气和营养物质受限,生长增殖缓慢,抗生素不能表现出良好的杀菌效果。本研究进行了LL-37 抗SS2 BF 形成的试验,研究发现LL-37 能够抑制SS2 BF 的形成,进一步展现抗菌肽治疗SS 感染的优越性。
本研究系统评价了抗菌肽LL-37 对SS2 的体外抗菌作用;初步阐明了LL-37 的杀菌机制是破坏SS2 细胞膜结构,使细菌内容物流出,导致菌体崩解死亡;并证明了LL-37 的抗BF 作用。本研究为抗菌肽类药物的临床应用和抗SS 药物的研发提供参考。
