胡须刺激通过调节神经可塑性改善小鼠桶状皮质缺血性脑卒中后的神经功能缺损
2022-07-05孙金梅张成杰李尧陈彬
孙金梅,张成杰,李尧,陈彬
脑卒中是人类死亡的第3 大原因,缺血性卒中占全部卒中的75%~80%[1]。约33%~42%的脑梗死患者发病后3~6个月仍需要他人照顾[2]。脑梗死后的康复锻炼对改善脑梗死患者的生活质量有重要意义[3,4]。研究发现小鼠局灶性脑缺血后,予适量胡须刺激可上调血管内皮生长因子(vascular endothelial growth factor,VEGF)、碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)、Tie-1、ang2等的表达来促进血管生成进而改善梗死部位血流灌注[5,6],也可通过增加血清基质细胞衍生因子-1(stromal cell derived factor-1,SDF-1)、双肾上腺皮质激素(doublecortin,DCX)等的表达促进更多神经母细胞从室管膜下区向缺血半暗区迁移,促进脑梗死后的神经发生[7]。神经可塑性也参与康复锻炼促进脑梗死后功能的恢复过程[7,8],但具体机制尚未完全明确。
本研究通过建立小鼠桶状皮质(Barrel Cortex)局灶性脑梗死模型,探讨规律胡须刺激是否具有改善神经功能缺损的作用,并从神经可塑性角度探讨相关机制。
1 材料与方法
1.1 主要试剂与材料
1.1.1 实验动物 成年雄性C57bl/6 小鼠60 只,8~10 周龄,体质量25 g 左右,购自北京维通利华实验动物有限公司,饲养于首都医科大学附属北京友谊医院SPF级实验动物中心。本研究遵循实验动物相关的规章制度,通过动物伦理委员会批准。
1.1.2 主要试剂 突触素(synaptophysin,SPY)-1、生长相关蛋白43(growth associated protein 43,GAP 43)购于Cell Signaling 公司;脑源性神经营养因子(brain derived neurophic factor,BDNF)购于Santa Cruz 公司;神经丝蛋白(neurofilament,NF)、内参Tubulin 抗体购于Sigma公司。
1.2 方法
1.2.1 实验分组和设计 60 只小鼠随机分为3 组:假手术组、脑梗死组(桶状皮质局灶性脑缺血模型)和胡须刺激组(桶状皮质局灶性脑缺血+胡须刺激),各20 只。
1.2.2 脑梗死模型的建立 10%水合氯醛麻醉小鼠,左侧卧位固定于手术台上,10-0 的缝合线永久性的结扎胡须桶状皮质周围2~3 个大脑中动脉分支;4-0 缝合线阻断两侧颈总动脉血流7 min后恢复供血;关闭颅窗,粘合伤口。手术过程维持小鼠体温在(37.0±0.5)℃。假手术组小鼠,不进行大脑中动脉远端的结扎,其他操作步骤相同[9]。
1.2.3 胡须刺激方案 胡须刺激组小鼠于模型建立后第3天开始,使用简易振动棒(频率140 次/min)反复刮拨小鼠左侧所有胡须,15 min/次,3 次/d,共12 d。
1.2.4 行为学检测 ①HomeCage 行为学分析。脑缺模型建立后第14天,由预先放置的摄像头记录24 h内各组小鼠在笼内进食、饮水、跑动等自发活动。通过内置软件(version 3.0, Clever Systems, Inc.)对小鼠的行走时长、行走距离、跳跃、后肢站立、不动时间、活跃时间等参数进行统计、分析[10]。②贴纸去除试验[11]检测小鼠桶状皮质对应区的感觉和运动功能。经过适应训练后开始测试,左手轻抓小鼠的颈、背部皮肤,腹部朝上,右手用镊子将4 mm×4 mm的贴纸贴于小鼠的左前脚掌上,迅速放于笼中后记录小鼠感知到贴纸的时间(表现为小鼠站立、用胡须触碰贴纸等动作)以及去除贴纸的时间(可借助对侧的前爪或牙齿)。每只小鼠单侧行为学评估的最长时间为180 sec;若超过180 sec,小鼠仍未感知或去除贴纸,时间记录为180 sec。
1.2.5 Western blot 检测蛋白表达水平 脑缺血模型建立后第14天,10%水合氯醛麻醉小鼠后断头取脑,取梗死灶周围0.5 mm范围内邻近皮质脑组织,假手术组取相同部位。常规法行Western blot,检测各组梗死灶周围SYP-1、BDNF、GAP-43和NF蛋白的表达水平,以Tubulin为内参,计算目标蛋白与Tubulin的比值。
1.2.6 荧光免疫检测NF 纤维 脑缺血模型建立后第14天,用PBS心脏灌注后取脑,4%甲醛固定,切片机切片(10 μm),乙醇:乙酸混合溶液(2∶1)固定5 min,NF一抗(1∶400)孵育过夜,PBS 冲洗后二抗孵育1 h 后显色固定,免疫荧光照相机(BX61,Olympus)拍照,Image J软件测量NF 纤维荧光密度。每只小鼠选择6 个冠状脑切片,相邻脑片距离间隔90 μm,每个脑切片脑梗死周围(缺血半暗带区)随机选择6个区域。
1.3 统计学处理
采用GraphPad Prism 5软件处理数据。符合正态分布以及方差齐性的计量资料以(±s)表示,组间比较采用独立样本均数t检验;P<0.05为差异有统计学意义。
2 结果
2.1 胡须刺激对小鼠桶状皮质局灶性脑缺血后神经功能缺损的影响
贴纸去除试验结果显示,造模前,3组小鼠的贴纸感知时间和贴纸去除时间差异均无统计学意义(均P>0.05);造模后3、7、14 d,脑梗死组小鼠的贴纸感知时间和贴纸去除时间均高于假手术组(均P<0.05),提示桶状皮质局灶性脑缺血确实造成小鼠的神经功能缺损;造模后7 d,胡须刺激组小鼠的贴纸去除时间短于脑梗死组(P<0.05),造模后14 d,胡须刺激组小鼠的贴纸感知时间和贴纸去除时间均短于脑梗死组(均P<0.05),提示规律的胡须刺激可明显改善桶状皮质局灶性脑缺血小鼠的神经功能缺损的情况,见表1-1、表1-2、图1。

图1 3组小鼠贴纸去除试验结果
表1-2 3组小鼠贴纸去除试验的贴纸去除时间比较(s, ±s)

表1-2 3组小鼠贴纸去除试验的贴纸去除时间比较(s, ±s)
注:与假手术组比较,①P<0.05;与脑梗死组比较,②P<0.05
组别假手术组脑梗死组胡须刺激组只数20 20 20造模前4.40±1.17 4.60±1.07 4.80±1.23造模后3 d 4.70±1.70 28.10±10.26①27.00±7.82①造模后7 d 4.51±0.93 22.40±9.28①14.00±2.83①②造模后14 d 4.39±0.79 9.00±3.13①6.60±1.83②
表1-1 3组小鼠贴纸去除试验的贴纸感知时间比较(s, ±s)
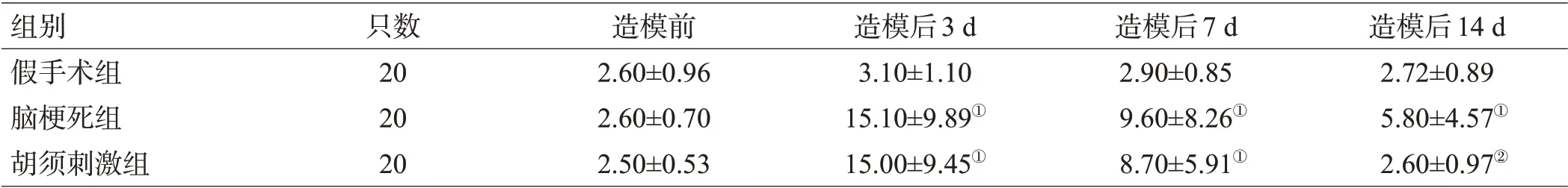
表1-1 3组小鼠贴纸去除试验的贴纸感知时间比较(s, ±s)
注:与假手术组比较,①P<0.05;与脑梗死组比较,②P<0.05
组别假手术组脑梗死组胡须刺激组只数20 20 20造模前2.60±0.96 2.60±0.70 2.50±0.53造模后3 d 3.10±1.10 15.10±9.89①15.00±9.45①造模后7 d 2.90±0.85 9.60±8.26①8.70±5.91①造模后14 d 2.72±0.89 5.80±4.57①2.60±0.97②
HomeCage 行为学分析结果显示,与假手术组相比,脑梗死组和胡须刺激组小鼠活跃性指标(活动距离、活动时长、跳跃时长、后肢站立和总体活跃时间)均有明显下降,而不动时间明显延长(均P<0.05);与脑梗死组相比,胡须刺激组小鼠活跃性指标均明显提高,不动时间明显缩短(均P<0.05),提示规律的胡须刺激可明显改善桶状皮质局灶性脑缺血小鼠的神经功能缺损的情况,见表2、图2。

图2 3组小鼠HomeCage行为学检测结果
表2 3组小鼠HomeCage行为学分析比较(±s)

表2 3组小鼠HomeCage行为学分析比较(±s)
组别假手术组脑梗死组胡须刺激组只数20 20 20活动总距离/m 266.84±15.07 146.02±41.32①194.92±42.59①②行走总时长/s 1582.64±219.34 901.66±258.30①1160.05±230.12①②跳跃总时长/s 31.48±8.32 15.14±9.85①28.77±17.09①②后肢站立总时长/s 25.38±5.38 14.39±6.32①23.86±10.51①②

注:与假手术组比较,①P<0.05;与脑梗死组比较,②P<0.05
2.2 胡须刺激对脑梗死后神经可塑性相关蛋白表达的影响
Western blot 结果显示,在小鼠桶状皮质局灶性脑缺血后14 d,梗死灶周围SYP-1和GAP-43蛋白的表达明显上调,给予胡须刺激后上调更加明显(均P<0.05);BDNF 呈同样趋势,但差异无统计学意义(P=0.06);梗死灶周围NF的表达明显下降,给予规律的胡须刺激可逆转该改变(P<0.05),见图3。
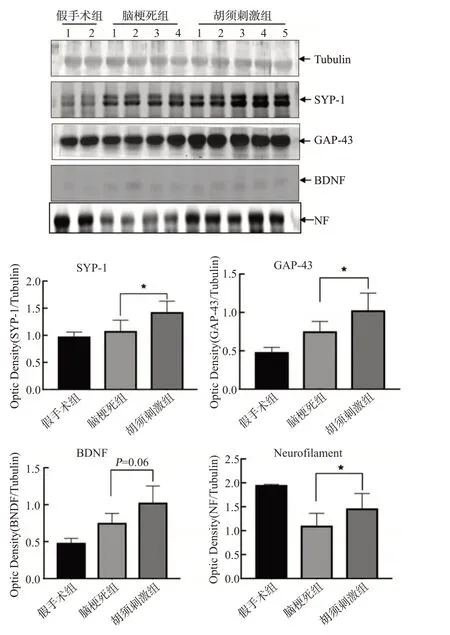
图3 3组小鼠梗死灶周SYP-1、BDNF、GAP-43和NF蛋白表达水平的Western blot检测结果
2.3 胡须刺激对梗死周围神经丝的影响
免疫荧光检测显示假手术组小鼠脑组织NF 纤维呈现绿色荧光,规律分布;脑梗死组病灶周围NF 荧光强度变低,纤维分布排列紊乱,密度减少;胡须刺激组NF 的纤维长度较脑梗死组增加,紊乱排列的现象改善,定量分析提示胡须刺激组NF的荧光强度较脑梗死组增加(P<0.05),见图4。

图4 3组小鼠脑组织NF免疫荧光检测结果
3 讨论
有效地康复锻炼可以通过激活内源性修复机制促进脑梗死后神经功能的恢复,降低致残率。脑梗死后内源性的修复机制可能来源于内源性神经生长因子分泌增加、内源性神经干细胞激活、迁移[12-14],也来源于抗炎细胞因子的调控[15]、梗死面积的缩小和梗死后的血管新生[16]等。内源性修复也有赖于神经系统的重塑。神经可塑性是指神经元及其网络连接在外界应激后出现结构、功能方面的适应性改变[17],在神经系统疾病的恢复中发挥着重要的作用[18,19]。研究证实,胡须刺激可促进小鼠局灶性桶状皮质缺血性卒中后的神经再生及血管再生,神经可塑性机制是否参与脑梗死小鼠神经功能恢复仍需进一步研究。
本研究中采用的模型为小鼠桶状皮质局灶性脑缺血模型,是大脑中动脉远端的永久性结扎所致局灶性脑缺血,缺血部位主要累及感觉皮质、运动皮质和桶状皮质区域,表现为对侧肢体的感觉和运动障碍及胡须感觉障碍。该模型具有梗死面积小、梗死体积相对稳定、死亡率低和存活时间长等优点[20]。桶状皮质为啮齿类动物胡须感觉功能区,胡须刺激可以作为桶状皮质缺血后功能康复的良好模型。行为学是评估神经功能缺损的直接体现,在本研究中小鼠的行为学不仅采用经典的贴纸感知、去除实验,也同时采用了HomeCage系统。HomeCage系统可定量分析小鼠行为学变化,尽可能避免人为干扰因素,提供更客观的评测数据。本研究发现桶状皮质脑梗死后小鼠的贴纸感知和去除时间都长于对照组,HomeCage行为学的活跃性指标低于对照组,不动时间长于对照组;证实了桶状皮质缺血后小鼠存在明确的神经功能缺损。与脑梗死组相比,胡须刺激组小鼠的上述指标均出现改善,即规律的胡须刺激可以明显改善脑梗死小鼠的神经缺损情况。
SYN-1和GAP-43是神经可塑性的标志,在神经康复中发挥关键作用[21]。SYN-1 是一种钙结合蛋白,位于突触前囊泡膜,参与突触可塑性的调节;GAP-43 是一种神经组织特异性磷酸蛋白,参与轴突和突触的“生长”或“可塑性”[22]。本实验Western blot 检测结果显示SYN-1和GAP-43蛋白在脑梗死后明显的上调,给予胡须刺激后上调的程度明显增加,且SYN-1 和GAP-43的上调趋势与BDNF 一致,提示神经可塑性和脑梗后的神经再生同时存在,可能共同参与脑梗死后的神经功能的恢复。NF 是神经元主要细胞骨架蛋白,作为一种神经元特异性的中间丝,其亚基蛋白表达和磷酸化水平可直接影响轴突直径、髓鞘形成和传导速率等,反映轴突缺血性损伤程度,可作为神经系统疾病的诊断标志[23]。神经系统损伤导致NF 被破坏后释放入血和脑脊液,在脑脊液和外周血可检测到NF的表达升高[24]。本实验通过免疫荧光技术检测到脑缺血后脑实质内NF崩解、紊乱,荧光变淡,而胡须刺激可逆转这一改变。
综上所述,本研究表明胡须刺激可促进脑梗死后神经功能缺损的恢复,可能的机制是通过调控NF、SYP-1 和GAP-43 等参与的神经可塑性。这为脑卒中的康复提供了新的思路。
