单细胞单粒子微束的发展及放射生物学应用现状
2022-07-05陈法国林海鹏党旭红梁润成
陈法国,林海鹏,王 勇,党旭红,梁润成,任 越
(1.中国辐射防护研究院,太原 030006;2.核药研发转化与精准防护山西省重点实验室,太原 030006)
微束是现代放射生物学研究中使用的一种重要实验条件。通过准直或聚焦方式,将粒子束斑限定到微米甚至亚微米量级,再利用细胞定位、粒子探测及束流控制技术,可以实现单个粒子对单个细胞或亚细胞结构的定量定位照射;相对于传统的照射方法,单细胞单粒子微束能够克服照射剂量及其空间和时间分布的不确定性。与此同时,随着活细胞成像、在线荧光观测等技术的耦合应用,使微束从早期的细胞定量定位照射平台,逐渐发展为细胞精准照射与细胞辐射响应分析的综合研究系统。单细胞单粒子微束的发展和应用,大大促进了细胞旁效应、低剂量辐射效应、亚细胞结构的辐射敏感性、DNA损伤及修复等一系列放射生物学问题的研究,并逐步将研究对象拓展到组织或体内模型[1-5]。
1 单细胞单粒子微束的发展
1.1 微束的实现方式
对于粒子加速器,经过分析磁铁、偏转磁铁、狭缝等一系列束流光学过程后,束流终端的束斑大小在mm量级;再利用准直或聚焦方式,可以将束斑的空间分辨率进一步限制到μm量级。1953年,美国芝加哥大学的Zirkle等人建立了世界上首个准直微束[6],利用两对金属平行板作为准直器在x和y方向上限定束流,获得了直径为2.5 μm的2 MeV质子束斑,开展空气中蝾螈活细胞的辐照实验研究;此后,逐步发展了微孔准直器、毛细玻璃管等结构的准直微束。1963年,前苏联Dymnikov等人[7]首次提出了利用四极磁铁的偏转作用将粒子束流聚焦到μm量级的方法;1976年,Cookson等人[8]基于英国Harwell大学的3 MeV粒子加速器,在世界上首次利用聚焦方法在空气中获得了束斑4 μm的质子、氘以及氦束。随着聚焦技术的发展,生物微束的束斑空间分辨率和照射定位精度都达到了亚微米量级;例如,德国慕尼黑大学SNAKE生物微束,可以使100 MeV的氧粒子在空气中的束斑空间分辨率达到0.55 μm[9],对55 MeV碳粒子实现0.7 μm×0.8 μm[10]的定位精度。
准直微束和聚焦微束的典型结构分别如图1和图2所示[11-12],二者具有以下几个方面的区别:(1)准直微束结构简单,聚焦微束系统相对复杂;(2)聚焦微束的空间分辨率更优。对于准直微束,毛细玻璃管是目前常用的准直结构,通常厚度在1 mm、准直孔内径在1 μm量级;受准直孔壁散射作用的影响,准直微束的空间分辨率很难达到2 μm以下[11,13]。对于聚焦微束,在真空中可以实现几十纳米的空间分辨率[14],经过透射窗后在空气中可以达到亚微米量级;(3)聚焦微束的束流引出比例高。受准直孔大小限制,准直微束的束流引出比例大约在10-6量级[13];而聚焦微束通过磁铁的偏转作用来限定束斑大小,引出的束流强度通常比准直微束高2~5个量级[1];(4)聚焦微束的照射速度更快、定位精度更高。准直微束的工作方式为束流端静止,通过机械移动样品台逐个实现样品细胞的照射,照射速度和定位精度受限于机械装置的移动速度和回程差;聚焦微束工作时不需要移动样品台,只通过电磁部件控制进行细胞扫描照射(控制速度比机械移动高2个量级[1]),照射速度和定位精度都优于准直微束。例如,英国GCI[11]和美国哥伦比亚大学(RARAF-I)[15]准直微束照射速度分别可达每小时约10 000、5 000个细胞,日本国立放射医学研究所(NIRS)SPICE聚焦微束的照射速度可达每分钟400个细胞[16]。
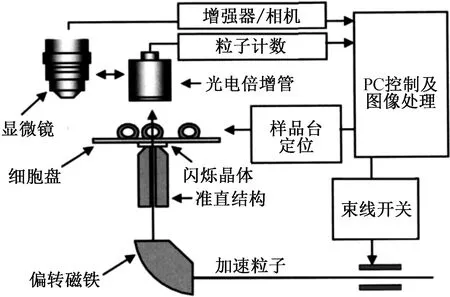
图1 准直微束的典型结构示意图(英国Gray癌症研究中心)[11]Fig.1 Typical sketch of collimated microbeam(Gray Cancer Institute, GCI)[11]
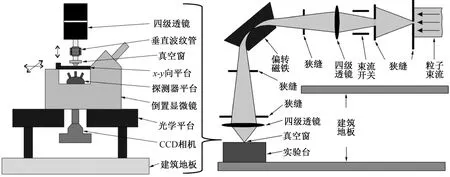
图2 聚焦微束的典型结构示意图(德国物理技术研究院)[12]Fig.2 Typical sketch of focused microbeam (Physikalisch-Technische Bundesanstalt, PTB)[12]
1.2 生物微束的发展现状
20世纪50年代,微束装置最早设计用于放射生物学研究[6],但此后很长一段时间内主要应用于粒子激发X射线荧光分析、卢瑟福背散射等粒子束分析方面(也称为核微探针)[1];直到20世纪90年代Nagasawa等人[17]在低剂量α照射实验中发现非靶细胞的遗传损伤,微束在放射生物学中的应用才得到了进一步发展,建立了以美国RARAF-I[15]和英国GCI[11]为代表的新一代生物微束。早期建设的生物微束大部分采用准直方式,21世纪初随着聚焦系统的成熟以及放射生物学对高分辨率实验条件的需求,新建的生物微束逐渐以聚焦方式为主,如德国PTB[12]、法国波尔多-格拉迪尼昂核子研究中心(CENBG)[18]、中科院近物所[19]等;原有的准直微束实验室基本都新建了聚焦微束,如美国哥伦比亚大学基于5.5 MV加速器新建了RARAF-II微束[15],英国GCI在2007年关停了其准直微束,借助Surrey大学[20]新建的聚焦微束开展研究工作。
针对不同粒子研究需要,目前世界上已经建立了多个轻粒子和重粒子生物微束,其中在运状态的典型微束装置列于表1。在质子微束的基础上,哥伦比亚大学还建立了中子微束[15],利用四级透镜将1.886 MeV的质子束聚焦到10 μm直径,经过涂覆1 μm厚7LiF层、厚度为20 μm的金箔后,可产生36 μm直径的中子束(利用荧光核径迹探测测量);对于中子产额集中的前向角度范围内,在细胞照射位置处的中子束直径约16 μm、平均能量为31 keV。
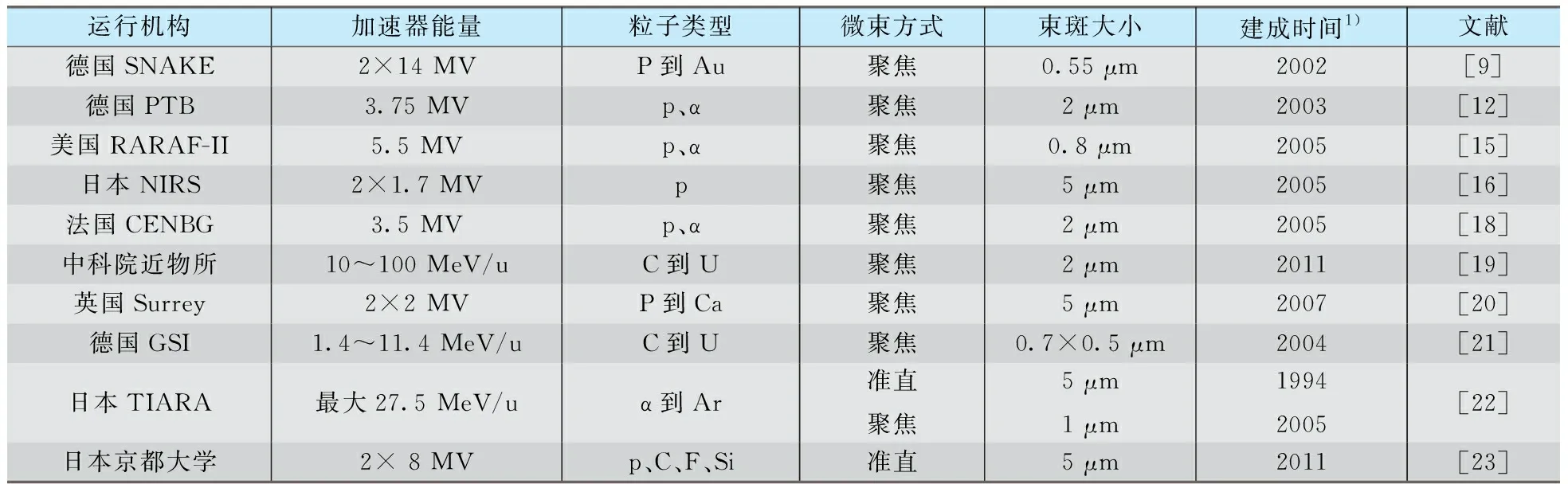
表1 在运状态的典型单细胞单粒子微束Tab.1 Typical single-cell single-particle microbeams in operation
1)生物微束的建成时间,并不是加速器设施的建成时间。
微米及亚微米量级的分辨率和定位精度的实现,使单个细胞或亚细胞结构的定位照射成为可能;结合计算机控制、图像识别、辐射探测、快速束流开关技术等多学科技术发展和集成应用,实现了对单个细胞的单粒子照射;在此基础上,集成活细胞显微成像设备后,生物微束发展成为了集精准物理照射和生物响应动态观测为一体的综合系统[1,4];例如,德国PTB[12]、法国CENBG[24]微束配备了荧光显微镜并耦合了微速摄影技术,美国RARAF-II配备了多光子显微镜以检测非染色细胞对辐射的分子动态响应[15]。在建成之后,相关实验室也在持续升级生物微束装置,例如日本TIARA为其准直微束替换了新的细胞定位系统以提升自动化水平,增加了粒子种类并实现了不同粒子束之间的快速切换[25];RARAF还提出了一种快速微束照射系统,让细胞以受控流态通过与微束相互垂直的微流控通道,利用高速摄像机进行快速识别和动态定位,可以将细胞照射通量提高1个量级达到每小时105个细胞[26];日本NIRS利用空间分辨率更高的荧光核径迹探测器(FNTD)来表征束斑大小,以弥补常用的CR-39探测器因蚀刻坑重叠而无法分辨粒子径迹的不足[27]。
2 单细胞单粒子微束的应用
基于细胞-亚细胞定位照射、照射剂量精准控制、细胞响应在线观测的三个功能特点,单细胞单粒子微束在低剂量效应、辐射诱导旁效应、亚细胞结构辐射敏感性等研究方面得到了广泛应用,并正在向更为复杂的组织和体内模型拓展[3]。
2.1 低剂量辐射生物效应
在20世纪90年代,粒子微束最初被设计用来研究低剂量照射下的细胞辐射生物效应[3]。在传统照射条件下,细胞受到粒子照射的概率以泊松分布估计,即在平均每个细胞1个粒子的照射情况下,37%的细胞不会受照、37%受到1个粒子照射、26%受到多个粒子照射[4]。为了准确研究室内氡照射的致癌风险,Miller等人[28]利用RARAF-I微束实验测试了单个α粒子照射哺乳动物细胞核的致癌效应,观察到了微束照射下细胞癌变比例明显低于传统“宽束”的实验结果,首次得出了多个粒子照射是造成细胞癌变危险主要原因的初步结论。此后,更多的实验研究了单粒子照射下的细胞毒性、致突变效应以及基因组不稳定性[3-4,29];同时也开展了重粒子照射下的细胞效应实验[2,21],以研究空间辐射的低剂量效应。
不论是流行病学、动物实验还是细胞和分子模型,系统的低剂量效应数据仍然比较少,主要根据高剂量下的辐射诱发癌症或遗传效应的统计数据,基于不同的假设模型外推低剂量辐射危险;国际放射防护委员会(ICRP)从防护目的出发,联合采用线性无阈(LNT)模型及剂量和剂量率效应因子(DDREF)作为低剂量辐射危险管理的基础;目前,国际上对LNT假设模型存在争论,而争论焦点集中在低剂量致癌危险的估计方面[29]。
对于高LET辐射低剂量效应的深入研究,粒子微束仍然是最重要的研究手段。例如,基于α粒子微束细胞实验结果估计的氡子体致癌危险,低于根据宽束泊松分布照射的估计值,但仍高于室内氡照射的实际水平[30]。Greubel等人[31]基于SNAKE微束能提供亚微米束斑的特点,实验研究了细胞内剂量空间分布对相对生物效能(RBE)的影响,并尝试通过调整20 MeV低LET质子的空间剂量分布来分析高LET辐射的RBE。Muggiolu等人[32]基于CENBG微束用一个3 MeV的α粒子照射单个细胞,首次原位观察了受照30分种内RNF8蛋白在DNA损伤部位的累积情况,如图3所示;Friedland等人[33]还基于SNAKE微束用给定数量的20 MeV质子、45 MeV Li粒子、55 MeV C粒子以亚微米空间分辨率照射AL杂交细胞,估计DNA损伤的影响,为生物物理模拟软件PARTRAC的相应模型提供实验数据支持。
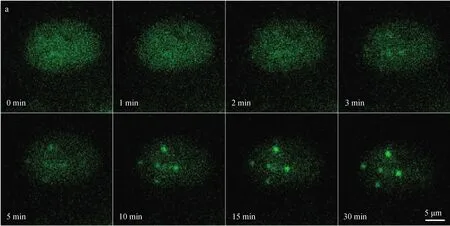
图3 受单个α粒子照射后细胞核内RNF8蛋白的微速摄影结果(CENBG )[32]Fig.3 Time-lapse imaging of RNF8 in a cell nucleus irradiated with single α-particles (CENBG)[32]
2.2 辐射诱导旁效应
基于可对单个细胞定位照射的特点,辐射诱导旁效应(RIBE)是粒子微束最主要的放射生物学应用之一。Prise等人[34]首次报道了基于微束的原代人成纤维细胞的旁效应研究,对细胞群体中的4个细胞照射5~15个3He粒子后,产生了比直接效应预期更多的微核与凋亡细胞;在后续研究中发现,单个粒子照射也会诱发未辐照细胞的微核和凋亡损伤[35];Zhou等人[36]利用α粒子照射人-仓鼠杂交AL细胞发现,20%细胞受照造成了受照细胞群体比预期高3倍的突变率,而采用细胞间通讯抑制剂进行预处理后可显著降低突变率;Shao等人[37]发现,不论细胞核还是细胞质受照都会造成周围未受照细胞微核率的增加,细胞DNA直接损伤不是诱发旁效应的必要条件。近期研究进一步表明,线粒体和内质网分别在细胞核与细胞质受照所诱发的旁效应中具有不同的作用,并且二者密切相关[38]。
基于轻粒子和重粒子微束的大量实验,研究了包括细胞周期进程变化、DNA损伤、基因突变、存活率改变和细胞死亡在内的多种辐射诱导旁效应[21],增进了对辐射诱导旁效应机制以及细胞内和细胞间信号传导作用的认识。在成纤维细胞、淋巴细胞、内皮细胞和不同肿瘤细胞等多种细胞系中观察到了辐射诱导旁效应,被确认的旁效应分子信号转导因子包括活性氧(ROS)、一氧化氮(NO)、转移生长因子-β1(TGF-β1)、环氧合酶-2(COX-2)、肿瘤坏死因子-α(TNF-α)、白细胞介素等[39]。受照细胞产生的信号因子可以通过两种途径传递,一种是可溶性信号分子通过周围介质传递到远处的细胞,另一种是小分子通过细胞间隙连接通讯作用(GJIC)传递给相邻细胞而诱发旁效应[40]。Kobayashi等人[41]基于SPICE微束,开展了一系列受照A549肺癌细胞与周围非受照WI-38正常成纤维细胞之间的信号传导作用研究,研究结果表明,癌细胞与正常细胞之间的GJIC不仅涉及DNA损伤信号的传递,也有助于增加癌症细胞与正常细胞的保护作用,进一步增进了对RIBE的认识以及GJIC在此过程中的作用。
辐射诱导旁效应是分子、细胞、组织和器官中多种因素相互作用的结果。目前,基于微束的旁效应研究以体外细胞模型的现象观察为主,有待进一步开展更为复杂的体内模型以及分子机制方面的深入研究,以便准确评估辐射风险和指导临床放疗[42]。
2.3 亚细胞结构的辐射效应
由于微米-亚微米量级的空间分辨率和定位精度,粒子微束还被用于研究细胞核、细胞质等亚细胞结构单独受照条件下的辐射敏感性。早期的主流观点认为,电离辐射造成的基因突变、癌变等效应主要是细胞核的直接损伤造成的;随后的实验研究发现,细胞核外的亚细胞结构受照也会诱发辐射效应并逐步受到关注。
对于细胞核的辐射效应,粒子微束的应用主要集中在DNA团簇损伤和修复的时空演化规律研究。高分辨率、高LET的粒子微束能够在细胞核内造成团簇性损伤,结合免疫染色、绿色荧光蛋白(GPF)标记、高分辨率荧光显微镜以及微速摄影技术,使参与DNA损伤识别、响应和修复的蛋白募集动态可视化成为可能[4]。英国GCI[43]、德国SNAKE[44]、GSI[45]等研究机构,最早利用粒子微束实现了细胞核DNA损伤和修复蛋白动态的可视化,以了解DNA损伤模式和程度及其时间和空间演化过程;借助于微速摄影技术,粒子微束可以在线观测单个细胞在受照几秒到几分钟内DNA损伤的早期响应。此后,相关研究机构进一步改进了在线细胞辐射响应观测技术。美国RARAF-II[46]增加了多光子显微镜,通过多光子激发进行激光扫描显微成像,能够对小动物、组织等生物样品进行三维成像;德国GSI微束[47]集成了可漂白细胞核内特定区域的激光部件,以检测修复蛋白的交换与结合行为;德国PTB微束[48]设计了一种辐照后对染色体畸变与微核进行在线实时可视化的方法。
粒子微束的应用,使单独研究亚细胞结构的辐射效应成为可能。美国RARAF[49]早期利用α粒子照射细胞质(通过双荧光染料分别定位细胞核与细胞质)的研究表明,细胞质也是辐射基因毒性效应的重要靶点,相对于细胞核受照具有较高的突变和较低的细胞死亡比例;进一步研究发现,细胞质受照也可以诱发非直接受照细胞的基因毒性效应,使研究重点逐渐转移到旁效应机制以及细胞内和细胞间信号传导作用。近期,Konishi等人[50]利用3.4 MeV质子微束,对比了细胞核、细胞质、细胞核+细胞质分别受照时DNA双链断裂(DSB)的修复机制,结果显示细胞质损伤触发了细胞核受照诱发的DSB增强修复作用。此外,作为细胞质中体积较大且存在DNA的细胞器,线粒体也是辐射损伤的靶点之一[51];Walsh等人[52]首次原位记录了碳粒子和质子微束(束斑<1 μm)靶向照射线粒体后的响应,观察到了辐射诱发的线粒体膜电位的变化,为推测线粒体的辐射效应机制提供了支持;Chen等人[53]基于SPICE微束,实验研究了PC-3细胞核接受500个质子或一定质子剂量照射后1~24小时内的DSB修复机制,首次揭示了免疫染色γ-H2AX对DSB修复机制的预测作用;Wang等人[54]基于SPICE质子微束实验研究了正常人肺成纤维细胞WI-38细胞质的辐射效应,发现NRF2抗氧化反应在缓解细胞质辐射诱导DSB中发挥着重要作用;Seibenwirth等人[55]基于SNAKE微束,实验研究了C粒子照射细胞核仁后的辐射效应。
2.4 组织或体内模型的辐射效应
生物微束最大的特点是在空间、时间和剂量精准受照条件下,原位检测活细胞的辐射生物效应;体外细胞实验有利于阐明辐射效应的基本机制,但很难由其推断出体内响应[4]。为此,微束应用研究的生物学对象也从细胞培养模型拓展到了更为复杂的三维组织模型以及体内模型。
英国GCI[56]最早利用微束研究了输尿管原代外植体在类似活体条件下的旁效应。此后,人表皮重建结构是微束应用研究中最常用的组织模型;美国RARAF[57]最早开展了三维人表皮重建组织的微束辐照实验,发现旁效应信号范围很广,并提出了旁效应在基于流行病学的低剂量辐射风险评估中至关重要的推断。目前,微束应用研究也已经拓展到了线虫、斑马鱼、小鼠等在体模型[2,30]。Suzuki等人[58-59]利用准直C粒子微束照射线虫中枢神经系统20 μm直径的有限区域,评估线虫运动能力随照射位置和剂量的变化,首次实验研究了中枢神经系统在辐射所致运动能力降低中的作用,同时研究了高剂量照射下线虫的运动能力抑制及诱导自噬作用;Yasuda等人[60]基于TIARA准直微束,以不同的直径照射青鳉鱼胚胎中心区域,发现受照胚胎中严重受损细胞或剩余完整细胞的比例决定了胚胎能否正常发育。
此外,随着近年来格栅状放疗(GRID)的临床应用,结合微束可在微米尺度范围内进行高剂量照射的特点,微束放疗(Microbeam Radiotherapy,MRT)在肿瘤精准照射方面的潜在价值开始受到关注。但MRT治疗效果的生物学机制尚不明确,也无法利用均匀照射数据或放射生物学损伤和修复模型来推测;针对MRT的临床前和临床放射生物学研究,也是生物微束装置未来的重要应用方向之一[61]。
3 小结
经过将近70年的发展,生物微束已经从最初的细胞照射工具,逐步演化成了集精准物理照射和生物响应动态观测为一体的综合实验系统。利用束流聚焦和自动控制技术,可以实现亚微米的束流空间分辨率,对亚细胞结构进行精准照射;借助于先进的显微成像技术,可以对受照样品生物响应的空间和时间演化进行在线原位观测。微束细胞-亚细胞定位照射、照射剂量精准控制、细胞响应在线观测的特点,促进了放射生物学在低剂量效应、辐射诱导旁效应、亚细胞结构辐射效应等方面的发展,并将研究对象从细胞培养模型逐步拓展到三维组织和在体模型。随着束流控制精度以及成像质量的提升,微束将继续在放射生物学研究中发挥重要作用。
针对辐射防护基础研究的需要,中国辐射防护研究院在2021年获批立项建设基于粒子加速器的辐射防护综合实验设施,将新建2×6 MV串列加速器以及包括单细胞单粒子微束在内的8个实验终端。拟建设的微束终端计划采用聚焦方式,以实现1 μm空间分辨率的预期指标,提供质子、He、B、C、Fe等粒子的照射束流,重点开展辐射生物效应方面的基础研究。
