贮藏方法对紫花苜蓿种子内生根瘤菌传代能力的影响
2022-07-05刘畅师尚礼康文娟苗阳阳吴芳
刘畅,师尚礼,康文娟,苗阳阳,吴芳
(1.甘肃农业大学草业学院,草业生态系统教育部重点实验室,甘肃省草业工程实验室,中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070;2.黑龙江八一农垦大学动物科技学院草业科学系,黑龙江 大庆 163319)
紫花苜蓿(Medicagosativa)是世界上种植面积最广的豆科牧草,由于其适应性广、产草量高、且富含蛋白质、维生素和矿物质等营养,被誉为“牧草之王”[1]。它与根瘤菌共生形成根瘤,能固定大气中的氮,进而提高产量。紫花苜蓿与根瘤菌的结合方式既有外部侵染方式,也有内生方式,既有共生促生方式,也有联合促生方式,二者的结合方式与促生效应或共生效应关系密切,这是紫花苜蓿与根瘤菌共生育种的研究热点。苜蓿根瘤菌以内生菌形式存在时,可以合成化合物促进植物生长、提高植物对水分和营养的吸收、联合固氮、提高植物的抗逆性[2]。根瘤菌内生于紫花苜蓿种子,可运移并定殖于苜蓿根、茎、叶、种子等组织[3],通过种子内生根瘤菌传代结瘤和固氮促生,这是共生系统可持续性的表现形式。苗阳阳[4]对苜蓿添加适宜浓度的外源物质如硼、赤霉素、苦参碱并接种荧光标记根瘤菌株,可以促使根瘤菌侵染昔蓿根系进入其内部,在苜蓿植株体内运移并定殖,最后运移到成熟种子中。种子内生菌可以协助寄主植物抗菌[5],提高植物抗旱能力[6]。种子内生根瘤菌能否传代至次代植株并结瘤固氮,对于种子内生根瘤菌的有效利用和在植物代际间的功能延续具有重要意义。
研究表明植物内生微生物也可垂直传代[7],Adam等[8]研究发现南瓜(Cucurbitamoschata)种子内生微生物可以垂直传播到下一代植物。Liu等[10]报道了在水稻(Oryzasativa)和玉米(Zeamays)中特定的内生菌可以进行多代传代,Johnston-Monje等[11]使用绿色荧光蛋白对内生菌进行标记,证明了内生菌是从玉米种子进入根和根际土壤,再运移到植物的其他组织,赵霞[12]对水稻种子内生细菌来源测定发现水稻植株内生菌存在代际间传代。
紫花苜蓿的主要繁殖方式为种子繁殖,种子质量直接影响到牧草产量[13],温度、湿度是影响种子质量的关键因素,也影响着种子内生菌的数量及生命力[14]。李春杰等[15]研究发现,随着贮藏温度的升高,苜蓿种子携带真菌检出率逐渐增高,张远兵等[16]发现冰箱内湿藏后的牡丹(Paeoniasuffruticosa)种子萌发率最高,孔祥辉等[17]发现韭菜(Alliumtuberosum)种子经过硅胶干燥处理后可以延长贮藏寿命。苜蓿种子内生根瘤菌在不同温度及水分条件下,是否可以保存活性并传代,目前鲜见报道。因此,本研究以不同贮藏方式的内生青色荧光蛋白(GFP)标记根瘤菌的紫花苜蓿种子为试验材料,通过对内生根瘤菌种子次代植株体内GFP根瘤菌分布和定殖数量研究,明确苜蓿种子内生根瘤菌传代能力和结瘤有效性,并筛选出有利于提高种子内生根瘤菌传代能力和传代有效性的最佳贮藏方法,为揭示优良根瘤菌在苜蓿种子代际间的延续提供依据,也为紫花苜蓿-根瘤菌共生育种奠定基础。
1 材料和方法
1.1 试验材料
种子来源:苗阳阳[4]于2014年在草业生态系统教育部重点实验室牧草实训基地生长4 a的甘农5号紫花苜蓿(Medicagosativacv.Gannong No.5),通过结荚期以根部直接浇灌的接种方法接种青色荧光蛋白(GFP)标记的根瘤菌株EnsifermelilotiLZgn5f(gn5f)和根瘤菌株Ensifer.meliloti12531f(12531f)获得两种内生根瘤菌种子,室内风干两个月后进行贮藏[18]。以无菌水浇灌苜蓿植株后收获的种子为对照。
gn5f的原始菌株E.melilotiLZgn5分离自甘农5号紫花苜蓿种子的内源根瘤菌,为快生型产酸根瘤菌;12531f原始菌株E.meliloti12531购自中国科学院微生物保藏中心—分离自非本苜蓿植株体内的外源根瘤菌,为慢生型产碱中华根瘤菌,通过三亲本杂交法构建荧光标记根瘤菌。
培养基:YMA刚果红培养基(1 L):0.5 g K2HPO4·3H2O,0.2 g MaSO4·7H2O,0.1 g NaCl,10 g甘露醇,1 g酵母粉,10 mL 0.25 g/100 mL刚果红溶液,1 000 mL蒸馏水,pH值7.0,固体培养基加琼脂15 g/L。
营养液:Hoagland有氮营养液和Hoagland无氮营养液,以1 mol/L的NaOH溶液或1 mol/L HCl溶液调节营养液 pH值=7.0±0.1。
1.2 试验方法
1.2.1 种子贮藏 将分别含gn5f和12531f的甘农5号紫花苜蓿种子和对照种子于2014年11月-2017年11月进行预处理,具体方法为:采用信封包装,25 ℃+自然湿度(相对湿度为45%—65%)(S1)、25 ℃+硅胶干燥(每一个月更换一次硅胶)(S2)、4 ℃+冰箱冷藏湿度(S3)和-4 ℃+冰箱冷冻湿度(S4)下贮藏[18]。
1.2.2 苜蓿幼苗培养 在草业生态系统教育部重点实验室沙培法栽培苜蓿幼苗[19]。严格控制生长条件与试验条件,区组内差异视为试验误差。分别选取贮藏后健康饱满、大小一致的紫花苜蓿gn5f内生种子、12531f内生种子和对照种子,在无菌操作台内碘伏消毒2 min并用无菌水清洗4次后用无菌滤纸吸干水分。蛭石、细沙洗净烘干,灭菌(121 ℃,灭菌26 min)3次后,蛭石∶细沙=1∶1装入直径30 cm、高30 cm、容积21 L的花盆内,花盆栽入土中20 cm深。每盆播种50粒已消毒的种子,表面覆盖干沙2 cm左右。每花盆内加Hoagland有氮营养液1次,发芽前浇无菌水补充水分。发芽后每15天浇Hoagland无氮营养液1次,期间浇无菌水补充水分,45 d收获苜蓿植株(植株相对高度约18 cm)。
1.3 测定指标及方法
1.3.1 苜蓿植株体内荧光标记根瘤菌的检测 每处理每个重复随机取3株幼苗,根、茎、叶分离,分别称取1 g置于无菌三角瓶中,在超净工作台内用医用碘伏浸没各部分震荡消毒2 min后,用无菌水冲洗,直至冲洗液澄清透明无泡沫。将表面消毒的植物组织在固体培养基上放置30 min后取出,培养基置于28 ℃下培养48 h,未长出菌落表明植物组织表面已彻底消毒[20],将消毒后的各个组织放到无菌研钵中,加无菌水2 mL,充分研磨后,将研磨液倒入5 mL无菌离心管中,4 000 r/min,离心5 min,吸取0.2 mL上清液涂布于含刚果红的YMA固体培养基中(根部吸取上清液后,用无菌水配置成10-1、10-2、10-3稀释液),28 ℃培养48 h[21]。培养结束后,黑暗条件下用手提式紫外灯(波长336 nm)观察并记录发青色的荧光标记根瘤菌落数,换算出每克植物组织中荧光标记根瘤菌数量[22]。
1.3.2 结瘤能力检测 每处理每个重复随机取10株幼苗(根系完整),蒸馏水冲洗根系周围细沙、蛭石,无菌滤纸吸干水分。
(1)测定苜蓿幼苗的单株结瘤数;(2)测定苜蓿幼苗的单株有效根瘤重,使用灭菌的手术刀,将每株幼苗的所有根瘤沿根瘤与根系连接处切下,放在滤纸上吸干表面水分后称重[23];(3)苜蓿幼苗的根瘤直径测量:游标卡尺;(4)根瘤等级:根瘤等级划分参考5分制计分法[24]:1分:中空无内容物的死亡根瘤;2分:横切面呈灰白色的无效根瘤;3分:直径小于0.5 mm的粉色根瘤;4分:直径0.5~1 mm的粉色根瘤;5分:直径大于1 mm的粉色根瘤;(5)固氮酶活性:采用乙炔还原法[25]。切下根瘤,称取鲜重,放置8 mL青霉素瓶中,盖紧瓶塞并密封,使用微量注射器抽取0.8 mL空气,并注入0.8 mL乙炔气体,反应2 h。然后使用100 μL微量注射器吸取50 μL瓶内气体注入气象色谱仪[26]。
C2H4水平(μmol/(g·h))=
C:标准C2H4浓度(nmol/mL);hx:样品峰面积;V:反应气体体积(mL);hs:标准C2H4峰面积22.4(乙烯的物质的量);t:反应时间(h);m:瘤重(g)。
1.3.3 生长指标 每处理每个重复随机取4株幼苗(根系完整),蒸馏水冲洗根系周围细沙、蛭石,无菌滤纸吸干水分,测定生长指标。
(1)单株叶片数(复叶);(2)株高、根长测量:直尺;(3)地上生物量:天平称取地上鲜重;然后放于烘箱中105 ℃烘20 min,随后80 ℃烘至恒重,称其干重;(4)地下生物量:同(3)。
1.4 数据处理
数据结果采用SPSS 20.0进行方差分析,Duncan法多重比较,利用R语言做相关性分析,EXCEL 2016制图。
2 结果与分析
2.1 贮藏方法对苜蓿种子内生根瘤菌传代定殖的影响
不同贮藏处理下,次代植株各组织部位中可不同程度检测到gn5f、12531f根瘤菌。苜蓿种子内生根瘤菌可传代至次代植株中(图1)。
gn5f在S1、S3、S4贮藏处理的植株根部可检测到,且S1贮藏处理较S3、S4贮藏处理根瘤菌数量分别增加了308.88%和78.07%(P<0.05),而S2贮藏处理未检测到(图1-A)。12531f在S1、S2、S4贮藏处理的植株根部可检测到,且S2处理根部定殖数量最大,为560.63 cfu/g,显著高于S1和S4(P<0.05),分别提高了117.23%,284.60%;S3贮藏处理根部未检测到12531f。CK处理根部均未检测到gn5f和12531f(图1-A)。
次代植株茎部标记根瘤菌定殖情况为,gn5f在S1、S3、S4贮藏处理植株茎部可检测到,S1贮藏处理茎部定殖数量最多,为303.03 cfu/g,分别高于S3、S4贮藏处理117.11%和36.00%(P<0.05)。12531f在S1、S4贮藏处理植株茎部检测到,S1贮藏处理的定殖数量最大,为36.13 cfu/g,高于S4294.33%(P<0.05)。标记根瘤菌gn5f、12531f在CK和S2贮藏处理植株茎部未检测到(图1-B)。
次代植株叶部标记根瘤菌定殖情况为gn5f在S1、S2贮藏处理植株叶部可检测到,S1贮藏处理叶部定殖数量最大,为11.10 cfu/g,显著高于S2贮藏处理127.46%(P<0.05)。12531f在S2、S3、S4贮藏处理植株叶部可检测到,S4贮藏处理12531f定殖数量最多,为25.27 cfu/g,较S2、S3贮藏处理分析增加了17.97%和410.50%(P<0.05),但S1贮藏处理未检测到。gn5f、12531f在CK叶部均未检测到(图1-C)。
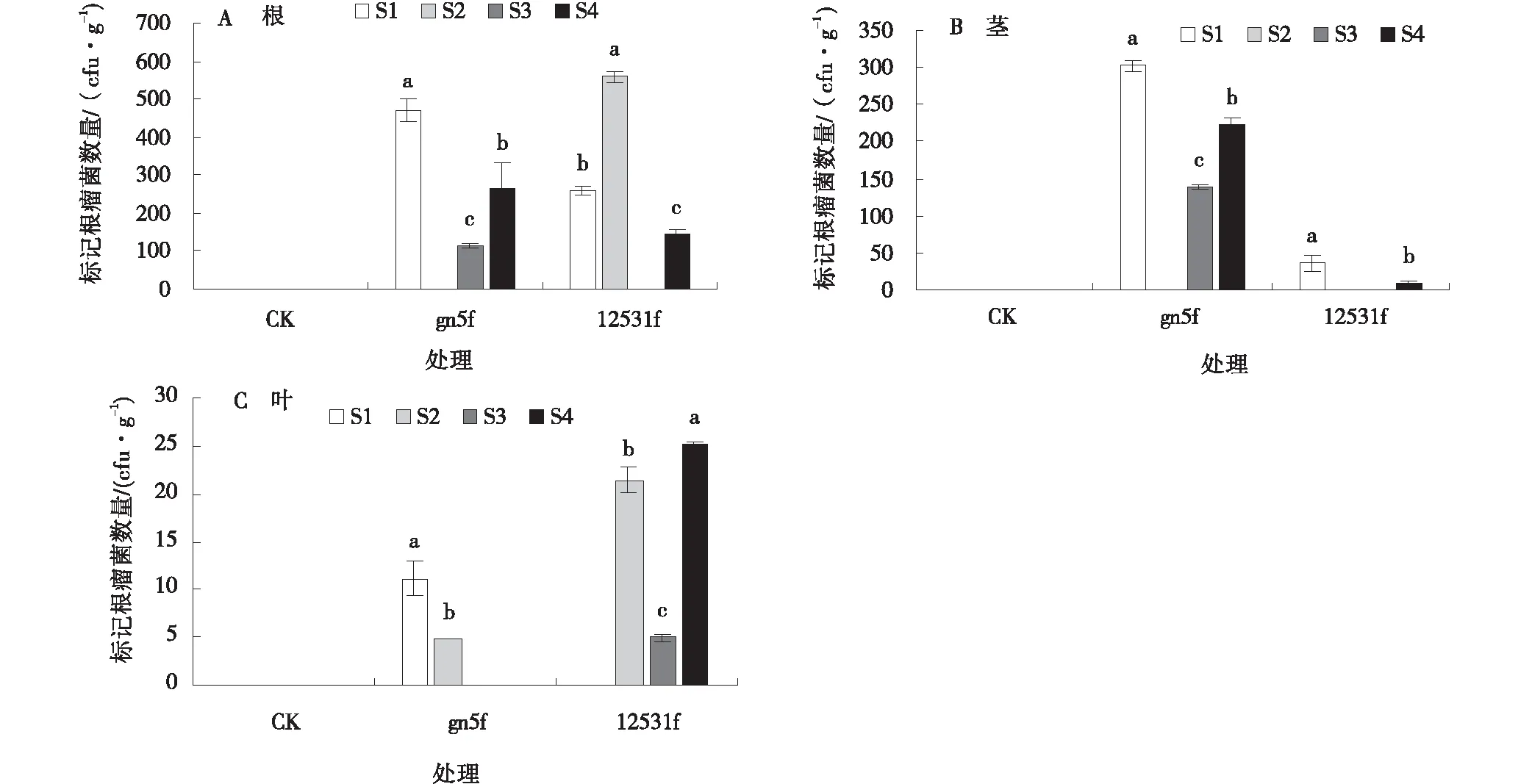
图1 不同贮藏方法下苜蓿内生荧光标记菌株gn5f、12531f在次代植株根、茎、叶内的定殖数量
根据以上分析,gn5f在S1处理各部位数量均最高,12531f在S2处理根部数量最高,两个菌株在次代植株中的内生部位和定殖数量受到种子贮藏条件的影响。在各贮藏处理下,次代植株两个菌株内生部位从根、茎到叶,根瘤菌数量均呈递减趋势,且根部>>茎部>>叶部。
2.2 贮藏方法对次代植株结瘤有效性的影响
各贮藏处理下,不同程度增加gn5f、12531f在次代植株上的结瘤能力(图2)。S1贮藏处理次代gn5f单株结瘤数最高,为12.33个,较CK高37%。S3贮藏处理单株结瘤数为8.67个,较CK高8.38%。S2、S4贮藏处理单株结瘤数分别为6.33个和6个,较CK分别减少了34.52%、27.97%(P<0.05)。S2处理12531f单株结瘤数最高,为13.33个,较CK高37.90%(P<0.05)。S1、S4贮藏处理单株结瘤数分别为7个和5个,较CK分别减少了22.22%、39.98%;S3贮藏处理单株结瘤数为10.67个,高于CK 33.38%(P<0.05)(图2-A)。
S1贮藏处理gn5f单株有效根瘤重最高,为0.101 4 g,较CK增加了1 183.54%(P<0.05)。S2贮藏处理单株有效根瘤重为0.016 9 g,较CK减少了3.98%。S3、S4贮藏处理单株有效根瘤重分别为0.0376 g和0.0145 g,较CK分别增加了353.01%、62.92%(P<0.05)。S3贮藏处理12531f单株有效根瘤重最大,为0.028 g,较CK增加了237.35%(P<0.05)。S1、S2贮藏处理单株有效根瘤重分别为0.014 5 g和0.022 0 g,分别高于CK83.54%、25%(图2-B)。
4个贮藏处理下,gn5f、12531f根瘤直径均高于CK。gn5f、12531f均在S2贮藏处理根瘤直径最高,分别为2.16 mm和1.82 mm,较CK分别增加了44.00%和21.33%(P<0.05)(图2-C)。
S1贮藏处理gn5f根瘤等级最高,为5,显著高于CK和同菌株其他贮藏处理(P<0.05)。S2贮藏处理根瘤等级为3,较CK减少了25.00%。S2贮藏处理12531f根瘤等级最大,为5,较CK增加了25.00%(P<0.05);S1贮藏处理根瘤等级为4,高于CK 33.33%;S4贮藏处理根瘤等级为2,较CK减少了33.33%(P<0.005)(图2-D)。
S1贮藏处理gn5f固氮酶活性最强,为60.46 μmol/(g·h),显著高于CK(P<0.05)。S3、S4处理固氮酶活性有不同程度提升,且S2贮藏处理12531f固氮酶活性最强,为126.44 μmol/(g·h)。S1、S4贮藏处理固氮酶活性为0.034 3 μmol/(g·h)、0.162 1 μmol/(g·h),较CK分别减少了86.38%、44.68%;S3贮藏处理固氮酶活性为81.67 μmol/(g·h)(P<0.05)(图2-E)。

图2 不同贮藏方法下内生gn5f、12531f种子的次代苜蓿幼苗单株结瘤数、单株根瘤重、根瘤直径、根瘤等级、固氮酶活性
2.3 不同贮藏方法种子内生根瘤菌对次代植株生长的促进效应
S1、S3贮藏处理次代植株gn5f单株叶片数分别为14.33和11.00,分别高于CK 38.72%、17.90%(P<0.05)。S2、S4贮藏处理单株叶片数和CK一样,分别为11.33和9.67。S2、S3贮藏处理12531f单株叶片数分别为16.00和11.67,分别高于CK 41.22%、25.08%(P<0.05)。S1、S4贮藏处理单株叶片数为11.33和11,分别高于CK 9.67%、13.75%(图3-A)。
4个贮藏处理下,次代植株的株高均高于CK。gn5f在S1贮藏处理株高最大,为19.52 cm,较CK增加了40.63%(P<0.05)。12531f在S2贮藏处理株高最大,为19.85 cm,较CK增加39.40%(P<0.05)(图3-B)。
4个贮藏处理下,次代植株根长均高于CK。gn5f在S1贮藏处理根长最高,为15.43 cm(P<0.05),较CK增加了33.82%(P<0.05)。12531f在S2贮藏处理根长最大,为17.23 cm,较CK增加36.04%(P<0.05)(图3-C)。
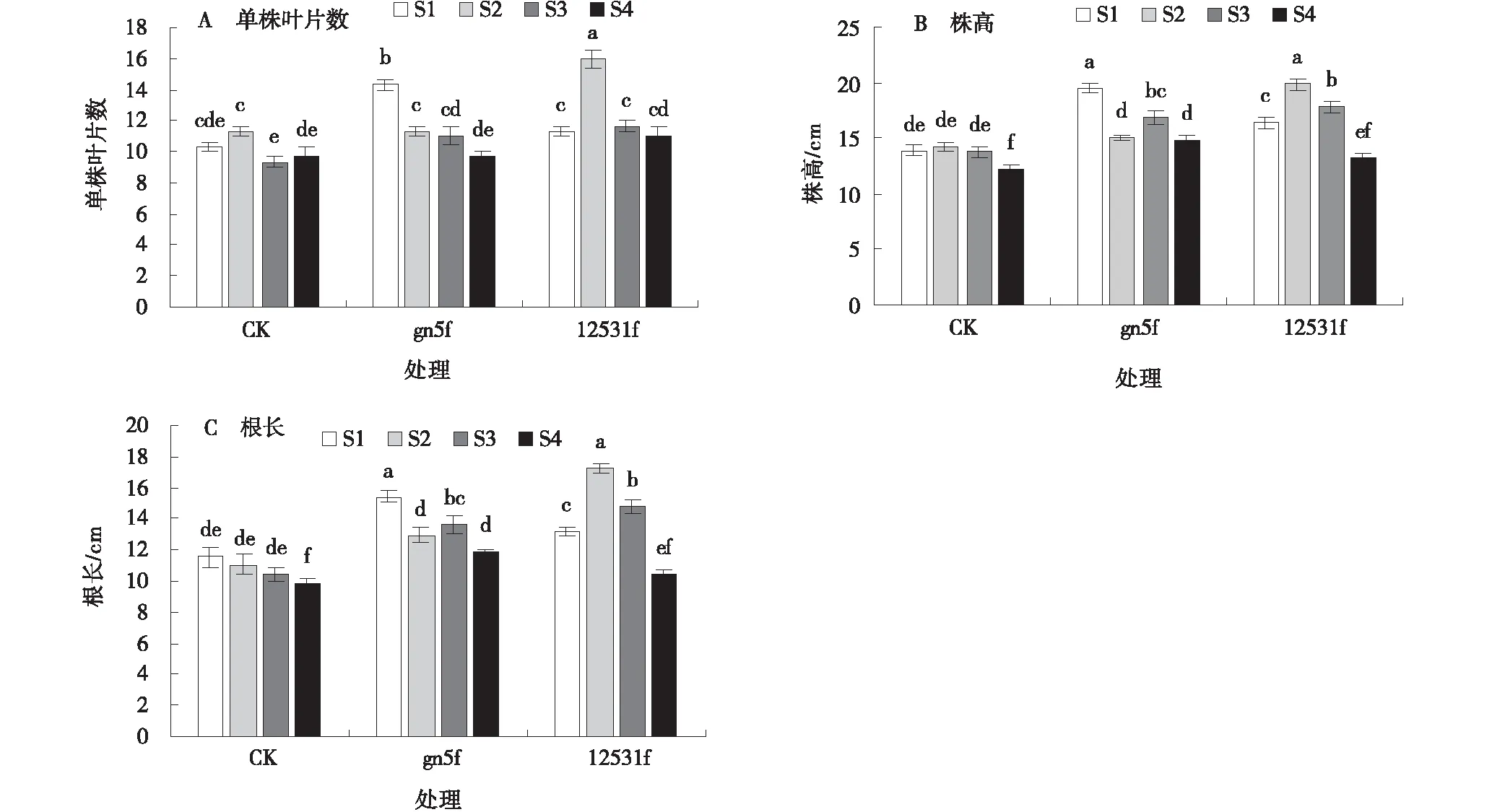
图3 在不同贮藏方法下内生gn5f、12531f种子的次代苜蓿幼苗单株叶片数、株高、根长
内生根瘤菌对次代植株苗期的生物量积累有不同程度的促进作用,S1贮藏处理次代植株gn5f地上鲜重最高,为0.4934 g,较CK高68.11%(P<0.05)。S2贮藏处理地上鲜重为0.2871 g,较CK减少了3.63%;S3、S4贮藏处理地上鲜重分别为0.3612 g、0.2837g,较CK分别高39.89%、9.71%。4种贮藏处理下12531f地上鲜重均高于CK,在S2贮藏处理地上鲜重最高,为0.5135 g,较CK提高了72.37%(P<0.05)(表1)。

表1 不同贮藏方法下次代植株苗期的生物量
4个贮藏处理下,次代植株地上干重均高于CK。gn5f在S1贮藏处理地上干重最高,为0.1405 g,较CK增加了137.73%(P<0.05)。12531f在S2贮藏处理下地上干重最高,为0.1399 g,较CK增加了144.58%(P<0.05)。
4个贮藏处理下,次代植株根鲜重均高于CK。gn5f在S1贮藏处理根鲜重最高,为0.4179 g,较CK增加了223.70%(P<0.05)。12531f在S2贮藏处理根鲜重最高,为0.3587 g,较CK增加了284.05%(P<0.05)。
4种贮藏处理下gn5f根干重均高于CK,在S1贮藏处理根干重最高,为0.1036 g,较CK增加了600.00%(P<0.05)。S2、S3、S4贮藏处理根干重分别为0.0276 g、0.0321 g、0.0194 g,较CK分别增加了196.77%、221.00%、162.16%。12531f在S2贮藏处理根干重最高,为0.090 4 g,较CK增加了872.04%(P<0.05)。
2.4 次代植株传代根瘤菌结瘤有效性与生长效应的相关性分析
对不同贮藏处理下的次代植株根系结瘤有效性、生长效应进行相关性分析表明,单株结瘤数与根瘤等级、固氮酶活性、单株叶片数、株高、根长均呈极显著正相关(P<0.01),相关系数达到70%以上,与地上鲜重、地上干重呈正相关(P<0.05);根瘤等级和固氮酶活性都与单株叶片数、株高、根长、地上干重呈极显著正相关(P<0.01)(图4)。单株叶片数和根长与单株有效根瘤重、根瘤直径不相关外,与其他9个指标间亦呈极显著正相关(P<0.01),相关系数达到75%以上。株高与根瘤直径不相关外,与单株有效根瘤重呈正相关(P<0.05),与其他9个指标间亦呈极显著正相关(P<0.01);地上鲜重与单株叶片数、株高、根长、地上干重、根鲜重、根干重呈极显著正相关(P<0.01),相关系数达到80%以上(图4)。根瘤直径与其他11个指标之间的相关性较低。

图4 贮藏方法对次代植株苗期根系结瘤能力、幼苗生长能力的相关性分析
3 讨论
内生根瘤菌是能与宿主植物互利共生的有益细菌,可以合成化合物促进植物生长、提高植物对水分和营养的吸收、联合固氮、提高植物的抗逆性[27]。种子是下一代植株内生根瘤菌的重要来源,但是种子内生根瘤菌的来源并不明确。而在本研究中,将具有荧光标记根瘤菌的种子作为试验材料,有利于更深入地研究内生根瘤菌的传代能力和传代有效性,同时避免了其他来源内生根瘤菌的干扰。此外,本研究采用不同贮藏方法的内生根瘤菌种子,可筛选出适宜优良苜蓿-根瘤菌共生体的贮藏条件。
本研究在次代植株苗期的各部位均可检测到gn5f、12531f,说明种子内生根瘤菌可以传代至次代植株中。张彩文[28]在研究中发现,水稻亲代种子内生菌可在植株生长发育过程中传播到根、茎组织并最终传播到子代种子内,即种子内生菌可以进行垂直传播,与本试验结果一致。张淑卿[29]标记菌迁移试验发现的根瘤菌自根向茎顶部的运移通道是存在的,标记根瘤菌在运移通道中的分布是不连续的,在部分通道组织内能只能选择性允许标记菌通过,不能长期定殖。本试验中不同贮藏条件的种子内生根瘤菌虽均可以传代至次代植株中,但两种菌株在根部定殖数量高于茎、叶部,且gn5f在S1贮藏处理根、茎、叶部定殖数量显著高于其他贮藏处理;12531f在S2贮藏处理根部定殖数量显著高于其他贮藏处理,个别贮藏条件下的次代植株苗期根、茎、叶部未检测到标记根瘤菌,可能是茎、叶部位标记根瘤菌测定不表现,这都证实了其研究结果。
gn5f和12531f在次代植株苗期的定殖数量有差异,gn5f在S1贮藏条件次代植株中的数量最多,12531f在S2贮藏条件次代植株中的数量最多。可能是由于两种菌株来源不同,对于甘农5号紫花苜蓿来说,gn5f原始菌株gn5为内源菌株,是快生型根瘤菌,12531f原始菌株12531为外源菌株,是慢生型根瘤菌,两种菌株的遗传性状差异较大;其次可能是种子贮藏方法不同导致内生根瘤菌在次代植株传代能力不同。温度影响细菌的生理生化代谢途径,Hoch等[30]研究发现当温度低于12 ℃时,微生物的生长速率与温度成正相关,在适宜温度下,细菌繁殖快,更容易存活,温度过低后微生物生长出现逆境,表现为微生物数量较低等,祁娟[31]的研究表明在-16~20 ℃苜蓿种子内生根瘤菌存在着低温临界点,低于此温度临界点,苜蓿种子内生根瘤菌生长会受阻,本试验也证实了这一点。适宜的贮藏温度内生根瘤菌适合存活可以顺利传代,而低温对微生物生长的抑制作用较大,从而导致-5 ℃下内生根瘤菌数量较少[32]。适宜的温度下微生物才能生长繁殖,过高或过低的温度均不利于微生物的生长和繁殖,这就可能造成不同温度贮藏下的次代植株苗期内生根瘤菌数量差异较大。
不适宜的贮藏温度可能会导致种子中的内生菌致死[33],在种子贮存过程中,内生菌的活性的降低先于种子活力的降低[34],与种子的活力相比,内生菌的活性更容易受温度、湿度等外部条件的影响,其活力比种子活力低[35-36]。苗阳阳[18]在研究25 ℃、25 ℃硅胶干燥、-4 ℃和4 ℃贮藏方法下次代种子内生根瘤菌数量时,其数量和本试验中次代植株内生根瘤菌数量有差异,或因内生根瘤菌在苜蓿种子中的定殖数量可能会随着贮藏时间及条件的变化而降低,也可能是因为内生根瘤菌存在于种子中但是未表现出来或在贮藏过程中次代种子内生根瘤菌进行再一次的增殖或衰减。
接种根瘤菌可有效促进紫花苜蓿早结瘤,提高其产量和品质[37],本试验内生根瘤菌种子的次代植株结瘤竞争能力高于CK,两个内生根瘤菌菌株均可提高次代植株苗期的结瘤有效性和生长效应,任安芝等[38]也证明种子内生菌可以有效提高幼苗根长和苗高、生物量积累等,祁娟[31]将苜蓿种子内生根瘤菌分离纯化后回接的试管苗的结瘤指标、生物量均得到提高。本试验表明不同贮藏方法的种子内生根瘤菌可以高效传代,根瘤菌传代后依然可以增加苜蓿植株生物量。但内生根瘤菌能否在苜蓿植株生殖生长期稳定生存,并保持良好的促生效果,是否可以继续传代至第三代种子中有待继续研究。
4 结论
适宜的贮藏方法有利于提高种子内生根瘤菌的传代能力和传代有效性,在4种贮藏条件下,苜蓿种子内生根瘤菌均可传代至次代植株苗期各部位,gn5f内生种子适宜S1贮藏,可高效传代到次代植株共生结瘤,固氮促生;12531f内生种子适宜S2贮藏,可高效传代到次代植株共生结瘤,固氮促生。在各贮藏条件下,均可不同程度提高gn5f、12531f次代植株苗期的单株叶片数、株高、根长、生物量;gn5f内生种子在S1贮藏,可提高次代植株苗期的单株结瘤数、单株根瘤重、根瘤直径、根瘤等级;12531f内生种子在S2贮藏,可提高种子植株苗期的单株结瘤数、单株根瘤重、根瘤直径、根瘤等级、固氮酶活性;两种菌株稳定传代到下一代植株时均有向繁殖器官运移定殖的明显趋势。
