胃癌患者癌组织及血清中lncRNA-GC1的表达及其对化疗耐药性的影响*
2022-07-05陈芦斌石秦川刘靖圆
陈 域,郭 欣,陈芦斌,石秦川,刘靖圆
(空军第九八六医院普通外科,西安 710054)
胃癌是最常见的消化道肿瘤,在我国发病率呈逐年上升趋势,严重危害患者的生命健康[1-2]。内镜活检是目前诊断胃癌的金标准,然而由于患者检查时的不适和检查成本高昂,早期胃癌尤其是无症状个体筛查是临床实践中的一大困难[3]。顺铂是当前治疗胃癌的重要化疗药物之一,可不同程度地改善患者预后,但化疗耐药的发生阻碍其应用[4-5]。因此,探索具有高灵敏度和特异度的胃癌诊断新方法及胃癌细胞化疗耐药的分子机制,寻找有效的治疗靶点是当前的重要课题之一[6]。近年来,长链非编码RNA(long non-coding RNA,lncRNA)因功能多样性、相对稳定性及易检测性得到了许多研究者的关注[5]。lncRNA在细胞增殖、分化及凋亡等过程的调控中具有重要作用,已被证实可作为肿瘤筛查、治疗效果及预后评估的潜在靶点[7-8]。研究表明,与胃癌相关的长链非编码RNA-GC1(long non-coding RNA-GC1,lncRNA-GC1)作为一种RNA聚合酶Ⅱ转录物,可通过与组蛋白乙酰转移酶(histone acetyltransferase,HAT)和赖氨酸乙酰基转移酶2A (K-lysine acetyltransferase 2A,KAT2A)结合,激活与靶基因超氧化物歧化酶2(superoxide dismutase 2,SOD2)有关的组蛋白修饰,从而促进胃癌的进展[9]。本研究通过检测胃癌患者癌组织和血清中lncRNA-GC1的表达水平,探讨lncRNA-GC1在胃癌筛查中的价值,以及其对胃癌患者化疗耐药性的影响。
1 资料与方法
1.1 一般资料
选择2019年1月至2021年1月于本院行手术治疗的胃癌患者为研究对象。纳入标准:(1)经组织病理学确诊为胃癌;(2)年龄18~80周岁;(3)患者自愿参与研究。排除标准:(1)合并严重心、脑、肝、肾疾病;(2)合并其他系统恶性肿瘤;(3)临床病理资料完整。最终,纳入86例胃癌患者(胃癌组),其中男54例,女32例,平均年龄(61.25±5.21)岁。同时,纳入同期在本院体检的86例健康体检者作为健康对照组,其中男55例,女31例,平均年龄(61.82±5.54)岁。两组性别、年龄比较,差异均无统计学意义(P>0.05),均衡可比。本研究所有程序均符合赫尔辛基宣言,获得本院伦理委员会批准(KYLL2020-986-22),所有患者均自愿参与研究且签署知情同意书。
1.2 方法
1.2.1标本采集及资料收集
取所有胃癌患者术前和健康对照组血液标本2 mL,置于无抗凝剂的真空采血管中,3 000 r/min离心5 min,取上层血清,置于-80 ℃条件下待用。术中取患者胃癌组织和癌旁正常组织(距离癌组织≥5 cm)标本,在冰上剪碎、研磨,制成悬液,于-80 ℃条件下保存。收集胃癌患者的性别、年龄、肿瘤最大径、浸润程度、有无神经侵犯、有无淋巴结转移和临床分期等临床病理学特征。
1.2.2实时荧光定量PCR测定lncRNA-GC1表达水平
提取研究对象组织(细胞)和血清标本总RNA,采用Nano-Drop 1000分光光度计检测,参照反转录试剂盒说明书要求将RNA反转录为cDNA,-20 ℃保存待用。参照文献[9]设计引物,由上海天昊生物科技有限公司合成。lncRNA-GC1上游引物序列为 5′-TGG GGT AAC TTA GCA GTT TCA AT-3′,下游引物序列为5′-GGC AAG CAG TAA TCT TAC ATG ACA C-3′,片段大小110 bp。内参基因U6的上游引物序列为5′-CTC GCT TCG GCA GCA CA-3′,下游引物序列为5′- AAC GCT TCA CGA ATT TGC GT-3′,产物片段大小94 bp。反应体系包括0.75 μL E×12 TaqMan⑧基因表达检测液,7.5 μL TaqMan PCR反应混合液,3 μL cDNA模板,再加双蒸水(ddH2O)至15 μL。反应条件:95 ℃预变性10 min;94 ℃ 20 s,58 ℃ 20 s,72 ℃ 20 s,共40个循环,然后用荧光定量PCR仪定量测定。采用标准曲线法对lncRNA-GC1表达水平进行相对定量分析,应用2-ΔΔCT法计算结果。
1.2.3细胞培养和转染细胞系构建
选取胃癌细胞MKN-45作为实验对象,来自美国典型培养物中心(American Type Culture Collection,ATCC)细胞库。37 ℃,5% CO2条件下进行细胞培养。将lncRNA-GC1全长序列克隆进pSin载体上,进一步构建慢病毒载体并建立稳定转染胃癌细胞系MKN-45 GC1,对照细胞不进行转染处理(MKN-45 Vec)。48 h后应用嘌呤霉素筛选稳定转染细胞。
1.2.4噻唑蓝(MTT)实验检测细胞活力
将胃癌细胞系MKN-45 GC1及其对照细胞MKN-45 Vec接种于96孔细胞培养板中,每孔种植细胞数为5×103个,每种细胞平行重复3孔,24 h后细胞培养基换成含0、3、6、12 μg/mL顺铂的培养基,48 h后进行MTT实验,检测570 nm处吸光度(A570)值,以空白孔为参照评估各孔的增殖活力。
1.2.53-D细胞培养实验检测细胞增殖和生长能力
将胃癌细胞系MKN-45 GC1及其对照细胞MKN-45 Vec接种于24孔细胞培养板中,每孔种植细胞4×103个,培养基体积为500 μL,每种细胞平行重复3孔,在细胞种植后48 h更换含0.6 μg/mL顺铂的培养基处理细胞48 h,在第8天拍照检测并定量分析细胞增殖能力。
1.3 统计学处理
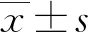
2 结 果
2.1 胃癌患者组织和血清lncRNA-GC1表达水平
胃癌患者癌组织lncRNA-GC1表达水平高于癌旁组织,差异有统计学意义(1.45±0.16vs.0.82±0.07,t=15.362,P<0.001),见图1A;胃癌组血清lncRNA-GC1表达水平高于健康对照组,差异有统计学意义(0.78±0.13vs.0.54±0.05,t=6.887,P<0.001),见图1B。
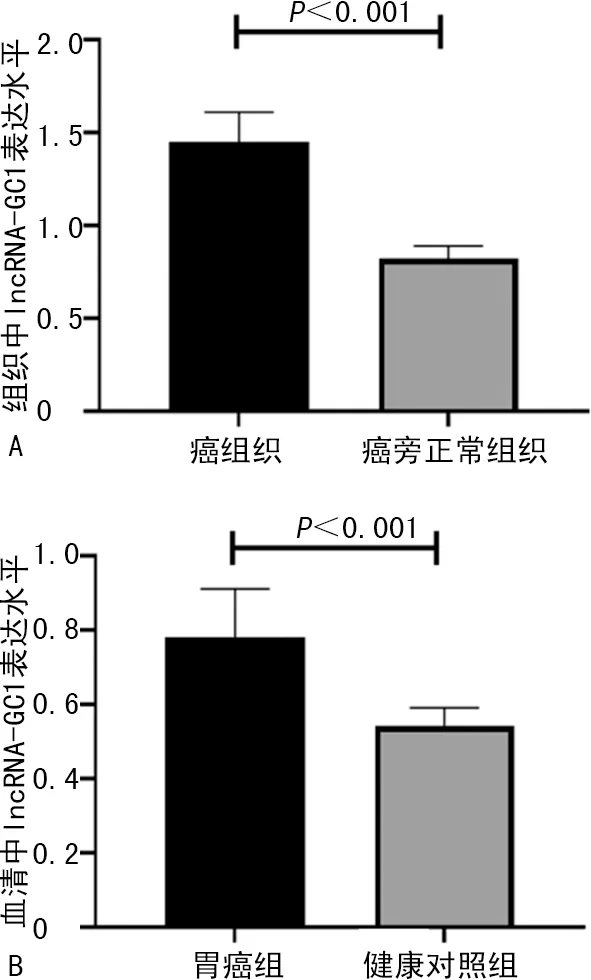
A:胃癌患者癌组织与癌旁正常组织中lncRNA-GC1表达水平比较;B:胃癌组与健康对照组血清lncRNA-GC1表达水平比较。
2.2 胃癌组织lncRNA-GC1表达水平与临床病理特征的相关性
胃癌患者癌组织中lncRNA-GC1表达水平与肿瘤最大径、神经侵犯、淋巴结转移有关,肿瘤最大径≥5 cm的患者癌组织lncRNA-GC1表达水平高于肿瘤最大径<5 cm者,有神经侵犯的患者癌组织lncRNA-GC1表达水平高于无神经侵犯者,有淋巴结转移的患者癌组织lncRNA-GC1表达水平高于无淋巴结转移者,差异均有统计学意义(P<0.05),见表1。
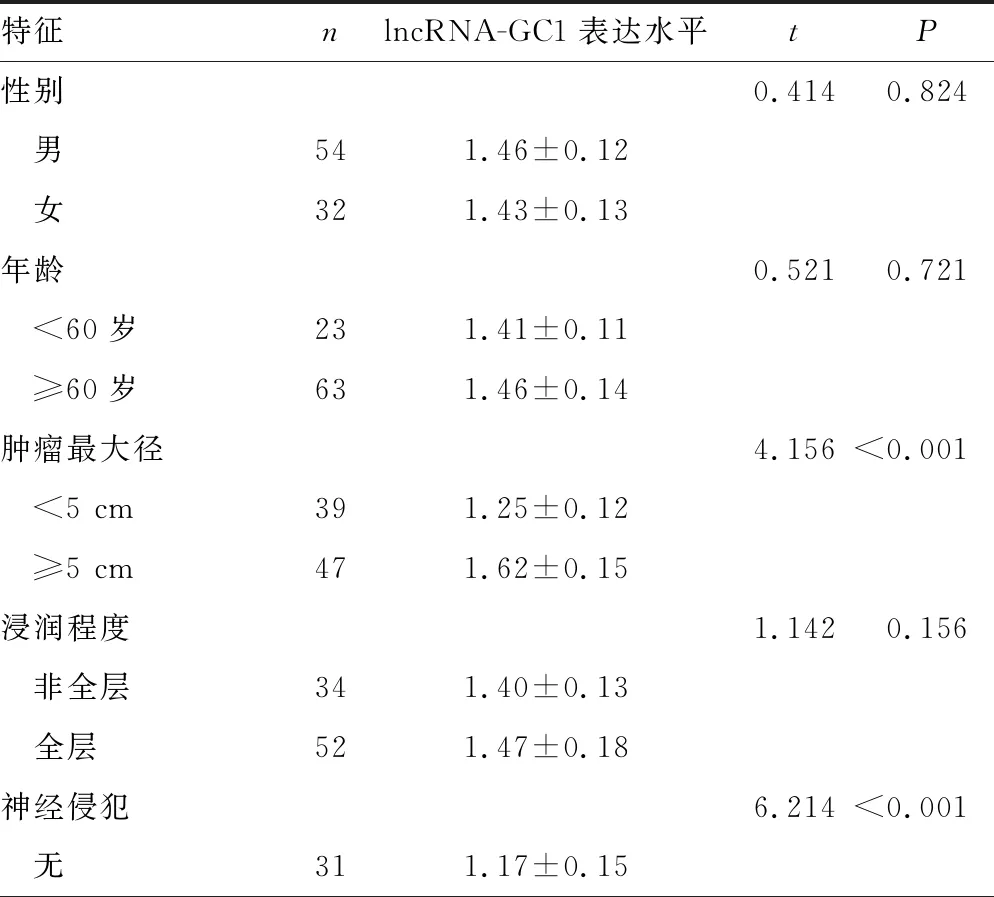
表1 胃癌组织lncRNA-GC1表达水平与临床病理特征的相关性
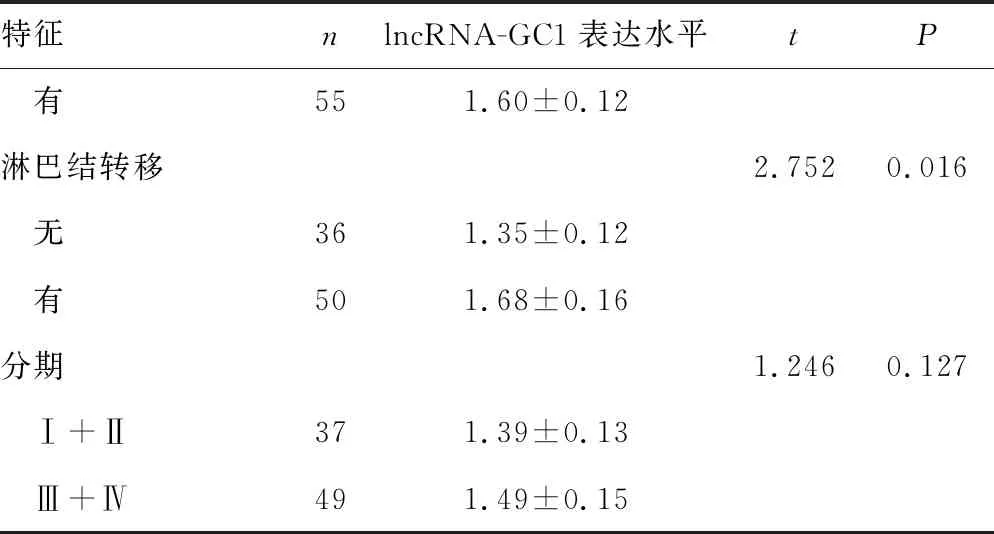
续表1 胃癌组织lncRNA-GC1表达水平与临床病理特征的相关性
2.3 胃癌患者血清lncRNA-GC1表达水平与临床病理特征的相关性
胃癌患者血清lncRNA-GC1表达水平与肿瘤最大径、淋巴结转移和临床分期有关,肿瘤直径≥5 cm的患者血清lncRNA-GC1表达水平高于肿瘤直径<5 cm者,有淋巴结转移的患者血清lncRNA-GC1表达水平高于无淋巴结转移者,肿瘤分期Ⅲ+Ⅳ的患者血清lncRNA-GC1表达水平高于肿瘤分期Ⅰ+Ⅱ者,差异均有统计学意义(P<0.05),见表2。
2.4 血清lncRNA-GC1水平诊断胃癌的ROC曲线分析
ROC曲线分析结果显示,血清lncRNA-GC1水平诊断胃癌的ROC曲线下面积(AUC)为0.849[95%CI(0.790,0.907),P<0.001],灵敏度为83.0%,特异度为81.4%,见图2。
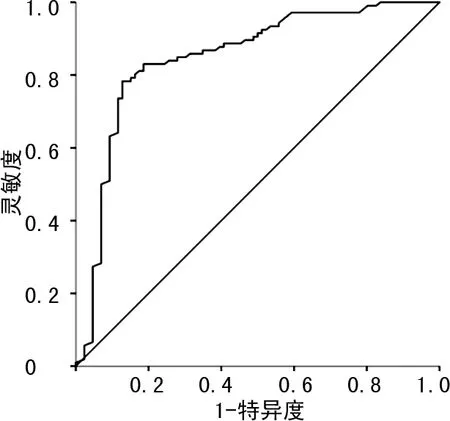
图2 血清lncRNA-GC1水平诊断胃癌的ROC曲线
2.5 lncRNA-GC1对胃癌细胞MKN-45增殖生长能力及顺铂耐药性的影响
实时荧光定量PCR实验结果显示,MKN-45 GC1细胞lncRNA-GC1表达水平较MKN-45 Vec细胞明显升高,见图3A。MTT实验结果表明,MKN-45 GC1细胞活力较MKN-45 Vec细胞明显升高;在分别加入3、6、12 μg/mL顺铂后,MKN-45 GC1和MKN-45 Vec细胞的细胞活力均明显下降,且MKN-45 GC1细胞活力均明显高于MKN-45 Vec细胞,见图3B。此外,3-D细胞培养实验显示,MKN-45 GC1细胞增殖能力明显高于MKN-45 Vec细胞;在加入6 μg/mL顺铂后,两种细胞增殖能力均受到抑制,且MKN-45 GC1细胞增殖能力高于MKN-45 Vec细胞,见图3C。
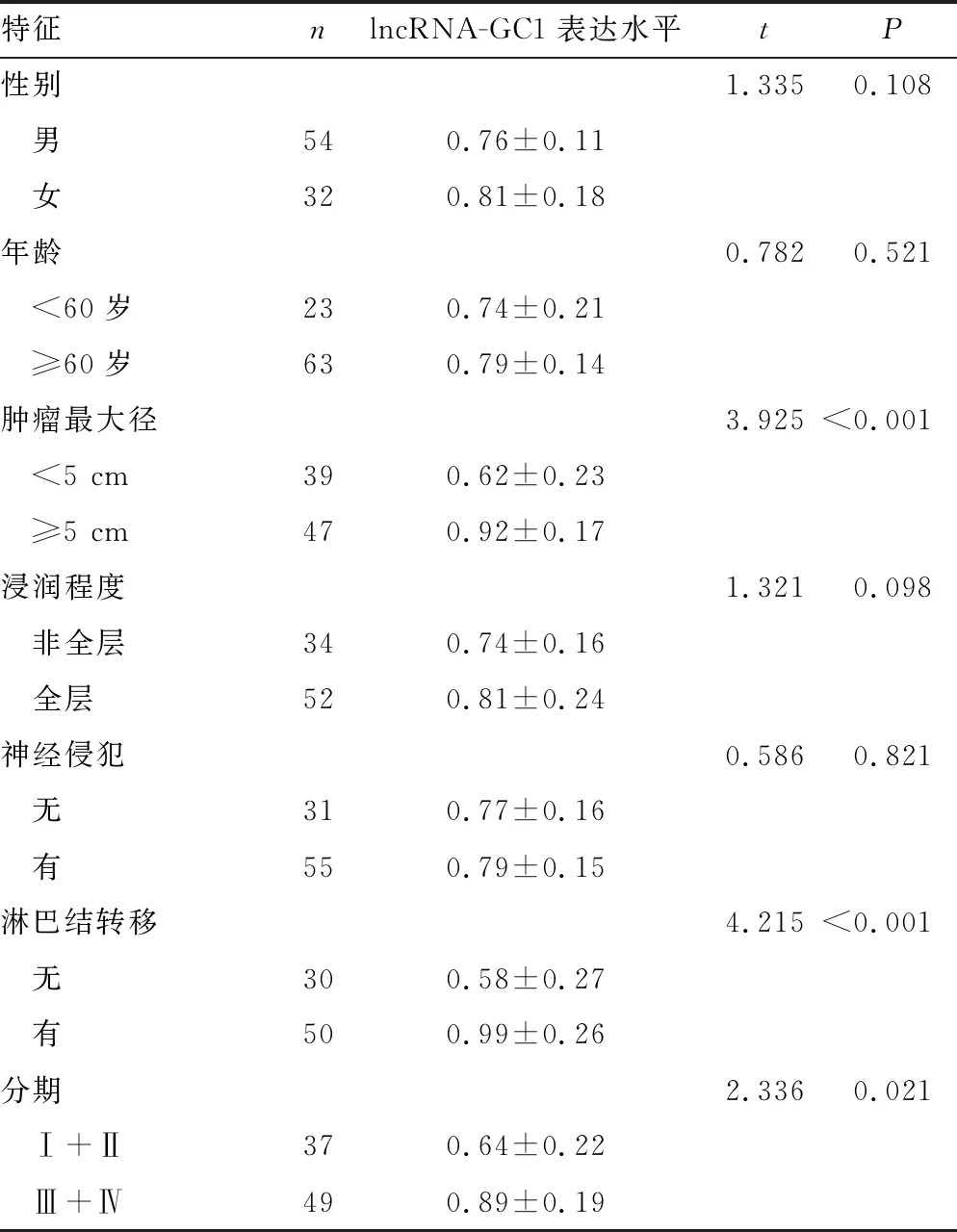
表2 胃癌患者血清lncRNA-GC1表达水平与临床病理特征的相关性
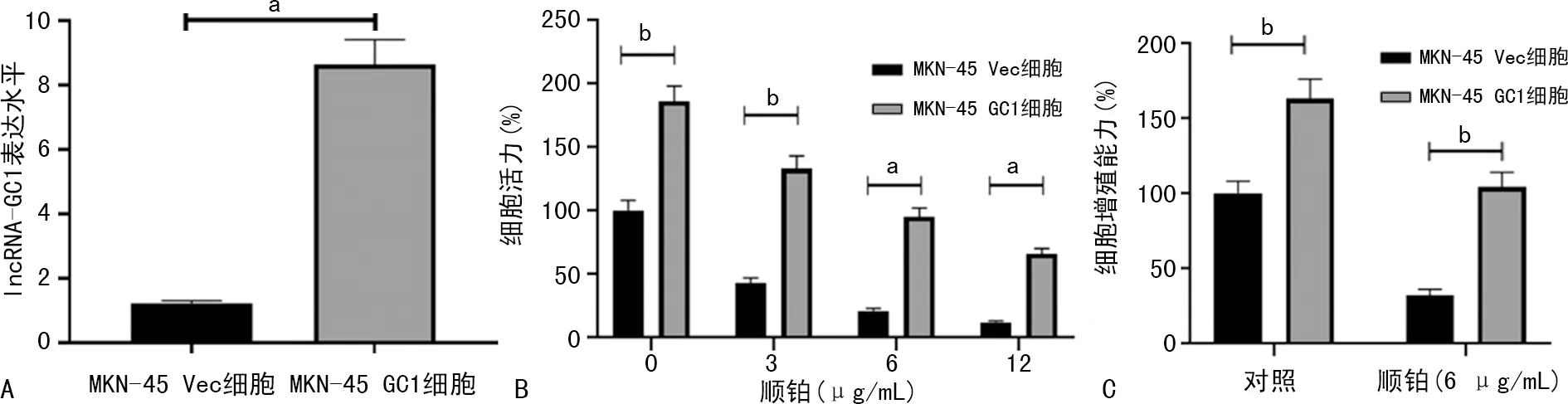
A:MKN-45 GC1与MKN-45 Vec细胞lncRNA-GC1表达水平比较;B:MTT实验检测不同水平顺铂作用后MKN-45 GC1和MKN-45 Vec细胞活力比较;C:3-D细胞培养实验检测MKN-45 GC1和MKN-45 Vec细胞的增殖能力;a:P<0.01;b:P<0.05。
3 讨 论
胃癌是常见的消化道恶性肿瘤,对人类健康造成了极大的威胁。然而,目前胃癌的发生、发展机制和化疗耐药机制还未完全明确[10]。lncRNA已被证实在包括胃癌在内的多种恶性肿瘤中表达异常[11]。顾秀玉等[12]研究发现,lncRNA在胃癌患者癌组织和血清中的表达明显增加,其表达水平与胃癌患者的肿瘤大小、分化程度、脉管癌栓、神经侵犯及平均生存时间有关;部分lncRNA可作为胃癌筛查及预后判断的分子标志物。韩涵等[13]研究显示,lncRNA-GC1在胃癌组织中明显高表达,并且与患者的肿瘤体积大小、淋巴结转移和病理学分级具有相关性,此外,细胞实验显示lncRNA-GC1可促进胃癌细胞的增殖生长和对顺铂的耐药性。GUO等[14]在最近的研究中报道,lncRNA-GC1在胃癌患者血清外泌体中表达明显增加,并且可作为肺癌早期诊断的无创性分子生物标志物。本研究检测了lncRNA-GC1在胃癌患者组织及血清中的表达水平,分析了其与患者临床病理特征的相关性,评估了血清lncRNA-GC1作为胃癌筛查分子标志物的可行性,并探讨了lncRNA-GC1在胃癌细胞增殖和顺铂化疗耐药中的作用。
本研究结果显示,胃癌患者癌组织lncRNA-GC1表达水平明显高于癌旁组织,血清lncRNA-GC1表达水平也明显高于健康对照组,提示lncRNA-GC1表达水平升高可能与胃癌的发生机制有关。此外,胃癌患者癌组织lncRNA-GC1表达水平与肿瘤最大径、神经侵犯、淋巴结转移有关,血清lncRNA-GC1表达水平与肿瘤最大径、淋巴结转移和临床分期有关。既往研究显示,肿瘤的疾病进展在一定程度上与肿瘤大小、神经侵犯、淋巴结转移等有关[15]。因此,lncRNA-GC1表达水平升高可能与胃癌的疾病进展有关。尽管既往研究已表明血清外泌体lncRNA-GC1表达水平可作为肺癌早期诊断的有效分子标志物[16-17],但考虑到血清检测快速、方便、廉价的优势,本研究应用ROC曲线分析了血清lncRNA-GC1诊断胃癌患者的效能,结果显示,血清lncRNA-GC1水平对胃癌的诊断效能较好,灵敏度为83.0%,特异度为81.4%,具有一定的临床应用价值。
本研究还进行了细胞实验,探究lncRNA-GC1对胃癌化疗耐药的影响。结果显示,转染后的MKN-45 GC1细胞lncRNA-GC1水平明显高于MKN-45 Vec细胞,说明转染成功。MTT实验结果表明,MKN-45 GC1细胞的细胞活力较MKN-45 Vec细胞明显升高;加入顺铂后,MKN-45 GC1和MKN-45 Vec细胞的细胞活力均明显下降,且MKN-45 GC1细胞活力高于MKN-45 Vec细胞。3-D细胞培养实验显示,MKN-45 GC1细胞的增殖能力明显高于MKN-45 Vec细胞;加入6 μg/mL顺铂后,两种细胞的增殖能力均受到抑制,且MKN-45 GC1细胞增殖能力强于MKN-45 Vec细胞。以上结果表明,lncRNA-GC1可促进胃癌细胞MKN-45的增殖生长,并促进细胞对顺铂的耐药。
本研究仍存在一些局限性:(1)所有研究对象均来自同一医院,可能存在选择偏倚;(2)纳入患者的样本量较小;(3)未进行术前、术后及复发胃癌患者血清lncRNA-GC1表达水平的比较,对lncRNA-GC1在胃癌中诊断价值的评估还不够全面。在今后的研究中会进一步完善这些不足,以获得更为准确的结果。
综上所述,lncRNA-GC1在胃癌患者组织和血清中表达上调,可作为胃癌筛查及预后判断的分子标志物,并且体外细胞实验表明lncRNA-GC1可促进胃癌细胞MKN-45的增殖生长,促进细胞对顺铂的耐药。
