LXR激动剂TO901317抑制N2a/APP695swe细胞内Aβ生成的机制研究*
2022-07-05罗英茂田茗源
黄 杰,张 雄,邓 煜,陈 非,罗英茂,田茗源
(1.重庆市精神卫生中心老年科 400036;2.重庆医科大学基础医学院 400016;3.重庆医科大学附属第二医院内分泌科 400010)
阿尔茨海默病(Alzheimer′s disease,AD)是最常见的神经退行性变性疾病,是痴呆的最主要的类型,其临床表现为进行性的认知功能障碍和记忆力损伤,而病理变化则是以细胞外β淀粉样蛋白(Aβ)增多并沉积形成老年斑、细胞内Tau蛋白过度磷酸化形成神经原纤维缠结(NFTs)和神经元丢失为主。其中,Aβ的产生及沉积形成老年斑是AD发生的关键[1]。在AD患者的脑内,Aβ生成的增多通常是由淀粉样前体蛋白(APP)依次经β-分泌酶(BACE1)和γ-分泌酶裂解导致。BACE1是Aβ生成的关键酶,主要位于细胞膜上胆固醇富集区,如脂筏(lipid raft)。而脂筏是质膜上富含胆固醇和神经鞘脂的动态微结构区域,其上分布着大量的膜蛋白受体,参与了信号转导[2]、物质转运等过程[3],也与神经突触可塑性有着密切的关系[4],其标志蛋白之一是小凹蛋白-1(caveolin-1)。研究表明,细胞内胆固醇水平可调节APP的加工,增强BACE1活性,促进Aβ生成,因此,抑制胆固醇合成和降低细胞内胆固醇水平将改变脂筏的构成,进而减少Aβ的生成[5]。
脑是富含胆固醇的器官,神经元中过多的胆固醇不能直接排到血液中,而是靠三磷酸腺苷结合盒转运子A1(ATP-binding cassette transporter A1,ABCA1)胆固醇跨膜转运体系来促进胆固醇的外排,减少其对神经元产生的毒副作用。ABCA1跨膜转运体系是以ABCA1为核心,以贫脂的载脂蛋白[如载脂蛋白A1(apoA1)、高密度脂蛋白(HDL)]为受体,并主要以肝脏X受体(liver X receptor,LXR)和视黄醇类X受体(retinoic X receptor,RXR)的联合调控介导细胞内游离胆固醇和磷脂偶联后向外转运,进而降低细胞内胆固醇水平。一系列报道都显示,ABCA1跨膜胆固醇转运体系在Aβ的沉积及清除中发挥了重要作用[6-7],这为开发防治AD的药物提供了新靶点[8]。研究证实,LXR受体可防止记忆衰退,延缓AD的发展,但机制尚不清楚[9-10]。因此,本实验采用LXR激动剂TO901317处理稳定表达APP的N2a/APP695swe细胞,检测TO901317对细胞内β淀粉样蛋白42(Aβ42)的影响,以及脂筏标记蛋白caveolin-1、APP和BACE1在mRNA和蛋白水平的表达情况,为AD的防治提供新的实验依据,现报道如下。
1 材料与方法
1.1 材料
1.1.1实验细胞
小鼠来源的神经瘤母细胞(N2a细胞)由厦门大学许华曦教授提供,分为两种类型:野生型细胞(N2a/wt细胞)、稳定转染Swedish家族型突变的人APP695细胞(N2a/APP695swe细胞)。
1.1.2主要试剂
DMEM高糖培养基、Opti-MEM培养基、青-链霉素和0.25%胰蛋白酶均购自美国Hyclone公司;LXR激动剂TO901317购自美国Sigma-Aldrich公司;G418购自Biosharp公司上海分公司;Aβ42 ELISA检测试剂盒购自北京博奥森生物技术有限公司;Trizol细胞裂解液购自美国Invitrogen公司;实时荧光定量PCR(real-time PCR,RT-PCR)试剂盒购自美国Promega公司;总蛋白抽提试剂盒、BCA蛋白浓度检测试剂盒、苯甲基磺酰氟(PMSF)和RIPA蛋白裂解液均购自上海碧云天生物技术有限公司;除了内参β-actin和辣根过氧化物酶(HRP)标记的二抗购自北京博奥森生物技术有限公司外,其余所有抗体均购自英国Abcam公司;电化学发光(ECL)试剂盒购自美国Millpore公司。
1.2 方法
1.2.1配置培养基
N2a/APP695swe细胞培养基:称取G418粉剂40 mg溶于10 mL DMEM中,过滤后加入84 mL DMEM、94 mL Opti-DMEM、10 mL胎牛血清、2 mL青链霉素,共配制200 mL培养基;N2a/wt细胞培养基:94 mL DMEM、94 mL Opti-DMEM、10 mL胎牛血清、2 mL青-链霉素,以上液体按比例配制好后放入4 ℃冰箱保存备用。
1.2.2细胞培养和TO901317处理
将N2a/APP695swe细胞和N2a/wt细胞复苏后,贴壁生长于上述配置的培养基中,置37 ℃ 5% CO2湿度饱和的培养箱中培养。将TO901317溶于DMSO∶磷酸盐缓冲液(PBS)为1∶3的溶液中,形成浓度分别为5、10和20 μmol/L的TO901317混合溶液,然后加入N2a/APP695swe细胞培养瓶中,以N2a/wt细胞作为对照。
1.2.3ELISA检测细胞Aβ42浓度
各组细胞(N2a/wt组、N2a/APP695swe组、DMSO对照组,以及经5、10和20 μmol/L TO901317处理N2a/APP695swe细胞的各TO901317处理组)经胰蛋白酶消化离心后收集上清液,加入20 μL Protease Inhibitor Cocktail Set 1,至终浓度为1 mmol/L,以防一系列蛋白酶降解Aβ,分装保存于-20 ℃。做好试剂和标准品的制备工作后,按照说明书进行操作:取出96孔板,加入标准品、待测样品后,再加入50 μL Aβ42检测抗体,同时设空白对照组,橡皮膏条封存,置室温3 h;洗涤4遍,甩掉板中液体后用吸水纸吸干,加入100 μL兔抗IgG-HRP工作液,封存并置室温30 min;吸干水分后再加入100 μL稳定液,封存,置室温30 min;再加入100 μL终止液,终止显色,用酶标仪在450 nm波长下读取吸光度(A450)值,然后根据标准曲线计算出Aβ42的浓度。
1.2.4RT-PCR检测细胞caveolin-1、BACE1与APP mRNA水平
各组细胞(N2a/wt组、N2a/APP695swe组、DMSO对照组、20 μmol/L TO901317处理组)经胰蛋白酶消化离心弃上清液,用Trizol法提取总RNA。β-actin:正向5′-GCC ATG TAC GTA GCC ATC CA-3′,反向5′-GAA CCG CTC ATT GCC GAT AG-3′;APP mRNA:正向5′-GGT GGC TGA GGA GAT TCA AG- 3′,反向5′-ATG AGA GCG TCG TTT CCG TA- 3′;BACE1 mRNA:正向5′-GGC GGG AGT GGT ATT ATG AA-3′,反向5′-GTG ATG CGG AAG GAC TGA TT-3′;caveolin-1:正向5′-TAT GAC GCG CAC ACC AAG GA-3′,反向5′-GCC CAG ATG TGC AGG AAG GA-3′。反应体系:Go Taq Green Master Mix 12.5 μL,逆转录产物(cDNA)2.5 μL,下游引物1 μL,上游引物1 μL,无核酸酶水8 μL,总体积 25 μL。PCR反应步骤:预变性94 ℃ 3 min;变性94 ℃ 30 s;退火58 ℃ 30 s;延伸72 ℃ 45 s。
1.2.5Western blot检测细胞caveolin-1、BACE1与APP水平
各组细胞(N2a/wt组、N2a/APP695swe组、DMSO对照组、20 μmol/L TO901317处理组)经胰蛋白酶消化离心弃上清液,加入1 mL RIPA蛋白裂解液,充分裂解后于4 ℃,13 000 r/min离心15 min后,用Bradford法测定每组蛋白样品浓度并分装保存。配置8%~10%的聚丙烯酰胺凝胶电泳(PAGE)胶,上样50 μg经十二烷基硫酸钠-PAGE(SDS-PAGE),将蛋白转至聚偏氟乙烯(PVDF)膜上,用5%脱脂奶粉室温封闭2 h,然后置入TBST缓冲液稀释的抗体caveolin-1、APP、BACE1和内参β-actin,4 ℃孵育过夜;充分洗涤后加入1∶5 000的HRP标记的羊抗兔二抗,室温孵育2 h,最后用ECL试剂盒行曝光显影,经Bio-rad Chemical Dox XRS凝胶成像系统进行条带的分析。
1.3 统计学处理
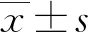
2 结 果
2.1 TO901317降低了N2a/APP695swe细胞内Aβ42的生成
ELISA结果显示:正常N2a/wt细胞(N2a/wt组)上清液中分泌的Aβ42为(1.33±0.33)ng/mL,低于N2a/APP695swe细胞(N2a/APP695swe组)的(3.78±0.31) ng/mL,以及DMSO处理后的N2a/APP695swe细胞(DMSO对照组)生成的Aβ42水平(3.67±0.28) ng/mL,差异均有统计学意义(P<0.01)。经5 μmol/L TO901317处理后,细胞上清液中生成的Aβ42水平为(3.55±0.34)ng/mL,与N2a/APP695swe组和DMSO对照组比较,差异均无统计学意义(P>0.05);随着TO901317处理浓度增加至10、20 μmol/L,细胞内Aβ42水平下降至(2.96±0.23)、(2.54±0.16)ng/mL,与N2a/wt组和N2a/APP695swe组比较,差异均有统计学意义(P<0.01),且具有浓度-依赖性,见图1。

1:N2a/wt组;2:N2a/APP695swe组;3:DMSO对照组;4:5 μmol/L TO901317处理组;5:10 μmol/L TO901317处理组;6:20 μmol/L TO901317处理组;a:P<0.01,与N2a/wt组比较;b:P<0.01,与N2a/APP695swe组比较。
2.2 TO901317对N2a/APP695swe细胞内caveolin-1、BACE1和APP mRNA水平的影响
RT-PCR结果表明:与N2a/wt组细胞比较,N2a/APP695swe组细胞内caveolin-1 mRNA表达水平明显降低(P<0.01),BACE1和APP mRNA表达水平明显升高(P<0.01)。N2a/APP695swe细胞经DMSO处理后(DMSO对照组),细胞内caveolin-1、BACE1和APP mRNA表达水平与N2a/APP695swe组比较无明显差异(P>0.05);而经20 μmol/L TO901317处理后,N2a/APP695swe细胞中caveolin-1 mRNA表达水平较N2a/APP695swe组明显升高(P<0.01),BACE1和APP mRNA表达水平较N2a/APP695swe组明显下降(P<0.01),见图2。

1:N2a/wt组;2:N2a/APP695swe组;3:DMSO对照组;4:20 μmol/L TO901317处理组;a:P<0.01,与N2a/wt组比较;b:P<0.01,与N2a/APP695swe组比较。
2.3 TO901317对N2a/APP695swe细胞内caveolin-1、BACE1和APP水平的影响
Western blot结果表明:与N2a/wt组细胞比较,N2a/APP695swe组细胞内caveolin-1表达水平明显降低(P<0.01),BACE1和APP表达水平明显升高(P<0.01)。经DMSO处理后,N2a/APP695swe细胞内(DMSO对照组)caveolin-1、BACE1和APP表达水平与N2a/APP695swe组比较无明显差异(P>0.05);而经20 μmol/L TO901317处理后,N2a/APP695swe细胞中caveolin-1表达水平较N2a/APP695swe组明显升高(P<0.01),BACE1和APP表达水平较N2a/APP695swe组明显降低(P<0.01),见图3。

A:各组细胞内caveolin-1、BACE1和APP表达情况;B:N2a/APP695swe细胞内caveolin-1、BACE1和APP表达的相对A450值统计柱状图;1:N2a/wt组;2:N2a/APP695swe组;3:DMSO对照组;4:20 μmol/L TO901317处理组;a:P<0.01,与N2a/wt组比较;b:P<0.01,与 N2a/APP695swe组比较。
3 讨 论
AD是常见的痴呆类型,其发病机制尚不完全清楚。Aβ在脑组织中生成过度或清除障碍都可能引起Aβ的沉积并形成老年斑,这是诱发AD的共同通路,也是目前公认的AD的关键致病因素。因此,寻找抑制Aβ产生的药物成为防治AD的重要研究方向。
Aβ由APP剪切而来,其方式有α-分泌酶剪切途径和BACE1剪切途径[11]。通常情况下,只有少部分α-分泌酶的小片段位于脂筏内,其绝大部分片段则位于含胆固醇极低的非脂筏区。而BACE1和γ-分泌酶都存在于富含胆固醇的脂筏区。当细胞内胆固醇水平升高时,α-分泌酶发生了移位,从非脂筏区移至膜上脂筏区,这一位置的改变不仅增加了α-分泌酶对APP的剪切,还促进了BACE1的糖基磷酸化,进而显著提高γ-分泌酶的活性,最终促进了Aβ的生成[12]。在本实验中,体外培养稳定表达APP的N2a/APP695swe细胞,结果显示在该细胞内脂筏亚结构域质膜微囊标志性蛋白caveolin-1表达较弱,而APP和BACE1表达水平较高,产生的Aβ42更多。
研究表明,胆固醇水平与生成的Aβ水平呈正相关;降低体内胆固醇水平会减少Aβ生成[5]。胆固醇的外排主要通过两个途径:B类Ⅰ型清道夫受体(SRBI)跨膜转运体系、ABCA1跨膜转运体系。前者经证实在AD神经元的胆固醇外流转运中未发挥关键作用[13],而后者则通过LXR/RXR的联合调控,介导细胞内游离胆固醇和磷脂偶联后向外转运,与AD的发生、发展密切联系。RIDDELL等[14]利用LXR激动剂TO901317处理转基因鼠Tg2576后,发现小鼠海马区Aβ沉积显著减少,记忆能力也增强。美国匹兹堡大学的FITZ等[15]也使用TO901317处理APP转基因小鼠,结果显示TO901317促进了高脂饮食饲喂转基因小鼠大脑组织中Aβ的清除,并改善了小鼠的认知功能,但其机制并未阐明。在本研究中也发现,TO901317处理N2a/APP695swe细胞后,细胞内的Aβ42生成减少,且呈浓度依赖性;进一步发现,TO901317处理后,N2a/APP695swe细胞内的caveolin-1表达增强,而APP和BACE1表达则降低。
综上所述,在AD的发生、发展过程中,胆固醇的转运障碍导致了脂筏的构成发生改变,进而引起脂筏上与Aβ生成密切相关的关键蛋白的增加。而LXR激动剂TO901317能通过激活LXR启动胆固醇的外排过程,改善脂筏的构成(增强caveolin-1的表达),从而抑制脂筏上APP和BACE1的募集,进而阻碍APP的剪切,最终抑制Aβ的生成。
