CO2 点阵激光结合丝素蛋白载积雪草苷水凝胶治疗兔耳增生性瘢痕的实验研究
2022-07-05杨艳商颖吕强张振
杨艳 商颖 吕强 张振
创面异常愈合通常会导致增生性瘢痕甚至瘢痕疙瘩的形成[1-2]。增生性瘢痕可能会导致局部功能障碍,给患者带来巨大的负担[3]。目前,瘢痕治疗方法众多,但效果不一,患者接受程度也不同[4-6]。瘢痕局部注射常伴有不良反应,且药物无法在瘢痕组织中长期维持高浓度[7];局部涂抹药物具有特异性高、方便、副作用少等优点,但药物难以渗透致密的瘢痕组织而导致疗效不佳[8-9]。因此,提高药物透皮效率是改善瘢痕治疗效果的重要因素。
2009 年以来,激光辅助透皮给药治疗增生性瘢痕的研究有了相关报道[10]。CO2点阵激光作为一种常用剥脱性点阵激光,通过产生点阵排列的微小激光束破坏皮肤角质层和真皮层,形成致密的微孔通道,能够迅速增加局部皮肤的药物吸收[11]。Wang 等[12]在一项临床研究中发现,CO2点阵激光联合曲安奈德能改善瘢痕疙瘩并降低复发率,认为CO2点阵激光能很好地促进药物透皮[13]。
丝素蛋白水凝胶(SNF)是一种具有良好生物相容性的天然纳米纤维。SNF 作为一种亲水-疏水-亲水聚合物,能负载水溶性药物或脂溶性药物[14]。此外,SNF 通过缓释给药,延长了药物在病灶内的滞留时间,有助于药物持续发挥作用[15],是一种理想的药物载体。积雪草苷(AC)已广泛用于抗瘢痕治疗,具有抗炎、促进伤口愈合、减少瘢痕形成的作用[16-18]。但AC 是疏水性药物,透皮困难。
本研究通过将疏水性AC 加载于SNF,形成SNF-AC,对其进行表征,探讨SNF 作为药物载体的可行性,并评价在CO2点阵激光作用下,SNF-AC 对兔耳增生性瘢痕的治疗效果。
1 材料与方法
1.1 实验试剂及仪器
AC(MCE,美国),高效液相色谱(Thermo Fisher,美国),C18 柱(Thermo Fisher,美国),原子力显微镜(Bruker Dimension ICON,德国),共焦拉曼光谱仪(InVia Qontor,Renishaw,英国),流变仪(Thermofisher Scientific,美国)。
1.2 丝素蛋白水凝胶制备
丝素蛋白溶液(质量分数6%)60 ℃下经过24 h浓缩到质量分数约20%,形成亚稳态纳米颗粒,去离子水稀释到质量分数2%,置于60 ℃恒温干燥箱中孵育24 h 以上,形成稳定的水凝胶[19]。该制备过程由苏州市现代丝绸技术国家工程实验室,苏州纳米科技协同创新中心完成。
1.3 丝素蛋白载积雪草苷水凝胶制备
将疏水的AC 溶解在甲醇中,然后与SNF(质量分数2%)按体积比1:1 混合。200 r/min 搅拌24 h后,将混合溶液以10 000 r/min 离心30 min,分离丝素蛋白载积雪草苷水凝胶和甲醇。丝素蛋白载积雪草苷水凝胶用蒸馏水洗涤3 次以去除残留的甲醇,制备成SNF-AC[14]。收集离心上清液计算未加载AC含量,采用高效液相色谱,C18 柱(5 μm,250 mm×4.6 mm)测定溶液中AC 含量。流动相为乙腈/水(25∶75 至2 min;90∶10 至8 min;25∶75 至10 min),流速为1.0 mL/min。检测波长为532 nm。AC 的加载效率(LE)和加载能力(LC)计算公式如下:
LE(%)=(Wt-Wf)/Wt×100%
LC(%)=(Wt-Wf)/Ws×100%
式中Wt 为AC 的总质量,Wf 为上清液中未加载的AC 的质量,Ws 为丝素蛋白水凝胶的总质量。
1.4 丝素蛋白载积雪草苷水凝胶表征
原子力显微镜(AFM)检测样品的形态。样品1∶1 000 稀释,在超声中分散10 min,然后旋涂2 μL 溶液到干净的云母表面,用氮气吹干表面。共焦拉曼光谱仪(532 nm 半导体激光器)评估SNF 中AC 的负载情况。流变仪(Mars40)测量SNF 和SNF-AC 的流变性能。25 ℃下以0.1~100 rad/s 的频率扫描范围内连续采集贮存模量(G')和损耗模量(G''),在0.1~100 s-1的剪切速度范围内检测SNF-AC 和SNF 的流动曲线。
1.5 兔耳增生性瘢痕模型
成年雄性新西兰大白兔6 只,体质量约2 kg,单笼饲养2 周(SLAC,上海)。盐酸赛拉嗪注射液(陆眠宁)联合氯胺酮按每100 克体质量1.5 mg 肌内注射麻醉。在兔耳上用手术刀产生直径为1 cm 的圆形伤口,去除全层皮肤和软骨膜,保留软骨。每个兔耳上产生4 个伤口,所有伤口均环绕兔耳中点,均匀分布。28 d 后兔耳创面愈合完全,可见直径约0.9 cm 的增生性瘢痕,颜色鲜红,质硬。本研究经上海交通大学医学院附属第九人民医院伦理委员会审核批准(SH9H-2019-TK206-1)。
将48 个成熟的兔耳增生性瘢痕随机分为4 组(每组12 个):①L+SNF-AC 组,CO2点阵激光处理后,在增生性瘢痕表面涂抹2.5 mg/mL SNF-AC 100 μL,每天2 次;②L 组,CO2点阵激光处理;③SNF-AC 组,只涂抹SNF-AC 2.5 mg/mL 100 μL,每天2 次;④Control 组,即空白对照组,无任何处理。激光治疗参数:DeepFX 模式,能量密度25 mJ,覆盖率20%,频率300 Hz,10 号光斑大小,治疗1 次。
分别在治疗后第7、14 天,静脉注射过量戊巴比妥钠处死实验兔,用带表卡尺测量增生性瘢痕厚度,获取两处读数,A 为单个兔耳增生性瘢痕组织最高处的厚度,B 为离该最高处1.0 cm 兔耳皮肤厚度(靠近兔耳中心点处)。计算相对厚度公式如下:相对厚度=A/B(相对厚度变化值即为治疗前后相对厚度的差值)。2 名皮肤科医生肉眼评估瘢痕的血管分布情况。根据温哥华瘢痕量表评估增生性瘢痕模型。大体观察后将标本以4%多聚甲醛固定24 h,脱水,石蜡包埋,切片(厚度7 μm),分别行HE 染色和Masson染色,观察各组增生性瘢痕的组织结构和胶原纤维的变化情况。
1.6 统计学分析
数据统计采用GraphPad Prism 软件(Version 9.00,GraphPad Software,美国),数据以表示,组间比较采用单因素方差分析,P<0.05 表示差异有统计学意义。
2 结果
2.1 丝素蛋白载积雪草苷水凝胶表征
原子力显微镜显示,加载AC 后丝素蛋白纳米纤维丝的直径略有增加,但无明显聚集,表明药物黏附于丝素蛋白纳米纤维丝并呈现均匀分布(图1A、B)。SNF 的流变学特性,包括贮存模量(G')、损耗模量(G'')和黏度,在加载AC 后没有出现明显变化(图1C、D)。SNF-AC 的拉曼光谱既在450~650 cm-1表现出典型的AC 峰,又在1 669 cm-1表现出典型的SNF 峰,证明了AC 的成功加载(图1E)。将4 mg/mL AC 加载到SNF 中,最终获得含有2.832 mg/mL AC的SNF-AC,其LE 为70.8%,LC 为0.283%。
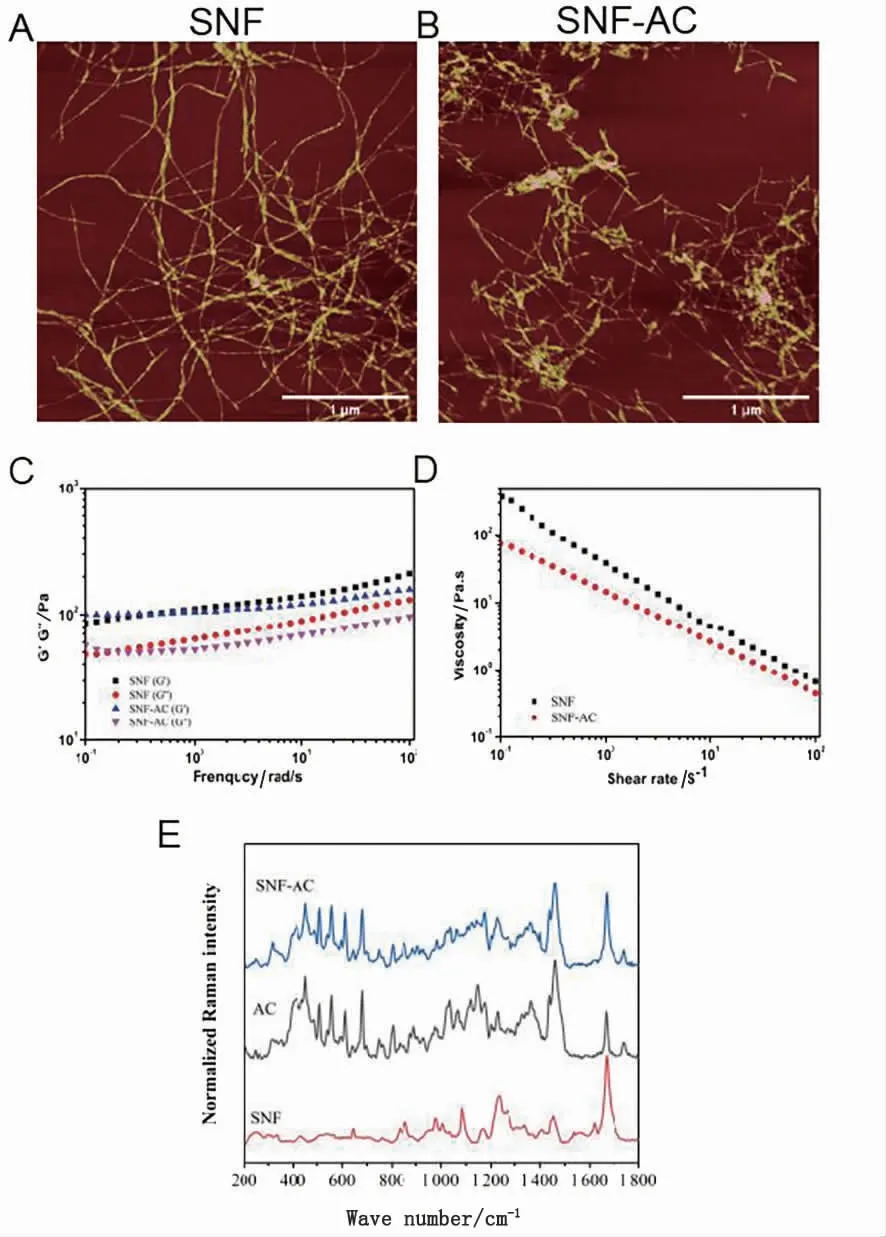
图1 丝素蛋白水凝胶和丝素蛋白负载积雪草苷水凝胶的表征Fig.1 Characterization of SNF and SNF-AC
2.2 兔耳增生性瘢痕治疗结果
治疗后第7、14 天,4 组的相对瘢痕厚度均降低,第7 天时,L+SNF-AC 组>L 组>SNF-AC 组>Control 组,且L+SNF-AC 组和L 组的相对厚度变化值显著高于Control 组(L+SNF-AC 组vs Control 组,P<0.01;L 组vs Control 组,P<0.05,图2A)。第14 天时,L+SNF-AC 组相对厚度变化值均高于其他3 组,但各组间均无统计学差异(P>0.05,图2B)。
瘢痕的血管分布评测发现,各组治疗后均有所改善。L+SNF-AC 组的增生性瘢痕从鲜紫红色变成与周围皮肤颜色相近(图3A、E、I);L 组的增生性瘢痕颜色从鲜紫红色变成肤色偏粉红(图3B、F、J);SNF 组(图3C、G、K)和Control 组(图3D、H、L)略有改善,但颜色仍为红色。第7 天时,血管分布评分改变(图2C):L+SNF-AC 组>L 组>Control 组>SNF-AC组,且L+SNF-AC 组血管分布评分改变显著优于其余3 组(L+SNF-AC 组vs L 组,P<0.05;L+SNF-AC组vs SNF-AC 组,P<0.01;L+SNF-AC 组vs Control组,P<0.01)。第14 天血管分布评分改变(图2D):L+SNF-AC 组也显著优于其余3 组(L+SNF-AC 组vs L 组,P <0.001;L+SNF-AC 组vs SNF-AC 组,P<0.001;L+SNF-AC 组vs Control 组,P<0.000 1)。
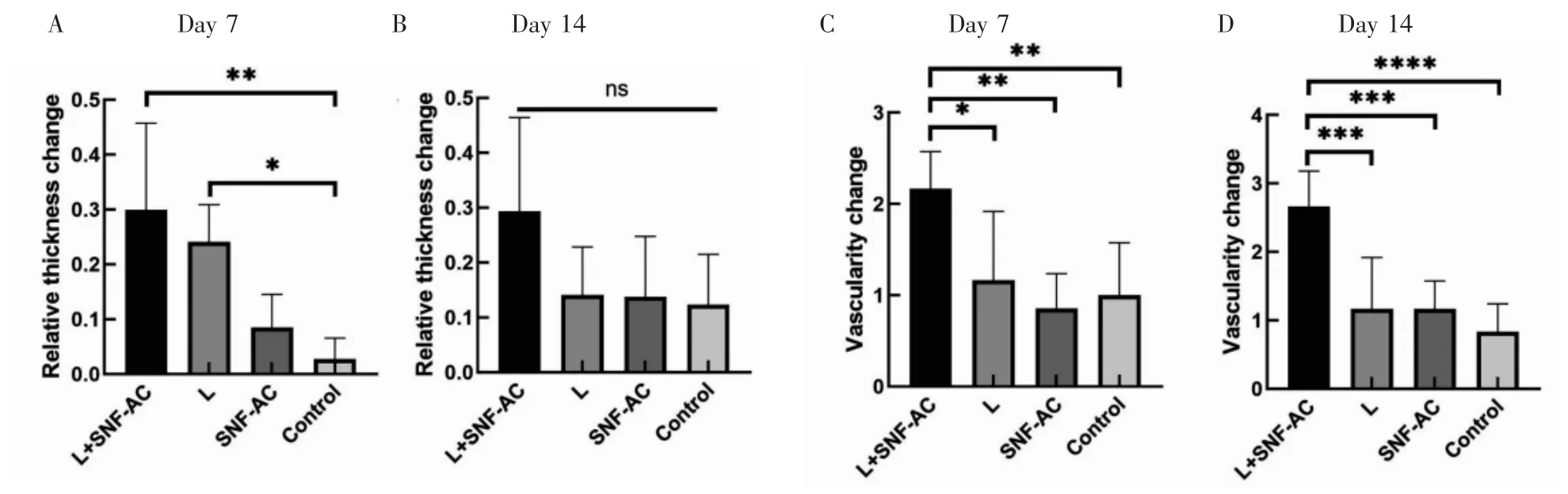
图2 兔耳增生性瘢痕治疗后相对厚度变化和血管分布变化Fig.2 Relative thickness change and vascularity change of rabbit ear hypertrophic scars after treatment

图3 兔耳增生性瘢痕(标尺:2.5 mm)Fig.3 Rabbit ear hypertrophic scars (Scale bar:2.5 mm)
增生性瘢痕HE 染色显示,治疗后第14 天L+SNF-AC 组增生性瘢痕表面趋于平整,而其余3 组增生性瘢痕表面均有不同程度凸起(图4)。Masson染色结果显示,治疗后第14 天,L+SNF-AC 组和L组的胶原纤维较整齐,接近正常皮肤组织,而SNFAC 组和Control 组的胶原排列紊乱(图5)。

图4 兔耳增生性瘢痕HE 染色Fig.4 HE staining of rabbit ear hypertrophic scar

图5 兔耳增生性瘢痕Masson 染色(标尺:50 μm)Fig.5 Masson staining of rabbit ear hypertrophic scar (Scale bar:50 μm)
3 讨论
增生性瘢痕的临床治疗方法有手术治疗和非手术治疗,但均无法达到理想的治疗效果[20]。在非手术方式中,药物是主要的治疗方法。其中,局部涂抹药物具有方便、无痛、稳定、副作用小、不经胃肠道环境影响等优点,但增生性瘢痕角质层增厚,真皮增生,药物的渗透被阻碍,很难达到有效的治疗浓度[9]。CO2点阵激光主要用于临床治疗面部皱纹、浅表性瘢痕、色素沉着障碍和改善皮肤质地[21]。此外,CO2点阵激光可在皮肤表面产生微孔通道,破坏皮肤屏障,诱导伤口愈合反应,可很好地促进药物透皮[22]。
SNF 是一种生物相容性较好的天然生物材料,能够有效加载不同亲疏水性的药物,在保持药物活性的同时实现长效的可控释放,是药物的理想载体[14];且SNF 具有高载药特性,其药物加载能力比传统药物载体脂质体高7 倍[15]。这些特性使SNF 能广泛应用于多个领域。例如,Ding 等[23]将SNF 载去铁胺,用于治疗糖尿病创面,SNF 载去铁胺比单独使用去铁胺能更有效地促进血管生成,缓解慢性炎症反应,加快创面愈合。Wu 等[24]将阿霉素加载到SNF,实现化疗药物在局部长达8 周的缓释,有效抑制了肿瘤的生长。SNF 不仅提高了药物的稳定性,而且通过缓释调控,有效加强药物的药理作用[25]。本研究成功将抗瘢痕药物AC 加载到SNF,并结合CO2点阵激光,增加药物的渗透,提高瘢痕的治疗效果。
本研究结果显示,治疗后第7 天,L+SNF-AC 组和L 组增生性瘢痕相对厚度相比Control 组显著改善,提示CO2点阵激光处理增生性瘢痕后,能够显著减少增生性瘢痕的厚度。CO2点阵激光可通过光热作用,去除表皮和部分真皮,上调多种金属基质蛋白酶,促进组织重塑[26],已被用于改善增生性瘢痕的颜色和质地[27]。Zhang 等[28]研究发现,CO2点阵激光能够促进增生性瘢痕的胶原重塑,从而减少瘢痕厚度。
此外,L+SNF-AC 组的血管分布改善显著,瘢痕组织内的充血减轻。可能的原因:①CO2点阵激光能够加速并促进药物透皮。多个研究证明,经过CO2点阵激光处理后,体外皮肤中5-氟尿嘧啶、顺铂或甲氨蝶呤的含量显著增加[13,29,30]。②AC 可减少炎症细胞浸润,抑制炎症介质如IL-6、TNF-α 的表达[31],而瘢痕组织内的慢性炎症反应会导致血管生成,成纤维细胞增殖,胶原沉积[1]。③相比于AC,SNF-AC 能够通过长期缓释AC,显著减少伤口愈合中炎症因子IL-6 和TNF-α 含量,从而减轻伤口炎症反应,并促进伤口愈合,减少瘢痕形成[15,25]。本研究中,SNFAC 利用CO2点阵激光产生的临时微孔通道,进入并布满于微孔通道内,当通道闭合,已进入瘢痕组织内的SNF-AC 固定在局部起到缓释药物的作用,最终达到持续治疗增生性瘢痕的作用。
综上所述,在CO2点阵激光协同下,SNF-AC 对增生性瘢痕具有良好的治疗效果,有助于减少增生性瘢痕的相对厚度,并改善血管分布。SNF 可作为抗瘢痕药物积雪草苷的有效载体。这为实现药物透皮后的局部给药以及增生性瘢痕的治疗提供一种创新且可行的治疗方法。
