基于hiPSC-CM 的新型明胶水凝胶构建体外心肌微组织研究
2022-07-05刘明璐姜思涵谭瑶陈颖罗润娇卢婷婷王会景付炜游正伟王伟
刘明璐 姜思涵 谭瑶 陈颖 罗润娇 卢婷婷 王会景 付炜 游正伟 王伟
组织工程是一种将种子细胞、生物因子和支架材料相结合,形成类似于人体组织的技术,近年来被广泛应用于器官再生、体外建模、药物筛选等领域[1-3]。目前常用的支架材料包括明胶、海藻酸钠、壳聚糖、胶原蛋白、纤维蛋白等[4-7]。明胶因其良好的生物相容性、可降解性,并且具有与体内微环境相似的特质,是最常用的构建体外微组织的支架材料[8]。然而,明胶机械性能差和易溶解性限制了其在生物医学领域的广泛应用,需要通过交联来稳定明胶的聚合物结构并增强明胶的机械性能[9-11]。明胶水凝胶交联的方法包括离子交联、热凝胶、化学交联、光聚合等[12-14]。
人诱导多能干细胞(Human induced pluripotent stem cells,hiPSC)来源广泛、不涉及伦理问题、没有免疫排斥,并且具有向心肌细胞、肝细胞、神经细胞等多种细胞分化的潜能。目前,人诱导多能干细胞来源心肌细胞(Human induced pluripotent stem cellsderived cardiomyocytes,hiPSC-CMs)已经处于比较成熟的阶段,是理想的组织工程种子细胞来源[15-17]。
本研究利用明胶制备了一种新型的多功能水凝胶,并对其表面结构、机械性能、细胞相容性进行研究,探索其混合hiPSC-CMs 构建心肌微组织及其冻存的可能性。
1 材料与方法
1.1 实验试剂与仪器
hiPSC 来自上海儿童医学中心李彦欣教授课题组,为脐带血细胞来源hiPSC。脐带血捐献者签署了相关知情同意书。本研究经上海儿童医学中心伦理委员会审查批准。
泰斯曼高压电源(大连泰思曼科技有限公司)、细胞培养箱(Thermo 公司,美国)、扫描电子显微镜[泰思肯贸易(上海)有限公司]、倒置相差显微镜(Leica 公司,德国)、台式单轴拉伸试验机(Instron 公司,美国)、流式细胞分析仪器(Beckman 公司,美国)、激光共聚焦显微镜(Leica 公司,德国)。
明胶(Sigma-Aldrich 公司,美国,A 型,来自猪皮)、甘油(Sigma-Aldrich 公司,美国,≥99.0%)、(NH4)2SO4(上海泰坦科技股份有限公司,≥99.5%)、戊二醛(上海麦克林生化科技有限公司,50%)、Ca(NO3)2·4H2O(国药控股股份有限公司,≥99.0%)、EDTA(Thermo 公司,美国)、基质胶(Cornin 公司,美国)、CHIR99021(Stemcell 公司,加拿大)、PBS 缓冲液(Hyclone 公司,美国)、TeSR-E8 培养基(Stemcell公司,加拿大)、减胰岛素B27 添加剂(Thermo 公司,美国)、加胰岛素B27 添加剂(Stemcell 公司,加拿大)、Accutase 消化酶(Stemcell 公司,加拿大)、Y-27632(Stemcell 公司,加拿大)、PMI1640(Thermo 公司,美国)、IWP-2(Stemcell 公司,加拿大)、α-Actin抗体(Sigma-Aldrich 公司,美国)、心肌细胞消化液(北京赛贝生物技术公司,中国)、肌钙蛋白cTnT 抗体(Proteintech 公司,美国)。
1.2 材料制备
将明胶粉末与Ca(NO3)2·4H2O 溶解在去离子水中,50 ℃下持续搅拌至澄清且无气泡。随后抽取一定量的明胶水溶液并挤入表面皿中,放入4 ℃冰箱30 min 使其成为凝胶状。材料由东华大学游正伟教授课题组制备。
1.3 材料冷冻扫描电镜
将制备好的材料放入2.5%戊二醛溶液中固定过夜,在液氮中速冻30 s,-90 ℃升华10 min,之后以10 mA 的电流溅射镀金60 s,送入扫描电镜样品室观察,冷台温度-140 ℃,加速电压5 kV,观察材料的表面形态。
1.4 材料机械性能
机械性能通过万能试验机(MTS E42)进行研究,进行循环拉伸测试时,加载和卸载速率均为20 mm/min,拉伸应变范围为100%,循环次数为10 次。
1.5 hiPSC 的培养、向心肌细胞分化及鉴定
hiPSC 采用TeSR-E8 培养基培养,细胞汇合度达到70%~80%时,EDTA 消化5 min,200× g 离心4 min 后,用含有5 μmol/L Y-27632 的TeSR-E8 培养基按照1∶8~1∶10 重悬,接种到6 孔板中,37 ℃、5% CO2培养箱中维持培养。每天用PBS 缓冲液清洗后,更换TeSR-E8 培养基。hiPSC 汇合度再次达到80%~85%时,用Accutase 消化酶消化5~7 min,200×g离心4 min 后,接种到12 孔板中,每孔1×106个hiPSC,在37 ℃、5% CO2的湿度培养箱中继续培养2 d 后,在含有12 μmol/L CHIR99021 的TeSR-E8培养基中进行分化。36 h 后更换为减胰岛素B27 培养基,1 d 后更换为含5 μmol/L IWP-2 的减胰岛素B27 培养基,分化第5 天更换为减胰岛素B27 培养基。自第7 天开始,培养基更换加胰岛素B27 添加剂,2 d 更换一次培养基。第10 天可以在12 孔板中观察到跳动的心肌细胞。
将第15 天的心肌细胞在PBS 中清洗后,用心肌细胞消化液Ⅰ消化10 min,心肌细胞消化液Ⅱ消化20 min,200× g 离心4 min 后,按1×105个/孔的细胞密度接种于预先铺好基质胶的激光共聚焦小皿上。待完全贴附,室温下4%多聚甲醛固定15 min,PBS 清洗3 次,每次5 min,0.5% TritonX-100 室温破膜15 min,PBS 清洗3 次,每次5 min,5%牛血清白蛋白室温封闭2 h,加入心肌细胞标志物cTnT 抗体(1∶200)和α-Actin 抗体(1∶200),4 ℃孵育过夜。PBS 清洗3 次,每次5 min,添加荧光二抗(1∶1 000)室温避光孵育2 h。DAPI(1∶1 000)室温核染5 min,激光共聚焦显微镜观察。
1.6 明胶水凝胶与hiPSC-CMs 的细胞相容性
将明胶水凝胶剪裁成24 孔板大小,用75%乙醇浸泡30 min 消毒,PBS 清洗3 遍后,紫外线照射2 h,PBS 清洗3 遍后,将第6 天的心脏前体细胞种在材料上继续进行心肌细胞分化,在第15 天对细胞进行心肌标志物染色,在激光共聚焦显微镜下观察染色后细胞。将第15 天的心肌细胞固定后,冷冻扫描电镜观察细胞在材料表面的形态。
1.7 hiPSC-CMs 混合明胶水凝胶构建心肌微组织
将明胶水凝胶90 ℃水浴12 h,使其完全熔化。取第15 天的心肌细胞,PBS 清洗后用心肌细胞消化液Ⅰ消化10 min,心肌细胞消化液Ⅱ消化20 min,200× g 离心4 min 后,去上清,与交联明胶水凝胶混合构建心肌微组织。用Calcein-AM/ propidium iodide(1∶1 000)避光孵育30 min,在显微镜下观察细胞的存活情况。
1.8 hiPSC-CMs 混合交联明胶水凝胶构建心肌微组织后冻存
hiPSC-CMs 混合交联明胶水凝胶构建心肌微组织后,直接放入-80 ℃冰箱冻存,24 h 后取出在37 ℃水浴锅中复苏,用Calcein-AM/ propidium iodide(1∶1 000)避光孵育30 min,在显微镜下观察细胞的存活情况。
1.9 沟槽交联明胶水凝胶
通过Adobe Illustrator 2021 设计了宽度60 μm、深度200 μm 的沟槽模具。再将交联明胶水凝胶溶液浇筑在沟槽上,冷却后脱胶,得到了沟槽有序排列的水凝胶。将第10 天的心肌细胞消化后,按10×105个/孔的细胞密度接种于预先铺好基质胶的材料上,在第15 天左右,室温下4%多聚甲醛固定15 min,PBS 清洗3 次,每次5 min,0.5% TritonX-100 室温破膜15 min,PBS 清洗3 次,每次5 min,5%牛血清白蛋白室温封闭2 h,加入心肌细胞标志物cTnT 抗体(1∶200)和α-actin 抗体(1∶200),4 ℃孵育过夜。PBS 清洗3 次,每次5 min,添加荧光二抗(1∶1 000)室温避光孵育2 h。DAPI(1∶1 000)室温核染5 min,激光共聚焦显微镜观察。
1.10 统计学分析
采用GraphPad Prism 8.0.2 软件进行统计分析,数据以表示,采用t 检验,P<0.05 表示差异具有统计学意义。
2 结果
2.1 明胶水凝胶的制备及鉴定
制备好的明胶水凝胶为黄色透明材料。在冷冻扫描电镜下呈现出均匀疏松多孔结构,孔径大小1~10 μm(图1A-D)。制备的交联水凝胶材料分别在第1 天、第3 天、第7 天进行循环拉伸力学测试,结果显示明胶水凝胶拥有良好的力学性能(图1E-G)。

图1 材料的制备及鉴定Fig.1 Preparation and identification of materials
2.2 hiPSC 的培养、向心肌细胞分化及鉴定
hiPSC 呈克隆样生长,排列紧密,边缘清晰,细胞呈较小的圆形,核质比高,细胞核显著。在hiPSC向心肌细胞分化的过程中,通过添加小分子进行诱导分化,可以观察到hiPSC 在分化过程发生形态变化,hiPSC 从分化开始时的紧密圆形克隆,逐渐变为近似短棒状的心肌细胞,在第10 天可以看到自发搏动的心肌细胞(图2A-E)。第15 天免疫荧光结果显示,细胞高表达心肌细胞标志物cTnT、α-actin(图2F-I)。

图2 hiPSC 细胞培养、分化及鉴定Fig.2 Culture,differentiation and identification of hiPSCs
2.3 明胶水凝胶与hiPSC-CMs 的细胞相容性
将第6 天的心脏前体细胞消化后种植在明胶水凝胶膜片上,可以观察到心肌细胞生长良好,在第10 天心肌细胞开始自发跳动(图3A)。第15 天的免疫荧光染色结果显示,心肌标志物cTnT、α-actin 在细胞高表达,表明心脏前体细胞在明胶水凝胶膜片上成功分化为心肌细胞(图3B)。扫描电镜结果显示,心肌细胞在材料上呈现典型短棒状细胞形态,细胞形态清晰,细胞与细胞之间出现细胞间连接(图3C)。

图3 明胶水凝胶与hiPSC-CMs 的细胞相容性Fig.3 Cell compatibility of cross-linked gelatin hydrogel with hiPSC-CMs
2.4 hiPSC-CMs 混合明胶水凝胶构建体外心肌微组织
将交联明胶水凝胶置于90 ℃水浴中使其完全熔化,将第15 天的心肌细胞消化后与交联明胶水凝胶混合,构建体外心肌微组织(图4A)。构建体外心肌微组织4 h 后,细胞死活实验显示,活细胞占62.33%,显著高于死细胞(36.67%),差异有统计学意义(P<0.05,图4B-E)。该结果表明,明胶水凝胶可以对心肌细胞起到保护作用。
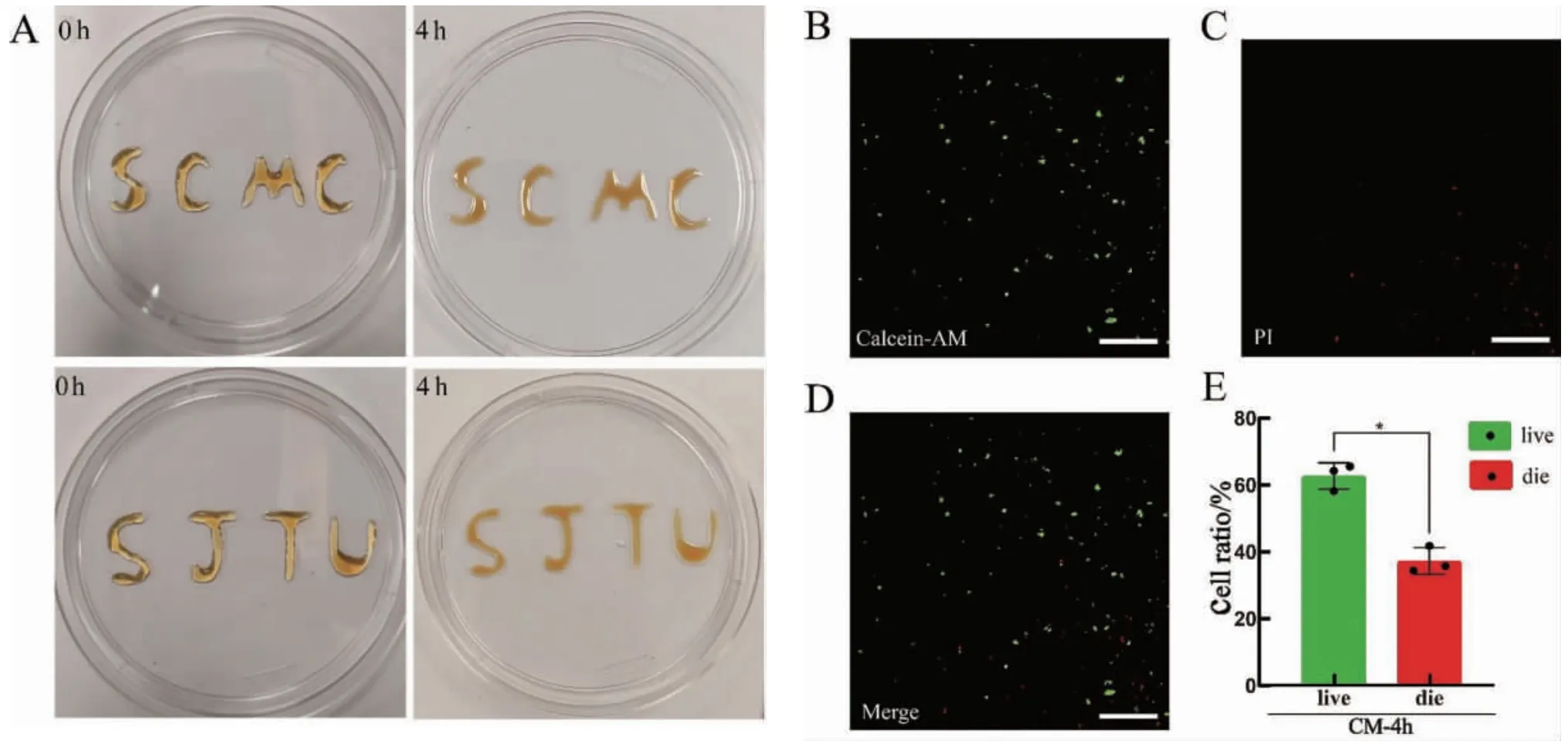
图4 hiPSC-CMs 混合明胶水凝胶构建体外心肌微组织Fig.4 hiPSC-CMs mixed gelatin hydrogel for construction of myocardial microtissue in vtro
2.5 hiPSC-CMs 混合明胶水凝胶构建心肌微组织后冻存
hiPSC-CMs 混合明胶水凝胶构建的心肌微组织,直接在-80 ℃冻存1 d 后进行复苏(图5A-C),细胞死活实验结果显示,活细胞比例为16.34%,死细胞比例为83.63%(图5D-E),直接冻存的心肌微组织中部分细胞存活,明胶水凝胶可能通过提供类似细胞外基质的环境对细胞进行了保护[18]。
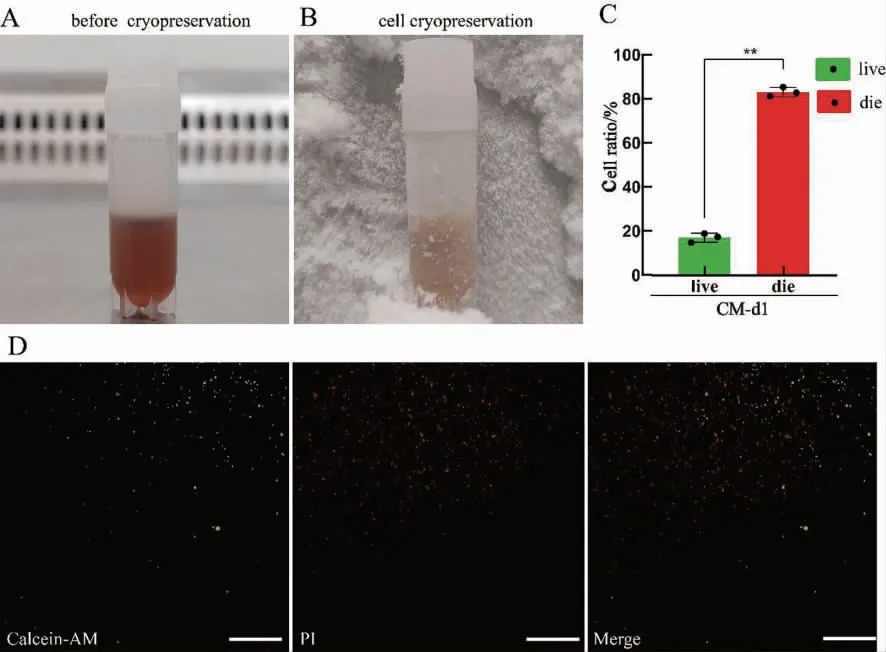
图5 体外构建心肌微组织后的冻存及复苏Fig.5 Cryopreservation and resuscitation of myocardial microtissue constructed in vitro
2.6 沟槽明胶水凝胶结合hiPSC-CM 的初步研究
根据心肌细胞的大小和有序排列的细胞特性,设计和制备了一种有序排列的、宽度60 μm、深度200 μm 的沟槽模具,在模具中倒入明胶水凝胶溶液制备成沟槽明胶水凝胶膜片(图6A)。有研究表明,通过表面微环境引导心肌细胞的有序排列有助于促进hiPSC-CM 的成熟[19]。根据扫描电镜结果,沟槽明胶水凝胶膜片的表面呈现孔径1~10 μm 疏松多孔的超微结构和排列整齐的沟槽(图6B)。将第6 天的心脏前体细胞种植在沟槽明胶水凝胶膜片上,发现细胞落在沟槽内,在第10 天左右出现心肌细胞的自发搏动并呈现出一定的有序排列性(图6C)。免疫荧光结果显示,沟槽内心肌细胞表达心肌细胞标志物cTnT、α-actin,且细胞沿沟槽有序生长(图6D)。

图6 沟槽明胶水凝胶结合hiPSC-CMs 的实验结果Fig.6 Experimental results of slotted gelatin hydrogel combined with hiPSC-CMs
3 讨论
组织工程是一种将种子细胞、生物因子和支架材料结合形成类似于人体组织的技术,广泛应用于器官再生、体外建模、药物筛选等领域。常用的明胶水凝胶存在机械性能差和易溶解的问题,许多研究都在通过各种方式致力于提高明胶作为生物墨水的各项性能,以实现其从生物材料向生物应用的转化[20-21]。此外,hiPSC-CMs 的分化体系目前已处于比较成熟的阶段,不涉及伦理学问题,且来源广泛,是理想的组织工程种子细胞。本研究通过明胶交联制备了一种多功能明胶水凝胶,可以混合hiPSC-CMs构建体外心肌微组织,并且在长时间的体外微组织构建过程中对细胞有较好的保护作用,构建的组织可以直接冻存,且冻存后有部分细胞存活。此外,制备的沟槽明胶水凝胶对心肌细胞有一定的有序排列引导作用。
综上所述,明胶水凝胶是一种多功能的组织工程支架材料,对体外构建心肌微组织中的细胞、冻存后细胞具有保护作用。此外,沟槽明胶水凝胶对hiPSC-CMs 的排列有一定影响。后续将对明胶水凝胶围绕体外构建过程中面临的抗菌、细胞保护、微组织冻存等问题进行深入研究,并进一步对沟槽明胶水凝胶对hiPSC-CMs 分化、成熟的影响进行探索。
