一种基于DNA 测序结果的静脉/淋巴管畸形新基因分型
2022-07-05刘泓源顾豪杨希胡丽徐梓安陈辉林晓曦
刘泓源 顾豪 杨希 胡丽 徐梓安 陈辉 林晓曦
静脉/淋巴管畸形是常见的先天性低流量脉管畸形。根据国际脉管性疾病研究学会的最新分类[1],静脉/淋巴管畸形可以作为单纯的脉管畸形单独出现,如静脉畸形、淋巴管畸形;也可存在混合脉管畸形成分(如淋巴静脉畸形),或合并过度生长作为综合征出现(如血管骨肥大综合征)。既往针对静脉/淋巴管畸形的诊断主要依赖于典型的临床表现、影像学表现和病理诊断[2-3],但对于混杂成分的诊断往往存在一定困难,主要表现为临床表现多样而不典型,影像学难以区分静脉或淋巴管畸形成分,病理表现不典型导致病例诊断仅能提供倾向性结论,并且不同个体的疾病发展差异巨大。因而,静脉/淋巴管畸形的鉴别诊断亟需寻求新的突破途径。
在遗传性疾病中,基因诊断是疾病诊断和预后判断的关键。在肿瘤研究中,基因诊断已经逐渐发展成为了临床诊断和病理诊断之外的第三种诊断方法,对于肿瘤发现、预后、治疗起到关键作用。第二代测序技术广泛应用后,基因诊断在非肿瘤领域和非遗传性疾病领域逐渐发挥重要作用。在脉管畸形领域,基因水平的研究不仅能帮助我们更好地理解脉管畸形发生发展的机制,也有望形成基因诊断模式,推进疾病的精准诊断和治疗。
本研究中,我们通过第二代测序技术,检测了55 例静脉/淋巴管畸形患者的组织、血浆或淋巴液,分析基因突变情况,并尝试提出静脉/淋巴管畸形的基因分型。
1 材料与方法
1.1 患者选择与标本获取
调取2019 年9 月至2020 年12 月在复杂血管瘤与脉管畸形样本库中留存的55 例静脉/淋巴管畸形患者组织样本,所有组织样本均经病理证实存在静脉/淋巴管畸形成分。对组织样本进行组织DNA的靶向捕获二代测序。全部送检样本均达到基因测序质控要求。所有患者均签署了样本库统一的知情同意书。
1.2 DNA 测序
基因二代测序由宁波爱她基因科技有限公司完成。具体步骤如下:使用Qiagen DNA 提取试剂盒抽提组织样本中的DNA。采用VAHTSTM Universal DNA Library Prep Kit for IlluminaV3 和VAHTS DNA Adapters set 3/4 for Illumina进行DNA 文库构建。基因组DNA 初始量为500 ng,使用Covaris 超声将基因组DNA 随机打断为200~300 bp 的片段后。将DNA 片段进行末端修复,使DNA 双链形成平末端,并分别在片段化的DNA 的5' 端加磷酸基团,3' 端加PolyA 尾。通过TA 互补配对连接将DNA adapter 序列加到片段两端,经过一轮PCR扩增后成为完整的片段文库。将片段文库纯化并分选后,先进行扩增富集,纯化后使用Qubit 3.0 荧光定量仪测定DNA 浓度。靶向捕获二代测序使用定制的AT134pool01 和AT134pool02 探针进行目标区域捕获,将扩增后的样品与探针进行杂交,形成外显子区域和探针复合体;使用试剂盒中配套纳米磁珠吸附上一步得到的复合体,清洗磁珠,去除未结合序列,然后将捕获的外显子序列洗脱下来,通过PCR扩增构建外显子文库,经纯化后使用Qubit 3.0 荧光定量仪测定DNA 浓度。外显子文库经过质检合格后,生成DNA 簇,使用Illumina Nova Seq 6000 高通量测序仪进行测序,Panel 文库经过质检合格后,生成DNA 簇,使用深圳华大智造科技有限公司的DNBSEQ-T7RS 测序仪进行测序。获得图片文件,经过初级分析获取光强数据并均一化后,读取碱基序列并过滤,完成数据质量打分。质量评估合格后进行数据拆分,将多个混合样品通过特定的index 标记进行区分,并生成相应的原始测序序列,以FASTQ 文件格式进行存储。
1.3 生物信息学分析
1.3.1 序列质量评估和控制
对原始测序序列进行二级分析,去除接头序列、N 含量大于10%的reads、质量低于10 的碱基超过50%的序列,从而获得可用于后续生物信息学分析的Clean reads。碱基类型分布检查后无AT、GC 分离现象。
1.3.2 基因组对比
通过序列对比软件BWA,将达到标准的Clean reads 与人参考基因组序列(GRCh37,hg9)对比,去除结果文件中冗余序列,对比获得SAM 格式文件,进一步处理为二进制格式BAM 文件。BAM 文件通过SAMTOOLS 或IGV 软件(Integrative Genomics Viewer)查看。用Picard 对比对结果进行排序,然后标记重复reads(Mark duplicate reads),最后利用重复标记后的比对结果进行覆盖度、深度等的统计。
1.3.3 SNV 和插入/缺失(InDel)的检测和注释
SNV 和small InDel 的检测主要使用GATK 软件工具包实现。根据Clean reads 在参考基因组的定位结果,使用Picard 进行去重复(Mark duplicates)、GATK 进行局部重比对(Local realignment)、碱基质量值校正(Base recalibration)等预处理,以保证检测结果的准确性;再使用GATK 进行SNV 和InDel 的检测,过滤,并得到最终的变异位点集。
1.3.4 变异结果注释
注释变异结果主要通过ANNOVAR 软件实现,根据变异位点在参考基因组上的位置以及参考基因组上的基因位置信息,可以得到变异位点在基因组发生的区域(基因间区、外显子区或UTR 区等),以及变异产生的影响(同义突变、非同义突变、移码突变等)。具体注释信息,分为6 个部分:变异位点位置和功能区域信息注释、数据库频率注释、保守/有害性注释、各样本基因型信息注释、疾病数据库注释以及变异基因功能注释。
2 结果
2.1 静脉/淋巴管畸形的临床特征
55 例诊断为静脉/淋巴管畸形的患者中,单纯静脉畸形19 例,单纯淋巴管畸形10 例,淋巴静脉畸形8 例,毛细血管淋巴静脉畸形4 例,血管骨肥大综合征14 例。
2.2 静脉/淋巴管畸形的基因检测结果
55 个静脉/淋巴管畸形组织样品进行DNA 的靶向捕获二代测序,经过生物信息学分析,筛选与受检者临床表型相关的致病或可能致病的变异,排除胚系突变和意义不明的体细胞突变后,发现3 种潜在致病基因、15 个变异位点。综合分析每例患者的基因检测结果,55 例患者中发现18 例存在TEK 突变、22 例存在PIK3CA 突变,1 例存在RASA1 突变,17 例没有发现与受检者临床表型相关的致病或可能致病的变异。
根据疾病的临床诊断和病理诊断进行临床分类,分为单纯静脉畸形、单纯淋巴管畸形、淋巴静脉畸形、毛细血管淋巴静脉畸形和血管骨肥大综合征,其突变基因各有特征,具体见表1。
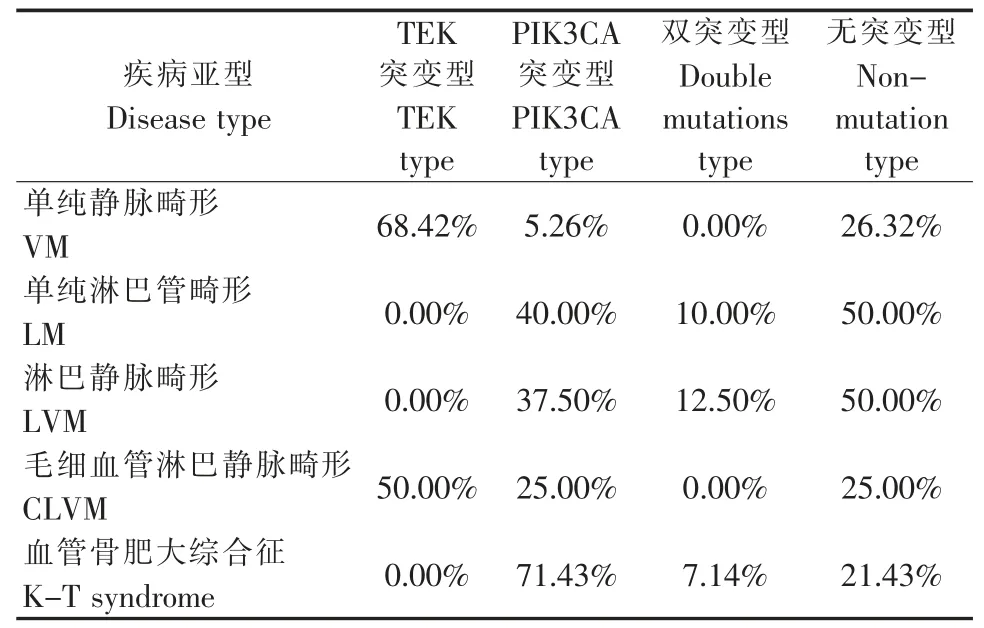
表1 不同疾病亚型的基因分型Table 1 The genotyping of different malformations
在单纯静脉畸形中,68.42%存在TEK 突变,其中最常见的突变是TEK L914F 点突变,占TEK 突变的76.92%;5.26%存在PIK3CA 突变;其余5 例均未检测出与受检者临床表型相关的致病或可能致病的变异。
在单纯淋巴管畸形中,40%存在PIK3CA 突变,其中最常见的突变是E542K 点突变,占PIK3CA 突变的50%;1 例同时存在TEK R614fs 突变和PIK3CA E542K 突变;1 例患者检出RASA1 R903del缺失突变;其余4 例均未检测出与受检者临床表型相关的致病或可能致病的变异。
在淋巴静脉畸形中,37.5%存在PIK3CA 突变,其中2 例为E542K 点突变、1 例为E545G 点突变;1例存在TEK R614fs 突变和PIK3CA E545K 突变;其余4 例均未检测出与受检者临床表型相关的致病或可能致病的变异。
4 例毛细血管淋巴静脉畸形中,2 例为TEK 突变,1 例为PIK3CA 突变,1 例未检测出与临床表型相关的致病或可能致病突变。
在血管骨肥大综合征中,71.43%存在PIK3CA突变,其中最常见的突变位点是E545K、C420R,分别占PIK3CA 突变的36.36%和27.27%;1 例同时存在TEK R50L 点突变和PIK3CA E545K 点突变;21.43%的血管骨肥大综合征患者未检出与受检者临床表型相关的致病或可能致病的变异。
就静脉/淋巴管畸形所检测出的各基因的突变情况而言,单纯TEK 突变中86.67%为单纯静脉畸形,100%伴有静脉畸形成分。单纯PIK3CA 突变中52.63%为血管骨肥大综合征,21.05%为单纯淋巴管畸形,94.74%伴有淋巴管畸形成分(表2)。就各基因的变异位点而言,TEK 最常见的变异位点为L914F,占TEK 突变的57%,PIK3CA 最常见的变异位点为E542K、E545K,分别占PIK3CA 突变的31.81%和27.27%。

表2 基因分型的表型特征Table 2 The phenotype of different genotypings
3 讨论
随着遗传学、分子生物学理论与技术的飞速发展,从更为本源的角度——基因水平来探索脉管畸形这一古老疾病是必然的选择。第二代测序技术(Next-generation sequencing,NGS)的广泛应用使得探究脉管畸形发生发展的根本原因成为可能。
在既往的研究中,RAS/Raf/MEK/ERK 通路和PI3K/AKT/mTOR 通路是脉管畸形中两条最为关键的信号通路[4],大多数脉管畸形相关的突变基因都集中于此。我们的研究明确了静脉/淋巴管畸形的基因突变类型和常见的热点突变位点。
这部分研究中,我们结合病灶组织的靶向捕获二代测序、静脉畸形病灶血液的游离DNA 靶向捕获二代测序和病灶组织的全外显子测序等3 种检测方式,筛选出7 种与疾病表型有关的致病或可能致病的变异基因,其中2 种与PI3K/AKT/mTOR 通路相关,4 种与RAS/Raf/MEK/ERK 通路相关。静脉/淋巴管畸形最常见的突变基因为TEK 和PIK3CA,均与PI3K/AKT/mTOR 通路相关,表明该通路在疾病的发生和发展中具有极为重要的作用。
在静脉畸形中,我们确认了TEK 是最主要的突变基因,少部分存在PIK3CA 基因突变,1 例存在GLMN 突变被认为是一种特殊类型的静脉畸形——球细胞静脉畸形。考虑到游离DNA 靶向捕获二代测序的总体检出率明显低于组织样本的靶向捕获二代测序,如果仅参考组织样本的靶向捕获二代测序结果,静脉畸形的活检病灶组织样本中75.86%存在TEK 基因突变,3.45%存在PIK3CA 突变,20.69%未检测出TEK 或PIK3CA 基因突变。因此,我们可以推断,静脉畸形中发生突变的最主要的基因是TEK,而TEK 突变的检出提示存在静脉畸形的成分。
在淋巴管畸形和淋巴静脉畸形中,我们确认了PIK3CA 是主要的突变基因,也有同时存在TEK 和PIKCA 两种基因突变的情况发生,而40%的淋巴管畸形和42.86%的淋巴静脉畸形并未检出与受检者临床表型相关的致病或可能致病的变异。我们推测,在部分淋巴管畸形和淋巴静脉畸形的患者中可能存在其他没有涵盖在我们测序靶向捕获列表中的致病基因突变,或者一些临床意义不明的变异也参与了淋巴管畸形和淋巴静脉畸形的发生发展。
在其他的多种病灶成分同时存在的混合畸形中,TEK 和PIK3CA 基因突变均被发现,但由于总体的患者数量较少,不足以确认哪一种基因是主要的突变基因,以及是否还存在其他潜在可能的基因突变类型,但PIK3CA 突变的检出提示存在淋巴管畸形的成分。
在血管骨肥大综合征中,PIK3CA 是最主要的突变基因。有观点认为这一疾病应该属于PIK3CA相关过度生长综合征群(PROS)[4-7]。PROS 包括了一大类散发性过度生长综合征,包括纤维脂肪性过度增生(FAO)、偏侧过度增生性多发性脂肪瘤病、CLOVES 综合征、巨趾/指畸形、纤维脂肪性浸润性脂肪瘤病及相关巨脑畸形综合征、巨脑畸形-毛细血管畸形综合征、发育不良型巨脑畸形等[3,5,8-9]。脉管畸形是PROS 诊断标准的重要部分,大部分患者均存在各种类型、各种成分的脉管畸形。在传统的经典定义中,血管骨肥大综合征并没有被归类到PROS 的疾病谱系中去,但是根据PROS 的诊断标准,血管骨肥大综合征的患者存在包括脂肪、肌肉、骨骼在内的一种或多种组织过度生长,存在毛细血管、静脉、淋巴管一种或多种脉管畸形成分,符合PROS 疾病的定义和诊断,因而从临床表现或表型的角度可以被归属到这一疾病谱系中。我们的研究进一步验证了血管骨肥大综合征的基因突变类型是PIK3CA 基因突变,进一步论证了将血管骨肥大综合征归类到PROS 的合理性。
综合所有的基因检测结果,我们发现TEK 基因最常见的热点突变位点是L914F,PIK3CA 基因最常见的突变位点是E542K 和E545K。在肿瘤学中,组织细胞的TEK 突变是罕见的,因而TEK L914F 这一热点突变可能是静脉畸形相关的独特突变类型,而PIK3CA 的热点突变位点与肿瘤中发现的热点突变位点相一致[10]。
根据以上结果分析,我们认为静脉/淋巴管畸形的致病基因是TEK 和/或PIK3CA,并且TEK 突变很可能仅与静脉畸形有关。因此,我们提出静脉/淋巴管畸形的基因分型:TEK 突变型(仅存在TEK 突变)、PIK3CA 突变型(仅存在PIK3CA 突变)、双突变型(同时存在TEK 和PIK3CA 突变)和无突变型(不存在TEK 或PIK3CA 突变),如图1 所示。TEK 突变型高度提示存在静脉畸形成分,所对应表型一般为单纯的静脉畸形。PIK3CA 突变型提示可能存在淋巴管畸形成分,对应表型可以是单纯的淋巴管畸形也可以是混合畸形或血管骨肥大综合征。双突变型提示可能存在混合成分的静脉/淋巴管畸形或血管骨肥大综合征。无突变型作为阴性结果,可能发生于各种类型的静脉/淋巴管畸形中。需要注意的是,以上结果的判断应当以组织样本的靶向捕获二代测序的结果为准,以避免假阴性(即被错误地归类到无突变型)的产生。静脉/淋巴管畸形基因分型的提出,成为了这一疾病在临床诊断、病理诊断之外的独立诊断模式,有助于更好地鉴别临床表现不典型、影像学表现不典型的静脉/淋巴管畸形,同时也为静脉/淋巴管畸形的精准医疗和靶向治疗提供了依据。

图1 基因分型在静脉/淋巴管畸形诊断与治疗选择中的意义Fig.1 The meaning of genotyping in diagnosis and treatment of venous/lymphatic malformations.
西罗莫司作为目前唯一能够用于静脉/淋巴管畸形的靶向药物,其疗效与基因突变的关系尚未明确[11],而已有的指南、文献、临床研究登记中,尚无西罗莫司以外其他靶向药物用于静脉/淋巴管畸形精准用药的研究,特别是基因突变相关的适应证。包括PI3Kα 选择性抑制剂、MEK 抑制剂在内的多种靶向新药目前已开展针对实体肿瘤的临床研究[12],但由于缺乏在脉管畸形领域的临床研究,无法用于脉管畸形的治疗,使之成为了静脉/淋巴管畸形精准治疗领域的瓶颈所在。同时,由于相关用药指南的缺乏,对于复杂静脉、淋巴管畸形的治疗缺乏规范与针对性,徒然增加了用药风险与成本,西罗莫司导致机会性感染引起死亡的案例报告时有出现[13-14]。本研究所提出的静脉/淋巴管畸形的4 种基因分型有助于我们更好地理解静脉/淋巴管畸形的发病机制,帮助后续进行疗效与基因突变关系的研究,并有望能够成为靶向用药的指征。
