氯化钙添加量对地衣芽孢杆菌凝乳酶凝乳性能的影响
2022-07-04李贻珍张卫兵张忠明
李贻珍 张卫兵 张忠明
(甘肃农业大学食品科学与工程学院/甘肃省功能乳品工程实验室,甘肃 兰州 730070)
凝乳酶是一种重要的工业酶制剂,在世界范围内被广泛使用,来源众多[1]。相较植物源和动物源的凝乳酶,微生物源的凝乳酶以其显著的优点备受关注[2]。近年来,源自芽孢杆菌的凝乳酶因其获取方法便捷、凝乳活性强、安全性高,且在干酪成熟过程中产生的苦涩味物质少[3]等优点引起了学术界的广泛关注。
研究表明,利用凝乳酶生产干酪时,在预热的鲜乳中添加适宜浓度的凝乳酶后,几分钟内即可引发酪蛋白凝聚反应[4],这种快速的凝胶聚集活动是牛乳中酪蛋白胶体-磷酸钙颗粒(即酪蛋白胶束)稳定性被破坏所导致的结果[5-6]。随着钙离子含量的增加,酪蛋白形成凝胶结构的硬度不断增大,这也是在制作干酪的牛乳中添加一定量氯化钙的本质原因[7]。因此,添加钙离子浓度与凝乳时间、凝乳效果、干酪产率等密切相关[8],适量添加氯化钙可以缩短凝乳时间,增大凝块硬度,使干酪质地更加紧致[9-10]。
通常情况下,在凝乳过程中,黏度值用于表示蛋白质之间的相互作用力,随着凝聚反应的进行,酪蛋白胶束间距离缩小,凝胶结构体积变大,从而使黏度值逐渐变大;浊度值表示酪蛋白胶束的聚集程度,凝乳体系对光的透过率越低,浊度值越大;而乳清光密度(optical density,OD)值是凝乳过程中排出乳清的吸光值,体系中蛋白聚集率越高,乳清OD值越小;粒径值主要指凝聚胶束的体积,随着凝乳过程的进行,胶束体积不断增大,粒径值也随之变大;持水力表示体系中束缚水的含量,凝乳后体系的持水力越大,表示凝块中束缚水含量越高;储能模量(即弹性模量)G′是凝乳过程中评价凝乳网状结构强度的重要指标,指在振动条件下每个应变周期所储存的能量大小。赵笑等[11]在研究一种酒曲凝乳酶时发现,随着氯化钙添加量的增加,体系凝乳时间明显提前,持水力、黏度值逐渐增大。Udabage等[12]研究表明,适当增加钙离子含量可增大凝乳体系的黏度值和凝块硬度,有利于缩短凝乳时间。Sbodio等[13]研究表明,在一定范围内,凝乳酶的凝乳性能与钙离子浓度呈正相关关系,钙离子的存在有利于酪蛋白的凝聚,且可以有效地改善凝乳结构,使蛋白聚集地均匀有致。目前,随着干酪市场的不断扩大,关于传统凝乳酶替代品的研究虽然较多,但微生物凝乳酶的探索研究仍限制很大,特别是关于细菌凝乳酶在凝乳过程中凝乳特性的研究还鲜有报道。在干酪生产中,影响凝乳酶作用的条件有很多,主要包括pH值、温度、钙离子浓度、凝乳酶添加量、底物浓度等因素。因此,研究不同凝乳条件对细菌凝乳酶凝乳性能的影响有重要意义。
甘肃省功能乳品工程实验室前期已从甘肃省天祝藏族自治县牦牛牧区土壤中筛选得到一株高效产凝乳酶的地衣芽孢杆菌菌株D3.11,并已详细考察了地衣芽孢杆菌D3.11凝乳酶在不同pH值[14]、不同温度[15]条件下的凝乳特性。本研究旨在不同氯化钙添加量条件下,探究地衣芽孢杆菌D3.11凝乳酶在凝乳过程中及凝乳后的相关特性,并以商品酶为对照,分析氯化钙添加量对该酶凝乳性能的影响,以期为细菌凝乳酶在干酪生产中的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料 新鲜荷斯坦牛乳,甘肃农业大学奶牛场;地衣芽孢杆菌 D3.11(BacilluslicheniformisD3.11),由甘肃省功能乳品工程实验室分离纯化并保藏于中国普通微生物菌种保藏管理中心(保藏编号为 CGMCC NO:3289);麸皮,淮南鸿汶农业发展有限公司;商品凝乳酶(由70%皱胃酶和30%牛胃蛋白酶组成,活力100 000 U·g-1),深圳富晟生物科技有限公司;纤维素透析袋(12 000~14 000 Da),上海源叶生物科技有限公司。
1.1.2 试剂 尼罗红(超级纯),梯希爱(上海)化城工业发展有限公司;无水乙醇(分析纯),甘肃易飞仪器科技有限公司;氯化钙(分析纯),国药集团化学试剂有限公司。其他试验试剂均为国产分析纯。
1.1.3 培养基 斜面种子培养基:牛肉膏3 g、NaCl 5 g、蛋白胨10 g、琼脂15 g、蒸馏水1 000 mL,pH值7.2~7.4。麸皮培养基:麸皮18 g、水100 mL,煮沸10 min,然后用4层纱布过滤,将滤液补水至100 mL,121℃灭菌25 min。液体培养基:牛肉膏3 g、NaCl 5 g、蛋白胨10 g、蒸馏水1 000 mL、pH值7.2~7.4。
1.2 仪器与设备
LSM 800型激光扫描共聚焦显微镜,德国卡尔·蔡司股份公司;754 PC型紫外可见光分光光度计,上海光谱仪器有限公司;LVDV-1型数字旋转黏度计,上海方瑞仪器有限公司;Discovery HR-1型混合流变仪,美国TA Instruments公司;Bettersize2600激光粒度分布仪,丹东百特仪器有限公司;Scientz-ND型真空冷冻干燥机,宁波新芝生物科技股份有限公司。
1.3 菌株发酵试验
1.3.1 菌种活化 将实验室斜面保藏的BacilluslicheniformisD3.11菌种转接至斜面种子培养基上,先在恒温培养箱中37℃培养24 h,再接入液体培养基于37℃、175 r·min-1条件下培养24 h。
1.3.2 粗酶液发酵 将活化后的液体菌液以4%的接种量接入麸皮培养基中,37℃摇床(转速175 r·min-1)培养72 h,8 000 r·min-1离心10 min后得到粗酶液。
1.4 酶液与脱脂乳的制备
1.4.1 地衣芽孢杆菌凝乳酶的制备 向粗酶液中边缓慢搅拌边加硫酸铵细粉末,磁力搅拌2 h,使硫酸铵充分溶解,饱和度达到20%。然后于4℃、8 000 r·min-1条件下离心15 min,收集上清液,缓慢加入硫酸铵至饱和度达到75%;4℃冰箱中静置过夜,8 000 r·min-1离心10 min,收集沉淀。将沉淀溶于0.05 mol·L-1、 pH值6.2的磷酸缓冲液中,置于透析袋中,在4℃条件下透析20 h。将透析后的酶液,倒入铝盒置于真空冷冻干燥机冻干23 h,收集酶粉,-20℃保存。
1.4.2 酶液的配制 称取一定量的地衣芽孢杆菌D3.11凝乳酶酶粉,溶解于磷酸缓冲液(0.05 mol·L-1, pH值6.2)中,将其酶活调整为150 SU·mL-1,40℃条件下预热5 min备用。称取商品酶5 g,加适量蒸馏水溶解后,调整酶活为150 SU·mL-1,40℃条件下预热5 min备用。
1.4.3 脱脂乳的制备 取新鲜荷斯坦牛乳于4 000 r·min-1离心20 min去除上层脂肪,加0.02%叠氮钠备用。
1.5 试验方法
1.5.1 黏度的测定 参照孔学民等[16]的方法。将脱脂乳在40℃条件下水浴预热5 min,分别在6个烧杯中加入乳样50 mL,依次按0.014%、0.016%、0.018%、0.020%、0.022%、0.024%添加无水氯化钙,充分溶解后分别加入5 mL酶液,采用数字旋转黏度计,选取3号转子,每隔10 min测定体系黏度值。
1.5.2 浊度的测定 参照Mizuno等[17]的方法。将脱脂乳在40℃条件下水浴预热5 min,取乳样各5 mL于6个离心管中,依次按0.014%、0.016%、0.018%、0.020%、0.022%、0.024%添加无水氯化钙,充分溶解后加0.5 mL酶液,充分混匀,每隔5 min取少量样品加蒸馏水稀释,采用紫外可见光分光光度计在450 nm处测定体系的透光率(T%),以(100-T)%代表浊度。
1.5.3 粒径的测定 参照Glantz等[18]的方法,采用激光粒度分布仪测定凝乳过程中酪蛋白聚集体粒径分布。将脱脂乳在40℃条件下水浴预热5 min,取乳样各5 mL于6个离心管中,依次按0.014%、0.016%、0.018%、0.020%、0.022%、0.024%添加无水氯化钙,充分溶解后加入0.5 mL酶液,充分混匀,在室温下凝乳0、10、20 min后,采用激光粒度分布仪测定凝乳酶诱导的酪蛋白胶束聚集体粒径大小,凝乳酶的添加对应时间为0 min。样品和水的折射率分别为1.52和1.33。以中位径D50表示酪蛋白胶束的平均粒径。
1.5.4 流变学特性的测定 参照Zhang等[1]的方法,并略作修改。将脱脂乳在40℃条件下水浴预热5 min,取乳样各5 mL于6个离心管中,依次按0.014%、0.016%、0.018%、0.020%、0.022%、0.024%添加无水氯化钙,充分溶解后加入0.5 mL酶液,充分混匀,分别取不同钙离子浓度条件下乳样4 mL,加0.4 mL酶液,混匀30 s后立即转移到流变仪玻耳帖平板上测定储能模量 (G′),其中测试温度为40℃,测试探头为60 mm平行板,间隙1 000 μm,频率1 Hz,应力0.1 Pa,采点间隔5 s,测定时长60 min。所有测试均在线性粘弹性区域内。
1.5.5 持水力的测定 参照《GB 5009.239-2016 食品安全国家标准 乳和乳制品酸度的测定》[19]。取脱脂乳各5 mL于6个10 mL离心管中,依次按0.014%、0.016%、0.018%、0.020%、0.022%、0.024%添加无水氯化钙,充分溶解后加入0.5 mL酶液,充分混匀,在40℃条件下凝乳30 min,于4℃、7 000 r·min-1条件下离心10 min,取上清称重。按照公式计算乳样持水力:
持水力=上清质量/样品质量×100%
1.5.6 乳清OD值的测定 参照李伟等[20]的方法。取脱脂乳各5 mL于6个10 mL离心管中,依次按0.014%、0.016%、0.018%、0.020%、0.022%、0.024%添加无水氯化钙,充分溶解后加入0.5 mL酶液,充分混匀,40℃条件下凝乳30 min,4℃、7 000 r·min-1条件下离心10 min,取上层排出的乳清,用紫外可见光分光光度计测定乳清在500 nm处的吸光值。
1.5.7 凝块微观结构的测定 参考Lopez等[21]的方法。在脱脂乳中分别添加地衣芽孢杆菌D3.11凝乳酶和商品酶酶液,凝乳60 min,使用不锈钢刀片从凝乳样品切取4 mm×5 mm×2 mm的薄片,置于带槽载玻片上,加2滴尼罗红乙醇溶液(0.1 g·L-1)于暗室中染色6 min;染色结束后,用蒸馏水冲洗染料,然后盖上盖玻片在激光扫描共聚焦显微镜下观察。
1.6 数据处理
试验数据重复测定3次。采用Origin 8.0软件进行绘图,并用SPSS 19.0软件进行统计学分析。
2 结果与分析
2.1 凝乳过程中黏度的变化
由图1-A可知,当钙离子浓度为0.014%时,凝乳40 min时两种酶体系的黏度均达到峰值。此时,地衣芽孢杆菌D3.11凝乳酶体系的最大黏度值为3 352 mPa·s,商品酶体系的最大黏度值为3 349 mPa·s。在凝乳40~60 min内,地衣芽孢杆菌D3.11凝乳酶体系比商品酶体系下降得更快。由图1-B可知,当钙离子浓度为0.016%时,地衣芽孢杆菌D3.11凝乳酶体系的黏度在凝乳50 min时达到最大值(3 342 mPa·s), 商品酶体系的黏度值在凝乳30 min时达到最大值(3 278 mPa·s),两种酶体系的黏度值在30 min后均保持稳定。

注:A~F分别代表氯化钙添加量为0.014%、0.016%、0.018%、0.020%、0.022%、0.024%。不同小写字母表示不同凝乳时间之间差异显著(P<0.05)。下同。Note: A~F represent 0.014%, 0.016%, 0.018%, 0.020%, 0.022%, 0.024% of CaCl2addition, respectively.Different lowercase letters indicate significant difference among different curd times at 0.05 level. The same as following.图1 不同氯化钙添加量条件下凝乳过程中黏度的变化Fig.1 The change of viscosity during the skimmed milk coagulation process under different CaCl2 addition
图1-C~E表明,当钙离子浓度为0.018%、0.020%、0.022%时,两种酶体系的黏度值在凝乳0~20 min内逐渐增大,两种酶体系的黏度值有凝乳20 min时达到峰值(地衣芽孢杆菌D3.11凝乳酶体系峰值分别是3 334、3 351、3 354 mPa·s,商品酶体系峰值分别是3 340、3 348、3 342 mPa·s),凝乳20~60 min内,两种酶体系的黏度值保持稳定,变化不显著(P>0.05)。
由图1-F可知,当氯化钙添加量为0.024%时,两种酶体系的黏度值在凝乳10 min时达到最大(地衣芽孢杆菌D3.11凝乳酶为3 349 mPa·s,商品酶体系为3 353 mPa·s),当凝乳时间为20~60 min时,两种酶体系的黏度值均显著下降(P<0.05),且地衣芽孢杆菌D3.11凝乳酶体系的黏度值比商品酶体系的黏度值下降更快。
2.2 凝乳过程中浊度的变化
由图2可知,当氯化钙添加量为0.014%~0.022%时,凝乳0~20 min内两种酶体系的浊度值均随钙离子浓度的增加而增大。其中,当氯化钙添加量为0.020%时,地衣芽孢杆菌D3.11凝乳酶体系浊度值在凝乳20 min内分别增长了22.13、12.60、7.50、9.31,商品酶体系浊度值在凝乳20 min内分别增长了23.76、8.77、12.09、6.06;当氯化钙添加量为0.022%时,地衣芽孢杆菌D3.11凝乳酶体系浊度值在凝乳20 min内分别增长了24.48、9.28、10.87、9.03,商品酶体系浊度值在凝乳20 min内分别增长了28.10、8.47、8.49、6.79。这说明钙离子在促进酪蛋白组分凝聚过程中起到了促进作用[22],随着蛋白微粒凝聚体体积的增大,透过率降低,浊度值增大。
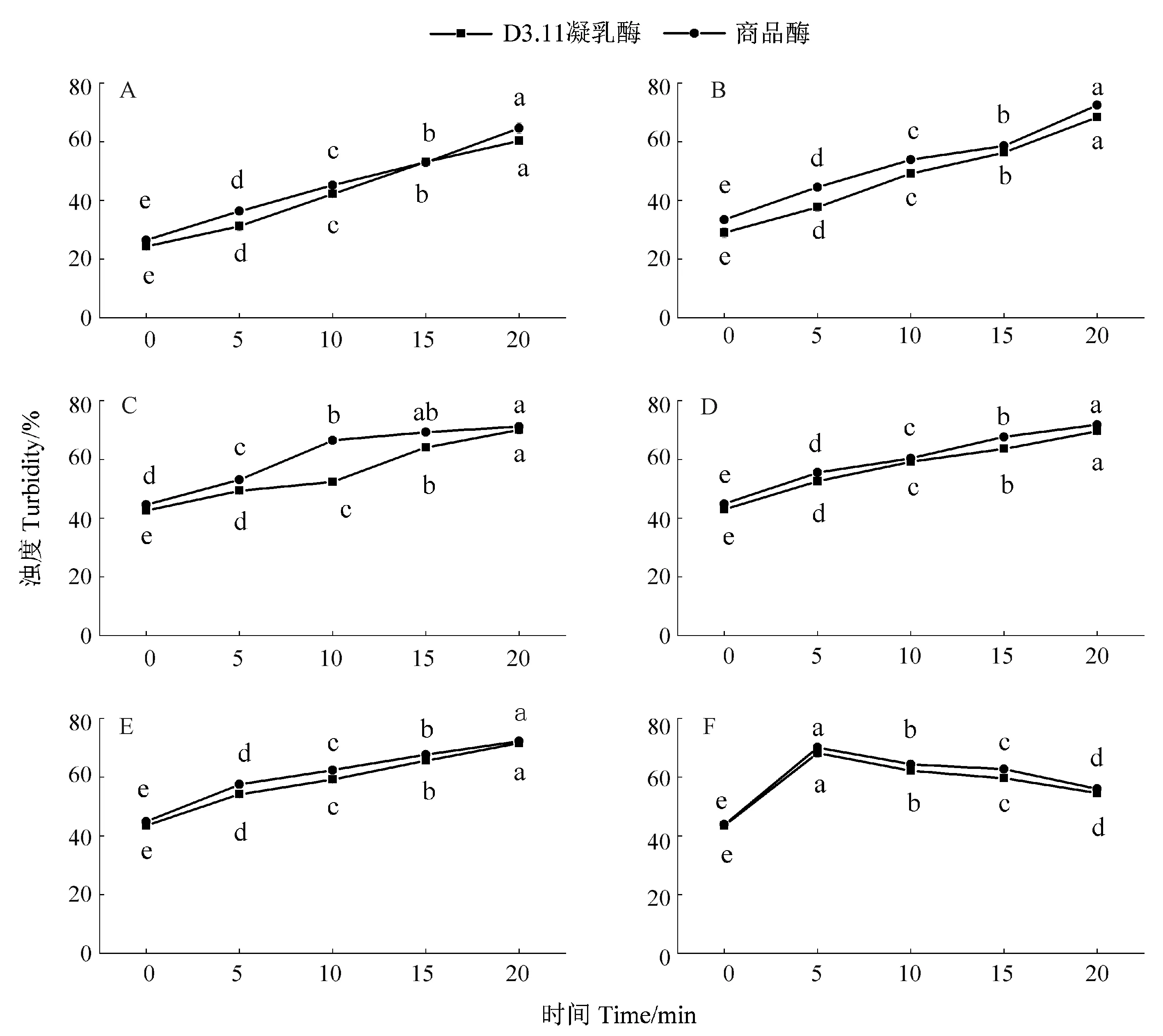
图2 不同氯化钙添加量条件下浊度的变化Fig.2 The change of turbidity under different CaCl2addition
2.3 凝乳过程中粒径的变化
由图3-A、D可知,凝乳0 min时,两种酶体系的蛋白粒径分布均呈单峰分布,且氯化钙添加量越小,峰向分布越偏向左侧。由图3-B、E可知,凝乳10 min时,两种酶体系的蛋白粒径分布以双峰为主,两种酶体系的主峰均在氯化钙添加量为0.014%时分布最左,即粒径值增长最慢;此时,商品酶体系的平均粒径较地衣芽孢杆菌凝乳酶体系的粒径更大,仍然呈现出钙离子浓度越大、体系蛋白粒径值越大的趋势,且两种酶体系的粒径变化差异较大。由图3-C、F可知,凝乳20 min时,两种酶体系的粒径分布出现多峰分布现象,但主峰明显,其中地衣芽孢杆菌D3.11凝乳酶体系的主峰主要分布在136.9~246.7 μm范围内,且当氯化钙添加量为0.020%时粒径值最大;商品酶体系的主峰主要分布在108.1~154.0 μm范围内,且当氯化钙添加量为0.022%时粒径值最大;总体来说,在凝乳0~20 min时,粒径值随氯化钙添加量的增加而增大,变化速度也随之越快。
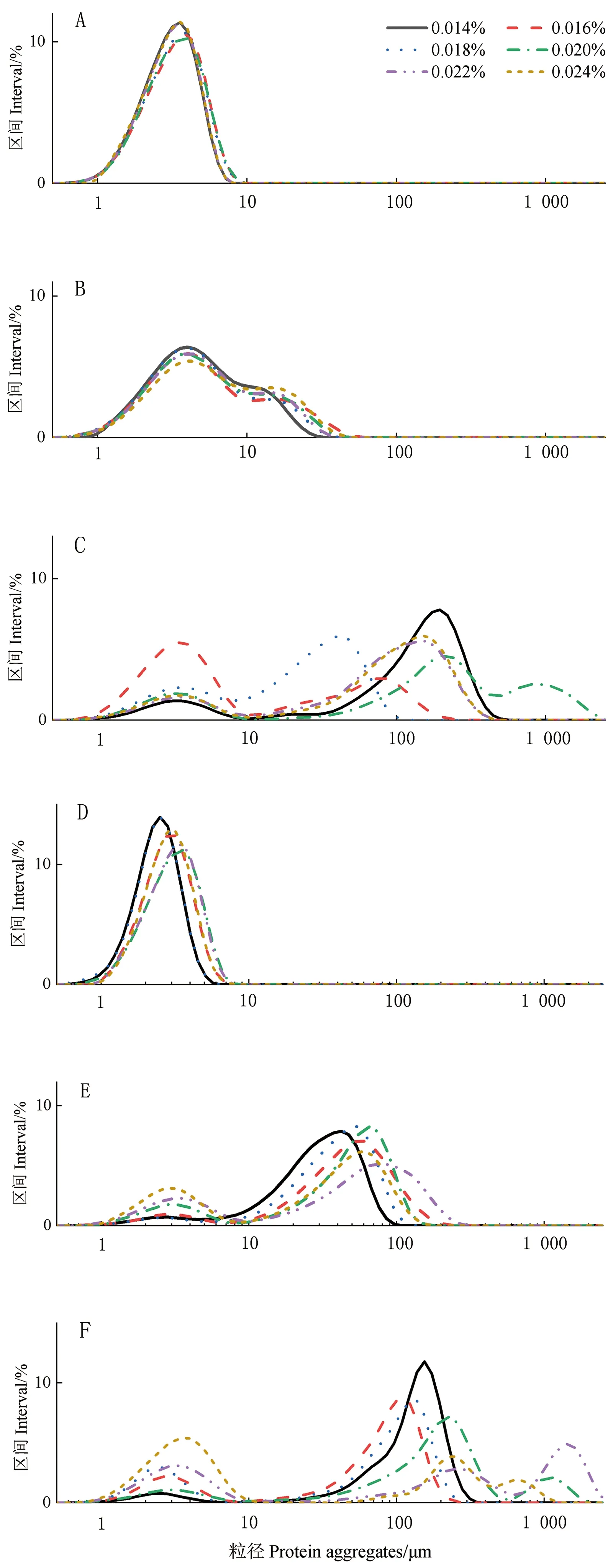
注:A、B、C分别表示地衣芽孢杆菌凝乳酶体系凝乳0、10、20 min时蛋白聚集体粒径分布;D、E、F分别表示商品酶体系凝乳0、10、20 min时蛋白聚集体粒径分布。Note: A, B and C represent the particle size distribution of protein aggregates in the Bacillus licheniformis D3.11 rennet system at 0, 10 and 20 min of coagulation, respectively. D, E and F represent the particle size distribution of protein aggregates in the commercial rennet system at 0, 10 and 20 min of coagulation, respectively.图3 不同氯化钙添加量条件下凝乳过程中蛋白聚集体粒径分布图Fig.3 Particle size distribution of protein aggregates during enzyme coagulation process under different CaCl2addition
2.4 凝乳过程中的流变学特性
储能模量的大小代表凝乳过程中凝结蛋白网络结构的强度,储能模量G′值越大,凝乳网络结构的强度越大,凝乳结构中的键合数目越多。
由图4-A可知,当氯化钙添加量分别为0.014%、0.016%、0.018%、0.020%、0.022%、0.024%时,地衣芽孢杆菌D3.11凝乳酶体系储能模量G′的峰值分别为49.51、43.27、30.21、26.96、43.81、37.86 Pa,达到峰值的时间分别是383、371、366、333、327、316 s。由图4-B可知,商品酶体系储能模量G′的峰值分别为14.16、32.54、34.42、30.07、47.56、58.27 Pa,达到峰值的时间为156、144、139、122、105、101 s。由此可知,商品酶体系达到峰值的时间依次提前了12、5、17、17、4 s,地衣芽孢杆菌D3.11凝乳酶体系达到峰值的时间依次提前了12、5、33、6、11 s,说明商品酶体系所能达到储能模量G′的峰值比地衣芽孢杆菌D3.11凝乳酶体系的更大,且两种酶体系储能模量G′到达峰值的时间均随钙离子浓度上升而缩短。综上所述,添加适宜浓度的钙离子可以促使凝乳过程中储能模量G′的增大,且随着钙离子浓度的上升,储能模量G′增大的速率也随之增大。

注:A:地衣芽孢杆菌D3.11凝乳酶体系;B:商品酶体系。Note: A : The Bacillus licheniformis D3.11 rennet system. B: The commercial rennet system.图4 不同氯化钙添加量条件下储能模量G′的变化Fig.4 The change of storage modulus inenzyme coagulation process under different CaCl2addition
2.5 持水力变化
由图5可知,0.014%、0.016%、0.018%、0.020%氯化钙添加量下,地衣芽孢杆菌D3.11凝乳酶体系的持水力分别为78.36%、86.36%、94.18%、97.09%,依次显著增加了8.00、7.82、2.91个百分点(P<0.05);商品酶体系的持水力分别为80.00%、87.09%、94.73%、97.64%,依次显著增加了7.09、7.64、2.91个百分点(P<0.05)。
当氯化钙添加量由0.022%增加到0.024%时,地衣芽孢杆菌D3.11凝乳酶体系的持水力降低了4.57个百分点,商品酶体系的持水力降低了2.93个百分点,说明当氯化钙添加量大于0.022%时,钙离子对持水力的增大有抑制作用。
2.6 乳清OD值的变化
乳清OD值是凝乳过程中排出乳清的吸光值,乳清OD值越小,表示乳清中蛋白质量分数越低。由图6可知,地衣芽孢杆菌D3.11凝乳酶和商品酶体系的乳清OD值随钙离子浓度的增大呈不断增大的趋势。当氯化钙添加量为0.014%、0.016%、0.018%、0.020%、0.022%、0.024%时,地衣芽孢杆菌D3.11凝乳酶体系的乳清OD值分别为0.263、0.367、0.377、0.383、0.394、0.446,商品酶体系的乳清OD值分别为0.251、0.321、0.362、0.377、0.382、0.412。其中,当氯化钙添加量由0.022%增加到0.024%时,钙离子对两种酶体系乳清OD值的影响最显著(P<0.05),地衣芽孢杆菌D3.11凝乳酶体系的乳清OD值增大了13.20%,商品酶体系的乳清OD值增大了7.85%。
2.7 氯化钙添加量对凝乳微观结构的影响
图7为激光共聚焦显微镜下呈现的不同氯化钙添加量条件下凝乳的微观结构,横向表示不同凝乳酶,纵向表示不同氯化钙添加量。当氯化钙添加量为0.014%时,商品酶体系形成的蛋白微粒比地衣芽孢杆菌D3.11凝乳酶体系的蛋白微粒更大,微粒间孔隙更小(图7-A、D);当氯化钙添加量为0.018%时,两种酶体系的孔隙无较大差别,蛋白凝聚好,结构致密,且商品酶体系形成的蛋白凝聚结构的孔洞更小(图7-B、E);当氯化钙添加量为0.022%时,商品酶体系形成的蛋白聚集体比地衣芽孢杆菌D3.11凝乳酶体系的蛋白聚集体更紧密,颗粒更均匀(图7-C、F)。总体来说,随着氯化钙添加量的增加,两种酶体系所呈现的蛋白聚集均凝结的更紧密,说明在一定范围内,添加适量的氯化钙对蛋白凝聚有促进作用。
3 讨论
3.1 氯化钙添加量对凝乳体系特性的影响
前人研究表明,在游离钙离子存在条件下,酪蛋白凝聚速度加快,黏度值随凝乳进程逐渐增大[23];当钙离子浓度过高时,会导致酪蛋白凝聚不彻底,质地松散,从而使黏度值下降[24]。此外,钙离子含量的增加促进了蛋白微粒的凝聚,随着凝聚体体积的增大,透过率降低,浊度值增大[25-26]。本研究发现,当氯化钙添加量大于0.022%时,两种酶体系的浊度值在凝乳5 min时先上升后减小,可能是因为钙离子浓度过高,导致蛋白微粒凝聚较快,乳清中透过率增大,浊度值缓慢减小。两种酶体系储能模量G′到达峰值的时间均随氯化钙添加量的增加而缩短,说明添加适量的氯化钙可以促使凝乳过程中储能模量G′的增大,且随着钙离子浓度的上升,储能模量G′增大的幅度也随之增大,这与倪莹宙[26]的研究结果基本一致。钙离子浓度的降低会显著减缓蛋白凝胶的形成过程,在适宜的范围内,钙离子浓度越高,酪蛋白凝聚越快,最终形成的蛋白胶束粒径也越大[10,27-28]。

注:不同小写字母表示不同氯化钙添加量之间差异显著(P<0.05)。下同。Note: Different lowercase letters indicate significant difference among different curd times at 0.05 level. The same as following.图5 不同氯化钙添加量条件下持水力的变化Fig.5 The change of water-holding capacity under different CaCl2addition

图6 不同钙离子浓度条件下乳清OD值的变化Fig.6 The change of whey OD value under different CaCl2addition

注:红色部分为被尼罗红染色的乳蛋白;黑色部分即孔隙为水相。Note: The red part is milk protein stained by Nile red. The black part is water phase.图7 不同氯化钙添加量对凝乳微观结构的影响Fig.7 Effects of different CaCl2 addition on the microstructure of curd
3.2 氯化钙添加量对乳清析出和凝块结构的影响
持水力是蛋白质凝聚过程中很重要的一个物理特性,强烈依赖于钙离子的含量,通常情况下,随着钙离子浓度的增大,乳清的析出率会上升,持水力会降低[29-31]。赵笑等[11]研究表明,当氯化钙添加量达到0.040%时,凝乳时间、黏度值和持水力的变化均不明显;当氯化钙添加量小于0.020%时,表现出的凝乳效果较好。Amaro-hernndez等[32]研究发现凝乳体系中钙离子浓度过低会导致乳清中酪蛋白聚集不彻底,透过率降低,乳清OD值增大,但若钙离子浓度过高,酪蛋白凝聚速度过快,则会造成蛋白损失,使乳清中蛋白含量增加,乳清OD值增大。这与本试验中乳清OD值的变化规律一致。通过观察微观结构发现,在一定范围内,钙离子浓度的增加有利于微观蛋白粒子的凝聚,这与Priyashantha等[8]的研究结果相似。本试验中,两种酶体系的持水力均随氯化钙添加量的增加呈先上升后下降的趋势,这可能是由于钙离子含量的增加使凝乳体系中的蛋白发生自我絮凝,乳清析出量增多,从而使得持水力下降,与Belenkaya等[33]的研究结果相近。
4 结论
本研究通过在不同氯化钙添加量条件下,对地衣芽孢杆菌D3.11凝乳酶体系的凝乳过程和凝块品质进行分析,基本掌握了氯化钙添加量影响地衣芽孢杆菌D3.11凝乳酶凝乳性能的规律。当氯化钙添加量在0.016%~0.022%时,凝乳体系的黏度、浊度均随钙离子浓度的增大而增大,粒径变化较快,达到储能模量G′峰值的时间较短。当氯化钙添加量为0.020%时,持水力达到最大,微观蛋白凝聚体均匀度最佳,凝乳效率及凝块品质均明显提高。
