浒苔多酚对肥胖小鼠血脂代谢及肠道菌群的调节作用
2022-07-04谷贵章王欣宇高兴杰杨文鸽徐大伦
邱 立 谷贵章 王欣宇 高兴杰 杨文鸽 徐大伦,*
(1 宁波大学食品与药学学院,浙江 宁波 315000;2 湖州市食品药品检验研究院,浙江 湖州 313000)
浒苔(Enteromorphaprolifera, EP)又名苔菜,是石莼科浒苔属藻类植物,因其可以食药兼用而受到亚洲国家(如中国、日本)的欢迎。浒苔具有很高的营养价值,含有人体必需的蛋白质、矿物质及维生素等[1],同时含有丰富的膳食纤维,已被开发成多种风味食品。多酚又名单宁,是一类广泛存在于植物体内的多元酚类化合物[2]。目前不断有研究者从褐藻[3]、茶叶[4]、蓝莓[5]等陆生或水生植物中提取得到多酚物质。体内体外实验均研究表明多酚具有清除体内自由基、抗肥胖、预防动脉粥样硬化等功效[2]。然而,关于浒苔多酚抗肥胖功能及作用机理多停留于蛋白及分子层面上,例如Lin等[4]与Huang等[6]分别报道浒苔多酚能调节糖脂代谢、改善胰岛素抵抗并减轻炎症反应,却鲜有基于肠道菌群及其代谢产物、肥胖以及宿主三者之间联系的报道。
随着社会节奏的加快,饮食不规律以及缺乏运动导致超重甚至肥胖人群数量呈现明显的上升趋势[7]。高脂肪饮食往往是导致肥胖的诱因,长期摄入高脂肪食物会加重肝脏的负担[8],同时也会增加罹患高血压、糖尿病和心血管疾病等慢性疾病的风险[9-10]。目前市面上有很多治疗肥胖症的药物,但都存在一定的毒副作用[11]。因此,越来越多的人开始将目光投向具有抗肥胖效果的功能性食品及天然活性成分上。
肠道菌群具有调节机体免疫及能量代谢,抵御病原菌入侵、改善修复肠道黏膜等功能[12]。肠道菌群结构的失调往往导致肥胖的发生[13],因此,肠道菌群可以作为治疗肥胖的潜在作用靶点,一方面,肠道菌群可以调节益生菌和致病菌的相对数量和组成结构来维持肠道微环境稳态[14];另一方面,肠道菌群能够产生对人体有益的短链脂肪酸(short chain fatty acids, SCFAs),发挥调节肠屏障功能,抑制炎症反应,减轻胰岛素抵抗的作用[15]。本研究拟探究浒苔多酚对高脂饮食(high fat diet, HFD)小鼠血脂及抗氧化水平的影响,同时应用分子生物学测序技术阐释浒苔多酚对肠道菌群的调控机制,以期为浒苔资源的高值化利用以及其多酚作为天然活性成分的应用提供数据支撑。
1 材料与方法
1.1 材料与试剂
野生型清洁级C57BL/6小鼠40只,雄性,体重20±2 g,购于杭州杭斯生物科技有限公司,所有试验操作都必须符合动物伦理规定及遵守相关法律规章制度。试验动物使用许可证号:SYXK(浙)2019-0005。新鲜干浒苔于2020年春季采自浙江象山地区,多酚粗提物由宁波大学食品与药学学院水产品加工与贮藏实验室制备。
低脂(对照)饲料购自上海普路腾生物科技有限公司,高脂饲料购自美国Research Diets公司。
甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、低密度脂蛋白胆固醇(lowdensity lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(highdensity lipoprotein cholesterol,HDL-C)、谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)、超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)、过氧化氢酶(catalase,CAT)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒、组织固定液,北京索莱宝科技有限公司;苏木素-伊红(hematoxylin-eosin,HE)染液、油红O染液,购于上海碧云天生物技术有限公司;二甲苯、石蜡,购于上海麦瑞尔化学技术有限公司;乙酸、丙酸、丁酸、异丁酸、戊酸、异戊酸标准品、甲酸,色谱纯,购于上海阿拉丁生化科技股份有限公司;其他化学试剂均为分析纯。
1.2 仪器与设备
BP221 S电子分析天平,北京赛多利斯科学仪器公司;Biofuge stratos 台式高速冷冻离心机,美国 Thermo Scientific 公司;SpectraMax i3 多功能酶标仪,美国 Molecular Devices 公司;DS-S24 型恒温水浴锅,上海森信实验仪器有限公司;KD-3358 生物组织切片机,浙江金华科迪仪器设备有限公司;DW-86L486 超低温冰箱,青岛海尔集团;DHG-9000 恒温干燥箱,上海合恒仪器设备有限公司;LD-5720B 冰冻切片机,沈阳恒松科技有限公司;DocuMeter pH 计,德国 Sartorius 公司;WN200 粉碎机,杭州旭众机械设备有限公司。
1.3 试验方法
1.3.1 浒苔多酚的制备以及组成成分分析 将新鲜干浒苔用粉碎机粉碎,以料液比1∶25 (mg∶mL)加入55%乙醇进行提取,超声波辅助提取,超声温度设置为45℃,时间为60 min。随后5 000 r·min-1离心10 min,收集上清液减压浓缩除去乙醇及大部分水,石油醚脱脂,冻干备用,所得浒苔多酚样品纯度为86.3%,得率为2.37 mg·g-1。参考王宸[16]的方法,采用高效液相色谱(high-performance liquid chromatography,HPLC)对EPP的化学成分进行分析。
1.3.2 动物饲养条件及试验分组 小鼠于宁波大学动物实验中心SPF级实验室饲养,温度为25±2℃,湿度为55%±5%,昼夜轮流交替,期间小鼠均能够自由进食饮水。
小鼠适应环境一星期后,随机分为4组:正常对照组(Control)、高脂对照组(high fat diets,HFD)、低剂量浒苔多酚组(lowEnteromorphaproliferapolyphenols,L-EPP)和高剂量浒苔多酚组(highEnteromorphaproliferapolyphenols,H-EPP),每组8只,其中低、高剂量浒苔多酚组分别采用100 mg·kg-1·d-1、 300 mg·kg-1·d-1的剂量对小鼠进行灌胃,每日1次,Control组和HFD组使用无菌生理盐水作为对照。试验从第1天灌胃开始共持续14周,每周1次记录小鼠的体重,同时每天观察小鼠的生理反应。第13周末,收集小鼠粪便用于肠道菌群分析,当晚所有小鼠禁食但不禁水,于第2天摘除眼球采血后通过颈椎脱臼法处死小鼠,收集小鼠的肝脏、肾脏、脾脏等器官以及白色脂肪组织(white adipose tissue, WAT)和褐色脂肪组织(brown adipose tissue, BAT)并进行称重。按公式(1)计算肝脏指数(hepatic index, HI),按式(2)计算小鼠脂肪指数(fat index, FI)。
(1)
(2)
白色脂肪组织与新鲜肝脏组织在放入液氮之前切成小块组织,置于固定液中浸泡24 h,用于后续的病理切片制作及染色。
1.3.3 血脂四项及抗氧化指标测定 小鼠血清中TC、TG、HDL-C、LDL-C、AST、ALT、MDA浓度和SOD、CAT、GSH-Px活性均按照试剂盒的说明进行检测。
1.3.4 组织切片分析 将新鲜肝脏组织在固定液中静置24 h后,用去离子水冲洗若干分钟,用预冷的切片机切下组织切片,并用油红O避光染色,在光学显微镜下观察肝脏细胞中脂滴聚集情况。
白色脂肪和肝脏组织在固定液常温浸泡24 h后,切成小块,依次进行脱水、透明、浸蜡、包埋操作。切成薄片后用恒温干燥箱烤片40 min,然后用苏木精-伊红染色,通过光学显微镜观察白色脂肪及肝脏组织的形态并拍照。
1.3.5 小鼠粪便肠道菌群分析 DNA提取和PCR扩增试验参考文献[3]的方法。
对每组样品进行质量控制后,即去除非特异性扩增序列以及嵌合体,对有97%相似度的聚成一个操作分类单元(operational taxonomic unit,OTU)。使用 QIIME(v2.0.0)对OTU进行分析。α多样性(Shannon、Simpson和Chao1)、Venn图以及主成分分析(principal component analysis, PCA)图使用R语言绘制(3.6.1)。
1.3.6 粪便中短链脂肪酸含量的测定 粪便中的脂肪酸谱通过气相色谱法测定,参考Cho等[17]的方法。
1.4 数据统计分析
数据结果以平均值±方差的形式表示,试验均重复3次。运用统计软件SPSS 25.0进行显著性分析,Prism9.0.0绘图。
2 结果与分析
2.1 浒苔多酚的组成成分及含量分析
如图1所示,采用HPLC提取到的浒苔多酚得率为2.37 mg·g-1,鉴定得到并用标品定量了7种酚类化合物,图中1~7序号所对应的物质成分依次为没食子酸(23.2)、对苯二酚(31.8)、(-)-表没食子儿茶素-3-O-没食子酸酯(491.3)、(-)-表没食子儿茶(61.8)、咖啡因(82.5)、表儿茶素-3-O-没食子酸酯(151.8)以及(-)-表儿茶素(47.7),其中表儿茶素-3-O-没食子酸酯和(-)-表没食子儿茶素-3-O-没食子酸酯是EPP中的主要多酚。
2.2 EPP对小鼠体重、脏器质量及指数的影响
体重可以直观反映肥胖程度,若肥胖高脂对照组小鼠的平均体重超过空白对照小鼠体重的20%则认为建立了肥胖模型。由表1可知,试验期间,HFD组小鼠的体重始终高于Control组以及EPP处理组,经过14周的高脂饮食诱导,HFD组小鼠平均体重是Control组小鼠体重的1.52 倍,具有极显著差异,证明肥胖模型建立成功。而经过不同剂量的EPP干预后,极显著降低了HFD组小鼠的体重,表明EPP以剂量依赖性的方式显著缓解了肥胖小鼠体重的增加,且高剂量的浒苔多酚具有更好的效果。
灌胃14周后,HFD组小鼠的结肠重量达到了0.28 g,经不同剂量的浒苔多酚干预后,极显著降低了肥胖小鼠的结肠重量。而HFD组小鼠的肝脏、白色脂肪组织和褐色脂肪组织的重量由于连续14周的高脂饮食,分别是Control组的1.26、6.19和1.23倍(P<0.01),而EPP处理组能有效控制肥胖小鼠肝脏及脂肪组织重量的增长,且剂量越高,效果越好。此外,EPP处理组能使肝脏指数(HI)和脂肪指数(FI)较HFD组有所下降,但HFD组小鼠的肝脏指数却极显著低于Control组(P<0.01),可能是由于HFD组的小鼠体重显著高于Control组所致,从而使得HFD组小鼠的肝脏指数下降。
2.3 EPP对肥胖小鼠血脂四项的影响
由图2可知,与Control组相比,HFD组小鼠的TC、TG和LDL-C浓度均极显著升高(P<0.01),HDL-C浓度极显著下降(P<0.01),出现高血脂症状;与HFD组相比,H-EPP组能够降低肥胖小鼠的TC、LDL-C、TG水平(P<0.01),升高HDL-C浓度(P<0.05),说明浒苔多酚提取物能够改善高脂饮食诱导的小鼠血脂紊乱的现象,降低罹患动脉粥样硬化的风险。
2.4 EPP对肥胖小鼠抗氧化应激的影响
血清酶ALT和AST 通常被认为是确定肝损伤程度的生化指标。如表2所示,与Control组相比,HFD喂养小鼠血清中ALT和AST活性分别显著升高了 107.7%(P<0.01)和81.5%(P<0.01),而对比HFD处理组,摄入 L-EPP和H-EPP 导致血清 ALT 活性显著降低22.1% (P<0.01)和37.4% (P<0.01),AST 活性显著降低 14.8% (P<0.01)和36.7% (P<0.01)。
由表2可知,与Control组相比,HFD组小鼠的MDA浓度极显著升高(P<0.01),SOD、GSH-Px和CAT活性极显著下降(P<0.01)。而相比HFD组,L-EPP组和H-EPP组的MDA浓度极显著降低(P<0.01),SOD、GSH-Px和CAT活性均不同程度地升高,与Control组相比也有一定程度降低。说明高脂饮食能诱发机体炎症,与此同时伴随肝脏处于氧化应激状态,而多酚结构中含有多羟基位点,浒苔多酚可以有效清除机体内的自由基起到抗氧化作用,从而缓解高脂饮食诱导的肝脏氧化损伤。
2.5 EPP对肥胖小鼠肝脏及脂肪组织形态的影响
图3为各组小鼠肝脏及脂肪组织切片的HE以及油红染色图。结果表明,Control组小鼠的肝细胞形态正常,肝核清晰可见,基本没有观察到脂肪的存在;HFD组小鼠的病理切片则显示,肝脏细胞变性,内部含有大量空泡,脂滴数目明显增多并呈堆积状;而EPP处理组脂滴数量减少且体积缩小,肝细胞脂肪轻度变性。对于脂肪细胞,相同的视野范围内HFD组细胞数目明显减小,细胞体积明显膨大;而EPP处理组能使脂肪细胞在视野范围内的数量以及体积更趋近于Control组。表明浒苔多酚能有效改善小鼠肝脏中的脂质代谢紊乱,减少肝脏中的脂滴,抑制肝脏以及脂肪细胞中脂肪的堆积。
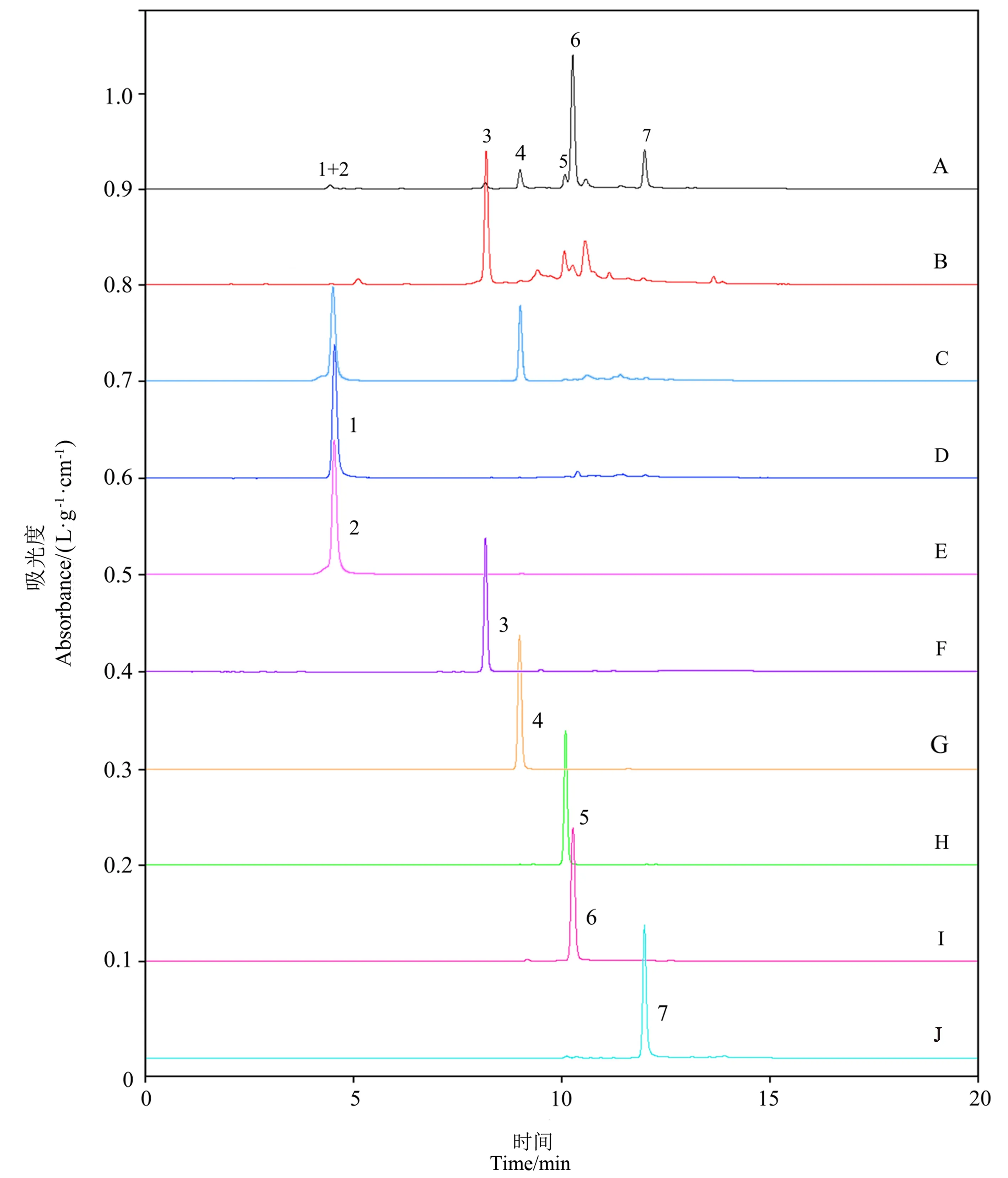
图1 EPP组成成分液相色谱图Fig.1 Liquid chromatogram of each component in the prepared EPP

表1 不同处理对小鼠脏器重量以及脏器指数的影响Table 1 Effects of different treatments on organ weight and organ index in mice

表2 不同处理对小鼠抗氧化应激的影响Table 2 Effects of different treatments on anti-oxidative stress in mice
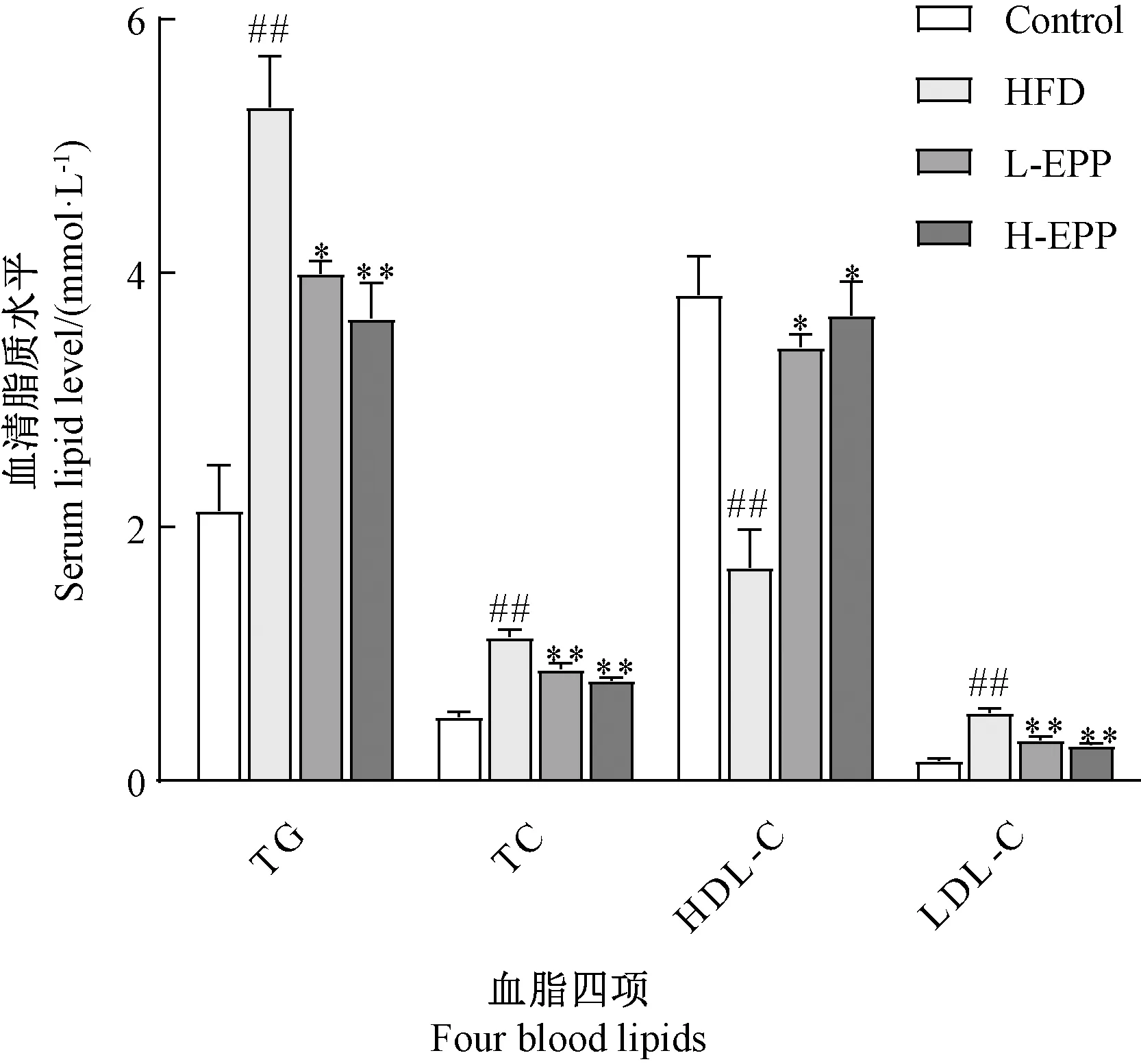
注:## 表示与Control组相比, HFD组差异极显著(P<0.01);* 表示与HFD组相比, L-EPP和H-EPP组差异显著(P<0.05);** 表示与HFD组相比,L-EPP和H-EPP组差异极显著(P<0.01)。下同。Note: ## represents that compared with the Control group, HFD group has extremely significant difference at 0.01 level. * represents that compared with the HFD group, L-EPP and H-EPP groups have significant differences at 0.05 level. ** represents that compared with the HFD group, L-EPP and H-EPP groups have extremely significant differences at 0.01 level. The same as following.图2 不同处理对小鼠血清生化指标的影响Fig.2 The effects of different treatments on the serum biochemical indicators of mice
2.6 EPP对高脂肥胖小鼠肠道菌群多样性及组成的影响
肠道菌群与脂质代谢紊乱关系密切[18]。为了研究由HFD诱导的肥胖引起的肠道菌群改变和EPP处理对肠道微生物群的影响,本试验通过16S rDNA测序方法分析膳食影响下肠道微生物多样性及组成结构的变化。Venn图可以直观地展示各组之间共享和独有的OTU数目,如图4-A所示,在小鼠接受不同剂量的EPP膳食后,OTU数目较HFD组有一定程度提高。菌群丰富度主要包括Chao1指数,而菌群多样性主要包括Shannon和Simpson指数。由表3可知,与Control组相比,HFD组的Shannon以及Chao1指数均极显著降低(P<0.01),而膳食EPP相比HFD组能有效升高Shannon与Chaol指数;但四组之间的Simpson指数差别不大。上述结果表明,补充EPP 可以有效防止HFD引起的肠道微生物群丰富度及多样性的降低。

表3 EPP对肥胖小鼠肠道菌群多样性的影响Table 3 Effect of EPP on the diversity of gut microbiota in obese mice
为比较微生物群落之间的差异,本试验计算了β多样性并进行主成分分析。由图4-B可知,Control组、HFD组与EPP处理组之间两两分开聚集且差异明显,说明不同的膳食成分会影响肠道微生物群的组成结构。
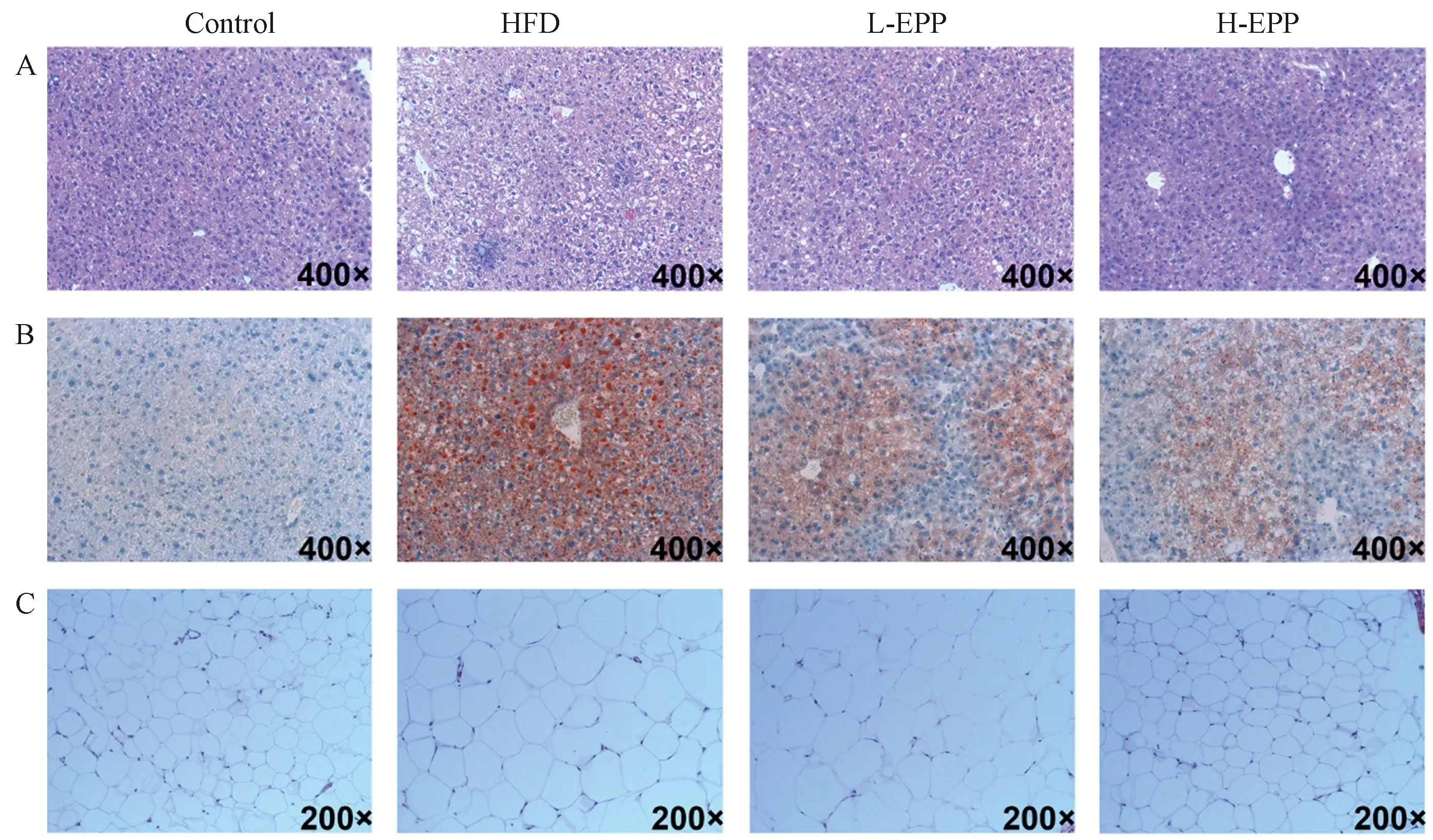
注: A:各组小鼠肝脏苏木精-伊红染色图; B:各组小鼠肝脏油红染色图; C:各组小鼠白色脂肪组织苏木精-伊红染色图。Note: A: Hematoxylin eosin staining of mice liver in each group. B: Oil red staining of mice liver in each group. C: Hematoxylin eosin staining of white adipose tissue of mice in each group.图3 小鼠肝脏及脂肪组织病理切片观察Fig.3 Histological observation of liver and adipose tissue in mice
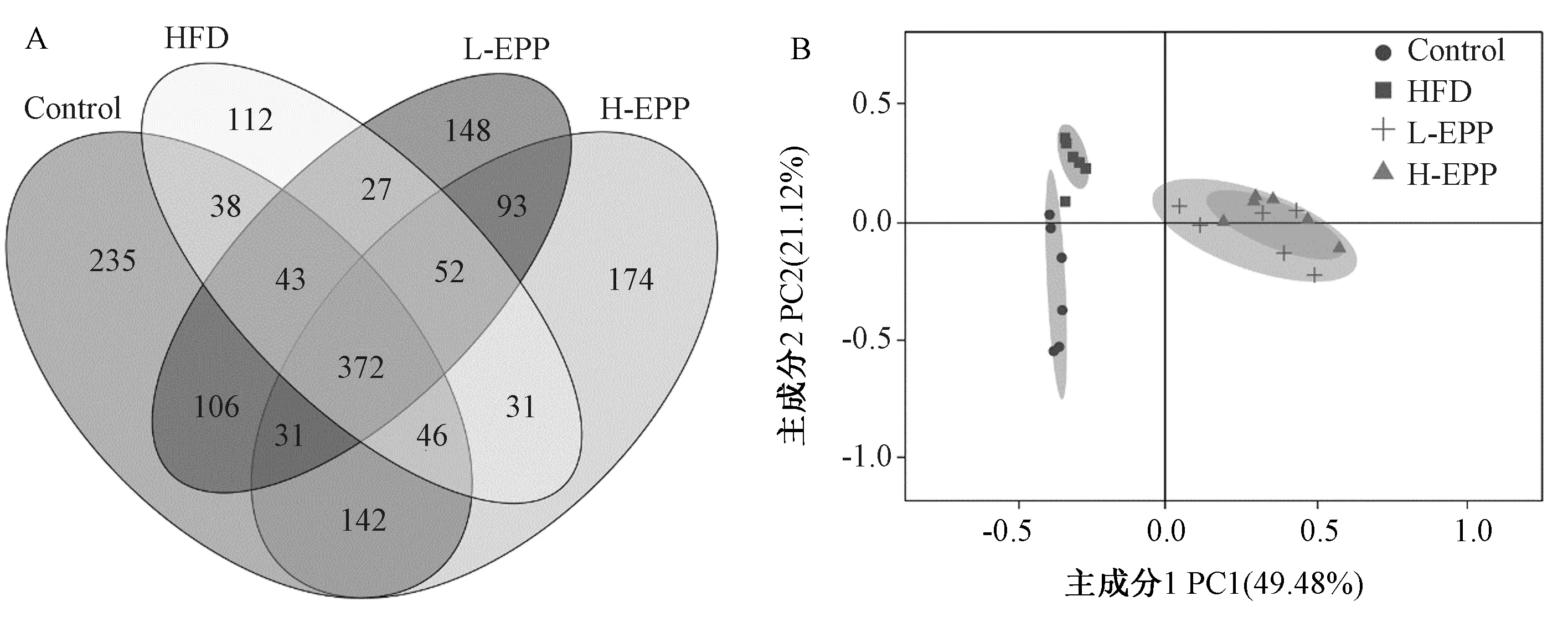
注:A: Venn图; B: 主成分分析。Note: A: Venn diagram. B: Principal component analysis.图4 EPP对肥胖小鼠肠道菌群多样性的影响Fig.4 Effect of EPP on the diversity of gut microbiota in obese mice
为进一步评估4组肠道微生物群的组成变化,本试验进行了不同水平的分类学分析。如表4所示,在门水平上,相较于Control组,HFD组中小鼠粪便中厚壁菌门(Firmicutes)的相对丰度以及F/B比值极显著升高(P<0.01),变形菌门(Proteobacteria)的相对丰度显著升高(P<0.05),拟杆菌门(Bacteroidetes)的相对丰度极显著降低(P<0.01)。EPP处理抑制了Firmicutes与Proteobacteria丰度的增加和Bacteroidetes丰度以及F/B比值的减少,使各种菌群的相对丰度更接近于Control组。
随后对各组小鼠粪便中的肠道微生物在属水平上进行分析,如表5所示。相比Control组,HFD组增加了瘤胃球菌属(Ruminococcaceae)与颤螺菌属(Oscillospira)的相对丰度,降低了副拟杆菌属(Parabacteroides)的相对丰度,而膳食EPP减轻了高脂饮食对特定菌群数量的不利影响,说明浒苔多酚能够调节肥胖小鼠肠道菌群在属水平上的组成结构。
2.7 EPP对高脂肥胖小鼠粪便中短链脂肪酸含量的影响
由表6可知,相较于Control组,HFD组小鼠粪便中各短链脂肪酸以及总酸含量均极显著下降(P<0.01),而高剂量的浒苔多酚与HFD组相比均能在一定程度上使各短链脂肪酸及总酸含量升高,但低剂量的浒苔多酚却出现相反的趋势,可能是由于低剂量的浒苔多酚还不足以使肠道菌群充分分解代谢膳食中的营养成分所致,从而减少了短链脂肪酸的生成。
3 讨论
脂质代谢异常通常被认为是肥胖的重要原因之一。当机体长期摄入高脂肪食物,便会导致血清中TC、TG和LDL-C含量增加[19]。在本研究中,高脂肥胖小鼠经浒苔多酚灌胃后,与HFD组相比,EPP处理组小鼠血清中TC、TG和LDL-C含量降低,HDL-C含量升高,与Cao等[20]和Wang等[19]分别在藜麦多糖和核桃青壳多糖中得出的结论相一致,说明膳食功能成分可在一定程度上调节高脂肥胖小鼠的体内血脂水平。ALT和AST是评价肝功能的两个重要指标,当肝细胞发生炎症和损伤时会导致血清中ALT和AST水平升高[21]; MDA 作为脂质过氧化的终产物,可以反映细胞损伤和脂质过氧化程度。Li等[22]发现膳食组氨酸往往伴随较低的肥胖患病率,而相较于肥胖人群,膳食组氨酸的人群血液中的GSH-Px、 SOD活性较低,MDA浓度则较高;朱晓玉[23]研究了甜菜碱对高脂饮食肥胖小鼠脂代谢的影响及其作用机理,发现与高脂饮食组对比,膳食甜菜碱的老鼠抗氧化能力提高,脂质过氧化减轻,这与其肝脏组织中含有较高的SOD和较低的MDA水平密不可分。本研究中HFD组小鼠相较于Control组可显著降低SOD、GSH-Px和CAT活性,升高ALT、AST和MDA浓度,说明高脂肥胖小鼠正处于氧化应激状态;而EPP的干预则能逆转这些指标并使其恢复至正常水平,说明EPP作为酚类化合物可间接抑制氧化应激引起的肝脏损伤。
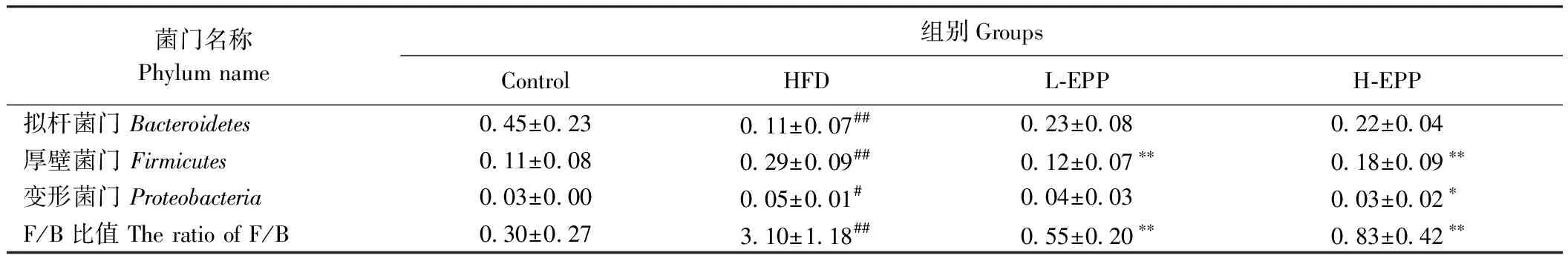
表4 EPP处理对肠道微生物门水平上相对丰度和F/B比值的影响Table 4 Effect of EPP treatment on relative abundance and F/B ratio in the phylum level of intestinal microbiota /%

表5 EPP处理对肠道微生物属水平上的影响Table 5 Effect of EPP treatment on the genes level of intestinal microbiota /%

表6 EPP处理对肥胖小鼠粪便中SCFAs的影响Table 6 Effects of EPP treatment on SCFAs in feces of obese mice /(mg·kg-1)
利用膳食多酚调节肠道微生物群具有预防肥胖发展的潜力,这可能归因于多方面因素,如肠道微生物群的多酚代谢物和特定菌群对肠道屏障功能的改善作用等[24]。Firmicutes与Bacteroidetes相对比值(F/B)可以作为生物标志物用于反映肠道菌群紊乱的程度,本研究发现,EPP组抑制了由高脂饮食诱导的HFD组F/B的上升,与前人研究结果一致[13,25]。作为肠道微生态失调的另一个潜在生物标志物,变形菌门相对丰度的增加与代谢紊乱和炎症有关[26]。H-EPP组显著降低了变形菌门的相对丰度,表明EPP可能通过减少该菌门丰度的方式发挥预防肥胖的作用。然而,这与文献报道的HFD喂养的小鼠粪便中变形菌门的丰度比健康组低的结论存在矛盾[27],推测肠道中的变形菌门在肠道代谢中具有更复杂的功能,变形菌门的代谢作用仍有待进一步了解。
本研究进一步在属水平上筛选出5个菌属,发现拟杆菌属、阿克曼菌属和副拟杆菌属在EPP处理组中富集,而颤螺菌属与瘤胃球菌属在HFD组中含量丰富。Wu等[28]用活菌Parabacteroides喂食高脂诱导的小鼠,发现其通过增加脂肪组织产热、增强肠道完整性以及降低炎症和胰岛素抵抗水平等途径减轻了小鼠的肥胖症状。早期研究发现,Oscillospira与Ruminococcaceae的相对丰度与肥胖及其相关的代谢紊乱呈正相关性,认为蘑菇多酚通过减少上述两种菌属的数量,减轻了高脂饮食诱导的肥胖小鼠的高血糖、肝脂肪变性和炎症症状[16]。而本研究发现,EPP上调了HFD组小鼠粪便中Bacteroides、Akkermansia和Parabacteroides益生菌的丰度,下调了Oscillospira与Ruminococcaceae条件致病菌的丰度,推测浒苔多酚抗肥胖的原因之一与其改变这些特定菌门或菌属的丰度有关。
短链脂肪酸通过为肠上皮细胞提供能量并增加粘蛋白的产生而改善肠屏障功能[29]。本研究发现,高剂量的浒苔多酚能增加肥胖小鼠粪便中各短链脂肪酸及其总酸的含量,由于高剂量组的浒苔多酚能促使Bacteroides与Akkermansia等益生菌的增殖,而这些益生菌又是产生SCFAs的巨大贡献菌,推测浒苔多酚进入肠道后被肠道菌群利用,通过上调某些特定的产酸菌的丰度促进SCFAs 的分泌可能是其抗肥胖的又一重要原因。
4 结论
浒苔多酚(EPP)具有改善小鼠肥胖症状,以及调节肠道菌群的作用。摄入不同剂量的浒苔多酚可以缓解高血脂症,并在一定程度上有效改善肝脏氧化应激带来的损伤,提高肝脏抗氧化水平,减少脂滴在脂肪细胞中的累积。同时,浒苔多酚能够提高肥胖小鼠的肠道菌群多样性,通过增加产酸的有益菌属和减少有害菌属的相对丰度使肥胖小鼠的肠道菌群发生有利改变。另外,浒苔多酚能够通过增加肥胖小鼠粪便中短链脂肪酸的含量,来调节肠道微环境,改善肥胖引起的肠道代谢紊乱。研究证实浒苔多酚作为海洋藻类浒苔的功能性成分,可以发挥抗肥胖作用。
