矮紧型、抗病同源四倍体不结球白菜矮桩秋冠新材料创制
2022-07-04王新雅陈文丽李竹帛侯喜林柳李旺刘同坤
王新雅 陈文丽 李竹帛 杨 阳 侯喜林 柳李旺 刘同坤,*
(1 南京农业大学作物遗传与种质创新国家重点实验室/农业部华东地区园艺作物生物学与种质创制重点实验室/南京农业大学园艺学院,江苏 南京 210095;2 南京理想农业科技有限公司,江苏 南京 210095)
不结球白菜(Brassicacampastrisssp.chinensisMakino)属十字花科芸薹属白菜亚种中的变种,原产于我国,品种繁多,主要在长江中下游地区种植,因其生长周期短、品质好,富含可溶性糖、可溶性蛋白、有机酸、氨基酸及人体所需的微量元素,受到人们的广泛喜爱,在长江中下游的年均消费量约占全年蔬菜总产量的1/3[1]。近年来,北方地区也大量引进种植不结球白菜,目前不结球白菜在我国蔬菜的周年供应中占有重要地位,不结球白菜的多倍体育种为不结球白菜种质创新和新品种培育奠定了基础。
蔬菜多倍体育种已有80余年的历史[2]。多倍体植物的成功诱变,为我国蔬菜作物的生产与发展提供了一条全新的途径。多倍体育种也是提高植物营养品质、增强抗逆性的有效方法之一[2]。多倍体植物抗逆性强、综合性状优良,使得多倍体育种变得越来越重要[3]。在生产和试验中,多倍体的诱导方法主要包括物理方法、化学方法和生物方法。但由于诱变效果普遍偏低,物理方法诱导已经完全被化学方法诱导所取代[4]。化学方法诱导主要包括秋水仙素和其他植物激素处理。秋水仙素因其诱变效果较好、操作简单、处理方法多样、成本低,在植物育种中广泛用于诱导多倍体,是最常用的化学诱变试剂[5]。近年来,秋水仙素已成功诱导出欧洲温室黄瓜[6]、矮牵牛[7]、油菜[8]、甜叶菊[9]、青花菜[10]和不结球白菜六合矮脚黄[11]等多种植物的多倍体植株。前人研究用浓度为0.2%的秋水仙素分别处理豇豆子叶生长点[12]、二倍体萝卜满堂红子叶生长点、二倍体不结球白菜超华一号茎尖生长点[13]和二倍体萝卜小顶红子叶生长点[14],已成功诱导出多倍体植株,诱变率分别为2.809%、4.79%、6.44%和4.76%。
多倍体鉴定的常用方法包括形态学鉴定、解剖学鉴定、细胞学鉴定、流式细胞仪鉴定等。形态学和解剖学鉴定能够初步筛选出疑似四倍体植株;染色体计数和流式细胞术是测定植物倍性水平的常规方法[15]。流式细胞术(flow cytometry,FCM)是近年来新兴的检测技术,通过使用流式细胞仪检测细胞核DNA含量,经计算机统计分析,绘制分布曲线图[16]。流式细胞术效率高、速度快、准确度高、重复性好,目前已通过该方法在百合[17]、草莓[18]、中华猕猴桃[19]等植物上成功鉴定出同源四倍体植株,但是不同植物品种利用流式细胞仪鉴定植株倍性时,在处理方法上会有所不同[20]。
矮桩秋冠是十字花科不结球白菜中的一个优良品种,叶片肥厚,植株矮壮,开展度较大,具有丰富的营养价值。四倍体植株相较于二倍体普遍具有巨大性,品质更高,抗病能力更强。作为以叶、茎为食用部位的蔬菜,不结球白菜四倍体植株能够提高其产量和商业价值。鉴于此,本研究利用秋水仙素处理矮桩秋冠二倍体植株,通过形态学、解剖学、细胞学特征和使用流式细胞仪进行鉴定,并对筛选出的四倍体植株进行农艺性状统计及营养品质鉴定,以期获得优质同源四倍体植株,进一步提高矮桩秋冠的营养价值和经济价值。
1 材料与方法
1.1 试验材料
本试验采用的材料为不结球白菜二倍体品种矮桩秋冠(2n=2X=20)多代自交系,由南京农业大学园艺学院白菜系统生物学实验室提供。试验于2019年9月—2020年11月在江苏省镇江市句容农博园试验基地进行。
1.2 同源四倍体不结球白菜诱导方法
本试验使用浓度为0.2%秋水仙素溶液,采用点滴的方式对二倍体植株子叶期生长点进行处理。于子叶出土后每日上午9点与下午5点分别进行1次处理,共进行5次处理,每次处理秋水仙素溶液剂量为20 μL,以蒸馏水作为对照。
1.3 多倍体的鉴定方法
1.3.1 形态学鉴定 在植株成熟后,以二倍体植株为对照,在同一时间观察诱变植株叶片、花器官、种子、植株高度等形态学性状[21],对诱变植株进行初步的筛选。
1.3.2 解剖学鉴定 以气孔和花粉粒的大小、形状为依据,气孔鉴定:选取疑似四倍体植株的完全展开叶,避开叶脉,撕取叶片下表皮,在光学显微镜(DM6B,Leica)下进行观察,并对气孔进行拍照。花粉粒鉴定:以二倍体花粉粒为参照,在显微镜下进行大小和形状的比较,多倍体花粉粒多呈现不规则形状[22],观察疑似植株花粉粒是否在大小和形态上与对照植株存在差异。
1.3.3 细胞学鉴定 将收取的疑似同源四倍体植株的种子进行催芽。将种子放置在铺有2层滤纸的培养皿中,25℃恒温条件下进行催芽。待种子根尖生长至1~2 cm时,将根尖切下放置在1.5 mL离心管中,冰水混合物预处理24 h后,卡诺试剂(无水乙醇∶冰醋酸为3∶1)固定24 h,随后取出根尖放入蒸馏水中洗净固定液。使用1 mol·L-1盐酸在60℃条件下解离3~5 min,切取1~2 mm根尖制片,卡宝品红染液染色10 min后,在显微镜下观察并对染色体进行拍照[23]。
1.3.4 流式细胞仪倍性分析 采用流式细胞仪对细胞核内的DNA相对含量进行测定。从矮桩秋冠疑似植株上取0.1 g新鲜幼嫩叶片放置于预冷的玻璃培养皿中,加入1 mL解离液(200 mmol·L-1Tris,4 mmol·L-1MgCl2·6H2O,0.5% (v/v) TritonX-100,pH值7.5),用预冷的刀片快速切碎,300目网过滤至1.5 mL离心管中,冰上孵育15 min,离心(4℃,4 000 r·min-1) 5 min,弃上清。重复3~5次,直至沉淀由绿色变为白色。加入染色液(0.5 mL Tris-MgCl2,10 μL RNase,7 μL碘化丙啶)混合均匀,4℃避光放置15 min后上机检测[24]。
1.4 二、四倍体矮桩秋冠的农艺性状统计及营养品质测定
1.4.1 农艺性状统计 将鉴定为同源四倍体的植株M0代蕾期单株套袋,自交授粉,单株收种。将M1代种子与对照组种子同时播种。各随机选取10株二、四倍体矮桩秋冠植株进行株高、单株质量、单叶质量、十叶厚、全株叶数、叶长、叶宽、叶柄长、叶柄宽、叶柄厚等农艺性状的统计。
1.4.2 营养品质测定 各随机选取3株二、四倍体矮桩秋冠植株同一部位的叶片,测定可溶性糖、可溶性蛋白、叶绿素、游离氨基酸、硝态氮以及纤维素含量等营养指标。可溶性糖含量测定采用蒽酮比色法使用MB-C-B602植物可溶性糖含量测试盒(迈博生物,广州);可溶性蛋白含量测定参考青格尔等[25]采用考马斯亮蓝G-250染色法;叶绿素含量测定参考甘勇辉等[26]采用乙醇提取比色法;有机酸测定参考肖平等[27]采用NaOH滴定法;硝态氮含量测定参考郭芸珲等[28]采用硝基水杨酸比色法;纤维素含量测定使用CLL-2-Y纤维素含量测试盒(科铭生物,苏州)测定。
1.5 光合特性分析
于晴天上午9:00—11:00,采用Li-6400便携式光合仪(北京力高泰科技有限公司)对光响应曲线进行测定,设定CO2浓度为400 μmol·mol-1,测定其在0、20、50、100、150、250、500、750、1 000、1 200、1 500、2 000 μmol·m-2·s-1光强下单位面积净光合速率(net photosynthetic rate, Pn)、蒸腾速率(transpiration rate Tr)、气孔导度(stomatal conductivity, Gs)、胞间CO2浓度(intercellular CO2concentration, Ci),每个光强下停留2~3 min,分别测定3个叶片,作3次重复。根据回归方程分别求出光饱和点(light saturation point, LSP)、光补偿点(light compensation point, LCP)、最大净光合速率(maximum net photosynthetic rate,Pmax)、表观量子效率(apparent quantum efficiency, AQY)、暗呼吸速率(dark breathing rate, Rday)等光合指标[29]。

注:A:植株;B:叶片;C:花器官;D:种子;E、F:气孔;G:荚果;H、I:花粉。Note: A: Plant. B: Leaf. C: Floral organ. D: Seed. E、F: Stomata. G: Silique. H、I: Pollen.图1 二、四倍体不结球白菜差异对比Fig.1 Comparison of tetraploid and diploid plants of non-heading Chinese cabbage
1.6 二、四倍体矮桩秋冠的抗病性测定
将菌种接种在V8固体培养基(36% V8果汁,2% 琼脂,0.2% CaCO3)上进行继代培养,20~25℃恒温避光条件下培养7~14 d。待培养皿内长满孢子后,用组培刀将菌丝刮下置于重悬液(1%蛋白胨,4%麦芽糖)中,剧烈震荡以释放孢子,再用纱布过滤出孢子,采用血球计数板调节孢子浓度至1×107个·mL-1。离体接种叶片时,将孢子悬浮液均匀点斑在叶片上,每个叶片2个斑,体积为10 μL,接种后的叶片放置于含有滤纸的培养皿中,12 h/12 h光暗交替、光强为400 μmol·m-2·s-1、 25℃恒温培养箱中培养3 d,观察叶片发病情况。于接种3 d后,以二倍体矮桩秋冠为对照组,四倍体矮桩秋冠为试验组,取对照组和试验组叶片病斑周围1 cm内健康的组织,于-80℃条件下保存待测。采用实时荧光定量PCR 检测受灰霉菌侵染的二倍体、四倍体矮桩秋冠中Botrytiscinereaactin的表达情况。每个处理设置3次重复。
1.7 数据分析
数据利用Excel 2019对所得数据进行整理,采用SPSS 20软件对数据进行分析。
2 结果与分析
2.1 形态学与解剖学鉴定分析
如图1所示,以二倍体为对照,同源四倍体植株开展度变小(图1-A);叶片变小、皱缩,叶色变浅,叶柄变短(图1-B);花瓣、雄蕊、柱头、花萼相较于二倍体有所变大(图1-C);种子直径增大(图1-D);显微镜观察发现,同源四倍体气孔孔径变大、保卫细胞体积变大且单位面积密度变小(图1-E、F);种荚更为膨胀粗大(图1-G);二倍体花粉粒呈规则的棒状,而同源四倍体的花粉粒呈现棒状、矩形、菱形等多种不规则形状(图1-H、I)。
2.2 细胞学鉴定分析
取部分通过形态学和解剖学鉴定的疑似四倍体植株的种子进行催芽,在显微镜下观察根尖细胞染色体数目,如图2所示。二倍体染色体为2n=2X=20条,同源四倍体植株根尖染色体为2n=4X=40条证明本试验成功诱变出同源四倍体矮桩秋冠植株,并成功收获同源四倍体植株的种子。
2.3 流式细胞仪鉴定分析
由图3可知,二倍体细胞核内的DNA相对含量峰值在50处,同源四倍体相对含量峰值在100处,为二倍体的2倍,通过流式细胞仪鉴定结果可再次确定细胞核内的DNA相对含量峰值在100处的植株为四倍体植株。
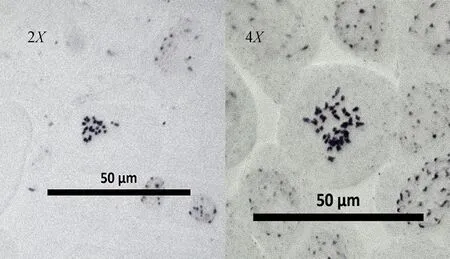
图2 二、四倍体不结球白菜细胞学鉴定结果Fig.2 The cytological identification of diploid and tetraploid non-heading cabbage
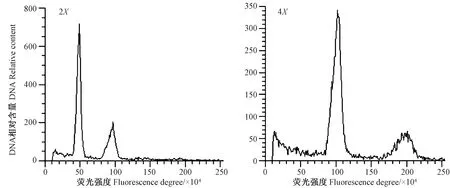
图3 二(左)、四(右)倍体不结球白菜流式细胞仪鉴定结果Fig.3 Identification results of diploid(left)and tetraploid (right) non-heading Chinese cabbage by flow cytometry
2.4 二、四倍体矮桩秋冠农艺性状测定
由表1可知,四倍体植株的单叶质量、十叶厚分别比二倍体植株提高了13.71%、40.36%,有极显著差异;四倍体植株的叶片数、叶宽、单株质量、叶柄厚、叶柄宽、株高、叶长、叶柄长分别比二倍体降低了1.32%、8.15%、11.03%、12.35%、15.56%、25.47%、37.82%、39.97%,其中株高、叶长、叶柄长有极显著差异。
2.5 二、四倍体矮桩秋冠营养品质鉴定
由表2可知,四倍体矮桩秋冠可溶性糖、纤维素、叶绿素四倍体植株分别比二倍体植株降低了26.98%、43.48%、45.95%,其中纤维素含量和叶绿素总浓度有极显著差异;硝态氮、可溶性蛋白、氨基酸含量分别比二倍体植株提高了0.47%、9.90%、14.16%,其中氨基酸有显著差异。
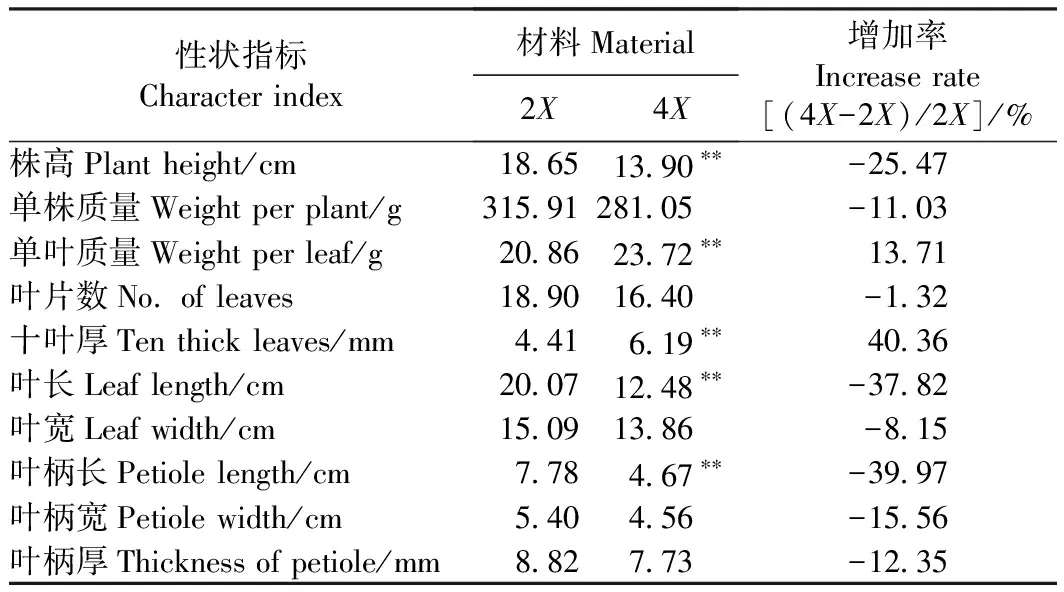
表1 二、四倍体植株主要农艺学性状比较Table 1 Comparison of main agronomic traits of diploid and tetraploid plants
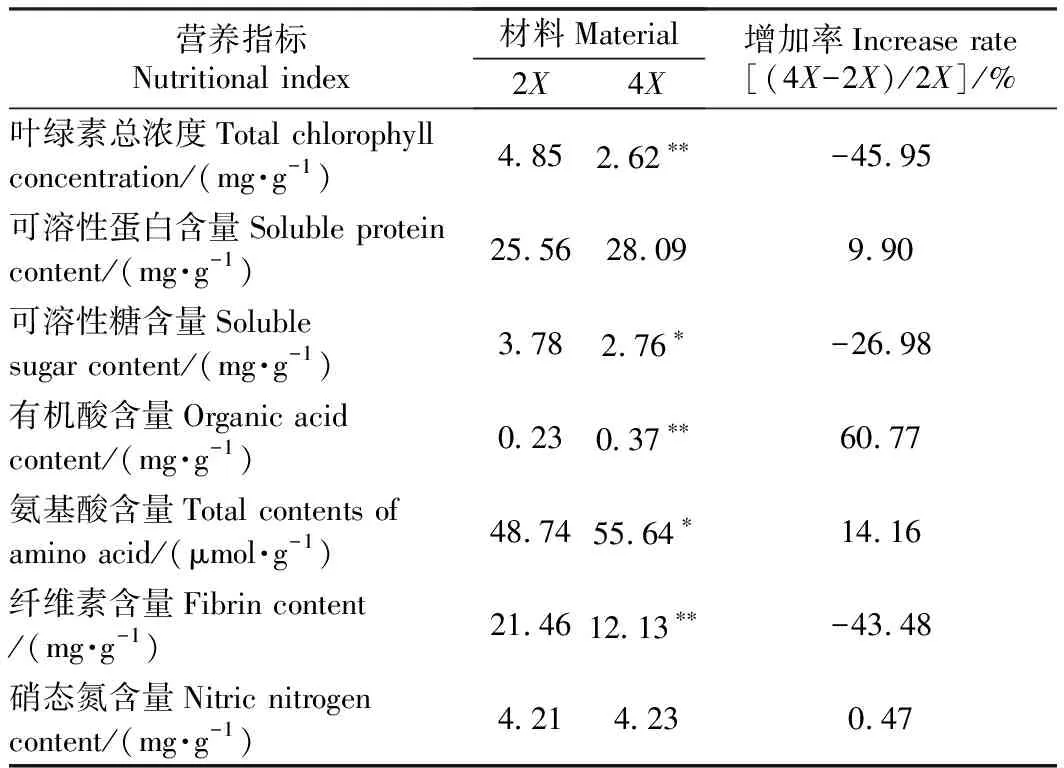
表2 二、四倍体矮桩秋冠营养品质的比较Table 2 Comparison of content of nutritional substance between diploid and tetraploid non-heading cabbage
2.6 二、四倍体矮桩秋冠的光合特性分析
如图4所示,四倍体矮桩秋冠的光合速率对光强升高的响应明显高于二倍体,且在高光强下表现出更高的净光合速率,说明四倍体的光合作用效率大于二倍体(图4-A)。相同光强下,四倍体植株叶片气孔导度明显大于二倍体,说明四倍体矮桩秋冠比二倍体具有更强的气体交换能力(图4-B)。四倍体植株蒸腾速率明显高于二倍体,再次说明在强光下四倍体的气体交换能力更强(图4-C)。同一光强下,四倍体胞间CO2浓度高于二倍体,与四倍体光合作用强于二倍体的结果一致(图4-D)。由表3可知,四倍体的LSP、AQY、Rday、Pmax分别比二倍体增加10.72%、16.07%、14.09%、29.19%,LCP比二倍体降低1.11%,其中AQY有显著差异,LSP、Rday、Pmax、LCP具有极显著差异。说明四倍体矮桩秋冠植株对光强升高的响应以及光合作用能力均强于二倍体植株。
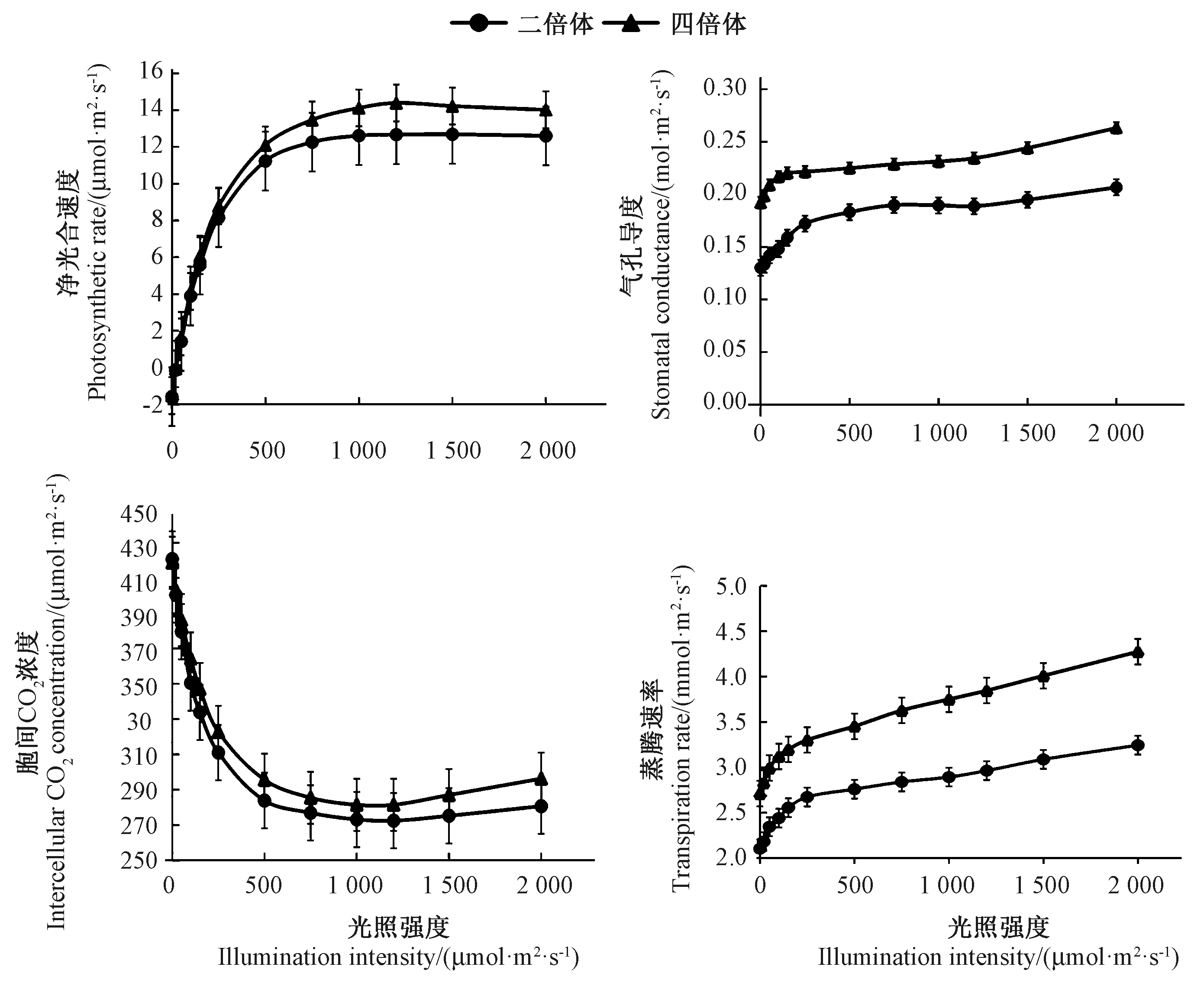
图4 二、四倍体植株光合特性比较分析Fig.4 Comparative analysis of photosynthetic characteristics of diploid and tetraploid non-heading Chinese cabbage

表3 二、四倍体的光响应曲线参数的比较Table 3 Comparison of the parameters of response curves of diploid and tetraploid plants
2.7 二、四倍体矮桩秋冠抗病测定
采用实时荧光定量PCR检测受灰霉菌侵染的二倍体、四倍体矮桩秋冠中B.cinereaactin的表达情况并观察二、四倍体不结球白菜叶片受到灰霉菌侵染时的表型性状。表型结果如图5所示,对比二、四倍体不结球白菜叶片受到灰霉菌侵染时的表型图,四倍体叶片症状明显轻于二倍体。B.cinereaactin在二倍体、四倍体中均有表达,但四倍体叶片的表达量低于二倍体(图6)。

图5 二、四倍体不结球白菜叶片受到灰霉菌侵染时的表型图Fig.5 Phenotype of diploid and tetraploid non-heading Chinese cabbage leaves infected by Botrytis cinerea
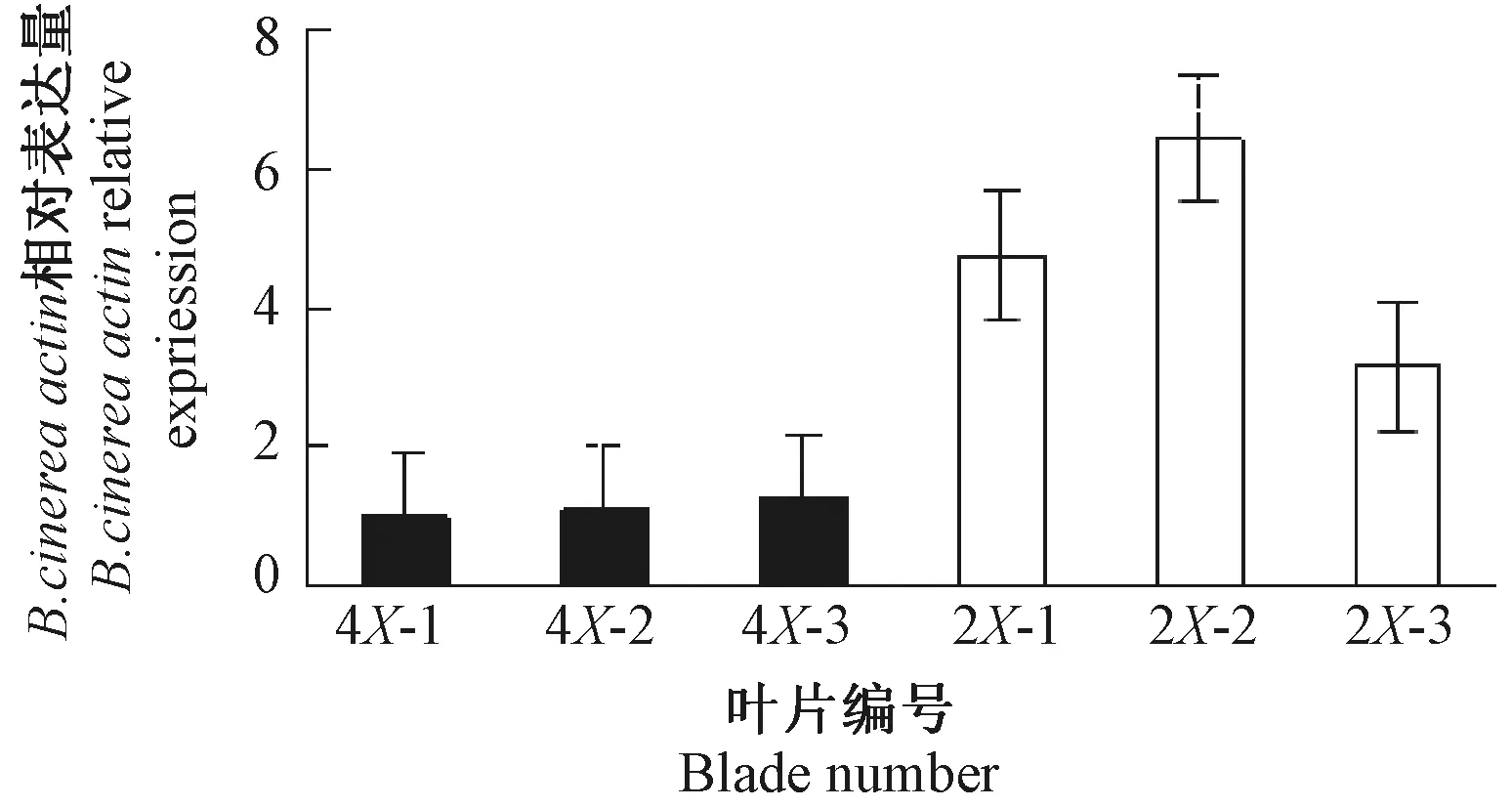
图6 二、四倍体不结球白菜受到灰霉菌侵染时B.cinerea actin在叶片中的定量表达Fig.6 Quantitative expression of B.cinerea actin in the leaves of diploid and tetraploid non-heading Chinese cabbage infected by Botrytis cinerea
3 讨论
多倍体植株在园艺生产中普遍比二倍体植株具有更高的营养品质、产量和抗逆性,目前诱导植物多倍化已经在多种植物中得到广泛应用。前人研究发现,多倍体植株在外观形态上多出现巨大化现象,但不是所有的四倍体都会产生此现象。刘惠吉等[30]选育出的南农矮脚黄四倍体植株表现出多倍体的巨大性,两年的增产率达到22.6%和22.4%;但是袁建民等[31]诱导的四倍体小果型西瓜株型矮小紧凑,叶片肥厚,叶色深绿;何立珍等[32]诱导的同源四倍体黄花菜植株生长势强植株矮小,茎部增粗;张晓曼等[33]诱导的同源四倍体田埂报春植株变矮,叶片变大变厚。本研究中,农艺性状调查结果显示,四倍体植株的株高没有出现巨大化现象,叶面积变小、叶片肥厚,整体株型矮小紧凑,单位面积产量有所提高,四倍体植株叶色变浅,与前人研究结果基本一致。营养品质测定结果显示,相较于二倍体,四倍体植株的氨基酸、有机酸、可溶性蛋白含量增加,叶绿素、可溶性糖、纤维素含量降低,说明四倍体部分营养品质提高,且食用口感较好,说明四倍体植株在食用价值方面有所提高。
光合作用是植物进行物质积累与生理代谢的基础,其效率的高低与产量潜力发挥以及品质优劣密切相关。因此研究作物的光合作用对农业育种工作具有重要意义[34]。植物光合能力影响植物对光的适应能力,通过光强-光合响应曲线分析比较二、四倍体的叶片光合生理特性,曲线拟合计算出的相关参数,进一步反映植物在不同光照条件下的适应能力[35]。本试验通过分析比较二、四倍体的光合特性发现,四倍体矮桩秋冠植株对光强升高的响应强于二倍体植株,四倍体拥有更强的光合作用能力,有利于干物质的积累。四倍体植株的LSP、AQY、Rday、Pmax均高于二倍体,LCP低于二倍体。研究中使用植物LSP和LCP作为植物对光环境适应能力的判断依据,其中LSP较高、LCP较低的植物对光环境具有更强的适应能力[36],结合本研究结果说明诱导后的不结球白菜四倍体的光合性能优于二倍体。染色体加倍可能导致多倍体植物的抗逆性增强[37]。本试验通过分析二、四倍体对灰霉菌侵染的抵抗能力发现,相比于二倍体,四倍体植株具有更强的抗逆性,说明四倍体具有更好的环境适应能力。秋水仙诱导产生的同源四倍体矮桩秋冠在农艺性状、营养品质、光合能力和抗病能力上相较于二倍体有一定程度的提高,符合育种目标的要求。同时,本研究创制的四倍体矮桩秋冠新种质是纯系,能作为育种亲本或直接作为常规种在生产上应用。
植株染色体加倍后,由于染色体发生变化导致染色体配对异常,与二倍体相比,四倍体植株的可育性降低,通过多代驯化可改善该情况。同时由于嵌合体[38]、基因突变和重组[39]导致诱变植株产生多种变化,在对植株进行鉴定筛选时,需选取各方面表现优良的育种材料,以提高优良品种的育种效率,从而进行下一步的研究[40]。
4 结论
本研究以二倍体不结球白菜矮桩秋冠植株为材料,获得了矮紧型、抗病不结球白菜同源四倍体矮桩秋冠新材料,为不结球白菜种质创新和新品种培育奠定了基础。研究发现,不结球白菜同源四倍体矮桩秋冠相较于二倍体并没有出现巨大化现象,具体原因有待后续研究证实。不结球白菜同源四倍体矮桩秋冠新材料的创制,为研究四倍体植株相较于二倍体未出现巨大化现象的原因提供了新的研究材料。
