红比利时杜鹃愈伤悬浮颗粒瞬时转化体系构建及植株再生
2022-07-05吴月燕谢晓鸿杨国霞蒋宝鑫李东宾鄢毅铖贾永红
何 凡 吴月燕 谢晓鸿 杨国霞 蒋宝鑫 李东宾 鄢毅铖 贾永红,*
(1 浙江万里学院生物与环境学院,浙江 宁波 315100;2 宁波市林场,浙江 宁波 315440)
杜鹃花(Rhododendron)是一种常见的灌木或乔木类园艺观赏花卉,其形态多样、花色繁多、花期较长,广泛用于环境绿化和室内美化,具有很高的观赏价值与经济价值。我国杜鹃花种类丰富,据统计,目前我国拥有600多种,占世界杜鹃花种类总量的半数以上[1-2]。但是,我国的杜鹃花多为野生原种,经过驯化或改造而适于室内栽培的杜鹃花品种较少。目前国内市场上大量销售的杜鹃花园艺栽培品种如比利时、东洋等,多是引自欧洲或日本的品种。同时,由于生态环境恶化,局部地区栖息的野生杜鹃花也面临生存挑战[3]。据《杜鹃花红色名录》[4]报告,我国受不同等级威胁的杜鹃花种类有213种,占总数的32.03%,表明我国杜鹃花的生存状态岌岌可危[5]。因此,加强我国杜鹃花遗传资源保护与开发利用研究迫在眉睫。
目前,我国杜鹃花研究主要集中于苗木栽培、杂交育种、生理生化指标测定等领域[6],而在亚细胞结构阐述、关键功能基因挖掘、遗传转化体系构建、信号转导通路探索等领域的研究较少,表型发生分子机制的解析也需要深入探索。遗传转化系统作为开展功能基因组学、分子育种、生物反应器等研究的关键技术之一,在促进基因功能研究领域的深入发展方面具有重要作用。特别是近年来,瞬时转化体系以其高效、快捷的优势日益被用于开展基因功能验证及组织定位、基因沉默[7-9]、蛋白互作等研究[10-14],并在快速重组蛋白生产方面显示出重要的应用价值[15]。
自从Rossi等[16]于1993年在烟草中首次成功建立农杆菌介导的瞬时转化技术以来,该技术目前已成功应用于多种植物,模式植物如拟南芥[17]、番茄[18],农作物如水稻[19],木本植物如苹果[20]、板栗[21],以及草本植物如草莓[22]、苜蓿[23]等。杜鹃花作为一种重要的木本园艺植物,其瞬时转化仍鲜有报道。
红比利时杜鹃花(Rhododendron×hybridumHort)是皋月杜鹃(Rhododendronindicum)、映山红(R.simsii)及毛白杜鹃(R.mucronatum)等经长期、反复杂交而育成的一种园艺花卉新品种。该品种花色艳丽、颜色多样,花期长,具有较高的经济价值。然而,红比利时杜鹃花生长缓慢、适应性不强,一定程度制约了该品种的广泛种植。鉴于此,本研究以宁波市地域特色杜鹃花园艺品种红比利时为研究对象,开展愈伤诱导、愈伤增殖、愈伤悬浮颗粒培养等研究,建立以愈伤悬浮颗粒为受体的农杆菌瞬时转化体系,并通过植物组织细胞工程技术,获得再生植株,以期为开展包括该品种在内的杜鹃花生物学性状发生与调控、分子育种、基因编辑等理论研究,以及提高杜鹃花经济附加值的实践应用研究奠定基础。
1 材料与方法
1.1 试验材料及前处理
红比利时杜鹃花嫩叶取自宁波北仑万景杜鹃良种园。从多株生长旺盛、无病害的3岁龄杜鹃花顶部分枝采集长(1.0~1.5)cm×宽(0.5~1.0)cm的嫩叶,无菌水冲洗叶片表面浮尘后放入冰盒带回浙江万里学院植物生理与分子改良实验室,参照何凡等[26]的方法进行前处理:少量清洁剂清洗嫩叶表面脏污后将其转入干净的广口瓶中并置于自来水细流下缓慢冲洗30 min左右。之后用无菌镊子将冲洗完成的嫩叶外植体转移至无菌玻璃瓶中,在灭菌的超净工作台上用适量70%酒精浸洗嫩叶约30 s,倒出酒精并用无菌水清洗1次。沥干无菌水,将0.1%的HgCl2溶液倒入玻璃瓶中消毒嫩叶约5 min,同时轻轻摇晃玻璃瓶,使外植体与HgCl2溶液充分接触,随后用无菌水浸泡清洗4~5遍。使用无菌镊子取出嫩叶放置于灭菌的干燥滤纸上,待水分吸干后,用灭菌剪刀将嫩叶剪成约1 cm2的小块,用无菌镊子将小块嫩叶外植体接种至培养基。
1.2 菌株、试剂与仪器
菌株:大肠杆菌DH5α,宝日医生物技术(北京)有限公司;农杆菌GV3101、pCAMBIA1301-CFP,上海唯地生物技术有限公司;pRI 101-AN,浙江万里学院李旭博士后馈赠。
试剂:木本植物培养基(woody plant medium,WPM)、植物组培抗菌剂(plant preservative mixture,PPM),美国Phytotech公司;噻重氮苯基脲(thidiazuron,TDZ)、6-苄基腺嘌呤(benzyladenine,6-BA)、2,4-二氯苯氧乙酸(2,4-dichlorophenoxyacetic acid,2,4-D)、萘乙酸(1-naphthaleneacetic acid, NAA)、玉米素(zeatin, ZT)、激动素(kinetin, KT),北京索莱宝科技有限公司;其余常规生化试剂均来自宁波奥博生化试剂公司。
主要仪器与设备:5804R高速冷冻离心机,德国艾本德中国有限公司;RZX型智能人工气候箱,宁波江南仪器有限公司;ZQZY-78BN震荡培养箱,上海知楚仪器有限公司;LSM980激光共聚焦显微镜,德国卡尔蔡司股份公司;DN300双目生物显微镜,宁波永新光学股份有限公司;超净工作台,力康精密科技(上海)有限公司。其余常规设备来自海门市其林贝尔仪器制造有限公司。
1.3 愈伤诱导的生长调节剂组合试验
以2.41 g·L-1WPM+ 20 g·L-1蔗糖+ 10 g·L-1麦芽糖+ 7.0 g·L-1琼脂为基本培养基,以2,4-D的4个浓度(0.1、0.2、0.3、0.4 mg·L-1)和TDZ的4个浓度(0.1、0.2、0.3、0.4 mg·L-1)按照浓度梯度一一对应的方式设定4个组合,将完成前处理的嫩叶分别接种到4组培养瓶中,每组接30瓶,共120瓶。接种后的培养瓶先在暗箱中培养7 d,然后将其转移到温度25±2℃、 光照强度1 500 lx、光照16 h/黑暗8 h的条件下继续培养,每7 d观察外植体的形态变化并及时清理发生污染、褐化、死亡的组培瓶。49 d后统计外植体的变化情况,以外植体正常愈化的数量占总接种数量的比例计算诱导率,依据试验结果确定生长调节剂的最优浓度组合。
1.4 愈伤增殖的响应面试验
把诱导获得的愈伤组织切割成小块,将其接种到继代培养基中作增殖培养。以2.41 g·L-1WPM + 20 g·L-1蔗糖 + 10 g·L-1麦芽糖 +7.0 g·L-1琼脂为基本培养基,借助Expert-Designer 10.0软件中Box-Behnken响应面法设计如下试验:以2,4-D(mg·L-1,X1)、6-BA(mg·L-1,X2)、TDZ(mg·L-1,X3)为自变量,以培养30 d后愈伤组织鲜重的增加值占最初接种愈伤组织块鲜重的百分比,即增殖率(%,Y)为响应值,设计三因素三水平试验(表1),确定继代培养过程中愈伤组织增长最快的生长调节剂最优浓度组合。

表1 愈伤组织继代增殖的Box-Behnken响应面法试验设计Table 1 Experimental design of Box-Behnken response surface method for callus subculture and proliferation
1.5 愈伤颗粒悬浮培养
在生长调节剂最优浓度组合条件下,选取继代培养5~7次的颗粒状愈伤组织5 g,将其接种到约100 mL液体继代培养基中(培养基方案为响应面试验优化后的结果),在温度25±2℃、光照强度1 500 lx、光照16 h/黑暗8 h、转速120 r·min-1的条件下继续培养,2~3周后,用40目的无菌细胞筛滤除大组织块,将筛选出的愈伤组织小颗粒分作2~3瓶,置于相同液体培养基并在相同条件下继续培养,重复上述步骤,最终获得批量愈伤颗粒悬浮液。
1.6 愈伤颗粒悬浮液的理化特性测定
在愈伤颗粒悬浮液制备过程中,称取2 g愈伤悬浮颗粒,接种到40 mL液体培养基中,重复30瓶,在同样培养条件下连续震荡培养20 d,期间每隔2 d随机取出3瓶测定如下指标:用pH计测量滤液的pH值;用电导率仪检测电导率;过滤溶液得到愈伤组织颗粒,将颗粒于60℃烘干2 h,之后称其干重,依据接种前后质量变化绘制生长曲线。
1.7 GUS染色
采用热激法将含有GUS(β-葡萄糖苷酸醇,β-glucuronidase)基因的pRI 101-AN质粒转入活化的农杆菌GV3101,经菌液培养、抗性筛选后,挑取阳性克隆接种于农杆菌培养基(yeast extract beef, YEB)液体培养基中,经扩增、离心等步骤获得含有pRI 101-AN的农杆菌。对照组选用不含pRI 101-AN质粒的活化的农杆菌GV3101。用10 mmol·L-1乙-(N-吗啉)乙磺酸,[2-(N-morpholino)ethanesulfonic acid, MES](pH值5.6)+10 mmol·L-1MgCl2+200 mmol·L-1乙酰丁香酮(acelosyringone, AS)的混合液重悬农杆菌,调节OD600为0.4、0.6、0.8、1.0,备用。准备生长状态良好的红比利时杜鹃花愈伤颗粒悬浮液3份,静置,去上清,将准备好的农杆菌侵染液与愈伤颗粒混合,分别侵染15、20、30、40 min后,弃上清,在下层颗粒中加入5 mL WPM液体培养基,轻轻混匀后,1 650 r·min-1室温离心3 min,获得沉淀物,洗涤重复3次;将洗涤后的悬浮颗粒接入新的WPM培养液,于30℃避光条件下,130 r·min-1摇床培养1 d,去上清获得侵染后的愈伤颗粒。将GUS染液与该愈伤颗粒在37℃恒温条件下孵育40 min,之后用75%乙醇对GUS染色后的愈伤颗粒脱色,在双目生物显微镜下观察染色情况并拍照记录。以平板中染色颗粒占全部颗粒的比例计算侵染率。
1.8 绿色荧光蛋白(green fluorescent protein, GFP)荧光试验
参照1.7节的试验方法及GUS染色的最佳条件,将含有pCAMBIA1301-GFP的农杆菌GV3101侵染液在OD600为0.6时侵染愈伤悬浮颗粒15 min,对照组选用不含pCAMBIA1301-GFP的GV3101侵染液。侵染后洗涤愈伤颗粒并制作制作悬浮颗粒装片,使用激光共聚焦显微镜并设置蓝光激发,观察GFP的发光效果。
1.9 不定芽、不定根诱导试验
参考前期研究结果[24],以2.41 g·L-1WPM+7 g·L-1琼脂+20 g·L-1蔗糖为基本培养基,添加2.0 mg·L-1TDZ与0.5 mg·L-12,4-D诱导愈伤组织不定芽。将生出不定芽的愈伤组织块转移到1/2 Read培养基,添加0.5 mg·L-1的吲哚丁酸(Indole-3-butyric acid,IBA)诱导生成不定根,并同时探讨了IBA与NAA对生根的影响。
1.10 统计分析
采用Excel 2019处理试验数据,以平均值±标准差(Mean ± SD)的形式表示。响应面试验采用Expert-Designer 10.0软件设计,方差分析采用该软件自带的ANOVA。折线图采用GraphPad Prism 8.0生物统计软件绘制,在统计结果分析中,P<0.05认为差异显著,P<0.01 认为差异极显著。
2 结果与分析
2.1 愈伤组织的诱导与优化方案的确定
观察发现,嫩叶接种2 d后,嫩叶切口处由绿色变为深褐色,叶片出现弯曲(图1-A);14 d后嫩叶变皱,叶脉开始膨胀变大,叶片边缘及叶脉处生出少量淡绿色愈伤组织;30 d后嫩叶四周由外向内逐步愈化生出大量愈伤组织(图1-B~D);49 d后整片嫩叶愈化完成(图1-E、F)。生长调节剂组合诱导嫩叶的愈化率统计结果见表2。依据愈化率及愈伤生长势,确定红比利时杜鹃花嫩叶的适宜诱导方案为:在2.41 g·L-1WPM+20 g·L-1蔗糖+10 g·L-1麦芽糖+7 g·L-1琼脂+0.050 mg·L-1PPM抗菌剂的基本培养基中,加入0.3 mg·L-12,4-D+0.3 mg·L-1TDZ,此条件下的愈化率可达97.78%。
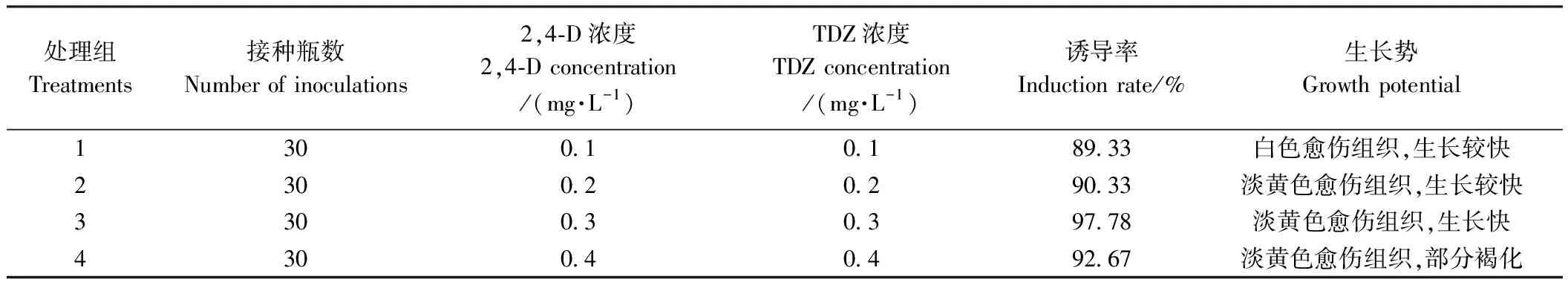
表2 愈伤诱导的生长调节剂组合设计方案与结果Table 2 Combination design and experiment result of growth regulators for callus induction

注:A:嫩叶接种;B~D:愈伤分化过程;E、F:致密型愈伤组织;G、H:继代5次后的疏松型愈伤组织。Note:A: Young leaves inoculation. B~D: Callus differentiation process. E、F: Compact callus. G、H: Loose callus after subculture for 5 times.图1 嫩叶愈伤组织诱导及继代Fig.1 Callus induction and subculture of young leaves
2.2 愈伤增殖的响应面试验
2.2.1 愈伤增殖的响应面试验结果 设定2,4-D(mg·L-1,X1)、6-BA(mg·L-1,X2)和TDZ(mg·L-1,X3)的三因素三水平试验,测定愈伤组织的增殖率,响应面试验结果如表3所示。对结果进行回归拟合分析,得到各参数之间的二次多项式回归模型:
Y=164.53+2.67X1+13.23X2+24.26X3+5.91X1X2+0.11X1X3+8.58X2X3-90.86X12-63.56X22-32.33X32。

2.2.3 最佳提取工艺参数的预测及试验验证 取X1、X2、X3中任意2个变量,愈伤增殖率受其中2个变量交互作用的影响结果如图3所示。结果表明,曲面受TDZ变化的曲折程度大于6-BA和2,4-D。通过二次模型所得到的等高线图和响应曲面可知,3种激素之间的交互作用较强。由图2-A可知,激素TDZ曲线面最陡,说明激素TDZ对愈伤增殖的影响最大。各激素交互作用明显,均呈曲线,有明显峰值,说明增殖率随3种激素浓度的增加先升高后降低,且有明显的最佳值。

表3 愈伤组织增殖的Box-Behnken响应面试验结果Table 3 Box Behnken response surface experiment results of callus proliferation

表4 愈伤组织增殖的响应面二次回归方程模型方差分析Table 4 Analysis of variance of response surface quadratic regression equation model for callus proliferation
综上分析,愈伤组织最优增殖效果的生长激素配比方案为:0.61 mg·L-12,4-D+0.65 mg·L-16-BA+1.57 mg·L-1TDZ,理论预测增殖率高达170.19%。采用优化后的方案进行愈伤组织增殖检验,实际测得增殖率约为167%,比软件理论预测值170.19%约小3个百分点。

图2 响应面试验结果Fig.2 Results of response surface experimental

图3 愈伤颗粒悬浮培养的接种(A)和持续增殖(B、C)及最终结果(D)Fig.3 Inoculation (A) and continuous proliferation (B, C) of callus suspension culture and results (D)
2.3 愈伤颗粒悬浮培养物建立及理化特性
将继代5次获得的愈伤颗粒经细胞筛过滤后所得的小颗粒(图1-G、H)接种于2.41 g·L-1WPM+20 g·L-1蔗糖+10 g·L-1麦芽糖+0.61 mg·L-12,4-D+0.65 mg·L-16-BA+1.57 mg·L-1TDZ的液体培养基中震荡培养(图3-A),每7 d换一次新的培养液,期间肉眼可见愈伤颗粒数量不断增加(图3-A~C),30 d后愈伤颗粒悬浮培养结果如图3-D所示。在培养过程中,3种理化指标检测结果表明,pH值呈现先降低后升高的趋势(图4-A);溶液电导率总体呈现下降趋势(图4-B),这种反向相关性可能与不断消耗的离子和持续生成的代谢物有关。悬浮颗粒在第4至第12天期间呈现指数生长,最高增幅可达45%(图4-C)。
2.4 GUS染色试验
染色试验结果表明,对照组愈伤颗粒未被染色(图5-A、B),而成功转化pRI101-AN质粒的愈伤颗粒呈现出GUS染色效果(图5-C、D)。以愈伤颗粒GUS染色为指标,评价愈伤颗粒在不同浓度侵染液、侵染不同时间下的侵染率,结果表明,OD600为0.6的农杆菌在侵染15 min时效果最好,侵染率为26.28%(表5),此时GUS染色效果如图5-C、D所示。
2.5 GFP荧光试验
GFP荧光试验结果表明,对照组未检测到荧光(图6-A),试验组检测到多个GFP荧光斑块(图6-B,蓝色箭头所示)。当含有pCAMBIAB01-GFP的农杆菌侵染愈伤颗粒时,因侵染效果不同与瞬时转化效率差异,愈伤悬浮颗粒出现GFP荧光斑彩。

图4 愈伤颗粒培养过程中pH值的变化(A)、电导率的变化(B)和生长曲线(C)Fig.4 Changes of pH value (A), conductivity (B) and growth curve (C) during callus culture
2.6 不定根、不定芽诱导结果
诱导结果表明,将不定芽接种至1/2 Read培养基中(图7-A、B),培养40 d后长出不定根(图7-C、D),直至长成试管苗(图7-E、F)。同时,参考前期研究方法[24],通过比较IBA与NAA对生根效果的影响,结果同样发现IBA和NAA均可诱导根的分化,但NAA诱导的根细短且易脱落,而IBA诱导的根长势较快且健壮。随着IBA和NAA生长调节剂浓度的增加,生根率降低。当IBA含量为0.5 mg·L-1、NAA含量为0 mg·L-1时,生根率最高,统计结果显示为20.16%±0.71%。由此表明,IBA有利于根的分化;生根的最适培养基为1/2 Read+0.5 mg·L-1IBA。

图5 GUS染色的对照组(A、B)与试验组(C、D)愈伤悬浮颗粒Fig.5 Control group(A、B) and experimental group(C、D) stained with GUS in callus suspension particles

表5 农杆菌侵染愈伤颗粒实验结果Table 5 Experiment of Agrobacterium tumefaciens infecting callus particles
3 讨论
瞬时转化体系与再生系统的构建是开展基因功能研究以及构建转基因植株的重要技术之一。本研究以嫩叶为外植体,成功构建红比利时杜鹃愈伤颗粒瞬时转化体系,并通过诱导愈伤组织出芽、生根,成功获得试管苗。

图6 GFP瞬时表达的对照组(A)和试验组(B,蓝色箭头指示)愈伤悬浮颗粒Fig.6 Control of transient expression of callus particles (A) and GFP expression (B, indicated by blue arrow)

注:A、B为不定芽分化;C、D为不定根分化;E、F为试管苗。Note: A and B are adventitious bud differentiation. C. D are adventitious root differentiation. E. F are test tube seedling.图7 愈伤组织不定芽、不定根的诱导Fig.7 Induction of adventitious buds and roots from callus
愈伤组织诱导是植物细胞工程研究领域中一项基础且重要的试验,其诱导效果受基因型、组织部位、生长调节剂种类与浓度等许多因素影响[25]。表6比较了多个不同物种的愈伤组织诱导试验,发现常用的生长素类生长调节剂包括NAA、IBA、2,4-D,常用的细胞分裂素类生长调节剂包括6-BA、ZT、TDZ、KT。在多数试验中,两类生长调节剂分别选一种按“1+1”方式组合使用,如杜鹃红山茶[26]、云锦杜鹃[27]、仙茅[28]、凤丹牡丹[29]、郁金樱[30]及本研究的红比利时杜鹃等,但部分试验采用“2+1”方式如兴安杜鹃的根段[31]、甬之妃杜鹃的嫩叶[24]和杉木的针叶[32]或“1+2”方式如野生大白杜鹃的针叶、嫩叶和上胚轴等组织[33],也有采用“2+2”的方式的如芍药的花药[34]。诱导结果发现,除芍药的花药外,其余试验都获得了高于60%的愈伤诱导率。本研究红比利时杜鹃采用“1+1”组合方式,获得了97%的愈伤诱导率。在生长调节剂浓度使用上,有“低生长素、高细胞分裂素”组合,如云锦杜鹃幼叶的“0.05+2.0”[27]、仙茅幼叶的“0.5+1.5”组合[28];也有高生长素、低细胞分裂素组合,如甬之妃杜鹃嫩叶的“2.0+1.0”[24]、凤丹牡丹幼胚的“2.5+0.1”[29];还有生长素与细胞分裂素浓度近似的组合如本研究红比利时杜鹃嫩叶的“0.3+0.3”,且都获得了高于60%的诱导率。从上述结果看,在外植体、生长调剂种类与浓度等3个参数的选择上,愈伤组织诱导试验在外源生长调节剂的种类与浓度选择上似乎没有固定规律。1957年Skoog等[35]曾经提出一个著名的“Skoog-Miller”模式,即细胞分裂素与生长素的浓度比例会影响外植体的分化方向,比例高可诱导芽分化,比例低则诱导根分化,比例接近1则诱导愈伤组织分化。然而,本研究结果与“Skoog-Miller”模式发生矛盾,该矛盾可能因不同外植体中内源激素的种类与含量差别所导致,详细原因有待深入研究。

表6 愈伤组织诱导试验的生长调剂使用比较Table 6 Comparison of growth regulators used in callus induction experiment
愈伤组织增殖与愈伤组织诱导是两个不同的生物学过程。愈伤组织诱导是体细胞去分化的试验,涉及到体细胞中与分化有关基因的重编程,然而愈伤组织增殖是去分化后获得的分生细胞、薄壁细胞、厚壁细胞等的增殖试验,主要与有丝分裂有关[36]。因此,在愈伤组织诱导与愈伤组织增殖试验中,外源生长调节剂的使用方式也不同。例如仙茅[28]幼叶愈伤组织诱导试验的生长调剂为0.5 mg·L-1NAA + 1.5 mg·L-16-BA,而愈伤组织增殖试验的生长调节剂为0.5 mg·L-1NAA + 2.0 mg·L-16-BA;郁金樱[30]愈伤组织诱导试验的生长调节剂为1.0 mg·L-12, 4-D + 0.5 mg·L-16-BA,而愈伤组织增殖试验的生长调节剂为1.0 mg·L-16-BA,差别明显。本研究红比利时杜鹃愈伤组织诱导试验的生长调节剂为0.3 mg·L-12, 4-D + 0.3 mg·L-1TDZ,而愈伤组织增殖试验的生长调节剂为0.61 mg·L-12, 4-D + 0.65 mg·L-16-BA + 1.37 mg·L-1TDZ,两个试验的诱导率和增值率分别为97.78%与167%,效果均较好。
在红比利时杜鹃愈伤组织增殖效果研究的基础上,本研究以愈伤悬浮颗粒为受体,探讨了农杆菌介导的瞬时转化体系构建。农杆菌介导的瞬时转化效果与菌株类型、侵染液浓度、受体类型、外界环境等诸多因素有关[12],受到组织细胞的化学组成、结构、生理、生化、免疫等多种参数影响[37]。表7比较了几个不同物种的瞬时转化试验参数,结果表明,常用的农杆菌菌株为GV3101、EHA105,侵染液OD600多数在0.6~1.0之间;受体材料多数为叶片[38]、愈伤组织[39-40]、愈伤悬浮细胞[41-42]等,只有少数使用茎段[43]或子叶节[44]的报道;报告基因通常采用GUS或GFP[38-45]。从转化效率来看,不同的受体材料转化效率差别较大,杜梨叶片采用GV3101的转化效率甚至达到100%[38]。本研究针对红比利时杜鹃瞬时转化体系构建的参数设置与上述报道结果中的参数值相近,并获得26.8%的转化效率。
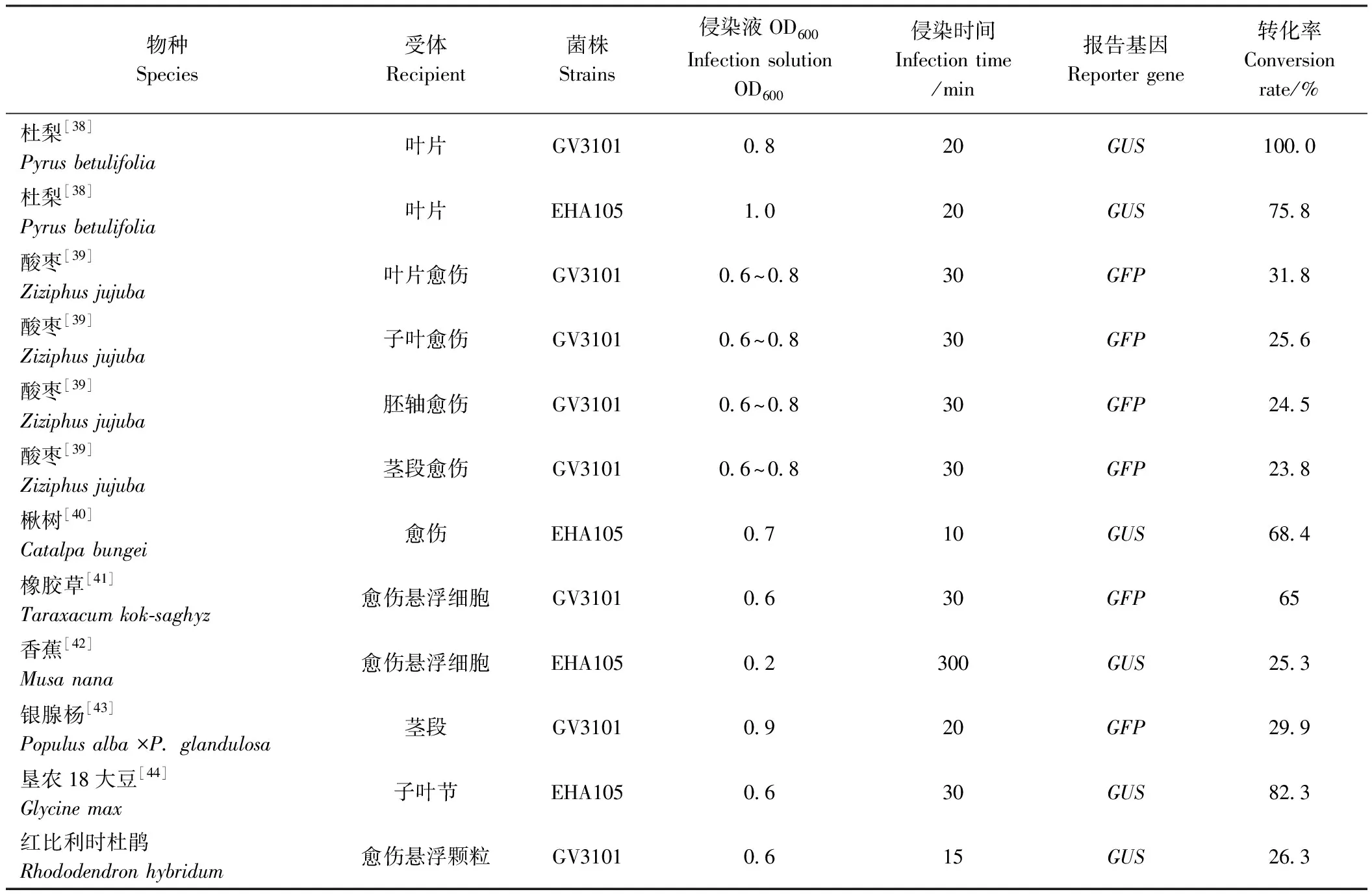
表7 农杆菌介导瞬时转化试验的部分参数比较Table 7 Comparison of some parameters of Agrobacterium mediated transient transformation experiment
再生系统的构建是植物组织工程的重要环节[6]。据不完全统计,杜鹃花属植物的再生系统多是以顶芽、侧芽或带芽的茎段为外植体,借助直接器官诱导的方式建立的。例如,用茎尖成功繁殖的锦绣杜鹃(R.pulchrum)[46],以顶芽繁殖的两种西洋杜鹃栽品种(R.britannia和R.america)[47]。少数杜鹃花属植物的再生系统是通过愈伤组织诱导,再从愈伤组织种产生不定芽的间接器官发生方式建立的。例如,目前仅发现2例以叶片为外植体诱导愈伤并培育出组培苗的研究报道,即牛皮杜鹃(R.aureum)和云锦杜鹃(R.fortunei)[48]。张开文等[6]认为,杜鹃属植物因外植体灭菌难度大、易污染等原因导致杜鹃花愈伤组织再生相对困难,因此以间接器官发生的方式构建的再生系统较少。本研究以红比利时嫩叶为外植体,借助响应面方法优化了生长调节剂的使用方案,高效率诱导产生愈伤组织,之后通过诱导出芽、生根,建立了红比利时杜鹃花的间接器官发生途径。
综上,本研究成功构建了红比利时杜鹃愈伤悬浮颗粒瞬时转化体系,并实现了愈伤组织间接再生试管苗,研究结果为后续开展功能组学研究奠定了基础。
4 结论
本研究以愈伤悬浮颗粒为受体,构建了农杆菌介导的红比利时杜鹃瞬时转化体系,并实现愈伤组织再生试管苗。研究发现,2,4-D和TDZ组合能高效诱导嫩叶愈化,2,4-D、6-BA和TDZ组合能促进愈伤增殖。愈伤继代5次后可形成疏松型愈伤颗粒,经液体悬浮培养可获得愈伤悬浮颗粒,该愈伤悬浮颗粒是农杆菌介导的瞬时转化体系的良好受体。同时,该愈伤组织可通过间接器官发生途径实现试管苗再生。
