基于网络药理学和体外实验探讨复方苦参注射液抗非小细胞肺癌的作用机制研究
2022-07-04颜渊鸳章波海南省第三人民医院药剂科海南三亚57000桂林医学院科学实验中心广西桂林5499
颜渊鸳,章波(.海南省第三人民医院药剂科,海南 三亚 57000;.桂林医学院科学实验中心,广西 桂林 5499)
肺癌在中国的发病率和病死率均较高,且是世界上病死率最高的恶性肿瘤[1]。根据不同的组织学行为和病理表现,原发性肺癌主要分为小细胞肺癌(SCLC)和非小细胞肺癌(NSCLC)[2]。其中,NSCLC占肺癌病例的80%~85%,这是一种以基因突变的分子亚型为特征的疾病[3]。目前,含铂类药物为晚期NSCLC的一线药物,其作用机制为通过与DNA结合产生复合物,导致DNA断裂并出现错误编码,进而干扰DNA正常生理功能,发挥抗肿瘤作用[4]。然而,研究表明,多数晚期NSCLC患者经铂类一线化疗后效果欠佳。虽然增加剂量强度可提高疗效,但不良反应亦随之加强,不利于患者耐受[5]。除增加剂量强度外,联合用药亦可提高药物疗效。随着中医药受重视程度日益增高,越来越多的中药在癌症的治疗过程中展现出独特的疗效[6]。复方苦参注射液(CKI)具有散结止痛、凉血解毒等功效,在临床中可用于NSCLC的辅助治疗[7-8]。然而,其抗NSCLC的作用机制尚不明确。网络药理学在探索中药药理机制方面拥有巨大优势,其可借助公共数据库[9]和文献,获得药物成分和特定疾病的靶点信息,进而预测药物防治疾病的有效成分、药效靶点。此外,借助生物信息学分析可进一步挖掘其及可能参与调控的细胞信号转导通路等[10]。
本文拟通过网络药理学的方法探索CKI抗NSCLC的分子机制,并通过实时荧光定量PCR(qPCR)实验对关键基因进行验证,以期为CKI在临床合理应用提供科学有效的依据。
1 材料与方法
1.1 CKI有效成分收集
查阅文献发现,Ma等[11]使用LC-MS/MS对CKI进行分析,共鉴定出21个有效成分。经Pubchem数据库中搜索后,共导出16个有效成分(见表1)可用于后续网络药理学分析的有效成分三维结构数据。
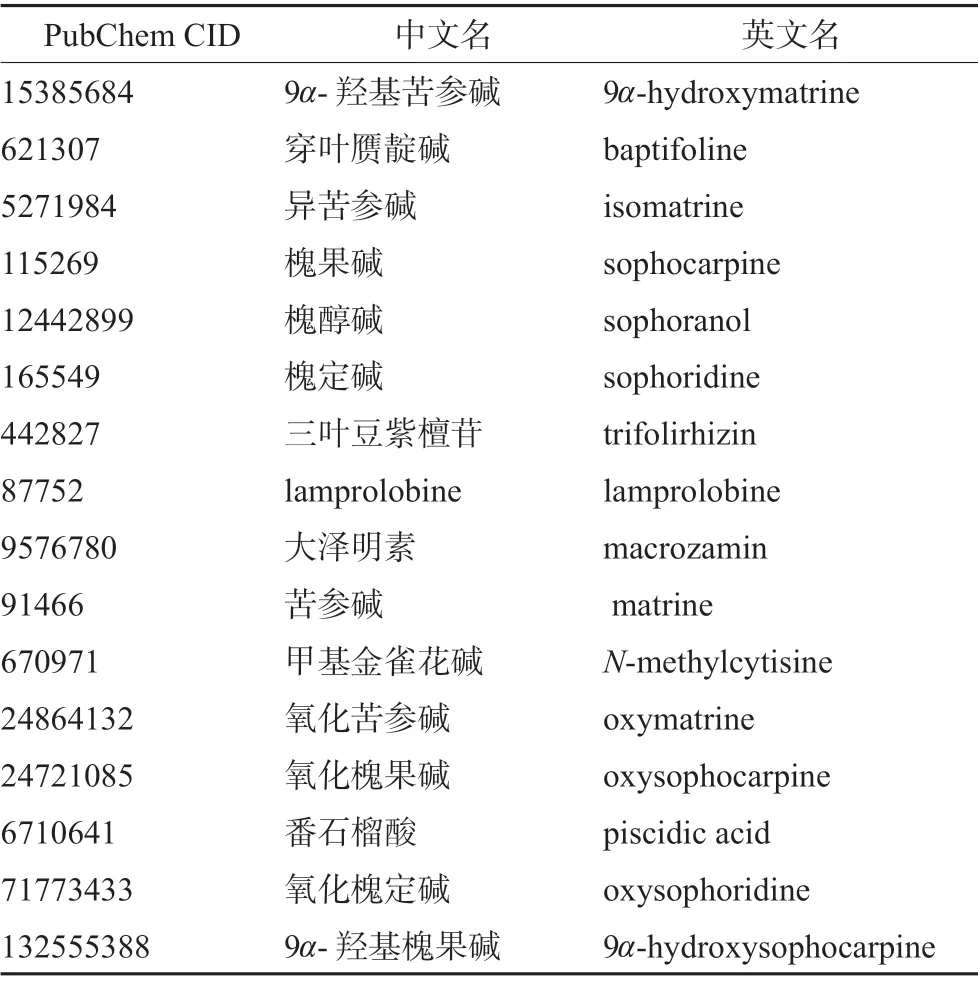
表1 CKI有效成分信息 Tab 1 Information of active ingredients in CKI
1.2 CKI有效成分靶点预测
将上述16个有效成分的三维结构均保存为mol2格式,并上传至Pharm Mapper 数据库[12-14](http://www.lilab-ecust.cn/pharmmapper/)。基于反向药效团匹配法,选择药物的药效团模型,设置最终产生300个蛋白构象,得到与CKI中16个有效成分相关的靶点名称、基因名称、Uniprot ID等结果。合并16个有效成分相关的靶点,导入 UniProt数据库(https://www.uniprot.org/),选择物种为“Homo sapiens”,剔除重复、非人源与不规范的靶点,最终得到与CKI有效成分相关的蛋白靶点。
1.3 收集NSCLC相关靶点
分别在Drug Bank(https://www.drugbank.ca/)、CTD(http://ctd.mdibl.org/)、Gene Cards(https://www.genecards.org/)、OMIM(https://omim.org/)数据库检索NSCLC相关靶点。为了减少假阳性结果,CTD数据库中NSCLC相关靶点选取基因总数的1%作为后续研究靶点,Gene Cards数据库中NSCLC相关靶点仅选取评分大于20的基因作为后续研究靶点,Drug Bank数据库和OMIM数据库收集全部靶点。合并4个数据库的靶点即为NSCLC相关靶点。
1.4 蛋白-蛋白互作网络(PPI)构建
将CKI有效成分相关靶点与NSCLC相关靶点取交集,得到CKI抗NSCLC潜在作用靶点。再将潜在作用靶点导入STRING(http://string-db.org/)数据库,物种限定为人类,获得潜在作用靶点蛋白互作关系文件。提取上述文件中 node1、node2 和 Combined score 信息导入 Cytoscape 3.8.2 软件进行可视化分析,运用软件中Network Analyzer功能计算蛋白互作网络的拓扑参数。根据拓扑参数中的度值(degree)来筛选核心蛋白,即任意蛋白度值大于所有蛋白度值中位数,则认为该蛋白为CKI抗NSCLC潜在作用靶点中的关键靶点。
1.5 关键靶点生物信息学分析
将筛选出的关键靶点的蛋白名均转换为Gene Symbol,并以该格式导入 David 6.8 数据库(https://david.ncifcrf.gov/),进行GO分析及KEGG通路分析。下载David数据库分析结果,数据经整理后使用R语言中ggplot2包进行可视化。
1.6 A549细胞体外实验验证
1.6.1 材料 A549细胞株(中国科学院上海细胞库)。CKI(山西振动制药股份有限公司,批号:20210106);RPMI 1640培养基、胎牛血清(美国Gibco公司);CCK-8试剂盒(美国MedChemExpress公司);TRIzol试剂(美国Ambion公司);qPCR试剂盒(日本TaKaRa公司);PCR引物[生工生物工程(上海)股份有限公司]。TECAN SPARK酶标仪、QuantStudio 5实时荧光定量PCR仪(美国Thermo公司);Galaxy 170 S培养箱(英国New Brunswick公司)。
1.6.2 细胞分组及给药 A549细胞在37℃、5% CO2饱和湿度下,培养于RPMI 1640培养液中(含 10% 胎牛血清、100 U·mL-1青霉素及 0.1 mg·mL-1链霉素)。实验共分为3组,正常对照组(A549细胞,不加药物干预),CKI低剂量组(培养基中CKI含量为40 μL·mL-1),CKI高剂量组(培养基中CKI含量为80 μL·mL-1)。
1.6.3 细胞活性实验 采用CCK-8试剂盒检测细胞活性。取1×104个·mL-1的细胞悬液100 μL接种于96孔培养板中,培养24 h,待细胞贴壁后,按照“1.6.2”项下分组对细胞进行药物处理,每组6个复孔。药物处理24 h,每孔加入10 μL CCK-8试剂,于37℃、5%CO2饱和湿度下孵育1 h,用酶标仪在450 nm处测定吸光度值,并计算细胞存活率(%)。
1.6.4 qPCR检测参与调控相关信号通路基因的mRNA相对表达 A549细胞经CKI干预24 h后,弃去培养基,PBS清洗细胞5次,TRIzol试剂提取各组细胞总RNA,于260 nm处测量其吸光度值,测定总RNA浓度。利用随机六聚体引物和SuperScript Ⅲ逆转录酶试剂盒获得互补DNA(cDNA)。逆转录后采用20 μL体系进行qPCR检测mRNA相对表达量,结果采用 2-ΔΔCt法进行相对定量分析。引物序列见表2。

表2 引物序列 Tab 2 Primer sequences
1.7 统计学方法
2 结果
2.1 CKI和NSCLC靶点分析
将CKI的16个有效成分上传至Pharm Mapper 数据库后,剔除非人源靶点后,共收集到372个CKI靶点,NSCLC靶点426个。将CKI和NSCLC靶点进行对比分析,得到40个CKI抗NSCLC潜在作用靶点(见图1)。通过STRING数据库及Cytoscape软件,绘制了40个CKI抗NSCLC潜在作用靶点的PPI网络(见图2)(其中红色代表基因在该网络度值大于各靶点度值中位数,蓝色代表小于中位数。红色靶点视为CKI抗NSCLC关键靶点)。对PPI网络进行拓扑分析后发现,该网络中平均聚类系数为0.63,平均节点度为11.48,平均最短路径为1.37~3.42,介数中心0.29~0.73,在关系网络中体现了较好的连通特性(见表3)。同时,根据拓扑参数中的度值,选取大于度值中位数的靶点作为CKI抗NSCLC潜在作用的关键靶点,共19个(见图2)。

表3 CKI抗非小细胞肺癌作用靶点互作关系的拓扑学分析 Tab 3 Topological analysis of the interaction between CKI targets against NSCLC
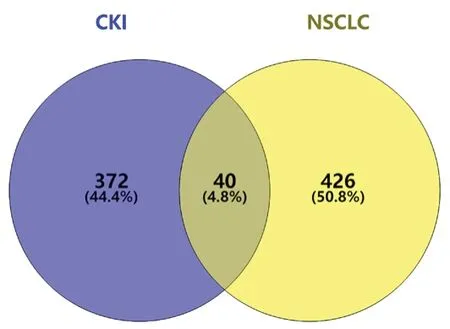
图1 CKI和NSCLC靶点韦恩图Fig 1 Venn diagram of CKI and NSCLC targets
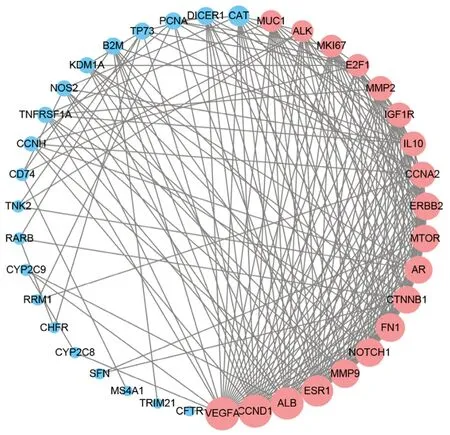
图2 CKI抗NSCLC潜在作用靶点PPI网络Fig 2 PPI network of potential CKI targets against NSCLC
2.2 CKI抗NSCLC关键靶点GO分析
将19个关键靶点导入David数据库,进行GO分析。结果显示,GO分析中,19个关键靶点参与了93个生物过程(BP),包括转录的正调控、基因表达的正调控、RNA聚合酶Ⅱ启动子的转录正调控等;13个细胞组分(CC),包括细胞核、细胞膜、核染色质等;27个分子功能(MF),包括酶结合、蛋白激酶绑定、ATP结合等。按照参与基因功能的基因个数,选取各基因功能前十个条目,应用R 4.10软件将其绘制成条图进行可视化(见图3)。
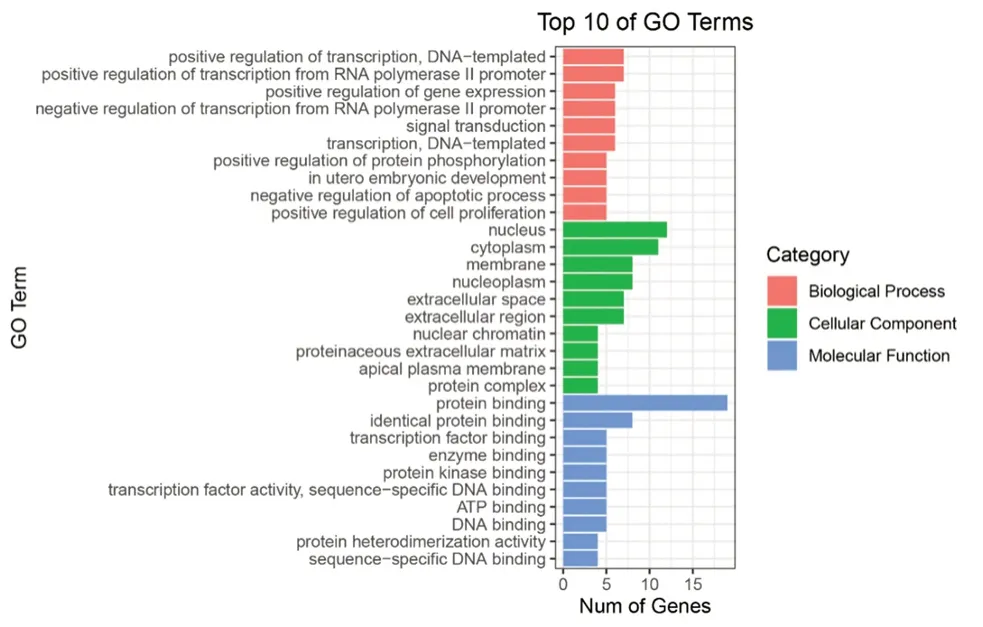
图3 CKI抗NSCLC关键靶点GO分析条图Fig 3 GO analysis of key CKI targets against NSCLC
2.3 CKI抗NSCLC关键靶点
将19个关键靶点导入David数据库,进行KEGG信号通路富集分析。结果显示,19个关键靶点参与调控了30条信号通路,选取P值最小的20条信号通路绘制气泡图进行可视化(见图4)。可以发现,与NSCLC相关的信号通路主要有缺氧诱导因子1(HIF-1)信号通路、丝裂原活化蛋白激酶(AMPK)信号通路、磷脂酰肌醇3'-激酶(PI3K-Akt)信号通路。此外,KEGG信号通路富集分析的数据显示,共6个基因参与调控上述3条与NSCLC相关的信号通路,分别为ERBB2、MTOR、CCND1、IGF1R、VEGFA、FN1(见表4)。

图4 CKI抗NSCLC关键靶点KEGG信号通路富集分析气泡图Fig 4 Enrichment analysis of KEGG signaling pathway,a key CKI target against NSCLC
2.4 CKI对A549细胞活性的影响
CCK-8实验结果显示,相比于正常对照组,经给药培养24 h后,CKI低、高剂量组中A549细胞活性有显著下降趋势,且A549细胞活性下降趋势呈剂量依赖性,表明CKI具有抑制A549细胞活性的作用(见图5)。

图5 CKI对A549细胞活性的影响CCK-8实验结果Fig 5 Effect of CKI on A549 cell viability by CCK-8
2.5 qPCR检测参与调控相关信号通路基因的mRNA相对表达
qPCR实验结果显示,相比于正常对照组,CKI低剂量组及高剂量组A549细胞中ERBB2、MTOR、IGF1R、VEGFAmRNA相对表达量显著降低,CCND1、FN1 mRNA相对表达量差异无统计学意义(见图6),表明CKI可能是通过抑制ERBB2、MTOR、IGF1R及VEGFA基因的表达调控HIF-1、AMPK及PI3K-Akt信号通路,进而发挥其抑制A549细胞活性的作用。

图6 信号通路相关关键基因qPCR实验结果Fig 6 qPCR of key genes related to signaling pathways
3 讨论
本研究通过文献及数据库挖掘共找到19个CKI抗NSCLC的关键靶点,在对其进行GO分析后发现,靶点主要涉及到转录的正调控、基因表达的正调控、RNA聚合酶Ⅱ启动子的转录正调控等生物学过程。同时,KEGG富集分析发现,CKI可能通过调控HIF-1信号通路、AMPK信号通路及PI3K-Akt信号通路等发挥抗NSCLC作用。此外,通过CCK-8细胞活性实验证明CKI具有抑制NSCLC的作用。进一步的qPCR实验验证表明,CKI调控上述3条信号通路可能与抑制ERBB2、MTOR、IGF1R及VEGFA基因的表达有关。
缺氧是包括NSCLC在内的实体肿瘤的一个特征,与肿瘤的恶性程度直接相关[15]。在缺氧肿瘤微环境中,缺氧诱导因子(HIF)被激活,激活的HIF诱导与血管生成、代谢调节、细胞凋亡和肿瘤生存相关的多个基因的表达[16]。HIF在血管形成和肿瘤血供恢复中的重要作用使肿瘤难以治疗,导致对放疗、化疗和免疫治疗产生抗药性[17]。据报道,缺氧诱导因子-1α的上调与NSCLC的肿瘤坏死和患者总生存期相关[18]。因此,抑制HIF-1信号通路可能有助于NSCLC的治疗。自噬是一种进化上保守的分解代谢机制,是真核细胞通过膜转运途径循环或降解内部成分的一种机制,可以通过消除细胞异常增殖以维持体内稳态,有望成为治疗癌症的靶点[19]。研究表明,AMPK信号通路及PI3K-Akt信号通路均与细胞自噬的发生密切相关,抑制该通路的异常表达有助于癌症的治疗[20-21]。本研究中,通过网络药理学发现CKI抗NSCLC的作用机制可能与NSCLC细胞中HIF-1信号通路、AMPK信号通路及PI3K-Akt信号通路的异常表达有关。进一步通过qPCR实验验证发现,CKI可有效抑制与上述通路相关的CKI抗NSCLC靶点(ERBB2、MTOR、IGF1R、VEGFA)mRNA的表达。
综上所述,本研究通过网络药理学技术分析了CKI抗NSCLC的分子机制并对信号通路关键基因靶点进行qPCR实验验证,进一步为CKI的临床应用提供了科学依据。然而,本研究并未对发现的HIF-1信号通路、AMPK信号通路及PI3K-Akt信号通路进行进一步的实验验证,使得本研究结论具有一定局限性。因此,CKI如何调控上述3条信号通路的实验验证或将成为后续研究重点。
