下调DNA 损伤激活的长链非编码RNA 抗心房颤动大鼠心肌纤维化的机制研究
2022-07-03杨淑玲谷云飞杨定宪高爱玲尚伟陈滢伊张光
杨淑玲,谷云飞,杨定宪,高爱玲,尚伟,陈滢伊,张光
心房颤动(房颤)是常见的室上性心律失常,发生率较高,严重时可导致心力衰竭[1-2]。其病因复杂,与心房肌电重构、结构重塑和自主神经失调有关;其中心肌纤维化导致的结构重塑是房颤重要的病理生理因素[3]。心房炎症与心肌纤维化密切相关[4-5]。
丝裂原激活的蛋白激酶(MAPK)通路的激活在心房纤维化中起着核心作用[6],p38 丝裂原激活的蛋白激酶(p38 MAPK)/核因子κB(NF-κB)通路是体内重要的炎症通路,与房颤和不良的心房纤维化有关[7]。
据报道,长链非编码RNA(lncRNA)在结构重塑和肌电重构中起着重要作用,如lncRNA H19[8]和lncRNA MIAT[9]与心脏纤维化相关。有报道称,DNA损伤激活的长链非编码RNA(lncRNA NORAD)在急性心肌梗死中上调,可促进心肌纤维化和细胞凋亡,敲低其表达可减少梗死面积和纤维化改善病情[10];还可抑制高糖诱导的人肾小球系膜细胞纤维化和心肌细胞凋亡[11-12]。然而,lncRNA NORAD 在房颤诱导的心肌纤维化中的作用仍未明确。因此,本研究旨在探究lncRNA NORAD 对房颤大鼠心肌纤维化的影响及潜在机制。
1 材料与方法
1.1 实验动物
SPF 级雄性SD 大鼠48 只,体质量200~220 g,购自北京维通利华实验动物技术有限公司。
将大鼠饲养在12 h 光照间隔12 h 黑暗、温度(23±2)℃、相对湿度45%~60%的房间中,自由饮食和摄水。
1.2 药品、试剂及仪器
乙酰胆碱(ACh)、氯化钙(CaCl2)(Sigma-Aldrich 公司,美国);重组腺相关病毒血清型9(rAAV9)载体含用于沉默DNA 损伤激活的长链非编码RNA 的小干扰RNA(rAAV9-siNORAD)基因及其阴性对照(rAAV9-NC)、实时荧光定量PCR引物(GenePharm 公司,中国);p38 MAPK 抑制剂SB203580(Med Chem Express 公司,美国);RIPA裂解液、BCA 试剂盒(碧云天生物科技公司,中国);Masson 三色染色试剂盒(Solarbio 公司,中国);总RNA 提取试剂盒(天根生化科技有限公司,中国);双链DNA 染料试剂(SYBR Green)(上海联迈生物工程有限公司,中国);肌酸激酶同工酶(CKMB)、心肌肌钙蛋白I(cTnI)、肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)ELISA 检测试剂盒(上海酶联生物科技有限公司,中国);兔源一抗丝裂原活化蛋白激酶激酶6(MKK6)、p38MAPK、磷酸化p38MAPK(p-p38MAPK)、NF-κB p65、磷酸化NF-κB p65(p-NF-κB p65)、β-肌动蛋白(β-actin)及二抗辣根过氧化酶(HRP)标记的山羊抗兔IgG(Abcam 公司,英国)。
NanoDrop 2 000 分光光度计(Thermo Scientific公司,美国);ABI 7 500 实时荧光定量PCR 仪系统(美国应用生物系统公司);动物心电图系统(Nasiff Associates 公司,美国);iMark680 多功能酶标仪、蛋白转膜装置(Bio-Rad 公司,美国);BX61 电动显微镜(Olympus 公司,日本)。
1.3 方法
分组及建模:rAAV9-siNORAD 及其阴性对照(rAAV9-NC)用于实验干预。SD 大鼠随机分为对照组、房颤组、rAAV9-NC 组、rAAV9-siNORAD 组、SB203580 组 和rAAV9-siNORAD+SB203580 组,每组8 只。除对照组外,各组大鼠每天经尾静脉以1 ml/kg 的剂量注射ACh-CaCl2混合液(60 μg/ml ACh和10 mg/ml CaCl2),共7 d,诱导建立房颤模型[13]。于实验前、建模后观察并记录大鼠的心电图,若房颤大鼠出现P 波消失,代替为小f 波,频率在350~600 次/min 的典型房颤心电图,说明大鼠房颤模型制备成功[13]。
建模后,rAAV9-NC 组 和rAAV9-siNORAD组大鼠尾静脉分别注射rAAV9-NC 和rAAV9-siNORAD(2×1011个载体基因组颗粒/每只大鼠);SB203580 组大鼠给予1 mg/kg 的SB203580 尾静脉注射;rAAV9-siNORAD+SB203580 组大鼠经尾静脉注射1 mg/kg 的SB203580 和rAAV9-siNORAD,1 次/d,连续14 d。
心电图记录与分析:实验前和建模后,戊巴比妥钠(40 mg/kg)腹腔注射使大鼠麻醉。将12 导联心电图的四肢导联插入动物的四肢中,连接心电图仪(纸速50 mm/s,电压10 mm/mV),记录各组大鼠心电图变化,记录并排除非窦性心律。实验第22 d,再次对大鼠进行心电图测试,记录房颤的发生率和持续时间。
检测血清心肌酶和炎性因子水平:心电图检测完成后,腹主动脉取血,静置后以1 617 g 离心15 min,分离血清,按照ELISA 检测试剂盒说明书的操作检测CK-MB、cTnI、TNF-α、IL-6 水平[14]。具体操作为:将50 μl 的大鼠血清加入包被的96 孔板的每个孔中,然后在37℃下孵育60 min。反应结束后,用洗涤缓冲液洗涤孔3 次,然后在每个孔中加入HRP 标记的抗体,37℃孵育30 min。弃去孔内液体,用洗涤缓冲液洗涤孔3 次,再向每孔加入底物A、B 各50 μl,混匀后37℃避光温育10 min。最后加入终止缓冲液,在450 nm 波长处测量光密度(OD),根据标准曲线,计算CK-MB、cTnI、TNF-α 和IL-6 水平。
Masson 染色检测心房组织纤维化:取大鼠心脏,用磷酸盐缓冲液(PBS)(主要成分为Na2HPO4、KH2PO4、NaCl 和KCl,pH 7.4)洗涤血液。分离左心房组织,并分为三部分,两部分于-80℃冰箱保存,分别用于实时荧光定量PCR 和蛋白免疫印迹(Western blot)实验;最后一部分用4%多聚甲醛固定,石蜡包埋、切片,进行Masson 三色染色,在光学显微镜下观察胶原蛋白沉积,计算心房胶原容积分数(CVF)[15]。胶原纤维染成蓝色。每个样品选择三个视野,用Image-Pro Plus 6.0 软件分析结果。CVF(%)=心肌胶原纤维面积/所测视野面积×100%。
实时荧光定量PCR 检测心房组织lncRNA NORAD、Ⅰ型胶原(COL1-A1)和Ⅲ型胶原(COL3-A1)mRNA 表达:取-80 ℃冰箱保存的部分左心房组织。用总RNA 提取试剂盒提取总RNA。使用分光光度计对总RNA 进行定量检测。按照试剂盒说明书进行逆转录。收集cDNA 用于实时荧光定量PCR 扩增[16]。反应体系(20 μl):cDNA(200 ng/μl)2 μl,SYBR®Premix Ex TaqTM(2×)10 μl,上下游引物(引物序列见表1)各0.4 μl,ddH2O 7.2 μl。反应条件:95℃预变性10 min;95℃变性10 s,60℃退火60 s,72℃延伸60 s,进行40个循环。使用2-ΔΔCT方法以甘油醛-3-磷酸脱氢酶(GAPDH)作为内参对照计算目的基因的相对表达量。

表1 引物序列及产物长度
Western blot 检测心房组织p38 MAPK/NF-κB通路相关蛋白表达:剩余左心房组织在RIPA 裂解液中裂解,4℃,12 000 g 离心15 min。收集上清液,BCA 法测定蛋白质浓度。取等量蛋白样品通过SDS-PAGE 电泳分离,并转移到PVDF 膜上。然后,将膜封闭并与一抗(MKK6、p38 MAPK、p-p38 MAPK、NF-κB p65、p-NF-κB p65、β-actin,1:1 000)在4℃下孵育过夜。次日将膜用含Tween-20的TBST 缓冲液(主要成分为50 mmol/L Tris、150 mmol/L NaCl、0.05% Tween-20,pH 8.0)洗涤3 次,每次10 min,然后在室温下与HRP 标记的羊抗兔IgG 二抗(1:4 000)在黑暗中孵育1 h。最后,增强化学发光法(ECL)显色,凝胶成像仪观察蛋白条带并拍照,分析结果,β-actin 为内参对照。
1.4 统计学方法
数据使用GraphPad Prism 8.0 软件进行统计分析,计量资料以均值±标准差表示。多组间比较采用单因素方差分析,组间多重比较行LSD-t检验;计数资料以例(%)表示,差异比较行卡方检验。P<0.05 为差异有统计学意义。
2 结果
2.1 各组大鼠房颤的发生率和持续时间的比较
心电图结果显示,实验前各组大鼠的心律正常;建模后,对照组大鼠可观察到规则的P 波,心律正常;房颤大鼠可观察到P 波消失,出现大小不等、不规则的f 波,R-R 间期变化不规则,提示成功建立了房颤模型(图1)。实验结束后,与房颤组相比,rAAV9-siNORAD 组和SB203580 组大鼠房颤的发生率均降低,且持续时间均明显缩短(P均<0.05);与rAAV9-siNORAD 组 和SB203580 组相比,rAAV9-siNORAD+SB203580 组大鼠房颤的发生率均降低,持续时间明显缩短(P均<0.05,表2)。
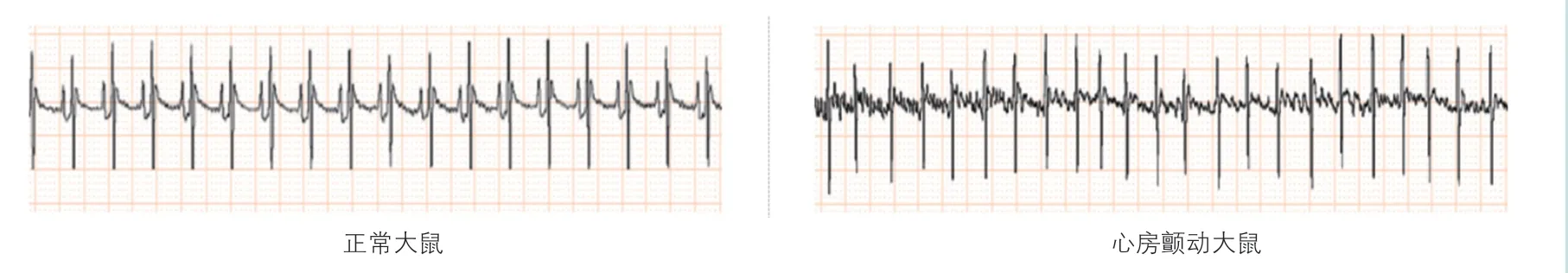
图1 正常大鼠及心房颤动大鼠心电图
表2 实验结束后各组大鼠房颤发生率和持续时间比较()
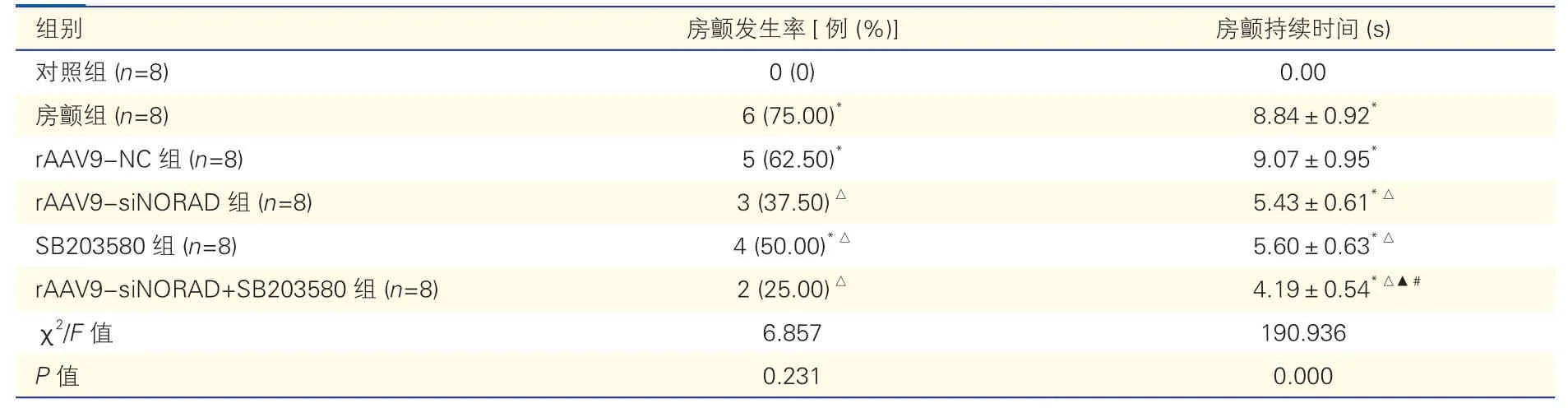
表2 实验结束后各组大鼠房颤发生率和持续时间比较()
注:房颤:心房颤动;rAAV9-NC:重组腺相关病毒血清型9 阴性对照;rAAV9-siNORAD:重组腺相关病毒血清型9 载体含用于沉默DNA 损伤激活的长链非编码RNA 的小干扰RNA;SB203580:p38 丝裂原激活的蛋白激酶抑制剂。与对照组比 *P<0.05;与房颤组比△P<0.05;与rAAV9-siNORAD 组比 ▲P<0.05;与SB203580 组比 #P<0.05
2.2 各组大鼠血清CK-MB、cTnI、炎性因子水平的比较(表3)
表3 各组大鼠血清CK-MB、cTnI、炎性因子水平比较()
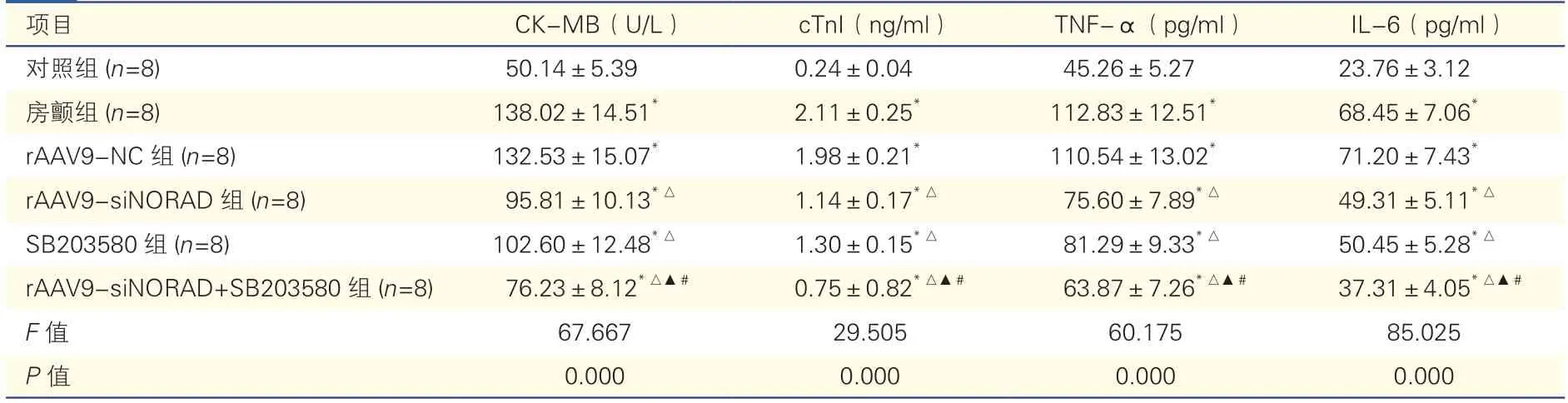
表3 各组大鼠血清CK-MB、cTnI、炎性因子水平比较()
注:房颤:心房颤动;rAAV9-NC:重组腺相关病毒血清型9 阴性对照;rAAV9-siNORAD:重组腺相关病毒血清型9 载体含用于沉默DNA 损伤激活的长链非编码RNA 的小干扰RNA;SB203580:p38 丝裂原激活的蛋白激酶抑制剂:cTnI:心肌肌钙蛋白I;CK-MB:肌酸激酶同工酶;TNF-α:肿瘤坏死因子-α;IL-6:白细胞介素-6。与对照组比*P<0.05;与房颤组比△P<0.05;与rAAV9-siNORAD 组比较 ▲P<0.05;与SB203580 组比较#P<0.05
与对照组相比,房颤组大鼠血清CK-MB、cTnI、TNF-α、IL-6 水平均明显升高(P均<0.05);与房颤组相比,rAAV9-siNORAD 组和SB203580 组大鼠血清CK-MB、cTnI、TNF-α、IL-6 水平均明显降低(P均<0.05);与rAAV9-siNORAD 组和SB203580 组相比,rAAV9-siNORAD+SB203580 组大鼠血清CKMB、cTnI、TNF-α、IL-6 水平均明显降低(P均<0.05)。
2.3 各组大鼠心房组织纤维化比较
Masson 染色结果显示,房颤组大鼠的心房组织有明显的纤维化改变,胶原纤维增生,排列紊乱,CVF 较对照组明显增加[(35.29±5.35)%vs.(1.41±0.23)%,P<0.05],房颤组和rAAV9-NC 组CVF[(32.63±4.82)%]及在心脏间质和血管周围组织的纤维化方面差异均无统计学意义。与房颤组相比,rAAV9-siNORAD 组和SB203580 组大鼠心房组织均可见蓝染的胶原纤维减少,CVF 分别为(21.48±2.79)%、(24.15±2.86)%均明显降低(P均<0.05);与rAAV9-siNORAD 组和SB203580 组相比,rAAV9-siNORAD+SB203580 组大鼠心房组织均可见蓝染的胶原纤维最少,CVF[(14.36±2.20)%]明显降低(P均<0.05),见图2。

图2 各组大鼠心房组织Masson 染色(×200)
2.4 各组大鼠心房组织lncRNA NORAD、COL1-A1和COL3-A1 的mRNA 表达比较(表4)
表4 各组大鼠心房组织lncRNA NORAD、COL1-A1 和COL3-A1 的mRNA 表达比较()
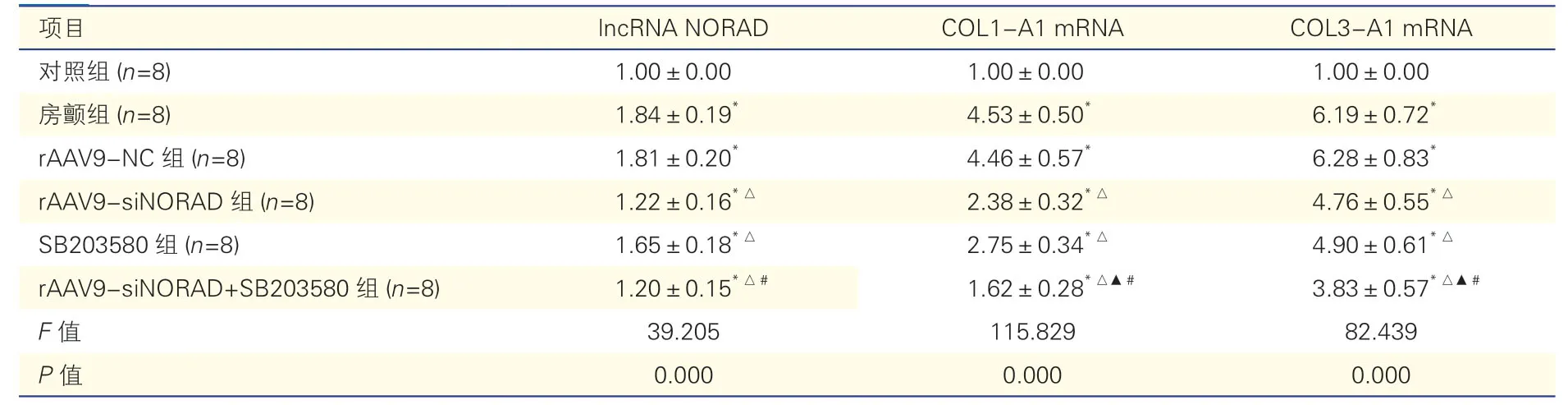
表4 各组大鼠心房组织lncRNA NORAD、COL1-A1 和COL3-A1 的mRNA 表达比较()
注:房颤:心房颤动;rAAV9-NC:重组腺相关病毒血清型9 阴性对照;rAAV9-siNORAD:重组腺相关病毒血清型9 载体含用于沉默DNA 损伤激活的长链非编码RNA 的小干扰RNA;SB203580:p38 丝裂原激活的蛋白激酶抑制剂;lncRNA NORAD:DNA 损伤激活的长链非编码RNA;COL1-A1:Ⅰ型胶原;COL3-A1:Ⅲ型胶原。与对照组比*P<0.05;与房颤组比△P<0.05;与rAAV9-siNORAD 组比较▲P<0.05;与SB203580 组比#P<0.05
与对照组相比,房颤组大鼠心房组织lncRNA NORAD、COL1-A1 和COL3-A1 的mRNA 水平明显升高(P均<0.05);与房颤组相比,rAAV9-siNORAD组和SB203580 组大鼠心房组织lncRNA NORAD、COL1-A1 和COL3-A1 的mRNA 水平明显降低(P均<0.05);rAAV9-siNORAD 组 和SB203580 组相比,rAAV9-siNORAD+SB203580 组大鼠心房组织COL1-A1和COL3-A1 的mRNA 水平明显降低(P均<0.05)。
2.5 各组大鼠心房组织p38 MAPK/NF-κB 通路相关蛋白表达比较(图3)
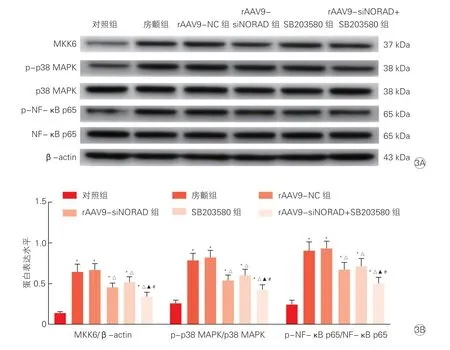
图3 各组大鼠心房组织p38 MAPK/NF-κB 通路相关蛋白水平比较
与对照组相比,房颤组大鼠心房组织MKK6 蛋白水平、p-p38 MAPK/p38 MAPK 和p-NF-κB p65/NF-κB p65 的比值均明显升高(P均<0.05);与房颤组相比,rAAV9-siNORAD 组和SB203580 组大鼠心房组织MKK6 蛋白水平、p-p38 MAPK/p38 MAPK和p-NF-κB p65/NF-κB p65 的比值均明显降低(P均<0.05);与rAAV9-siNORAD组和SB203580组相比,rAAV9-siNORAD+SB203580 组大鼠心房组织MKK6蛋白水平、p-p38 MAPK/p38 MAPK 和p-NF-κB p65/NF-κB p65 的比值均明显降低(P均<0.05)。
3 讨论
近年来,研究证实lncRNA 参与房颤的进展,并在心房纤维化中起重要作用,lncRNA NORAD 与心肌细胞损伤和心肌纤维化密切相关[10-12]。尾静脉注射ACh-CaCl2属于药物诱导建模,是目前建立房颤模型常用方法[13,17],而且有报道称,ACh-CaCl2建模后大鼠心房出现纤维化改变[13]。因此,本研究采用此方法成功建立了大鼠房颤模型,并在房颤大鼠中观察到lncRNA NORAD 上调,血清心肌损伤标志物(cTnI、CK-MB)和炎性因子(TNF-α、IL-6)水平升高,纤维化标志物胶原蛋白表达也上调,并且心房纤维化的程度增加。这提示,lncRNA NORAD的升高可能与房颤大鼠心房纤维化程度有关。
腺相关病毒(AAV)可用于在体内基因转移实验,且不同血清型对组织器官的嗜性各有不同,其中AAV9 在全身具有更广泛的表达分布,对心脏具有明显亲和性,已被广泛使用[18-19]。本研究采用rAAV9-siNORAD 注射到大鼠体内以敲低lncRNA NORAD,结果显示敲低lncRNA NORAD 可以降低房颤的发生率和持续时间,并降低COL1-A1 和COL3-A1 的mRNA 水平以及血清心肌损伤标志物和炎性因子水平,减轻心房纤维化。提示下调lncRNA NORAD 可减轻房颤大鼠心房纤维化。
炎症介导的心肌纤维化在房颤发展中起关键作用[20]。p38 MAPK 是MAPK 家族控制炎症反应最重要的成员,参与心脏重塑过程中与肥大和炎症相关的有害信号通路的激活,并参与心肌成纤维细胞中基质金属蛋白酶和胶原蛋白的调节[21-22]。在细胞受到刺激后,NF-κB p65 可发生磷酸化,上调IL-6 和TNF-α 水平,加剧心肌梗死后的炎症反应和心肌纤维化程度[23]。而且在心肌梗死后发生房颤的大鼠模型中,NF-κB p65 和p38 MAPK 的磷酸化水平增加,降低其磷酸化水平可缓解心肌梗死诱导的房颤的发生率和持续时间[7]。MKK6 是一种负责p38 MAPK 磷酸化的重要MAPK 激酶,可在应激刺激后激活p38 MAPK。本研究结果显示,房颤大鼠心房组织中MKK6 蛋白和p-p38 MAPK/p38 MAPK 和p-NF-κB p65/NF-κB p65 比值升高;说明房颤中p38 MAPK/NF-κB p65 通路被激活。敲低lncRNA NORAD 后,房颤大鼠心房组织MKK6 蛋白和p-p38 MAPK/p38 MAPK、p-NF-κB p65/NF-κB p65 比值明显降低,且与单独应用p38 MAPK 抑制剂SB203580 作用效果相似;且SB203580 和rAAV9-siNORAD 的联合应用对p38 MAPK/NF-κB p65 通路和心肌纤维化的抑制作用优于两者单独应用。提示,下调lncRNA NORAD 可能通过抑制p38 MAPK/NF-κB p65 通路激活对房颤大鼠发挥抗心肌纤维化作用。
综上所述,下调lncRNA NORAD 可减轻房颤大鼠心肌纤维化,其作用机制可能与抑制p38 MAPK/NF-κB p65 通路有关。本研究仅从动物水平上进行了初步探究,下一步将从体外细胞水平论证结果,并对右心房病理学变化深入观察探究。此外,由于NORAD 为非编码RNA,存在多个靶点,多方面调控的作用,是否能通过其他通路发挥作用,需进一步探索。
利益冲突:所有作者均声明不存在利益冲突
