兼具抗氧化及抗菌活性的玉米醇溶蛋白肽制备及其乳化特性
2022-07-02唐文婷孙庆杰王洪彩蒲传奋
唐文婷,孙 玥,孙庆杰,王洪彩,蒲传奋,*
(1.青岛农业大学食品科学与工程学院,山东 青岛 266109;2.山东禹王生态食业有限公司,山东 德州 251200)
食品乳液体系一般由水及油两种不相溶体系混合而成,常见的单层乳液根据分散相的不同可分为水包油(oil in water,O/W)和油包水(water in oil,W/O)两种类型。乳液为热力学不稳定体系,在贮藏过程中因多种理化因素影响,易出现絮凝、奥斯瓦尔德熟化、脂肪上浮(分层)、聚结和相转化等常见的热力学不稳定现象。为了维持乳液稳定,通常通过加入乳化剂降低界面张力。食品蛋白因其来源广泛、营养安全、具有一定的乳化性能,已应用于食品乳液中。在蛋白稳定的乳液体系中,蛋白吸附至油-水界面,降低了油-水界面张力,促进了油相在水相中的分散,抑制了液滴凝聚。蛋白的结构、氨基酸组成、吸附量、带电特性都会影响乳液的外观及贮藏稳定性。植物蛋白(大豆蛋白、大米蛋白、玉米蛋白、小麦蛋白等)及动物蛋白(酪蛋白、乳清蛋白、卵清蛋白等)均已被用于乳液的稳定。
食品乳液的连续相、界面层及分散相的成分各异,在加工贮藏过程中极易发生各种理化变化。如油脂在乳液中会发生水解或氧化等化学变化;界面层乳化剂可能会发生可逆性的界面吸附行为;而水相中则含有金属离子或者高浓度的盐、糖等,这些物质的存在可能对乳液的稳定性产生影响。除热力学不稳定因素外,乳液的微生物稳定性及油脂的氧化稳定性是乳液类产品的关注热点。在诸多乳液研究中,常添加氮化钠用于抑制乳液的微生物生长,但叠氮化钠有剧毒,显然不能添加于食品中。目前,构建具有抑菌功效的食源性乳液的策略主要是采用具有抑菌作用的植物精油作为油相,如雪松精油、百里香精油、丁香精油等。此外,在抑制乳液脂质氧化方面,使用蛋白和多酚复合物被证实可有效抑制油脂的氧化。如Zhao Tiantian等分别采用鳀鱼蛋白水解物和儿茶素、没食子酸、单宁酸的复合物抑制鱼油乳液的脂质氧化。Jia Xiao等证实大米蛋白和阿魏酸的复合物能够降低乳液贮藏过程中脂质氧化产物üü过氧化氢、硫代巴比妥酸反应物和己醛的浓度,提高乳液的脂质氧化稳定性。综上,开发同时具有抗氧化及抗菌功效的食源性蛋白类乳化剂,可为食源性蛋白在乳液食品中的潜在多功能应用提供理论参考,还可拓展新型蛋白乳液类食品的品类。
玉米醇溶蛋白为玉米深加工的主要副产品之一,是一种天然植物蛋白,含有50%以上的疏水性氨基酸,其中亮氨酸、脯氨酸和丙氨酸的含量较高,因此疏水性较高。玉米醇溶蛋白经酶水解后,可获得具有抗氧化、降糖、醒酒等多种生理功效的小分子肽。采用玉米醇溶蛋白及其水解产物稳定乳液已有关报道。但尚鲜见乳液制剂中耦合蛋白肽的抗氧化及抗菌性能的相关研究。且已有的玉米醇溶蛋白水解产物主要集中于水解所得混合肽类的蛋白水解物,而非确定氨基酸序列的蛋白肽。
因此,本实验在前期研究的基础上,采用胰蛋白酶和木瓜蛋白酶水解玉米醇溶蛋白,以1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除率、大肠杆菌()抑制率和乳化活性指数为指标,比较不同水解时间产物的抗氧化性及抗菌性能。以抗氧化、抗菌活性最高的组分为筛选对象,采用ÄKTA蛋白纯化系统和反相高效液相色谱分离纯化出单一组分,并经质谱分析鉴定其氨基酸序列。分别验证制备色谱收集和合成肽的双抗活性及乳化性能,并评价其稳定的O/W型乳液的贮藏稳定性、氧化稳定性和抗菌性能。研究结果可为新型绿色食源性蛋白肽类乳化剂的开发及应用提供新思路。
1 材料与方法
1.1 菌株、材料与试剂
菌株:大肠杆菌()、金黄色葡萄球菌()、枯草芽孢杆菌()、单核细胞增生李斯特菌()(以下简称单增李斯特菌),由青岛农业大学食品科学与工程学院微生物实验室提供。
玉米醇溶蛋白(纯度92%) 上海金穗生物科技有限公司;玉米油 中粮集团有限公司;LB培养基杭州微生物试剂有限公司;胰蛋白酶(1∶250)、木瓜蛋白酶(>200 U/mg) 上海麦克林生化科技有限公司;Spectra/Por透析袋(截留分子质量为100 Da)美国Spectrum公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)(纯度98%)、VC(纯度99%)、2,2’-联氮-双(3-乙基苯并噻唑啉-6-磺酸)(2,2’-azinobis-(3-ethylbenzothiazoline-6-sulphonic acid),ABTS)(纯度98%) 上海阿拉丁生化科技股份有限公司;乳酸链球菌素(Nisin) 山东元泰生物工程有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
YXQ-30SII全自动立式电热压力蒸汽灭菌锅上海博迅实业有限公司医疗设备厂;SW-CJ-2D超净工作台 苏净集团苏州安泰空气技术有限公司;LRH-70恒温恒湿培养箱 上海一恒仪器有限公司;BKPOLR电子显微镜 重庆奥特光学仪器有限公司;Free Zone 2.5冷冻干燥机 美国Labconco公司;ÄKTA蛋白纯化系统 美国GE公司;高效液相色谱(high performance liquid chromatography,HPLC)系统 美国Agilent公司;PREP 150LC制备型液相色谱仪、MALDI SYNAPT QTof MS基质辅助激光解析电离四极杆飞行时间质谱(matrix-assisted laser desorption/ionization quadrupole time-of-flight mass spectrometry,MALDI Q-TOF MS)仪 美国Waters公司;BS-16A自动部分收集器 上海沪西分析仪器厂有限公司;Infinite F50酶标仪 瑞士Tecan公司;Mastersizer 2000激光粒度分析仪英国Malvern公司。
1.3 方法
1.3.1 玉米醇溶蛋白水解物的制备
1.3.1.1 玉米醇溶蛋白胰蛋白酶水解产物的制备
在预实验基础上,配制6 g/100 mL玉米醇溶蛋白分散液(800 mL),调节pH值至8.0,磁力搅拌条件下加入底物质量2%的胰蛋白酶,采用pH-state法于37 ℃反应2 h,分别于0、10、20、30、60、120 min取出100 mL,沸水浴加热10 min钝化蛋白酶,调节pH值至7.0。所得水解产物离心15 min(10 000h、4 ℃),上清液经100 Da透析袋透析,冻干备用。
1.3.1.2 玉米醇溶蛋白木瓜蛋白酶水解产物的制备
在预实验基础上,配制6 g/100 mL玉米醇溶蛋白分散液(800 mL),调节pH值至6.0,磁力搅拌条件下加入底物质量1.5%的木瓜蛋白酶,采用pH-state法于40 ℃反应2 h,分别于0、10、20、30、60、120 min取出100 mL,沸水浴加热10 min钝化蛋白酶,调节pH值至7.0。所得水解产物离心15 min(10 000h、4 ℃),上清液经截留分子质量100 Da透析袋透析,冻干备用。
1.3.2 玉米醇溶蛋白水解物的分离纯化
根据DPPH自由基清除率和抑菌率的实验结果,分别采用凝胶色谱和反相色谱对玉米醇溶蛋白木瓜蛋白酶水解60 min的产物进行分离。使用ÄKTA蛋白纯化系统(配有SuperdexSuperdex peptide 10/300GL型凝胶柱)对卵白玉米醇溶蛋白水解物进行粗分。分别采用2 倍柱体积的体积分数20%乙醇溶液、超纯水、体积分数30%乙腈溶液(含0.1%三氟乙酸)对凝胶柱进行洗脱平衡。蛋白水解物配成10 mg/mL溶液,经0.22 μm滤膜过滤后上样(0.5 mL)。采用体积分数30%乙腈溶液(含0.1%三氟乙酸)以0.5 mL/min流速洗脱2 倍柱体积。检测波长220 nm,自动收集器收集各吸收峰对应组分,并冷冻干燥。将上述各吸收峰对应冻干组分配成2 mg/mL的溶液,经0.22 μm滤膜过滤后采用反相HPLC(配有Kromasil C柱(250 mmh10 mm))分离。色谱条件:柱温25 ℃,流动相A为体积分数0.1%三氟乙酸溶液,流动相B为含0.1%三氟乙酸的体积分数80%乙腈溶液,流速0.5 mL/min,线性梯度洗脱(30 min内0~100% B),紫外检测波长215 nm。色谱分离过程中,收集各吸收峰对应的组分,冻干、复溶并检测其DPPH自由基清除率和抑菌率。
1.3.3 玉米醇溶蛋白氨基酸序列鉴定
纯化所得反相色谱单峰所对应的组分采用MALDI Q-TOF MS进行氨基酸序列分析。图谱采用正离子(ESI+)采集模式。质谱条件为源温度100 ℃;毛细管电压3.5 kV;检测电压1 700 V;锥孔电压40 V;锥孔气流速500 L/h;脱溶剂温度300 ℃;脱溶剂气流速300 L/h;碰撞能量6 eV。质谱所得数据采用仪器自带软件Masslynx V4.1进行氨基酸序列分析。
1.3.4 抗氧化性质测定
1.3.4.1 DPPH自由基清除率
根据周浓等的方法稍作修改测定DPPH自由基清除率。取1 mL样品溶液(0.5 mg/mL)与2 mL 0.2 mmol/L的DPPH-乙醇溶液充分混合,并于室温下避光反应30 min,反应结束后,以等体积乙醇代替样品加入到DPPH-乙醇溶液中作为空白,在517 nm波长处测定样品吸光度。样品DPPH自由基清除率按公式(1)计算。

式中:为样品+DPPH-乙醇溶液的吸光度;为样品+不含DPPH的乙醇溶液的吸光度;为等体积乙醇代替样品+DPPH-乙醇溶液的吸光度。
1.3.4.2 ABTS阳离子自由基清除率
将ABTS固体粉末溶于10 mL的pH 7.4、0.1 mol/L磷酸盐缓冲液(phosphate buffered saline,PBS),使ABTS终浓度为2.45 mmol/L。然后向其中加入0.006 6 g过硫酸钾,避光保存16 h后作为ABTS工作液。将1 mL样品溶液(0.5 mg/mL)与3.0 mL ABTS工作液充分混合,避光反应5 min,使用磷酸盐缓冲液替代样品作为空白,以不含ABTS的PBS为对照,在734 nm波长处测定样品吸光度。样品的ABTS自由基清除率按公式(2)计算。

式中:为样品+ABTS工作液的吸光度;为样品+不含ABTS的PBS的吸光度;为PBS+ABTS工作液的吸光度。
1.3.4.3 铁离子还原能力
样品的铁离子还原能力采用Jin Hua等的方法进行测定。取0.2 mL样品溶液(0.5 mg/mL)与1.0 mL质量分数1%铁氰化钾溶液混合。混合物在50 ℃下保温20 min后冷却至室温。再将1.0 mL的质量分数10%三氯乙酸溶液添加至上述混合物中,10 000h离心15 min。取上清液,采用去离子水稀释2 倍,之后加入400 µL质量分数0.1% FeCl溶液。旋涡振荡均匀并静置10 min后,在700 nm波长处测定吸光度,以等体积的水代替样品溶液作为空白对照,以样品溶液与空白对照吸光度的差(Δ)表示样品还原能力。
上述抗氧化活性分析中以相同浓度的VC作为阳性对照,以不含肽的PBS(0.1 mol/L、pH 7.4)作为阴性对照。
1.3.5 抑菌活性的测定
1.3.5.1 最小抑菌浓度的测定
通过微量稀释法测定样品对指示菌的最小抑菌浓度(minimal inhibit concentration,MIC)。离心(4 000 r/min、4 ℃、20 min)收集菌体,采用灭菌PBS洗涤3 次并将菌体浓度重悬至1h10CFU/mL。将玉米醇溶蛋白肽通过灭菌PBS(10 mmol/L、pH 7.2)配制成1.024 mg/mL的母液,经0.22 μm滤膜过滤除菌,并用灭菌PBS梯度稀释至不同质量浓度。分别将50 μL不同质量浓度肽溶液、100 μL受试菌液和100 μL培养基移入灭菌平底96 孔板,振荡均匀后于37 ℃培养24 h,酶标仪测定每孔OD。阳性对照组采用Nisin,阴性对照组采用等体积不含肽的PBS。与初始值相比,OD不再增加的样品最小浓度即为MIC。
1.3.5.2 抑菌率的测定
采用液体培养法测定玉米醇溶蛋白肽的抑菌效果。培养至对数期的待测菌株离心(4 000 r/min、4 ℃、20 min)并收集菌体,采用灭菌PBS(10 mmol/L、pH 7.2)洗涤3 次并重悬至菌体浓度为1h10CFU/mL。向灭菌96 孔板中依次加入100 μL培养基、100 μL菌悬液和50 μL经过滤除菌的蛋白肽(50.0 μg/mL),以灭菌生理盐水代替蛋白水解液作为空白组。混匀后置于37 ℃恒温培养箱中培养24 h,酶标仪测定OD,并按式(3)计算抑菌率。

式中:OD为空白组OD;OD为样品组OD。
1.3.6 玉米醇溶蛋白肽的制备
分别采用制备液相色谱和化学合成的方法制备玉米醇溶蛋白肽。制备液相色谱样品按上述分离方法进行预处理,在最后色谱分离阶段采用PREP 150LC制备型液相色谱分离制备并收集,色谱条件:流速:5 mL/min;检测波长:214 nm;进样量:3 mL;流动相A为超纯水,流动相B为100%甲醇。洗脱程序:0~15 min,95%~90%流动相A;15~30 min,95%~90%流动相A;30~60 min,30%~10%流动相A。色谱柱为SunFire Prep COBD(19 mmh250 mm,5 μm)。化学合成样品采用固相合成法,委托上海楚肽生物科技有限公司合成。合成粗肽采用1.3.2节中HPLC法进行纯化(纯度≥95%),采用1.3.3节中MALDI Q-TOF MS法验证合成肽的氨基酸序列。
1.3.7 乳液制备
将一定量的玉米醇溶蛋白水解产物用去离子水分散至1 g/100 mL,按油相体积分数10%加入玉米油,采用高速剪切(10 000 r/min)处理10 min,再采用探头(探头直径6 mm)式超声处理10 min(600 W,工作1 s,停止1 s),制备水包油乳液。
1.3.8 乳化活性指数及乳化稳定性测定
玉米醇溶蛋白水解产物稳定的乳液采用0.1%十二烷基硫酸钠溶液稀释100 倍,于500 nm波长处测定其吸光度,按式(4)计算乳化活性指数(emulsifying activity index,EAI)。样品于室温下静置10 min后再次于500 nm波长处测定吸光度,按式(5)计算乳化稳定性(emulsion stability index,ESI)。作为比较,同时测定了吐温-80稳定的乳液的EAI和ESI。

式中:为稀释倍数(100);为蛋白的质量浓度/(g/mL);为乳液油相体积分数/%;为样品0 min的吸光度;为样品10 min时的吸光度。
1.3.9 乳液粒径及Zeta-电位测定
采用Zetasizer Nano-ZS90激光粒度仪测定乳液的粒径、多分散系数(polydispersity index,PDI)和Zeta-电位。为了避免多重光散射对测定的影响,采用去离子水稀释样品500 倍。连续相和分散相的折光指数分别为1.333和1.475,所有测试均在25 ℃下进行。每个样品测定重复3 次,结果以平均值表示。
1.3.10 乳液贮藏稳定性分析
将新制备的乳液在25 ℃下避光放置30 d,每5 d取出适量按照1.3.9节方法测定其粒径、PDI和Zeta-电位。
1.3.11 乳液氧化稳定性分析
1.3.11.1 过氧化值测定
过氧化值(peroxide value,POV)的测定参考Jin Hua等的方法。将样品置于45 ℃烘箱中加速氧化,于设定时间取出0.2 mL乳液与1.13 mL的异辛烷和0.37 mL的异丙醇混合,旋涡振荡1 min后,5 000h离心30 min。离心结束后,取0.2 mL的异辛烷-异丙醇萃取液(下层)与1.87 mL甲醇和0.93 mL正丁醇混合。向混合液中加入15 μL 3.94 mol/L硫氰酸铵和15 μL亚铁溶液并旋涡振荡。混合物避光静置20 min后,于510 nm波长处测定吸光度。通过过氧化氢异丙苯质量浓度-吸光度绘制标准曲线,计算样品POV,单位为mg/kg。
1.3.11.2 硫代巴比妥酸反应物含量测定
硫代巴比妥酸反应物(thiobarbituric acid reactive substances,TBARS)含量测定参考Jin Hua等的方法并稍加修改。取乳液样品和2.0 mL 0.02 mol/L硫代巴比妥酸溶液等体积混合并于沸水浴中反应15 min。冷却至室温后,样品以5 000h离心15 min。 取上清液,在532 nm波长处测定吸光度。通过丙二醛质量浓度-吸光度绘制标准曲线确定样品的TBARS含量。
1.3.12 乳液抗菌性分析
乳液的抗菌性能采用纸片扩散法评价。选择培养至对数期的待测菌株,制备1h10CFU/mL的菌悬液。移取100 μL的菌悬液至固体培养基上,并均匀涂布。将直径为6 mm的灭菌滤纸片浸入10 倍稀释乳液中1 min,取出沥去多余液体,并放置于涂布有菌悬液的培养基表面,于37 ℃下孵育24 h。孵育结束后,测定抑菌圈直径。按式(6)计算乳液抑菌率。

1.4 数据统计与分析
所有数据均为3 次重复试验结果,表示为平均值±标准差。采用Origin软件进行图表绘制,采用SPSS 23.0软件进行数据分析。
2 结果与分析
2.1 玉米醇溶蛋白水解产物的DPPH自由基清除能力和E.coli抑菌率
在预实验基础上,分别采用胰蛋白酶和木瓜蛋白酶对玉米醇溶蛋白水解处理不同时间,并通过分析水解产物DPPH自由基清除能力和抑菌率评价各水解产物的抗氧化能力和抑菌能力。DPPH自由基是抗氧化活性评价中最常用的自由基之一,DPPH自由基含3个苯环,苯环中间的氮原子上含一个孤对电子。在DPPH自由基清除实验中,当DPPH自由基与具有抗氧化活性的物质反应时,该孤对电子被配对,DPPH的深紫色自由基被还原成非自由基形式而褪色。在自然界中分布广泛,也存在于人和动物肠道中,为条件致病菌,故选取为评价指示菌。由图1A可见,在水解前30 min内,玉米醇溶蛋白胰蛋白酶水解产物的DPPH自由基清除率和抑菌率迅速增大至最大值。在之后的90 min水解时间内,胰蛋白酶水解产物的抑菌率由46.5%下降至19.8%;DPPH自由基清除率在30~60 min内保持稳定,之后在120 min时下降至59.8%。而木瓜蛋白酶水解产物在60 min时表现出最高的DPPH自由基清除率和抑菌率,且其最大DPPH自由基清除率高于胰蛋白酶水解产物(图1B)。两种蛋白水解产物的DPPH自由基清除率和抑菌率随水解时间的差异性变化可能与蛋白酶的特异性作用位点及不同水解时间的水解度差异有关。胰蛋白酶的酶切位点为精氨酸和赖氨酸,木瓜蛋白酶优先切割的位点为精氨酸、赖氨酸和苯丙氨酸。水解时间的延长导致多肽水解程度及多肽产率增加,进而影响产物的分子质量和多肽中亲、疏水性氨基酸的组成。Kong Baohua等研究表明,玉米醇溶蛋白的碱性蛋白酶水解物具有较高的抗氧化能力,在较低浓度下可与丁基羟基茴香醚、-生育酚、抗坏血酸等抗氧化剂相媲美。研究发现,玉米蛋白水解物的抗氧化能力与其分子质量和疏水性有关。玉米醇溶蛋白的6种蛋白酶水解产物同样具有抗菌活性,其中胃蛋白酶水解产物表现出最强的抗菌活性,且在121 ℃条件处理20 min后仍能保持活性。

图1 玉米醇溶蛋白胰蛋白酶(A)和木瓜蛋白酶(B)水解产物DPPH自由基清除能力和E.coli抑菌率Fig.1 DPPH radical scavenging capacity and inhibition percentage against E.coli of trypsin (A) and papain (B) hydrolysates derived from zein
2.2 玉米醇溶蛋白水解产物的乳化性能
以EAI为指标,进一步分析了玉米醇溶蛋白两种蛋白酶水解产物的乳化性能。与未水解蛋白相比,两种蛋白酶水解产物表现出不同的乳化活性。在整个120 min的消化时间范围内,胰蛋白酶水解产物的EAI持续升高至27.7 m/g,而木瓜蛋白酶水解产物的乳化性能在60 min处即达到稳定(EAI为32.8 m/g),继续水解并未导致EAI的进一步增加(图2)。玉米醇溶蛋白经适度水解后,其分子质量变小,肽链分子柔性增加,具有更好的油-水界面吸附能力。Wang Yonghui等报道了玉米醇溶蛋白的碱性蛋白酶水解产物具有两亲性和界面活性。张京京等同样发现,玉米醇溶蛋白的碱性蛋白酶水解产物较未水解的蛋白乳化性能提高5.36 倍。综合考虑DPPH自由基清除能力和抑菌率的结果,选择玉米醇溶蛋白木瓜蛋白酶水解60 min的产物作为下一步分离分析对象,记为ZPH60。

图2 玉米醇溶蛋白胰蛋白酶和木瓜蛋白酶水解产物的EAIFig.2 Emulsifying activity indexes of trypsin and papain hydrolysates derived from zein
2.3 玉米醇溶蛋白水解产物ZPH60的分离纯化结果
采用ÄKTA蛋白纯化系统对玉米醇溶蛋白水解物ZPH60进行粗分,其洗脱图谱如图3A所示,得到6个主要洗脱峰。收集各洗脱峰组分冻干复溶并测定DPPH自由基清除率和抑菌率,仅发现组分2和组分6同时具有抗氧化能力和抗菌活性(图3B)。其中组分6的DPPH自由基清除率和抑菌率明显高于组分2。因此,选择组分6(记为ZPH60-6)经反相HPLC再次分离得到10个洗脱组分,收集各部分并测定DPPH自由基清除率和抑菌率(图4)。其中组分8在0.5 mg/mL质量浓度下表现出46.70%的DPPH自由基清除率,在50 μg/mL质量浓度下对具有68.87%的抑菌率。

图3 蛋白纯化系统分离ZPH60洗脱图谱(A)及各洗脱峰组分DPPH自由基清除率和E.coli抑菌率(B)Fig.3 Elution profile of ZPH60 separated using ÄKTA protein purification system (A) and DPPH radical scavenging capacity and inhibition percentage against E.coli of each elution peak (B)

图4 ZPH60-6的HPLC图谱(A)、各洗脱峰组分的DPPH自由基清除率和E.coli抑菌率(B)以及组分8的HPLC图谱(C)Fig.4 HPLC profile of ZPH60-6 (A), DPPH radical scavenging capacity and inhibition percentage against E.coli of each elution peak (B)and HPLC profile of active peak 8 (C)
2.4 玉米醇溶蛋白水解产物ZPH60的氨基酸序列分析结果
采用反相HPLC对收集所得组分8进行检测,结果如图4C所示,主峰峰型对称单一,其纯度在96.1%以上,满足进行质谱分析氨基酸序列的要求。在质谱分析中,高能场轰击带电多肽使其断裂形成多肽片段离子,得到其二级质谱图(图5A)。通过氨基酸序列分析得出,该活性峰的氨基酸序列为LLAH(Leu-Leu-Ala-His)(图5B),使用ExPASy(http://www.expasy.ch/)的omputer pI/Mw预测软件分析其理论等电点为6.74,理论分子质量为452.55 Da,与测定分子质量452.39 Da相符。
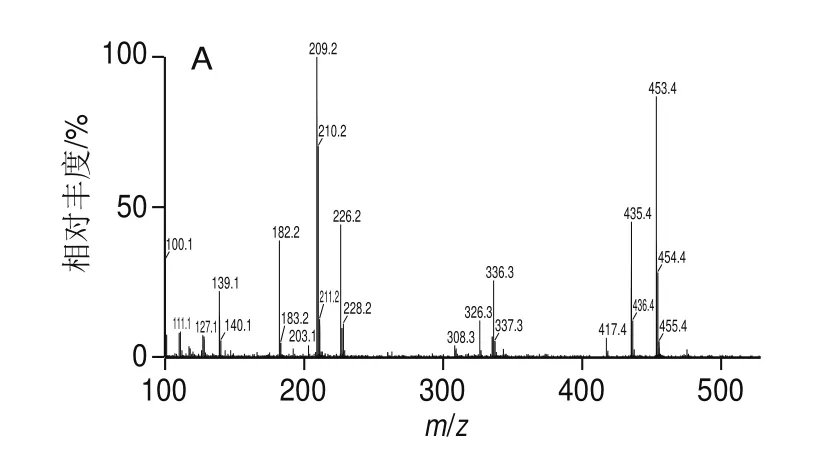

图5 ZPH60-6-8的质谱图(A)和氨基酸序列分析(B)Fig.5 Mass spectrum (A) and amino acid sequence analysis (B)of ZPH60-6-8
2.5 玉米醇溶蛋白LLAH的抗氧化、抗菌及乳化能力
清除自由基能力是评价体外抗氧化活性的常用方法。除DPPH自由基外,ABTS阳离子自由基也是常用的自由基之一。ABTS法是基于ABTS与过硫酸钾反应生成蓝绿色阳离子自由基,抗氧化物质能与自由基发生反应而使反应体系褪色的原理构建。还原能力的测定原理是抗氧化活性物质可还原铁氰化钾中的Fe成为亚铁氰化钾的Fe,再进一步和FeCl反应生成700 nm波长处有最大吸光度的Fe[Fe(CN)](普鲁士蓝)。DPPH自由基、ABTS阳离子自由基的清除率和Δ越大则说明样品的抗氧化活性越强。表1显示,通过制备液相色谱收集和化学合成的LLAH具有相近的自由基清除能力和还原能力。LLAH的DPPH自由基清除能力、ABTS阳离子自由基清除能力约为VC的50%,但其铁离子还原能力与后者相近。之前的研究也证实,玉米黄粉经碱性蛋白酶水解后,可获得氨基酸序列为LDYQ(Leu-Asp-Tyr-Gln)的高纯度抗氧化肽。

表1 玉米醇溶蛋白LLAH的抗氧化能力Table 1 Antioxidant capacity of zein peptide LLAH
LLAH中的碱性氨基酸组氨酸可能由木瓜蛋白酶选择性水解碱性氨基酸位点产生,其羧基可同金属离子螯合,钝化金属离子,从而抑制了自由基链式。此外,亮氨酸在该肽中占据了50%的氨基酸比例。在已报道的抗氧化肽中,一定比例的亮氨酸残基被认为是有益于抗氧化活性的。据报道,氨基酸序列为LPF(Leu-Pro-Phe)、LLPF(Leu-Leu-Pro-Phe)和 FLPF(Phe-Leu-Pro-Phe)的3种玉米蛋白肽具有DPPH自由基和ABTS阳离子自由基清除能力,这些肽由玉米粉经碱性蛋白酶和风味蛋白酶水解所获得,肽段氨基酸序列中的Leu残基被认为与玉米蛋白肽的抗氧化活性有关。鱼皮胶原蛋白抗氧化肽HGPLGPL(His-Gly-Pro-Leu-Gly-Pro-Leu)中亮氨酸的比例同样较高。
由表2可知,分离所得及化学合成的LLAH对受试革兰氏阳性细菌(、、)和革兰氏阴性细菌()的生长均有抑制作用,而Nisin对革兰氏阴性细菌()未表现出抑制活性。LLAH对不同菌株生长的抑制能力各有不同,其对、、、的MIC分别为8.0、8.0、32.0、16.0 μg/mL;这可能是LLAH对各细菌的抑制机理不同所致。相同质量浓度(50.0 μg/mL)下分离纯化所得LLAH对各受试菌株的抑制效果均高于化学合成LLAH,这可能是化学合成过程中副反应的发生以及组氨酸的消旋引起的。Kang等发现玉米醇溶蛋白的胃蛋白酶水解产物中低于3 000 Da的组分显示出极大的抗菌活性,并从其中分离出N端序列同样是亮氨酸的抗菌肽,与本研究中分离所得的N端氨基酸相同,提示玉米醇溶蛋白肽中N端的亮氨酸对抗菌活性有贡献。

表2 玉米醇溶蛋白LLAH的抗菌能力Table 2 Antibacterial capacity of zein peptide LLAH
由表3可知,分离纯化所得LLAH及化学合成的LLAH的EAI分别为69.22 m/g和69.53 m/g,与吐温-80相当。LLAH N端的两个亮氨酸为疏水性氨基酸,C端组氨酸为亲水性氨基酸,因此,该肽的亲水性和疏水性氨基酸较为集中,具有较好的两亲性能,可吸附并稳定地分布在乳液液滴的水-油界面。
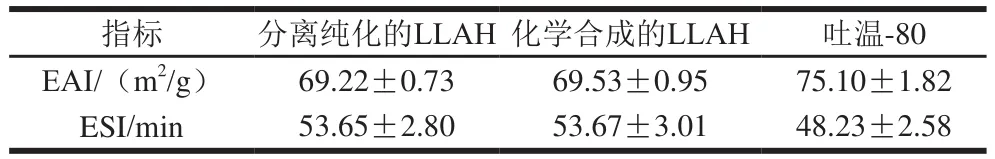
表3 玉米醇溶蛋白LLAH的乳化能力Table 3 Emulsifying capacity of zein peptide LLAH
2.6 乳液的粒径分布及微观形貌
表4为LLAH和吐温-80稳定乳液的平均粒径、Zeta-电位和PDI。两种乳液的液滴平均粒径均小于300 nm,Zeta-电位绝对值大于30 mV,且PDI小于0.3。Zeta-电位绝对值大于30 mV可认为乳液液滴之间具有足够的静电斥力以维持胶体体系的稳定性,这和两者PDI均小于0.3相互印证。与吐温-80稳定的乳液相比,LLAH稳定的乳液液滴粒径略小,且其PDI较小,表明LLAH具有与吐温-80相当的乳化能力,且分散性更为均一。由图6可见,吐温-80稳定的乳液具有较大的粒径分布范围,且显微镜观察可见,吐温-80稳定的乳液较LLAH稳定的乳液表现出更多的液滴聚集。

表4 LLAH和吐温-80稳定乳液的平均粒径、Zeta-电位和PDITable 4 Average particle size, zeta potential and polydispersity index(PDI) of LLAH or Tween-80 stabilized emulsion

图6 玉米醇溶蛋白肽LLAH及吐温稳定的乳液的粒径分布及显微镜图Fig.6 Particle size distribution and microscopic image of zein peptide LLAH or Tween-80 stabilized emulsion
2.7 乳液的稳定性
2.7.1 乳液的贮藏稳定性
图7A显示,LLAH及吐温-80稳定的乳液在30 d贮藏期内的平均粒径并无明显差异,在初始5 d内,两者的平均粒径均无明显变化,在10 d之后开始随贮藏时间的延长而缓慢增加。与新鲜制备的乳液相比,LLAH稳定的乳液在贮藏30 d之后,平均粒径由(263.4±3.5)nm增至(313.8±2.4)nm,增幅为19.1%。吐温-80稳定乳液的平均粒径由(286.8±3.5)nm增加至(338.7±7.9)nm。LLAH表现出较吐温-80较小的液滴尺寸。Dalgleish等指出,液滴的布朗运动速率与其粒径呈负相关,小液滴进行快速的布朗运动,可以在长期存储条件下实现在重力作用下的均匀分布。LLAH稳定乳液的较小粒径表明其可以更好地抵御重力沉降作用。此外,根据乳液的PDI和Zeta-电位分析,LLAH稳定的乳液在30 d内,PDI和Zeta-电位分别由0.210、-41.87 mV变化至0.227、-39.87 mV;吐温-80稳定乳液的PDI和Zeta-电位则分别由0.289、-35.78 mV变化至0.318、-35.02 mV。更小的尺度多分散特性和较高的Zeta-电位绝对值表明LLAH具有更好的乳液稳定效果。通常认为,Zeta-电位绝对值大于30 mV的胶体分散系因具有较大的静电排斥作用而是稳定的,因此,尽管吐温-80稳定乳液具有较高的PDI和较小的Zeta-电位,仍可认为制备的两种乳液在30 d贮藏期内具有较好的贮藏稳定性。

图7 玉米醇溶蛋白肽LLAH及吐温-80稳定的乳液的贮藏稳定性(A)及加速氧化过程中TBARS含量(B)和POV(C)变化Fig.7 Changes in storage stability (A), POV (B) and TBARS content (C)during accelerated oxidation of zein peptide LLAH and Tween-80 stabilized emulsion
2.7.2 LLAH稳定乳液的氧化稳定性
乳液的氧化稳定性分别通过POV和TBARS含量来评价脂质初级氧化产物和次级氧化产物的生成状况。初级氧化产物主要由不饱和脂肪酸氧化产生,TBARS主要由脂质氢过氧化物分解产生。图7B、C显示,新鲜制备的吐温-80稳定乳液中POV和TBARS含量分别为0.63 mg/kg和0.89 mg/kg。加速氧化过程中,吐温-80稳定乳液POV和TBARS含量随贮藏时间延长呈持续上升趋势,在第30天时分别达到6.78 mg/kg和7.32 mg/kg,表明该乳液在贮藏期间经历了脂质氧化。与吐温-80组相比,LLAH稳定乳液的POV和TBARS含量在30 d贮藏期间无明显变化,表现出较缓慢的氧化历程。这表明LLAH可以减少油相与氧气之间的相互作用以及降低脂质的氧化程度。油-水界面是脂质作为分散相和连续相水相的接触区域,乳液中脂质氧化主要发生在油-水界面,因此可以认为,LLAH的抗氧化性能极大地影响了乳液的氧化稳定性。LLAH的自由基清除能力和铁离子还原能力暗示其可以通过发挥断链型抗氧化剂作用,实现抑制脂质氢过氧化物分解成过氧化自由基和烷氧基的反应,并进一步阻止自由基继续作用于不饱和脂肪酸进而生成自由基的反应。Shen Yating等同样基于POV和TBARS含量进行分析研究,发现玉米粉的中性蛋白酶水解产物能显著改善乳液的氧化稳定性,且乳液脂质氧化抑制效果与玉米粉蛋白酶水解产物呈剂量依赖关系,高浓度的水解产物对乳液脂质氧化表现出更有效的抑制作用。
2.7.3 乳液抗菌性分析结果
采用抑菌率来评价乳液的抑菌活性,由表5可见,吐温-80稳定的乳液并未检测到抑菌活性,而LLAH稳定的乳液对4种受试菌株均表现出抑菌效果,表明油-水界面的LLAH仍能在乳液制剂中发挥抑菌活性。Nielsen和Lou Zaixiang等的研究证实将精油转化成乳液能够保留其抑菌活性。Moghimi等认为,乳液制剂使得抑菌成分更好地作用于受试菌株的损伤细胞膜中,克服了抑菌成分不能直接作用于细胞膜的缺陷。

表5 玉米醇溶蛋白肽LLAH及吐温-80稳定的乳液的抑菌率Table 5 Antibacterial capacities of zein peptide LLAH or Tween-80 stabilized emulsion
3 结 论
本实验采用胰蛋白酶和木瓜蛋白酶分别水解玉米醇溶蛋白,比较两种酶解不同时间酶解产物的DPPH自由基清除率和对大肠杆菌的抑菌率,选择高抗氧化和抑菌活性组分作为分离对象,结合透析、凝胶色谱、反相色谱纯化及质谱分析,得到了氨基酸序列为LLAH的双抗活性肽。该肽在0.5 mg/mL质量浓度下具有一定的DPPH自由基清除率、ABTS阳离子自由基清除率和铁离子还原能力,在质量浓度为32 μg/mL时对大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌和单增李斯特菌具有抑制活性。经该肽稳定的乳液平均粒径为(263.4±3.5)nm,同样具有抑菌活性、贮藏稳定性和氧化稳定性。本研究结果为具有双抗活性的玉米醇溶蛋白肽的分离鉴定及在乳液制剂中的使用提供了理论参考,同时可拓宽玉米醇溶蛋白的高值化加工和利用途径。
