中性粒细胞/淋巴细胞比值在评估早期脊髓损伤严重程度中的应用研究
2022-07-02洪健侯景明程成陈辉段霞刘宏亮
脊髓损伤(Spinal cord injury, SCI)是一种严重致残性疾病
。目前对SCI严重程度的评定相对可靠的方法有美国SCI协会(American Spinal Injury Association,ASIA)损伤分级以及神经电生理检查等。患者在遭遇创伤的早期通常经历脊髓休克期,在此期间临床上无法得到准确可靠的ASIA损伤分级或神经电生理结果,这个过程可能长达3~6周
。因此,早期判断SCI患者的损伤严重程度是康复科医师常面对的临床难题,这极大地阻碍了SCI患者个体化康复计划的制定和预后的评估。外周血常规是SCI患者入院早期的常规检查之一。中性粒细胞/淋巴细胞比值(Neutrophil-to-lymphocyte ratio,NLR)可以通过外周血常规结果计算得出,能可靠反映机体免疫炎症反应程度的指标。SCI后的炎症免疫级联反应导致的继发性损伤一定程度上决定了SCI的严重程度。NLR是否能用于评估脊髓损伤患者早期的严重程度,目前尚缺乏临床证据。本研究通过回顾性分析62例SCI患者的临床资料,探讨分析NLR在评估早期SCI严重程度上的价值。
1 资料与方法
1.1 一般资料 回顾性纳入2010年6月~2021年1月由陆军军医大学附属西南医院急诊收入并转入康复科住院治疗的SCI患者62例。纳入标准:年龄16~80岁,性别不限; 符合SCI神经学分类国际标准(2011版);在SCI后急诊入院;由我院急诊科转入康复科行后续康复治疗,且有完整康复评定数据的患者。排除标准:亚急性或慢性SCI急性加重者;马尾神经或神经根损伤者;合并创伤性脑损伤、脑出血、严重胸部损伤、腹腔脏器损伤及严重四肢、骨盆骨折者。本研究已获得我院医学伦理委员会批准通过(批号:(B)KY2021154)。
1.2 方法 收集所有纳入患者的数据资料:①一般资料:性别、年龄、致伤原因、首次采血时间(距离受伤时间)、是否手术治疗、手术距离受伤时间;②实验室检验结果:患者入急诊重症监护室的首次静脉血常规(白细胞计数、中性粒细胞计数、淋巴细胞计数、单核细胞计数、红细胞计数、血红蛋白水平),计算NLR值;③SCI评定结果:患者渡过脊髓休克期后(以球海绵体反射阳性、损伤平面以下出现肌力或肌张力升高、损伤平面以下可引出反射,出现其中任一表现则判定为脊髓休克期结束)首次评定的ASIA损伤分级
。根据ASIA损伤分级将纳入的62例患者分为完全性运动损伤组(ASIA损伤分级A级或B级)35例,不完全性运动损伤组(ASIA损伤分级C级、D级)27例。
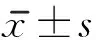
2 结果
2.1 纳入患者的基本特征 共纳入62例符合研究标准的SCI患者,其中男51例(82.26%),女11例(17.74%);年龄(40.31±13.33)岁;致伤原因为高坠伤29例(46.77%),车祸伤13例(20.97%),其他原因(砸伤、摔伤、刀刺伤等)20例(32.26%);首次采血时间33.00(21.75,68.00)h;经手术治疗者58例(93.55%),未手术者4例(6.45%);手术距离受伤时间126.00(90.50,194.25)h。2组间患者在性别、年龄、致伤原因、首次采血时间(距离受伤时间)、是否手术治疗、手术距离受伤时间的差异均无统计学意义。见表1。

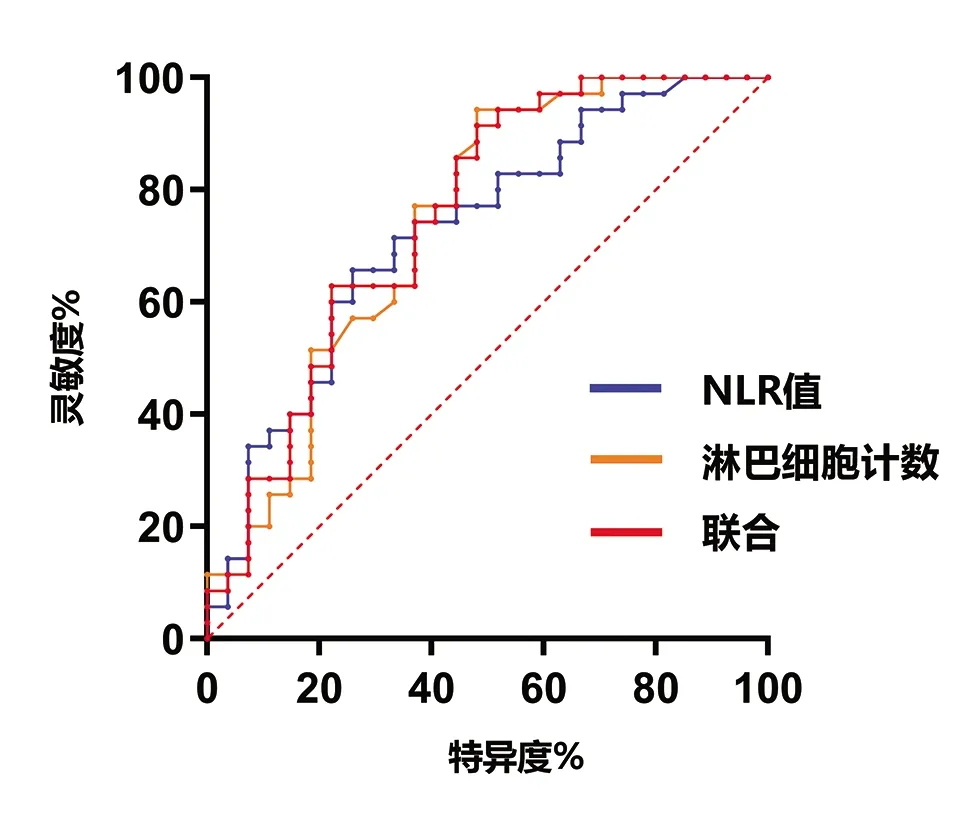
2.4 NLR值及淋巴细胞计数对脊髓完全性运动损伤的评估价值 ROC曲线显示,NLR值的曲线下面积为0.726(95%CI:0.598~0.854,
<0.05),当截断值为9.711时,有最大约登指数0.398,其敏感度为65.71%,特异度为74.07%;淋巴细胞计数的曲线下面积为0.740(95%CI:0.610~0.870,
<0.05),当截断值为1.220时,有最大约登指数0.461,其敏感度为94.29%,特异度为51.85%;二者联合的曲线下面积为0.751(95%CI: 0.625~0.878,
<0.05),二者联合的ROC曲线下面积与NLR值、淋巴细胞计数各自曲线下面积差异(分别为0.025和0.011)以及NLR值与淋巴细胞计数曲线下面积差异(0.014)均无统计学意义。见图1。

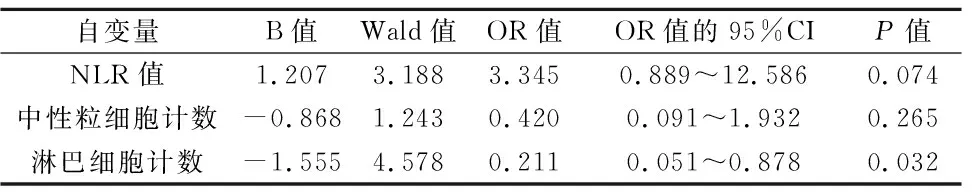
2.3 NLR值及其他可能影响因素的多因素Logistic回归分析 以SCI严重程度作为因变量,将可能与SCI严重程度相关的NLR值、淋巴细胞计数、中性粒细胞计数等变量纳入多因素Logistic回归分析,结果显示,淋巴细胞计数水平升高是脊髓损伤后完全性运动损伤的独立保护因素(OR=0.211,95%CI: 0.051~0.878,
<0.05),中性粒细胞、NLR值与损伤程度无关。见表3。
2.2 NLR值及其他可能影响因素的组间比较 完全性运动损伤组患者的入院后首次NLR值水平显著高于不完全性运动损伤组(
=-3.031,
<0.05),淋巴细胞计数水平显著低于不完全性运动损伤组(
=3.883,
<0.01);2组间的白细胞计数、中性粒细胞计数、单核细胞计数、红细胞计数、血红蛋白水平的差异均无统计学意义。见表2。
本文中我们采用了Schnorr ZKP方案[10],假设Alice对秘密值 wA做了零知识证明ZKP(wA),可通过如下方式使Bob相信自己拥有这一秘密而不向Bob泄露秘密wA的任何信息。
3 讨论
将唤醒教育理论充分运用到学校体育教学中才能充分调动学生学习的积极性,才能激发学生学习的兴趣,才能培养学生主动探索学习的能力,只有将学生置身于轻松愉悦、自由民主的教学环境中,才能在切实提高学校体育教学质量的同时提高学生学习的效率。
1981年年初蓄水量计算:山间河谷区面积107.9km2,根据地下水水位资料与潜水含水层埋深资料分析,确定含水层厚度为5.43 m,给水度为0.2,从而计算出1981年年初蓄水量为11 717.9万m3。供水保证程度分析见表2、表3。
临床上评估SCI严重程度的相对准确且常用的方法为ASIA损伤分级、神经电生理检查,前者根据患者运动、感觉功能的保留程度进行分级,后者通过诱发电位、神经传导速度及肌电图的表现来判断损伤程度。但SCI早期患者处于脊髓休克期时,损伤平面以下无任何运动、感觉或反射活动存在,在此阶段内无论ASIA损伤分级或神经电生理检查均不是评估损伤程度的可行手段。目前也有部分关于SCI后脑脊液及外周血中的生物标志物与神经损伤或恢复之间联系的研究,但由于证据不确切,或需腰椎穿刺等原因,目前并不是SCI临床常用的检查项目
。因此,寻找一种在SCI早期即可获得的便捷有效的生物标志物,用于判断损伤严重程度,为早期干预提供依据具有重要意义。
本研究结果显示,完全性运动损伤组患者的入院首次外周血NLR值水平显著高于不完全性运动损伤组,而淋巴细胞计数明显低于不完全性运动损伤组,在调整混杂因素后,淋巴细胞计数升高是完全性运动损伤的保护因素,提示SCI患者早期高NLR水平以及低淋巴细胞水平与损伤程度较重有一定相关性,而ROC曲线也显示高NLR值以及低淋巴细胞计数对SCI后完全性运动损伤具有一定的早期评估价值。
SCI早期的炎症反应很大程度决定了其继发性损伤的程度,因此损伤越严重者其NLR值可能越高,我们的研究结果印证了这一观点。NLR值近年来被研究用以评估创伤性脑损伤、脑卒中、心血管疾病的严重程度及预测转归,但用于脊髓损伤评估相关的研究目前仍不充分。Zhao等
研究发现,ASIA评分较低者的NLR明显高于评分较高者,且NLR水平升高是颈髓损伤6个月预后不良的独立危险因素。目前较为普遍的观点认为高NLR值能够反映血管内皮损伤及炎症反应程度,由此来对心脑血管疾病病情严重程度及预后产生影响
。而SCI在原发的结构性损伤之外也伴有继发的血管内皮损伤及炎症反应,并且患者伤后长期处于慢性炎症状态中,可能持续数年甚至永久存在
。SCI急性期神经细胞破坏,周围组织缺血水肿,内皮细胞损伤及缺血再灌注损伤可在2天内引发中性粒细胞浸润、炎性介质大量释放,1~2周内巨噬细胞和淋巴细胞浸润,氧化应激加重,全身炎症反应进展,在慢性期神经细胞变性,少突胶质细胞凋亡,胶质瘢痕逐步形成,整个SCI神经及软组织的修复过程均处于或轻或重的炎症状态之中。炎症反应作为一把双刃剑,在促进组织修复的同时,也会促进神经毒素的释放对内皮细胞、神经细胞造成损伤,炎症环境也会促使星形胶质细胞形成胶质瘢痕来保护受损区域,但同时也造成了正常神经细胞再生的障碍。因此,SCI伤的高NLR值水平可能通过反映较重的炎症反应,从而间接提示了较重的损伤及不良的预后。
普通管理员只能管理自己发布的内容。超级管理员可以分配普通管理员,并且可以管理其分配的多个普通管理员所发布的内容。系统管理员,可以管理所有的内容,具有最高权限。
NLR是由中性粒细胞计数与淋巴细胞计数相比计算得出的导出值,我们的研究结果显示,SCI患者早期外周血NLR水平升高可能与其淋巴细胞数目降低更为相关。这与SCI可能诱发全身免疫抑制的观点相一致。我们知道,正常人的免疫功能调节依赖交感神经的活性,而在SCI后,脊髓交感节前神经元失去上级中枢的抑制,淋巴器官失去交感神经支配,导致脾脏萎缩及淋巴细胞减少
。另一方面,SCI使由肾上腺传入下丘脑的神经信号减少甚至丢失,下丘脑-垂体-肾上腺轴反馈异常,下丘脑易化性降低,脾脏及胸腺功能减退,导致T细胞和B细胞数量减少
。因此,SCI通过诱发全身免疫抑制进而导致外周血淋巴细胞数目的减少。在我们的研究中,单因素及多因素分析结果均显示外周血淋巴细胞计数减少很可能提示SCI程度较严重,运动功能残留更少。SCI越严重的患者,脊髓神经传出及传入功能受损越重,其淋巴器官失交感神经支配以及下丘脑-垂体-肾上腺轴神经反馈异常也更加明显,SCI诱发的全身免疫抑制越强,最终导致淋巴细胞数目减少较SCI轻者更加明显。同时,SCI后T淋巴细胞及B淋巴细胞的活化及扩增均对脊髓神经功能有修复和保护的作用
,因而淋巴细胞减少也可能导致神经功能恢复不良。目前对淋巴细胞与SCI程度及预后关系的研究较少,但有多项研究表明SCI诱发的全身免疫抑制可能增加感染风险进而影响神经系统的长期恢复
。
综上所述,SCI患者早期外周血NLR值能够评估损伤的严重程度,与淋巴细胞计数联合后的预测效果可能更好。外周血常规为SCI伤后入院早期的常规检验项目,因此NLR值在损伤早期即容易获得且价格低廉,并且方便进行动态观察,故对早期评估病情、及时采取干预措施有一定的临床意义。
[1] 杨永红, 刘沙鑫, 张仁刚, 等. 康复期脊髓损伤患者家属压力现状及影响因素分析[J]. 中国康复, 2014,29(5):365-367.
[2] Jeffries M A, Tom V J. Peripheral Immune Dysfunction: A Problem of Central Importance after Spinal Cord Injury[J]. Biology, 2021,10(9):928.
[3] 李建军, 王方永. 脊髓损伤神经学分类国际标准(2011年修订)[J]. 中国康复理论与实践, 2011,17(10):963-972.
[4] 闵令霞, 刘宏亮, 段霞, 等. 急性脊髓损伤生物标志物的研究进展[J]. 中国康复, 2021,36(1):45-49.
[5] Zhao J, Lai S, Du Z, et al. Circulating neutrophil-to-lymphocyte ratio at admission predicts the long-term outcome in acute traumatic cervical spinal cord injury patients[J]. BMC musculoskeletal disorders, 2020,21(1):547-548.
[6] Zhao J, Du Z, Yuan Q, et al. Prognostic Value of Neutrophil-to-Lymphocyte Ratio in Predicting the 6-Month Outcome of Patients with Traumatic Brain Injury: A Retrospective Study[J]. World Neurosurgery, 2019,124:411-416.
[7] Song S, Zhao X, Rajah G, et al. Clinical Significance of Baseline Neutrophil-to-Lymphocyte Ratio in Patients With Ischemic Stroke or Hemorrhagic Stroke: An Updated Meta-Analysis[J]. Frontiers in neurology, 2019,10:1032.
[8] Kaya A, Kurt M, Tanboga I H, et al. Relation of neutrophil to lymphocyte ratio with the presence and severity of stable coronary artery disease[J]. Clin Appl Thromb Hemost, 2014,20(5):473-477.
[9] Anwar M A, Al S T, Eid A H. Inflammogenesis of Secondary Spinal Cord Injury[J]. Front Cell Neurosci, 2016,10:98.
[10]Brennan F H, Popovich P G. Emerging targets for reprograming the immune response to promote repair and recovery of function after spinal cord injury[J]. Curr Opin Neurol, 2018,31(3):334-344.
[11]Allison D J, Ditor D S. Immune dysfunction and chronic inflammation following spinal cord injury[J]. Spinal cord, 2015,53(1):14-18.
[12]Noble B T, Brennan F H, Popovich P G. The spleen as a neuroimmune interface after spinal cord injury[J]. Journal of neuroimmunology, 2018,321:1-11.
