二甲双胍药动学影响因素的研究进展
2022-07-02申亦可尼样卓玛胡琳秦宁宁李文斌赵安鹏王荣孙月梅
申亦可 尼样卓玛 胡琳 秦宁宁 李文斌 赵安鹏 王荣 孙月梅
关键词二甲双胍;药动学;基因多态性;药物相互作用;肠道菌群;高原低氧
二甲双胍是一种基础口服降糖药物,广泛用于2 型糖尿病(type 2 diabetes mellitus,T2DM)的治疗。《中国2型糖尿病防治指南(2020 年版)》建议将二甲双胍作为T2DM患者的一线治疗药物[1]。对于肾功能良好的患者,在接受二甲双胍多剂量治疗后,其药物消除半衰期(t1/2)约为5 h,平均肾脏清除率(CLr)为(510±130)mL/min,表观分布容积(Vd)为63~276 L,口服清除率(CL/F)为(1 140±330)mL/min,绝对生物利用度(F)为40%~70%[2]。一项荟萃分析结果表明,与安慰剂组相比,持续服用3 个月二甲双胍(1 500 mg)的T2DM患者的糖化血红蛋白水平降低了1%[3]。但在临床实际应用过程中,二甲双胍的疗效和不良反应存在显著的个体差异,大约30%~40%的患者服用二甲双胍后未能降至理想的血糖水平[4]。Christensen 等[5]研究表明,服用相同剂量二甲双胍的受试者血浆稳态谷浓度为54~4 133ng/mL,提示该药的药动学行为可能存在较大的个体差异,需对部分患者的用药剂量进行调整以达到满意的治疗效果[3,6]。药动学研究是临床合理用药的基础,二甲双胍血药浓度个体差异较大,可能导致药物在个体水平引发不同程度的不良反应,或者呈现出不同的药效。为指导二甲双胍的临床个体化用药,本研究对二甲双胍药动学影响因素(如基因多态性、药物相互作用、肠道菌群、高原低氧环境、生理功能等)的研究进展进行了综述。
1 基因多态性对二甲双胍药动学参数的影响
1.1 吸收和分布
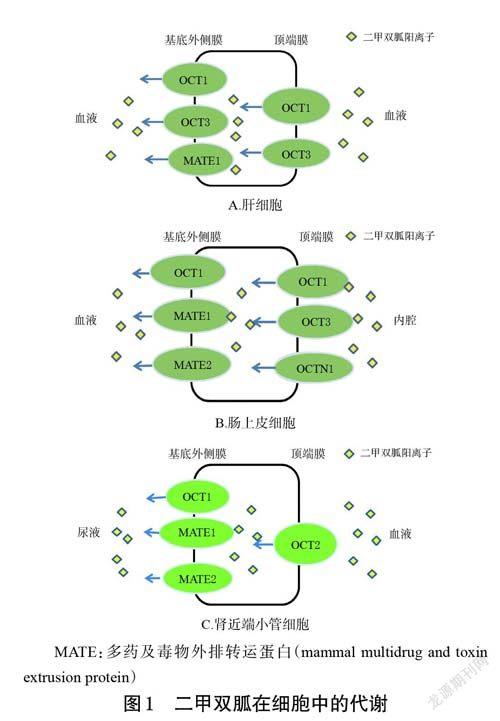
二甲双胍主要在肠上皮细胞和肝细胞中吸收和分布,主要由有机阳离子转运体1(organic cation transporter1,OCT1)、OCT3[7 - 9]、新型有机阳离子转运体1(novelorganic cation transporters 1,OCTN1)[10]和质膜单胺转运蛋白(plasma membrane monoamine transporter,PMAT)[11]介导转运(图1A、图1B)。
二甲双胍经口服后主要在小肠被缓慢吸收,由位于小肠上皮细胞顶端膜的PMAT摄取[11]。有研究表明,位于小肠上皮细胞顶端膜的OCTN1 也可介导二甲双胍的吸收过程,且OCTN1 基因多态性会影响该药的药动学行为[12]。Nakamichi 等[10]对OCTN1 基因敲除(OCTN1-/-)小鼠进行了研究,发现OCTN1-/-小鼠灌胃二甲双胍(50mg/kg)后的最大血浆浓度(cmax)高于野生型(OCTN1+/+)小鼠;但当增加给药剂量(175 mg/kg)后,OCTN1-/-小鼠的cmax 低于OCTN1+/+小鼠。有学者在1 项纳入了96 例韩国健康志愿者的群体药动学研究中发现,OCTN1基因-917C>T 的遗传多态性对二甲双胍的药动学参数有显著影响,主要表现为cmax、血药浓度-时间曲线下面积(AUC)显著增加[12]。
二甲双胍口服后还可以通过肝脏摄取,OCT1 与OCT3 可协同转运血液中的二甲双胍至肝脏内代谢。Shu 等[13]在OCT1 基因敲除(OCT1-/-)小鼠中发现,其肝脏中的二甲双胍质量浓度明显低于正常小鼠,提示OCT1 基因多态性对肝脏摄取二甲双胍至关重要。OCT1 和OCT3 基因的遗传变异可能会导致二甲双胍的转运能力下降:Shu 等[14]对OCT1(即SLC22A1)基因多态性进行了进一步的研究,结果表明,健康高加索人群口服二甲双胍后,在携带野生型及突变型SLC22A1 的人群中,G465R、420del、G401S、R61C 4 个位点功能性降低的人群的AUC和cmax均显著增大,口服分布容积(V/F)显著减小。Tzvetkov 等[15]对上述研究结果进行验证时发现,携带突变型OCT1 且上述4 个位点(G465R、420del、G401S、R61C)功能性降低的103 例健康高加索男性志愿者口服二甲雙胍后,其CLr 显著增加,肝脏摄取量减少;然而,与之前研究不同的是,功能性降低的等位基因并没有导致二甲双胍AUC的差异。由于OCT1 可以和各种结构不同的有机阳离子[包括1-甲基-4-苯基吡啶离子(1-methyl-4-phenylpyridinium,MPP+)] 相互作用,Shu等[16]以MPP+为底物检测了爪蟾卵母细胞OCT1 基因多态性对OCT1 功能的影响,结果显示,OCT1 基因的5 个位点(R61C、P341L、G220V、G401S、G465R)突变均会使OCT1 转运活性减弱或丧失。但Duong 等[17]研究发现,是否携带功能性降低的OCT1 等位基因(包括R61C、G401S、420del、G465R)对T2DM患者服用二甲双胍的药动学参数并无影响。有学者在中国新疆维吾尔族人群中发现,服用二甲双胍后,携带SLC22A1 M420del 突变等位基因(GT、TT突变型)人群的血浆浓度和AUC均明显高于GG野生型[18]。Kerb 等[19]发现了OCT1 的25 个单核苷酸多态性(single nucleotide polymorphism,SNP)位点,其中非同义突变体R61C、C88R 和G401S 可能改变了OCT1 底物作用的时间和强度。Itoda 等[20]在日本人群中也发现了15 个SNP位点,其中有8 个与Kerb 等[19]发现的相同,另有7 个是新发现的OCT1 突变位点。其中,OCT1 rs622342(A>C)突变与二甲双胍的降糖效果相关,携带该内含子突变的患者服用二甲双胍的疗效会有所降低[3];且该位点与MATE1 rs2289669(G>A)之间存在相互作用,当OCT1 rs622342 与MATE1 rs2289669 两个位点的基因型均为突变纯合子时,患者的糖化血红蛋白降低水平最为显著。总而言之,OCT1 基因突变主要包括R61C、G401S、420del、G465R 位点突变,主要通过改变药物的吸收来增大AUC、提高血药浓度。
1.2 代谢和排泄
二甲双胍以原型发挥药效并排出体外[21-22]。MATE是二甲双胍排泄过程中重要的转运体(图1C),主要表达于肾脏刷状缘膜、肝细胞胆管侧膜,可降低组织细胞中二甲双胍的浓度。基于MATE1 基因(即SLC47A1)敲除(MATE1-/-)小鼠的相关研究表明,MATE1 在药物经有机阳离子转运至小鼠尿液和胆汁的过程中发挥了至关重要的作用[23]。还有研究显示,二甲双胍肾脏清除的差异大约有90%可归因于遗传特征,SLC47A 基因的变异可能导致接受二甲双胍临床治疗的糖尿病患者出现个体差异[5]。Stocker 等[24]在健康志愿者中研究了MATE转运体编码基因新型启动子变异对二甲双胍药动学和药效学参数的影响,结果表明,携带MATE1 rs2252281(T>C)突变基因的糖尿病患者(145 例)服用二甲双胍的疗效优于野生型;此外,携带MATE2 rs12943590 纯合子突变的健康志愿者的二甲双胍血浆浓度水平显著低于野生型(P<0.05),且CLr为野生型的22%[24]。Choi等[25]对253例不同种族糖尿病患者(包括189 例高加索人与64 例非裔美国人)的MATE2K(同MATE2)启动子g.-130G>A位点分型进行了分析,结果表明,MATE2K 启动子变异与患者糖化血红蛋白水平的变化有关(P<0.05),这一证据为MATE2K 启动子变异对二甲双胍降糖作用的影响提供了强有力的支持。可见,MATE1、MATE2 的变异是健康受试者和T2DM患者二甲双胍应答效果和药动学参数变化的重要影响因素。
二甲双胍在肾脏中除通过肾小球滤过外,还可通过OCT2 介导的肾小管分泌清除(图1C)。OCT2(由SLC22A2 基因编码)主要分布于肾小管的基底外侧膜中,负责二甲双胍的肾排泄[26]。Song 等[27]研究表明,二甲双胍肾小管排泄和CLr 的变化主要受OCT2(586C>T、602C>T、808G>T)突变的影响,突变型受试者二甲双胍的血浆浓度更高[27]。在1 项基于中国健康受试者的SLC22A2 基因分型研究中发现,SLC22A2 基因rs316019(808G>T)位点突变个体的二甲双胍的CLr 明显降低[28];而另一基于欧洲裔美国人和非裔美国人的健康志愿者的类似研究发现,SLC22A2 基因808G>T突变可使二甲双胍的CLr 增加[ 由(441 ± 108)mL/min 增加到(614±158)mL/min][9],这与在中国健康受试者中的研究结果[28]相反。有学者在中国新疆地区维吾尔族健康受试者中检测到了3 个与OCT2 有关的编码基因突变位点(突变率最高的位点为rs316019),这3 个位点的突变均可使二甲双胍血浆浓度升高、CLr下降[29]。1 项基于韩国健康受试者的回顾性分析结果表明,OCT2 基因rs316019(c.808G>T)位点突变受试者二甲双胍的CLr为(586.01 ± 160.54)mL/min,显著低于野生型受试者[(699.13±291.40)mL/min,P=0.048][30]。Choi 等[31]在卵母细胞中开展的研究表明,OCT1(P283L、P341L)和OCT2(T199I、T201M、A270S)的突变会影响二甲双胍的吸收。还有研究显示,OCT1 分布在近端和远端小管的管腔侧,负责二甲双胍在肾脏中的吸收和/或排泄[32-33],但关于其CLr 的变化尚无具体报道。由此可见,转运体基因多态性的改变有可能影响细胞对二甲双胍的反应性。另外,PMAT(由SLC29A4 基因编码)表达于肾上皮细胞顶端膜,可能参与了肾脏对二甲双胍的重吸收[34],因此其编码基因多态性可能会影响二甲双胍的排泄过程。总之,排泄转运体基因多态性的变化引起了CLr 的改变,并由此导致二甲双胍的肾排泄产生差异,从而影响了二甲双胍药理作用的发挥。
2 药物相互作用对二甲双胍药动学参数的影响
糖尿病患者往往伴随着多种并发症,需要合用多种药物才能达到满意的治疗效果。已有研究显示,药物转运蛋白基因多态性、不同性质药物的相互作用均可能改变二甲双胍的药动学参数,进而影响其临床药效,甚至引发严重的并发症或不良反应[32-36]。
有研究表明,二甲双胍与瑞格列奈、罗格列酮等降糖药物合用可抑制OCT1 转运体活性,从而使二甲双胍的摄取受到抑制[35]。质子泵抑制剂(proton pump inhibitors,PPIs)兰索拉唑是一种OCT2 抑制剂,与二甲双胍联用后,可增加二甲双胍的cmax 和AUC,延长其t1/2,并使CLr 降低13%[36];PPIs(如雷贝拉唑、泮托拉唑)还可通过体外抑制OCT2 和MATE转运体活性而减少二甲双胍的摄取[37-38]。作用于MATE 转运体的药物和二甲双胍联用也会发生药物相互作用,可通过影响药物的肾脏排泄而导致其无法达到满意的治疗效果或引发毒副反应[39]。如,Misaka 等[40]研究结果表明,西咪替丁和甲氧苄啶均显著减少了OCT1、OCT2、MATE1 和MATE2K介导的二甲双胍摄取。另一项研究表明,西咪替丁为MATE1 转运体抑制剂,可使二甲双胍的AUC显著增加50%,24 h 的CLr显著降低27%[41];同类药物雷尼替丁同为MATE1 转运体抑制剂,其也可降低二甲双胍的CLr[42];但法莫替丁为MATE1 转运体选择性抑制剂,与二甲雙胍联用时可提高二甲双胍的生物利用度并提高CLr [43]。在与抗感染药物联用时,有研究表明,甲氧苄啶可显著降低二甲双胍的CL/F 和CLr,增加cmax及AUC,延长t1/2[44];还有研究表明,MATE1 受体拮抗剂头孢氨苄可使二甲双胍cmax和AUC分别增加34%和24%,CLr 降低14%[45];有学者在1 项针对健康志愿者的研究中发现,联用MATE 转运体抑制剂乙胺嘧啶可导致二甲双胍的cmax和AUC分别增加42%和39%,CLr 降低35%[46]。降压药对二甲双胍的药动学行为也有影响。有研究表明,阿替洛尔可抑制转运体OCT2 的活性,延长二甲双胍的t1/2,降低其消除速率和排泄量[47];美托洛尔可诱导OCT1和OCT3 受体,抑制MATE1 受体,使得二甲双胍在大鼠体内的AUC显著减小,t1/2显著缩短,CL/F、V/F均显著升高[48]。此外,当酪氨酸激酶抑制剂伊马替尼、尼洛替尼、吉非替尼和厄洛替尼与二甲双胍联用时,前者可通过抑制OCT和MATE的活性来减少二甲双胍的消除[49]。
3 肠道菌群对二甲双胍药动学参数的影响
肠道菌群在二甲双胍治疗T2DM中起着至关重要的作用[50-51]。肠道菌群种类与丰度的不同与二甲双胍的降糖效果直接相关,这可能与肠道菌群影响该药的药动学行为有关[52-53]。Wu 等[53]通过建立肠道伪无菌大鼠糖尿病模型研究了肠道菌群与二甲双胍药动学参数的相关性,结果显示,与对照组糖尿病模型大鼠相比,伪无菌组大鼠体内二甲双胍的cmax显著升高,吸收相半衰期(t1/2 α)显著缩短(P<0.05)。本课题组曾建立了伪无菌Wistar 大鼠模型,对比肠道菌群变化对二甲双胍药动学参数的影响,结果发现,与正常对照组大鼠比较,伪无菌组大鼠二甲雙胍的AUC 增加了69.3%,CL/F 降低了41.7%,V/F 降低了57.7%,cmax增加了36.3%,说明肠道的伪无菌状态增强了机体对二甲双胍的吸收,表明体内肠道菌群的变化可能会影响二甲双胍的药动学行为[54]。有研究表明,二甲双胍相关转运体OCT1 的表达受肠道菌群的影响[55],因此肠道菌群失调可能影响了OCT1 的表达,从而导致二甲双胍在体内吸收、分布的改变。有学者在体外孵育实验中将肠内容物与二甲双胍分别孵育2、24 h 后,测得二甲双胍的剩余百分含量分别为(61.32±7.83)%和(52.25±5.21)%,进一步证明了肠道菌群对二甲双胍代谢的影响[56],但具体是哪些菌群或菌种导致了二甲双胍药动学参数的变化尚需进一步探究。
4 高原低氧环境对二甲双胍药动学参数的影响
高原低氧环境会干扰药物在体内的吸收、分布、代谢和排泄,进而可能对药物的临床疗效和安全性造成影响。年永琼[57]研究表明,急性缺氧可使大鼠体内二甲双胍的t1/2 增加27.8%,平均体内滞留时间(MRT0 - t)增加24.6%,消除速率常数(ke)降低22.9%,但对cmax无明显影响;慢性缺氧则可使大鼠上述参数的变化更加显著,且还可使cmax降低25.6%。本课题组前期对二甲双胍在急进高原大鼠体内的药动学行为进行了研究,结果表明,与平原组相比,高原组大鼠体内二甲双胍的AUC增加了23.2%,cmax降低了21.8%,CL/F降低了24.1%,MRT0-t增加了20.7%,表明高原低氧环境会使二甲双胍的体内吸收增加、清除减慢[54]。
高原低氧环境可使药物的药动学参数发生变化,目前的研究主要聚焦在不同低氧环境下代谢酶、转运体蛋白表达及活性的相应变化上[58-60]。有关高原低氧环境下二甲双胍相关转运体的变化研究集中于OCT1 和OCT2。例如,年永琼[57]通过测定低氧环境对大鼠肾脏内OCT2 蛋白和mRNA表达的影响,探讨了导致二甲双胍药动学参数变化的原因,结果显示,与平原组相比,急性缺氧组和慢性缺氧组大鼠OCT2 蛋白的表达均有所降低,其中急性缺氧组OCT2 蛋白表达降低了31.1%,慢性缺氧组OCT2 蛋白表达降低了14.8%;与平原组相比,急性缺氧组大鼠OCT2 mRNA的表达与慢性缺氧组比较差异无统计学意义(P>0.05),但两组均呈降低的趋势,分别下降了57.7%与49.7%。靳婷等[61]研究结果显示,大鼠在模拟海拔5 000 m的低压氧舱中暴露24、72 h 后,其肝、肠、肾组织中OCT1 蛋白的表达水平均显著升高,且暴露于急进高原实地环境1 d 后,其小肠转运体OCT1蛋白的表达水平显著升高,而OCT2 蛋白的表达水平显著降低。二甲双胍体内代谢涉及的转运体较多,但目前高原环境对其他转运体的影响尚未见报道。
以上研究表明,高原低氧环境下二甲双胍在大鼠体内的AUC增加、CLr 减小,即二甲双胍在大鼠体内的吸收增强、排泄减慢。结合高原低氧对二甲双胍转运体的影响表明,药动学参数的变化与二甲双胍在体内转运体的表达量呈正相关,说明转运体的表达可能是影响二甲双胍药动学行为的因素。但值得注意的是,Wojtal等[62]研究了人体十二指肠部位的转运体表达,发现在低氧环境下转运体OCT1、OCT2表达降低,与上文所提研究结果不同,这可能与人和动物的种属差异有关。
5 生理功能改变对二甲双胍药动学参数的影响
5.1 肝肾功能改变
研究显示,机体肾功能的变化也会对二甲双胍的药动学参数产生影响。Duong 等[63]报道了1 例在血液透析期间接受二甲双胍治疗(日剂量250 mg)的患者,其二甲双胍的清除率(CL)为149 mL/min,未观察到二甲双胍或乳酸浓度升高。Smith 等[64]在4 例T2DM患者中分析了二甲双胍的药动学特征,这些患者每周接受3 次间歇性血液透析,每次透析后口服二甲双胍500 mg,结果显示,透析期间患者的二甲双胍血浆浓度较为稳定,且在血液透析过程中,二甲双胍的CL 为78~196 mL/min。为可视化血液透析期间患者二甲双胍的药动学特征,Sinnappah 等[65]研究出了透析后服用二甲双胍500 mg的个体单预测血浆浓度典型模型,该模型预测患者二甲双胍血浆浓度在约4 h 时达到峰值,并在约12 h 时基本完成初始分布,随后血浆药物浓度缓慢下降,直到下一次透析。为适应不同患者的用药需求,不少研究者对不同肾功能患者进行了数学模型个体化预测给药,如Duong等[17]对二甲双胍普通片剂和缓释片剂进行非线性效应混合模型模拟后发现,根据患者肾功能设置二甲双胍的日给药剂量较为可靠,T2DM患者与CL 相关的单日最大剂量分别为500 mg(CL:15 mL/min)、1 000 mg(CL:30 mL/min)、2 000 mg(CL:60 mL/min)和3 000 mg(CL:120 mL/min),Li 等[66]的研究结果也与之一致。已有数据显示,肾功能不全的糖尿病患者的药物达峰时间(tmax)有所延后[64-65]。1 项采用生理药动学模型的预测研究结果显示,二甲双胍全身暴露量的显著增加不仅会导致患者肾功能下降,而且会导致严重的肝损伤[67]。另外,二甲双胍在慢性肝病无肝硬化患者中的药动学参数与T2DM患者相似,与健康受试者相比,慢性肝病无肝硬化患者体内二甲双胍的CL/F和肌酐清除率(CLcr)的比值略低[68]
5.2 种属及其机体状态
二甲双胍在正常大鼠和糖尿病模型大鼠中的药动学参数有明显差异,与正常大鼠相比,盐酸二甲双胍在糖尿病模型大鼠体内的消除较慢,其t1/2約为正常大鼠的4.6 倍,而CL/F约为正常大鼠的1/7 [69]。在1 项人体试验中,18 例受试者(9 例非胰岛素依赖型糖尿病患者和9 例健康受试者)先后接受了5 种方案的二甲双胍治疗,5 种方案治疗间隔至少1 周,其中包括4 种单剂量方案(分别为服用850、1 700、2 550 mg 的盐酸二甲双胍片和安慰剂)和1 种多剂量方案(850 mg 盐酸二甲双胍片,每天3次,共19 次),分别在末次服药后的48 h 内采集血浆和尿液样本以测定二甲双胍的药物浓度,结果显示,组别、性别、多剂量/单剂量治疗等因素对二甲双胍的药动学参数均无显著影响[70]。因此,种属差异可能会导致二甲双胍药动学相关研究结果的不同,但目前糖尿病状态下二甲双胍的药动学行为是否会发生改变仍有待进一步研究
5.3 其他
糖尿病合并其他疾病后,二甲双胍的药动学参数会发生改变。研究显示,妊娠期糖尿病的用药情况更加复杂,5%~13%的使用二甲双胍治疗的妊娠期妇女会发生生理变化,从而改变药物的药动学参数;在500和1 000mg的剂量下,妊娠期妇女体内二甲双胍的F、Vd、CLr 均较普通糖尿病患者有所增加或提高,若药物浓度降低,其疗效和安全性可能受到影响[71]。类风湿性关节炎患者的糖尿病发病率也较高。Chen 等[72]建立了胶原诱导性关节炎大鼠模型,与正常组大鼠相比,胶原诱导性关节炎模型大鼠单次灌胃二甲双胍的生物利用度显著降低,推测可能与肾脏转运体OCT2的功能上调有关。
6 结语
二甲双胍是一种有效的口服降糖药物,但由于其药动学参数易受多种因素的影响,患者的个体差异较大。现有研究表明,二甲双胍是OCT 和MATE 转运体的底物,OCT和MATE蛋白的表达量及功能活性会影响二甲双胍在体内的吸收、分布及消除;同时,OCT和MATE的其他底物药物与二甲双胍联用时可能会存在药物间相互作用,从而进一步影响二甲双胍的体内行为。此外,高原低氧环境对转运体表达的影响和肠道菌群种类的变化也会影响二甲双胍的药动学参数。与此同时,因糖尿病患者的并发症较多,还应注意肾病等并发症对二甲双胍药动学行为的影响。为提高二甲双胍用药的合理性及安全性,今后应继续对二甲双胍药动学行为开展深入研究,以更全面地指导患者个体化用药。
