博纳吐单抗治疗急性淋巴细胞白血病有效性和安全性的Meta分析
2022-07-02杨勇杰张绮雯鲁憬莉关克磊刘克锋杨楠杜书章康建张晓坚
杨勇杰 张绮雯 鲁憬莉 关克磊 刘克锋 杨楠 杜书章 康建 张晓坚





关键词博纳吐单抗;急性淋巴细胞白血病;Meta分析;有效性;安全性
急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)是骨髓造血系统恶性肿瘤之一,占急性白血病患者总数的30%~40%,主要特征为骨髓及淋巴组织中幼稚淋巴细胞异常增殖和聚集[1]。ALL的发病率呈双峰分布,第1 个发病高峰出现在儿童时期(1~4 岁),第2个高峰出现在50~60 岁,且男性高于女性[2]。临床实践显示,疾病危险分层和强化化疗方案显著提高了ALL患者的完全缓解率(complete remission rate,CRR),特别是儿童、青少年及青年ALL患者,但40 岁以上及复发或难治性患者的预后仍然较差[3-6]。
由于多种表面抗原均可在ALL癌细胞上表达,因此免疫疗法在ALL的治疗领域取得了较大进展。常见的免疫治疗药物包括利妥昔单抗、依帕珠单抗、奥英妥珠单抗和博纳吐单抗等[7-10]。其中,利妥昔单抗和依帕珠单抗是分别靶向分化群20(cluster of differentiation 20,CD20)和CD33 的单克隆抗体,奥英妥珠单抗则是由靶向CD22 的单克隆抗体与细胞毒性药物卡奇霉素偶联而成,上述3 种药物对复发或难治性ALL 具有一定的疗效,但其作用取决于癌细胞表面高度特异性的肿瘤抗原[11]。博纳吐单抗为一种新型的CD3 和CD19 双特异性抗体,相对分子量为55 kDa。该药是利用脱氧核糖核酸重组技术通过一段非免疫原性的接头序列将抗CD19 和抗CD3 单克隆抗体单链可变区融合而成,可连接CD19+恶性B淋巴细胞与CD3+T淋巴细胞,介导T细胞对肿瘤细胞的溶解,具有不受主要组织相容性复合体Ⅰ类分子限制、不需要T细胞共刺激分子参与等优点[12]。博纳吐单抗于2014 年被美国食品药品监督管理局(U. S. Foodand Drug Administration,FDA)批准用于成人和儿童复发或难治性前体B 细胞ALL。2020 年12 月,该药被国家药品监督管理局附条件批准在我国上市,用于治疗成人复发或难治性前体B细胞ALL。有研究发现,博纳吐单抗可能会导致CD19 靶抗原缺失,引发免疫逃逸,从而影响疗效[13];也有研究认为,博纳吐单抗在治疗过程中可能会引发多种不良反应,如神经系统毒性和细胞因子释放综合征(cytokine release syndrome,CRS),其中CRS是发生率较高、症状较为突出的急性不良反应[14]。考虑到博纳吐单抗為首个治疗ALL的双特异性T 细胞衔接分子药物,上市时间较短,故通过与现有治疗方案比较来全面评价博纳吐单抗治疗ALL的有效性和安全性显得尤为重要。基于此,本研究采用Meta 分析的方法系统评价了博纳吐单抗治疗ALL的有效性和安全性,旨在为其临床应用提供循证参考。
1 资料与方法
1.1 纳入与排除标准
1.1.1 研究类型国内外公开发表的随机对照试验(randomized controlled trial,RCT)和队列研究,语种限定为中文和英文;RCT无论是否采用盲法。
1.1.2 研究对象纳入经骨髓细胞学、化学染色和免疫分型等确诊为ALL的患者,其均符合《关于急性白血病分类的建议》中的相关诊断标准[15],且年龄、性别不限。
1.1.3 干预措施试验组患者给予博纳吐单抗;对照组患者给予传统化疗方案;两组患者的用药剂量、疗程均不限。
1.1.4 结局指标主要结局指标包括:随访1 年以上的总生存率(overall survival rate,OSR)、无复发生存率(relapse-free survival rate,RSR)、CRR、神经系统不良事件(neurological adverse events,NAE)发生率(如头痛、震颤发生率)、CRS发生率。次要结局指标包括:不良事件发生率(如总不良事件、≥3 级不良事件发生率)、感染情况(如感染、口腔炎、脓毒血症发生情况等)、血液系统不良事件发生率(如血小板减少症、贫血、白细胞降低、嗜中性白细胞减少症、发热性嗜中性粒细胞减少症、淋巴细胞减少和低丙球蛋白血症发生率等)、消化系统不良事件发生率(如恶心、呕吐、厌食、便秘、腹泻、腹痛发生率等)及其他不良事件发生率。完全缓解(completeremission,CR)被定义为骨髓淋巴母细胞数量<5%,外周循环中无母细胞且无其他髓外疾病累及[16]。不良事件发生率分级参照《常见不良反应事件评价标准4.0版》[17]。
1.1.5 排除标准排除标准包括:(1)重复发表的文献;(2)仅有摘要,无法获得全文的文献;(3)个案报道及会议论文。
1.2 文献检索策略
计算机检索PubMed、Embase、Web of Science、Cochrane 图书馆、中国知网、万方数据、中国生物医学文献服务系统。中文检索词为“博纳吐单抗”“白血病”;英文检索词为“blinatumomab”“AMG103”“MT103”“MEDI-538”“blincyto”“leukemia”“ALL”“acute lymphoblasticleukemia”。检索时限均为各数据库建库起至2022 年2 月3 日。采用主题词与自由词相结合的方式进行检索,同时对纳入文献的参考文献进行手工检索。以PubMed为例,具体检索策略见表1。
1.3 文献筛选与资料提取
由2 位研究者按纳入与排除标准独立筛选文献,如遇分歧,经讨论或与第3 位研究者协商解决。提取资料包括第一作者、发表年份、研究类型、研究国家、研究时限、患者例数、年龄、性别、干预措施、结局指标等。
1.4 文献质量评价
采用Cochrane 系统评价员手册5.1.0 推荐的偏倚风险评估工具对纳入的RCT进行质量评价,具体包括随机方法、分配隐藏、盲法实施、数据完整性、选择性报告和其他偏倚,每个方面均分为高偏倚风险、低偏倚风险和不清楚[18]。采用纽卡斯尔-渥太华量表(Newcastle-Ottawascale,NOS)对纳入的队列研究进行质量评价,具体包括研究对象选择(0~4分)、组间可比性(0~2分)、结果测量(0~3分);总分1~3分为低质量,4~9分为高质量[19]。
1.5 统计学方法
采用RevMan 5.4 软件进行统计分析。计数资料以风险比(risk ratio,RR)及其95%置信区间(confidenceinterval,CI)表示。采用χ 2和I 2检验分析各研究间的异质性。若P>0.1 或I 2≤50%,表示各研究间无统计学异质性,采用固定效应模型进行分析;反之则表示各研究间存在统计学异质性,需进一步分析异质性来源,在排除明显的异质性后,采用随机效应模型进行分析。按纳入研究的类型进行亚组分析,采用倒漏斗图进行发表偏倚分析。检验水準α=0.05。
1.6 证据质量评价
使用推荐分级的评价、制订与评估(grading ofrecommendations assemssment,development and evaluation,GRADE)系统评价证据质量,RCT 被定为高质量证据,可能降低其证据质量的5 个因素包括:研究局限性、研究不精确性、研究不一致性、研究结果间接性、发表偏倚;观察性研究(如队列研究)被定为低质量证据,可能升高其证据质量的3 个因素包括:大效应量、剂量-效应关系、负偏倚。证据等级评价分为高质量、中等质量、低质量和极低质量[20]。
2 结果
2.1 文献筛选流程与纳入研究基本信息
初检共获得相关文献2 739篇,经阅读题目、摘要、全文后,最终纳入8 项研究[10,16,21-26],其中3 项为RCT[10,16,21]、5 项为队列研究[22-26];共计2 841 例患者,包括试验组816例、对照组2 025 例。文献筛选流程见图1,纳入研究基本信息见表2。
2.2 纳入研究的质量评价
2.2.1 RCT 1 项研究采用了交互式语音应答系统[10],1项研究采用了计算机随机数字发生器进行随机分组[16];3 项研究均为开放标签试验,均未报告分配隐藏方案,均报告完整数据,均未选择性报告结果,均不清楚是否存在其他偏倚来源[10,16,21]。结果见图2、图3。
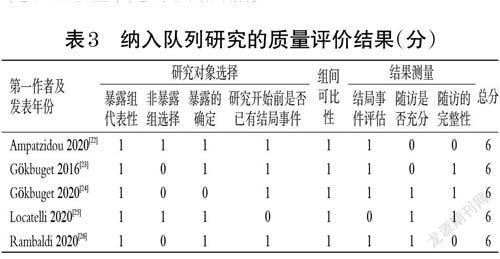
2.2.2 队列研究5 项队列研究的评分均为6 分,均为高质量文献[22-26]。结果见表3。
2.3 Meta分析结果
2.3.1 OSR 7 项研究报道了OSR,包括3 项RCT[10,16,21]和4 项队列研究[23-26]。各研究间有统计学异质性(P=0.07,I 2=49%),采用随机效应模型进行Meta 分析。Meta 分析结果显示,试验组患者的OSR 显著高于对照组[RR=1.30,95%CI(1.14,1.48),P<0.000 1]。按研究类型的不同进行亚组分析,结果显示,RCT研究中试验组患者的OSR[RR=1.27,95%CI(1.12,1.44),P=0.000 1]、队列研究中试验组患者的OSR[RR=1.33,95%CI(1.02,1.73),P=0.03]均显著高于对照组。结果见图4(图中,文献[23]和文献[25]实际纳入报道的OSR例数不是表1中的总例数)。
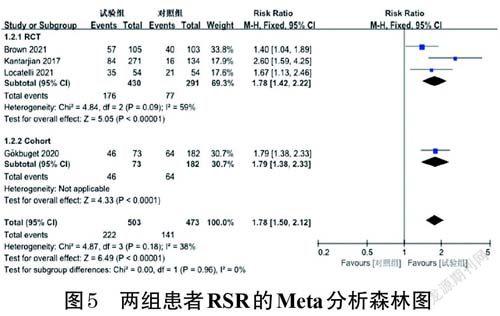
2.3.2 RSR 4 项研究报道了RSR,包括3 项RCT[10,16,21]和1 项研究队列[24]。各研究间无统计学异质性(P=0.18,I 2=38%),采用固定效应模型进行Meta分析。Meta分析结果显示,试验组患者的RSR显著高于对照组[RR=1.78,95%CI(1.50,2.12),P<0.000 01]。按研究类型的不同进行亚组分析,结果显示,RCT研究中试验组患者的RSR[RR=1.78,95%CI(1.42,2.22),P<0.000 01]、队列研究中试验组患者的RSR[RR=1.79,95%CI(1.38,2.33),P<0.000 1]均显著高于对照组。结果见图5。
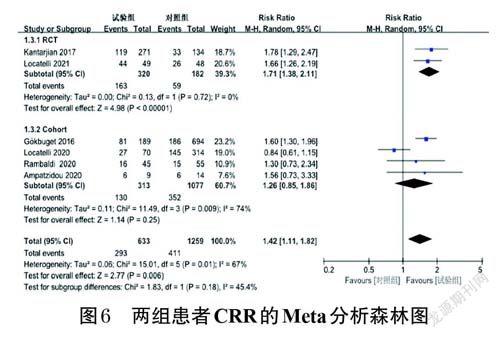
2.3.3 CRR 6 项研究报道了CRR,包括2 项RCT[10,16]和4 项队列研究[22-23,25-26]。各研究间有统计学异质性(P=0.01,I 2=67%),采用随机效应模型进行Meta 分析。Meta 分析结果显示,试验组患者的CRR 显著高于对照组[RR=1.42,95%CI(1.11,1.82),P=0.006]。按研究类型的不同进行亚组分析,结果显示,RCT研究中试验组患者的CRR 显著高于对照组[RR=1.71,95%CI(1.38,2.11),P<0.000 01],而队列研究中两组患者的CRR 比较差异无统计学意义[RR=1.26,95%CI(0.85,1.86),P=0.25]。结果见图6(图中,文献[16]、文献[23]和文献[25]实际纳入报道的CRR例数不是表1中的总例数)。
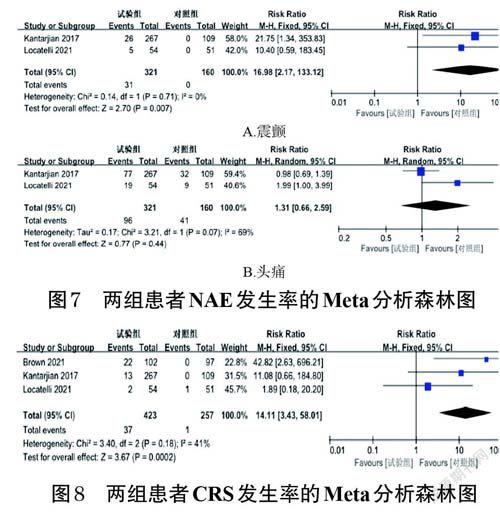
2.3.4 NAE发生率2 项RCT报道了NAE发生率[10,16],包括震颤和头痛,采用固定或随机效应模型进行Meta分析。Meta 分析结果显示,试验组患者的震颤发生率显著高于对照组[RR=16.98,95%CI(2.17,133.12),P=0.007];两组患者头痛发生率比较差异无统计学意义[RR=1.31,95%CI(0.66,2.59),P=0.44]。结果见图7(图中,文献[10]和文献[16]实际纳入报道的NAE例数不是表1 中的总例数)。
2.3.5 CRS发生率3 项RCT报道了CRS发生率[10,16,21]。各研究间无统计学异质性(P=0.18,I 2=41%),采用固定效应模型进行Meta 分析。Meta 分析结果显示,试验组患者的CRS 发生率显著高于对照组[RR=14.11,95%CI(3.43,58.01),P=0.000 2]。结果见图8(图中,文献[10]、文献[16]和文献[20]实际纳入报道的CRS例数不是表1 中的总例数)。
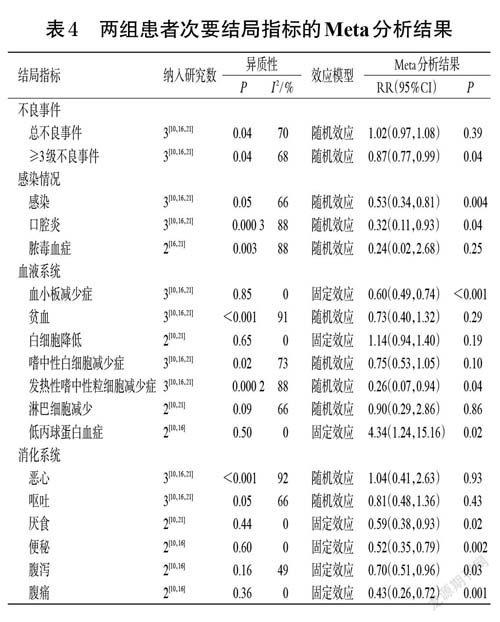
2.3.6 次要结局指标两组患者的总不良事件、脓毒血症、贫血、白细胞降低、嗜中性白细胞减少症、淋巴细胞减少、恶心、呕吐、高血糖、低血压、高血压、转氨酶升高、鼻衄的发生率比较差异均无统计学意义(P>0.05);试验组患者≥3 级不良事件、感染、口腔炎、血小板减少症、发热性嗜中性粒细胞减少症、厌食、便秘、腹泻、腹痛、低血钾的发生率均显著低于对照组(P<0.05),咳嗽、红疹、低丙球蛋白血症、发热的发生率均显著高于对照组(P<0.05)。结果见表4。
2.4 GRADE证据质量评价结果
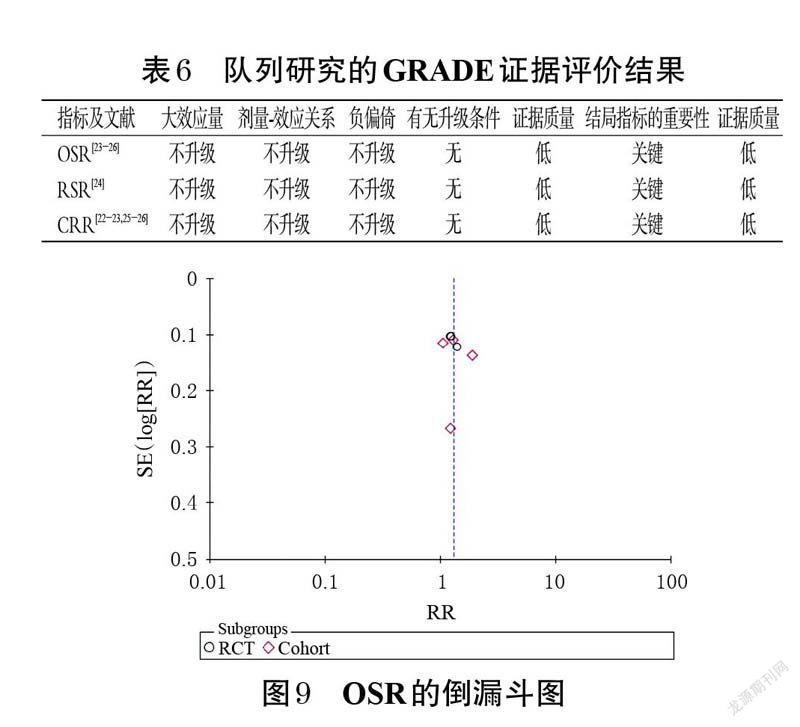
GRADE证据质量评价结果显示,RCT共纳入33 个结局指标,其中3 个(9.1%)为极低质量,23 个(69.7%)为低质量,7 个(21.2%)为中等质量,无高质量结局指标;队列研究共纳入3 个结局指标,无指标升级,其总体结局指标证据质量为低质量。结果见表5、表6。
2.5 发表偏倚
以OSR 为指标(纳入文献数最多)绘制倒漏斗图。结果显示,各研究散点在倒漏斗图内对称分布,提示本研究存在发表偏倚的可能性较小。结果见图9。
3 讨论
有证据表明,博纳吐单抗可与T细胞和肿瘤细胞结合形成复合物,从而诱导T 细胞启动细胞凋亡级联反应,定向杀灭肿瘤细胞[27];同时,博纳吐单抗还能增加白细胞介素2(interleukin-2,IL-2)等炎症因子的产生,IL-2可通过活化T 细胞和自然杀伤细胞而发挥肿瘤细胞杀伤效应[28]。本研究结果显示,接受博纳吐单抗治疗的ALL患者的OSR、RSR、CRR均显著高于传统化疗方案,提示博纳吐单抗的疗效较好。
尽管Meta 分析结果显示博纳吐单抗具有显著的疗效,但仍有不良事件发生。本研究结果显示,与传统化疗方案比较,博纳吐单抗会提高ALL 患者的震颤发生率,但具体机制尚不清楚。有学者就其机制提出两步模型的假设:首先,博纳吐单抗诱导外周T 细胞重新分布到血管内皮中,活化后的血管内皮进一步延展到血管周围空间;随后,博纳吐单抗通过B细胞的作用来促进T细胞活化和炎症因子释放,从而引发神经毒性[29]。CRS是一种因免疫细胞被激活并释放大量细胞因子而引发的严重的全身炎症反应综合征,继发于博纳吐单抗等免疫治疗,与NAE并列为重要且独特的毒副作用之一[14]。本研究结果显示,与传统化疗方案比较,博纳吐单抗会增加ALL 患者CRS 的发生风险,其原因可能为博纳吐单抗可引发抗原-抗体相互作用,从而激活细胞毒性T 细胞,并进一步活化巨噬细胞和单核细胞,最终诱导大量炎症因子释放[30]。
本研究结果还显示,试验组患者≥3 级不良事件、感染、口腔炎、血小板减少症、发热性嗜中性粒细胞减少症、厌食、便秘、腹泻、腹痛、低血钾的发生率均显著低于对照组,两组患者头痛、总不良事件、脓毒血症、贫血、白细胞降低、嗜中性白细胞减少症、淋巴细胞减少、恶心、呕吐、高血糖、低血压、高血压、转氨酶升高、鼻衄的发生率比较差异均无统计学意义,提示博纳吐单抗的安全性较好;但应注意的是,博纳吐单抗组患者咳嗽、红疹、低丙球蛋白血症、发热的发生率均较高,这可能与该药靶向CD19 有关,因此在用药时应密切关注患者的丙球蛋白水平[31]。此外,博纳吐单抗需连续给药(每个周期连续给药4 周),故需注意导管相关的血流感染,密切关注患者的感染风险[32-33]。GRADE结果显示,RCT 共纳入33 个结局指标,其中3 个(9.1%)为极低质量,23 个(69.7%)为低质量,7 个(21.2%)为中等质量,无高质量结局指标;队列研究共纳入3 个结局指标,无指标升级,其总体结局指标证据质量为低质量。发表偏倚分析结果显示,本研究存在发表偏倚的可能性较小。
综上所述,博纳吐单抗治疗ALL的疗效较好,感染和消化系统不良事件的发生率较低,但震颤、咳嗽、红疹、发热、低丙球蛋白血症和CRS的发生率较高。由于本研究纳入的指标证据质量普遍偏低,故所得结论需谨慎解读。本研究存在如下局限性:(1)纳入语种限定为中文和英文,可能存在语言偏倚;(2)纳入研究的样本量较小,检验效能可能不足;(3)由于RCT数量较少,本文还纳入了队列研究,可能会使研究结果存在一定偏倚;(4)纳入的患者类型、疾病分型、研究环境、随访周期等并不相同,可能導致研究结果存在偏倚;(5)纳入的研究均来源于欧美国家,这限制了本研究结论的代表性。因此,本研究所得结论有待更多大样本、高质量的研究进一步验证。
