miR-124所修饰rDPSCs来源外泌体对巨噬细胞极化的影响研究
2022-07-01刘兰宁唐焕珍李晓媛
刘兰宁 唐焕珍 李晓媛
牙髓干细胞(dental pulp stem cells,DPSCs)是具有多能分化和自我更新能力的间充质干细胞,在组织修复和再生中发挥重要作用,已广泛应用于免疫疾病、口腔疾病、脊髓损伤、心肌梗死等疾病的治疗[1]。DPSCs在正常或病理条件下均可分泌直径为30~100 nm的微小囊泡,即DPSCs来源外泌体,在组织缺损修复过程中,DPSCs首先迁移至受损的组织区域,然后释放外泌体参与细胞间旁分泌的相互作用,通过诱发内源性修复过程来发挥治疗作用[2,3]。作为组织损伤的新型疗法,DPSCs外泌体疗法相较于传统干细胞治疗,不需要直接使用细胞,从而避免细胞移植相关的限制和风险[4]。miRNA是长度约为22~26个核苷酸的非编码RNA,可调节细胞增殖、代谢、凋亡和器官发育等多种病理生理过程[5]。研究表明,miRNA可调节巨噬细胞极化以及随后的炎性反应[6];miR-124修饰的骨髓间充质干细胞外泌体负调控Ern1,从而促进巨噬细胞M2型极化并减轻大鼠脊髓缺血再灌注损伤[7]。而miR-124修饰的大鼠牙髓干细胞(rat dental pulp stem cells,rDPSCs)来源外泌体对巨噬细胞极化的影响尚未见报道,因此本研究通过提取miR-124修饰的rDPSCs来源外泌体并作用于皮肤缺损大鼠,观察其对巨噬细胞极化的影响以及治疗效果,以期为组织的再生调控提供理论依据。
1 材料与方法
1.1 实验动物 8周龄,体重为180~200 g,雄性SD大鼠购自广州赛业百沐生物科技有限公司,许可证号为:SCXK(粤)2020-0055。本研究得到了本院动物实验伦理委员会的批准,所有动物实验遵循3R原则。
1.2 主要试剂与仪器 miR-124模拟物(miR-124 mimics)及其阴性对照(miR-NC)均购自广州基迪奥生物科技有限公司;Trizol试剂、ELISA检测试剂盒、BCA试剂盒均购自赛默飞世尔科技中国有限公司;α-MEM培养基、胎牛血清(FBS)均购自Sigma-Aldrich公司;TaqMan MicroRNA逆转录试剂盒、TransStart®Green qPCR SuperMix、ECL化学发光试剂盒购自北京百奥莱博科技有限公司;CD63、CD81、TNF-α、TNF-1β、IL-6、IL-4、IL-10、IL-13、GAPDH兔多克隆抗体(anti-CD63、anti-CD81、anti-TNF-α、anti-TNF-1β、anti-IL-6、anti-IL-4、anti-IL-10、anti-IL-13、anti-GAPDH)、辣根过氧化物酶(HRP)标记的羊抗兔IgG二抗均购自美国Abcam公司;CO2培养箱购自德国SIGMA公司;流式细胞仪购自美国BD公司。
1.3 rDPSCs的分离与培养[8]用颈椎脱臼法处死大鼠后,无菌条件下取出下颌骨,并剥离颌骨表面的肌肉和组织,待暴露出颌牙后,建立牙髓通道,将牙髓从根管中取出。将牙髓组织切成小块,使用Ⅰ型胶原酶溶液(4 mg/ml)和分散酶溶液(4 mg/ml)分散牙髓组织为单细胞悬液,收集细胞悬液,置于含有10% FBS的α-MEM培养基中,在37℃、5%CO2的培养箱中培养。
1.4 流式细胞仪检测rDPSCs表面标志物 取对数生长期的第三代rDPSCs,用PBS稀释细胞浓度为1×106个/ml后,取600 μl等分为6份后分别装入1.5 ml离心管中,分别加入抗大鼠CD14-PE、CD34-PE、CD45-PE、CD90-PE、CD105-PE、CD146-PE于室温下避光孵育20 min,用PBS洗3次后,分别用200 μl PBS重悬细胞,设置6个重复,利用流式细胞仪检测rDPSCs表面标志物的阳性率。
1.5 rDPSCs的成骨成脂能力检测 第三代rDPSCs培养至90%融合度时,向6孔板中加入成脂肪诱导液,诱导14 d后,4%多聚甲醛固定,油红O染色观察脂肪细胞形成情况并拍照;第三代rDPSCs培养至90%融合度时向6孔板中加入成骨诱导液,诱导14 d后,4%多聚甲醛固定,茜素红S染色观察矿化结节形成情况并拍照。
1.6 miR-124过表达慢病毒载体转染rDPSCs 取第三代rDPSCs,调整细胞浓度为4×105个/ml,并分组为空白组、miR-NC组、miR-124组,待细胞融合度达到70%~80%时,将miR-NC组、miR-124组分别加入等量的miR-NC及miR-124 mimics重组慢病毒液,空白组加入等量的培养基。每组设置6个复孔,转染48 h后通过qRT-PCR检测转染效率。
1.7 rDPSCs外泌体的提取及鉴定 收集空白组、miR-NC组、miR-124组中的rDPSCs上清液各1 ml,分别加入200 μl外泌体提取试剂,4℃孵育过夜,2 000 r/min离心40 min后收集的沉淀即为外泌体,最后用200 μl PBS将沉淀重悬,并分别命名为Exosome组(Exo组)、Exo/miR-NC组、Exo/miR-124组。取部分外泌体,每组设置6个复孔,利用透射电镜观察外泌体形态,利用western blot检测外泌体标志蛋白CD63和CD81的表达,利用qRT-PCR检测各组外泌体中miR-124的表达。
1.8 大鼠皮肤缺损模型的建立及分组 将25只大鼠随机分为5组:sham组、model组、rDPSCs Exo组、rDPSCs Exo/miR-NC组和rDPSCs Exo/miR-124组,每组5只。参照文献[8],向大鼠腹腔内注射30 mg/kg戊巴比妥钠进行麻醉,将大鼠以俯卧位的状态固定于手术台上,背部中央常规备皮消毒后,切取直径为2.5 cm的全层皮肤,然后在其表面注射30 μl PBS,最后用3M皮肤敷料固定创面,荷包缝合术将模型区域固定,以构建皮肤缺损模型(model组)。sham组大鼠不做任何处理,仅在背部相应区域注射等量的PBS,model组大鼠在皮肤缺损区域注射等量PBS,rDPSCs Exo组、rDPSCs Exo/miR-NC组和rDPSCs Exo/miR-124组大鼠于皮肤缺损相应区域分别注射30 μl对应的外泌体。15 d后进行皮肤、血清取材检测。
1.9 qRT-PCR检测miR-124表达水平 分别收集各组rDPSCs、rDPSCs外泌体、皮肤缺损组织,用Trizol法提取RNA,利用TaqMan逆转录试剂盒将1 μg RNA逆转录成cDNA,以cDNA为模板进行PCR反应。引物序列为:U6-F:5’-GGCCTCTCGAACTTGCGT GTC-3’,U6-R:5’-CCATCGGAAGCTC GTATA CGA-3’;miR-124-F:TAAGGCACGCGGTGAATGC,miR-124-R:GTCG
TATCCAGTGCAGGGTCCGAGGT。使用U6作为内参基因,采用2-ΔΔCT计算miR-124相对表达水平。
1.10 Western Blot检测蛋白表达水平 收集各组rDPSCs外泌体或皮肤缺损组织,用预冷的RIPA裂解缓冲液提取总蛋白,BCA试剂盒检测蛋白浓度。通过10%十二烷基硫酸钠聚丙烯酰胺凝胶(SDS-PAGE)电泳分离等量蛋白质(50 μg),并转移到PVDF膜上。用5%脱脂奶粉封闭2 h后,将膜与一抗CD63(1∶2 000)、CD81(1∶1 000)、TNF-α(1∶3 000)、TNF-1β(1∶2 500)、IL-6(1∶2 000)、IL-4(1∶1 000)、IL-10(1∶3 000)、IL-13(1∶2 000)、GAPDH(1∶2 000)于4℃条件下孵育过夜。经洗涤后,加入HRP标记的羊抗兔二抗(1∶2 000)37℃孵育2 h,最后用ECL化学发光试剂可视化蛋白质。使用Image J软件对蛋白条带进行定量分析。
1.11 ELISA法检测大鼠血清中iNOS、CD206含量 分别收集1.8中五组大鼠的血清,严格按照ELISA检测试剂盒说明书进行iNOS、CD206含量的测定。

2 结果
2.1 rDPSCs的鉴定
2.1.1 流式细胞术结果显示,rDPSCs低表达CD14、CD34、CD45,高表达CD90、CD105、CD146。见图1,表1。
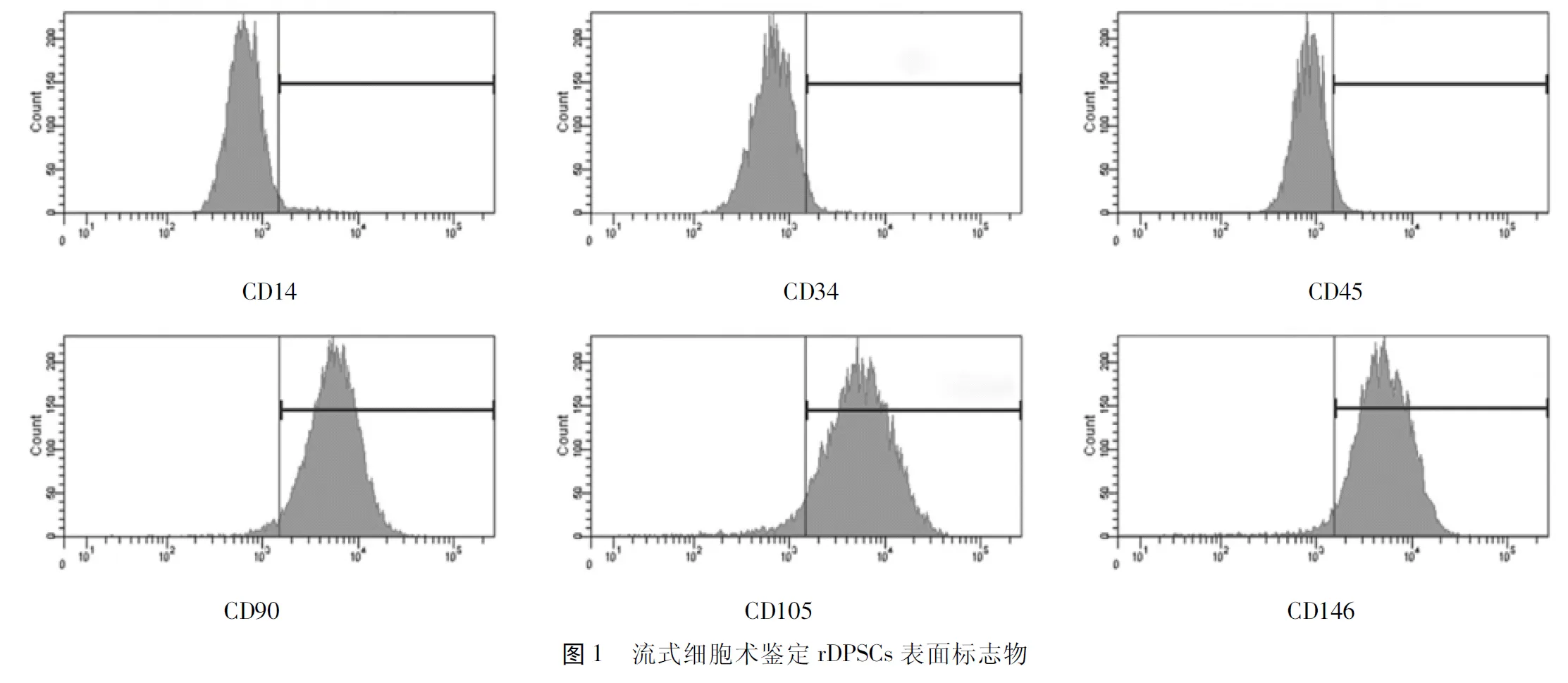
表1 rDPSCs表面标志物的阳性率比较
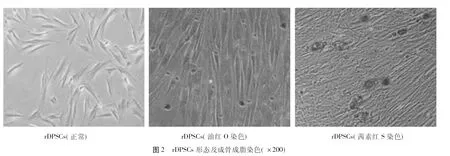
2.1.2 rDPSCs在正常条件下形态均一,呈成纤维样细胞分布,油红O染色和茜素红S染色均为阳性,证明成功分离获得rDPSCs且细胞具有成骨成脂能力。见图2。
2.2 rDPSCs外泌体的鉴定 透射电镜观察结果显示,可观察到大小均一,直径为50~100 nm,呈圆形或椭圆形的囊泡结构。CD63和CD81蛋白在rDPSCs外泌体中高表达,而在细胞裂解液中几乎不表达,证明成功分离获得rDPSCs外泌体。见图3、4。

图3 透射电镜观察rDPSCs外泌体的形态

图4 western blot检测CD63和CD81蛋白的表达
2.3 qRT-PCR检测转染后rDPSCs及rDPSCs外泌体中miR-124表达 与空白组和miR-NC组比较,miR-124组rDPSCs中miR-124表达水平显著升高,且Exo/miR-124组rDPSCs外泌体中miR-124表达水平显著高于Exo组和Exo/miR-NC组(P<0.05),证明转染成功,获得高表达miR-124的rDPSCs和rDPSCs外泌体。见表2、3。
表2 qRT-PCR检测转染后rDPSCs中miR-124表达
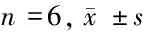
表3 qRT-PCR检测rDPSCs外泌体中miR-124表达
2.4 miR-124过表达的rDPSCs外泌体对大鼠创伤组织中miR-124表达的影响 与sham组比较,model组大鼠创伤组织中miR-124表达水平显著降低(P<0.05);与model组比较,rDPSCs Exo组、rDPSCs Exo/miR-NC组、rDPSCs Exo/miR-124组中miR-124表达水平显著升高(P<0.05),且rDPSCs Exo/miR-124组中miR-124表达水平显著高于rDPSCs Exo组和rDPSCs Exo/miR-NC组(P<0.05)。见表4。

表4 qRT-PCR检测各组大鼠创伤组织中miR-124表达
2.5 miR-124过表达的rDPSCs外泌体对各组大鼠血清中iNOS、CD206含量的影响 与sham组比较,model组大鼠血清中iNOS含量显著升高,CD206含量显著降低(P<0.05);与model组比较,rDPSCs Exo组、rDPSCs Exo/miR-NC组、rDPSCs Exo/miR-124组中iNOS含量显著降低,CD206含量显著升高(P<0.05),且rDPSCs Exo/miR-124组中iNOS含量显著降低于rDPSCs Exo组和rDPSCs Exo/miR-NC组、CD206含量显著高于rDPSCs Exo组和rDPSCs Exo/miR-NC组(P<0.05)。见表5。
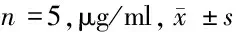
表5 ELISA法检测5组大鼠血清中iNOS、CD206含量
2.6 miR-124过表达的rDPSCs外泌体对皮肤缺损愈合过程中巨噬细胞极化相关因子的影响 与sham组比较,model组中与M1型极化的相关炎性因子TNF-α、TNF-1β、IL-6蛋白表达上调,与M2型极化的相关炎性因子IL-4、IL-10、IL-13蛋白表达下调(P<0.05);与model组比较,rDPSCs Exo组、rDPSCs Exo/miR-NC组、rDPSCs Exo/miR-124组中TNF-α、TNF-1β、IL-6蛋白表达下调,IL-4、IL-10、IL-13蛋白表达上调(P<0.05),且rDPSCs Exo/miR-124组中TNF-α、TNF-1β、IL-6蛋白表达显著低于rDPSCs Exo组和rDPSCs Exo/miR-NC组,IL-4、IL-10、IL-13蛋白显著高于rDPSCs Exo组和rDPSCs Exo/miR-NC组(P<0.05)。见图5,表6。
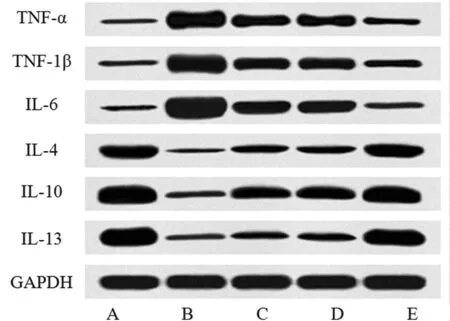
图5 western blot检测5组大鼠创伤组织中TNF-α、TNF-1β、IL-6、IL-4、IL-10、IL-13蛋白表达;A sham组;B model组;C rDPSCs Exo组;D rDPSCs Exo/miR-NC组;E rDPSCs Exo/miR-124组

表6 5组大鼠创伤组织中TNF-α、TNF-1β、IL-6、IL-4、IL-10、IL-13蛋白表达
3 讨论
组织修复与再生一直是医学界研究的热门话题,如何通过适当的调控来促进组织再生是科学研究者们探索的终极目标。干细胞由于具有高增殖率、容易获得、保持持久效力、高分化潜能等良好的特性,其已应用于多种疾病和组织再生的治疗,并产生了积极的治疗效果[9],而干细胞分泌的外泌体却比干细胞本身具有更大的治疗价值[10]。外泌体是富含核酸、蛋白质、脂类、氨基酸和代谢物,大小约为30~200 nm的细胞外囊泡,也是细胞间通信网络的重要组成部分[11,12]。DPSCs是从牙髓组织中分离出来的,来源较为充足,在组织的再生与修复中的应用具有广阔前景的干细胞[13]。本研究通过鉴定rDPSCs及rDPSCs外泌体,发现rDPSCs低表达CD14、CD34、CD45,高表达CD90、CD105、CD146,且rDPSCs在正常条件下形态均一,呈成纤维样细胞分布,油红O染色和茜素红S染色均为阳性,证明成功分离获得rDPSCs;透射电镜观察显示,可见大小均一,直径为50~100 nm,呈圆形或椭圆形的囊泡结构,且CD63和CD81蛋白在rDPSCs外泌体中高表达,而在细胞裂解液中不表达,证明成功分离获得rDPSCs外泌体。
已有研究报道,外泌体通过携带miRNA发挥促进细胞增殖、抑制细胞凋亡、促进血管生成、促进组织损伤修复等生物学作用[14];外泌体源性miR-124可以促进创伤性脑损伤急性期损伤脑组织中小胶质细胞由M1型向M2型转化,从而减轻创伤性脑损伤的神经炎症[15];外泌体可递送miR-124至机械性损伤后的小鼠皮层神经元并提高神经元中轴突再生相关因子NRP-1、GAP-43的表达,促进轴突再生[16];M2小胶质细胞来源的外泌体通过外泌体miR-124及其下游靶标泛素特异性蛋白酶14(USP14)减轻缺血性脑损伤并促进神经元存活[17]。本研究成功构建大鼠皮肤缺损模型,经rDPSCs外泌体干预后,大鼠血清中iNOS含量显著降低,CD206含量显著升高,TNF-α、TNF-1β、IL-6蛋白表达下调,IL-4、IL-10、IL-13蛋白表达上调,而miR-124过表达外泌体组干预后的改善效果更显著。据报道,巨噬细胞分为M1型和M2型两种类型,iNOS、CD206分别为M1型、M2型巨噬细胞极化标志物[18,19],M1型巨噬细胞分泌TNF-α、TNF-1β、IL-6等促炎因子,可导致机体的炎症损伤,M2型巨噬细胞分泌IL-4、IL-10、IL-13等炎症抑制因子,抑制促炎因子效应,发挥抗炎症损伤的作用[20,21]。提示miR-124过表达修饰的外泌体可能通过抑制M1型巨噬细胞极化来下调促炎因子TNF-α、TNF-1β、IL-6蛋白的表达,并通过促进M2型巨噬细胞极化来上调抗炎因子IL-4、IL-10、IL-13蛋白的表达,进而调控炎性反应来发挥促进组织修复与新生的作用。
综上所述,miR-124过表达修饰的rDPSCs外泌体可通过抑制M1型巨噬细胞极化、促进M2型巨噬细胞极化来调控炎性反应,进而在组织修复与再生中发挥促进作用。
