高岭土对煤生物产气的影响及微生物群落响应
2022-07-01黄新颖黄再兴陈子豪任恒星黄冠华
何 环,黄新颖,黄再兴,张 倩,陈子豪,赵 晗,任恒星,黄冠华
(1.中国矿业大学 化工学院,煤炭加工与清洁利用教育部重点实验室,江苏 徐州 221116;2.煤与煤层气共采国家重点实验室,山西 晋城 048000)
煤层气是成煤物质在煤化作用过程中生成且储集于煤层中的一种非常规天然气[1],根据成因可以分为热成因气和生物成因气,其中,生物成因气具有分布广、埋藏浅和开发成本低的特点,利用微生物增产煤层气是当前煤层气开发领域研究热点。
煤生物产气过程受到多种因素的影响,国内外研究人员希望通过优化产气条件来提高甲烷生成效率[2]。目前研究发现多种因素对煤生物产甲烷有很大影响。其中,包括物理因素如温度[3]、pH 值[4-5],化学因素如氧化还原电位[6]、外加碳源种类[7]、煤化程度[8]等,以及生物因素如外源菌群[9]、微生物预处理[10]等。煤是一种由无机矿物和有机质构成的复杂化合物,因此,其赋存的无机矿物对生物产气过程也会存在一定影响。邓寅生等[11]研究表明煤矸石的添加有利于义马长焰煤生物甲烷的产生;邵培等[12]证明煤中灰分对生气速率有影响,其中,黄铁矿和黏土矿物可以提高生物活性,加快生气速率。
高岭土是自然界中一种分布较常见的黏土矿物,在煤中分布也较多。已有研究表明,水相体系中固液界面上的离子、有机物和微生物与高岭土的相互作用控制着环境中许多重要的地球化学过程[13]。高岭土的存在会对微生物的分布、活性、多样性、基因表达与电子传递等产生影响。D.A.Ams 等[14]研究发现,高岭土可以作为Pseudomonas mendocina的营养来源,该细菌所分泌的嗜铁素与高岭土中的铁结合,加快矿物中铁元素的溶出速率,为菌株代谢提供生长因子。目前,研究人员大多支持矿物提高微生物活性是基于矿物的表面活性,但也有一些研究者认为矿物可以改变微生物的代谢方式来提高微生物活性[15]。J.Cuadros等[16]报道高岭土可以促进Escherichia coli的生长,主要原因在于高岭石降低了大肠杆菌对葡萄糖的降解速率,并将菌株降解乙酸所释放的部分能量用于细胞分裂。在贫瘠营养或者不利环境条件(如重金属、加热、紫外线等)下,矿物可保护微生物,维持微生物活性。最新研究结果显示,当大肠杆菌细胞附着在高岭土表面时,细菌的氧化还原代谢得到促进,可以对抗恶劣环境刺激[17]。也有研究指出,高岭土与银组成的复合物可以有效控制食品中病原微生物数量[18]。S.Hwang等[19]指出在添加高岭土和蒙脱石的培养基中,细胞的存活率明显提高,造成这种现象的原因是矿物改变了细菌生存与代谢方式。
由此可见,高岭土会对微生物的生长代谢活性产生影响,它也是煤中较为常见的无机矿物。但是,目前有关煤中高岭土对生物产气影响的研究报道较少。榆林是我国主要的煤产地之一,前期研究表明,该地区的煤具有较好的生物产气潜力[20]。因此,笔者以该地区煤样作为产气底物,前期驯化的微生物作为产气菌群,通过大浮沉方法得到低灰分煤,研究不同高岭土添加量对模拟产气过程中CH4产量、总挥发性脂肪酸(Volatile Fatty Acids,VFAs)、辅酶F420、煤中有机官能团和微生物群落结构的影响,以期为阐明煤中无机矿物对生物产气的影响机制提供实验依据。
1 材料与实验方法
1.1 微生物、煤与高岭土
实验中所用微生物为前期驯化保存的产甲烷混合菌群,该菌群对褐煤有较好的厌氧降解产气效果。微生物培养所用的基本盐培养基、微量元素和微生物群落结构组成见参考文献[21-22]。研究所用煤样采自陕西榆林,为了尽量减少煤本身的矿物组分对产气结果的干扰,依据GB/T 478-2008《煤炭浮沉试验方法》进行大浮沉实验,将榆林煤处理为不同密度等级煤,然后选择密度等级最低的煤(1.3~1.4 g/cm3,灰分质量分数4.84%),粉碎筛分至0.125 mm 以下作为生物模拟产气底物,处理前后煤的工业分析结果见表 1。实验所用高岭土样品购自天津市福晨化学试剂厂(化学纯),粉碎筛分至0.125 mm 以下备用。
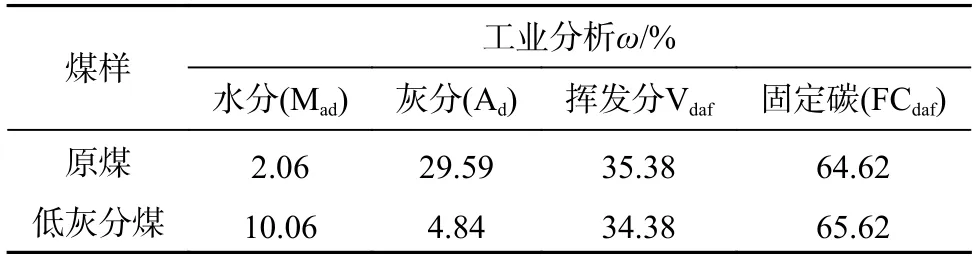
表1 原煤和低灰分煤样工业分析测试结果Table 1 Proximate analysis of raw coal and low ash coal samples
1.2 生物模拟产气实验
为探究高岭土添加量对榆林煤生物模拟产气的影响,根据原煤中元素含量和文献[23],按照高岭土质量占煤质量的不同质量分数,共设置7 个添加量梯度:0(空白对照组)、0.5%、1.0%、2.0%、4.0%、6.0%、8.0%,编号分别为G-1、G-2、G-3、G-4、G-5、G-6、G-7。每个梯度设置3 组平行样,将高岭土添加到250 mL 厌氧瓶中,每组加入200 mL 培养基,20 g 煤粉,灭菌后用无菌注射器接种20 mL 混合菌液,盖好瓶塞,然后将其放入35℃恒温培养箱中厌氧培养50 d,培养过程中定期检测瓶内甲烷含量变化。
1.3 参数分析方法
1) CH4含量
从模拟产气第15 天开始,每隔7 d 测量厌氧瓶顶部空间中气体产量的动态变化,用进样针采气前要将厌氧瓶充分摇匀。每次测完后用灭菌的无菌针头插入厌氧瓶并快速将厌氧瓶顶部空间中气体放出。采用气相色谱气体中CH4含量,气相色谱条件:美国 Angilent 7890 气相色谱配Carbonplot 色谱柱(60 m×320 μm×1.5 μm)和TCD 检测器,气密针进样,进样量0.5 mL。色谱进样口温度150 ℃,柱温箱温度30℃,检测器温度200℃。记录CH4浓度,然后将其换算成物质的量(mol),计算方法如下:
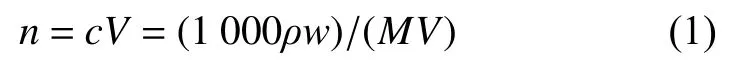
式中:n为物质的量;c为物质的量浓度;V为气体体积,ρ为物质密度;w为物质质量浓度;M为溶质的摩尔质量。
累积甲烷含量为每个实验点前甲烷产量之和。
2) VFAs 含量
VFAs 是厌氧消化过程的重要中间产物,通过检测VFAs 含量可以了解煤的生物降解过程。产气结束后,分别取各实验组和空白组的反应液10 mL,10 000 r/min 离心5 min,保留上清液,按照每1.5 mL样品加75 μL 的34% 磷酸的标准液进行封存,处理完毕后,用0.22 μm 滤膜过滤,然后密封待测。采用气相色谱(岛津,GC-2014)对VFAs 进行测定,色谱分析条件:Stabilwax-DA 30 m×0.53 mm×0.25 m 型毛细管柱,FID 检测器,检测器温度为150℃。
3) 辅酶F420含量
辅酶F420是一种胞内酶,测定时需要先破碎细胞,使得其中的酶释放出来。本次采用ELISA 方法测定F420含量,其具体过程如下:用注射器从厌氧瓶中收集培养液2 mL 放入灭菌离心管中,3 000 r/min 离心20 min 后,用移液器取上清1.5 mL 转到新的灭菌离心管,10 000 r/min 离心20 min 后弃掉上清液,用PBS(pH=7.2~7.4)重悬细胞,显微计数细胞浓度达到107个/mL左右,然后对样品进行反复冻融,破坏细胞使其释放出胞内成分。用BCA 蛋白法含量测试盒(ADS-W-DB005)测定样品中总蛋白浓度,确保其在20~2 000 μg/mL 范围内。按照试剂盒的操作流程取10 μL 样品加入酶标板孔,用酶标仪(芬兰,Labsystems Multiskan MS)在450 nm 波长下测定吸光度(OD 值),通过标准曲线计算样品中辅酶F420(CoF420)含量。
4) 煤的有机官能团
产气结束后,将反应后的残煤真空抽滤收集,冷冻干燥后将煤样研磨至粒度小于0.074 mm,取少量样品与KBr 按1∶120 加入用玛瑙研钵研磨后压片,用红外光谱(FT-IR)仪(德国布鲁克VERTEX 80 V)分析样品中有机官能团,测试扫描波段范围为4 000~400 cm-1,分辨率为4 cm-1。
5) 微生物群落结构
将产气结束后的培养液摇匀,取40 mL 混合液放入离心管中,在13 000 r/min 下离心20 min,弃去上清液,保留沉淀物质1~3 g,将其密封放入-80℃下冷冻24 h,然后用干冰保存寄送到上海美吉生物Illumina高通量测试平台进行测序。
细菌多样性测定引物序列:
338F:5'-ACTCCTACGGGA GGCAGCAG-3';806 R:5'-GGACTACHVGGGT WTCTAAT-3'。
古菌多样性测定引物序列:
524F:5'-TGYCAGC-CGCCGCGGTAA-3' ;958R:5'-YCCGGCGTTG-AVTCCAATT-3'。
2 实验结果与分析
2.1 CH4 产量
不同高岭土添加量的实验组产CH4量和累积产甲烷量曲线如图1 所示,从图1a 中可以看出,7 个梯度实验组的产气周期并不完全同步,但是整体CH4产量变化趋势基本一致。总的来看,不同添加量的高岭土可以分为2 组,0~1.0% 和2.0%~8.0%,在这2 个添加量区间内,大部分添加高岭土实验组在产气前期(第15-22 天)甲烷产量均高于对照组,其中0.5%和4.0%添加量在第22 天时达到最高后迅速下降,而添加量为6.0%和8.0%时甲烷产量在(第15-第29 天)仍逐渐上升,然后分别在第29 天和第36 天后下降。大部分添加高岭土实验组在第50 天产甲烷量均超过空白对照组,并且0~1.0% 添加量和2.0%~8.0% 添加量的累积产甲烷量均有先升后降的趋势,其中添加8.0 %高岭土在第50 天产气量最高,每克煤达到87.65 μmol,较空白组高30.56%,说明添加适量的高岭土在发酵后期能够促进煤的生物产气。
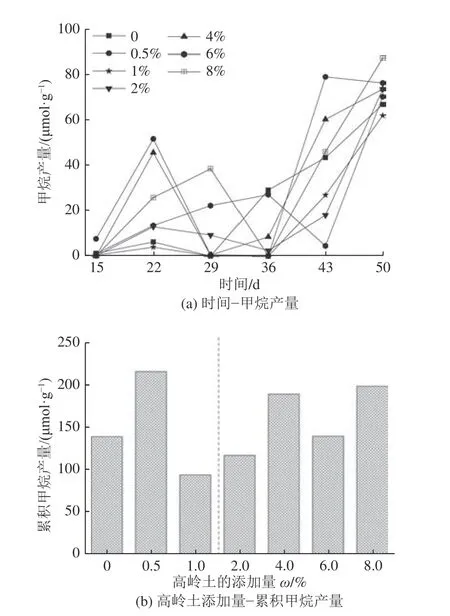
图1 甲烷产量变化趋势Fig.1 Change trend of methane production
不同高岭土添加量的实验组,累积甲烷产量由高至低的顺序为0.5%、8.0%和4.0%(图1b),其中,添加0.5%高岭土实验组的累积产甲烷量最高可达216 μmol/g 煤,较空白组提高55.4%。从实验结果来看,煤的生物产气量并非与高岭土添加量成正比,而是在一定区间内波动,这可能是因为微生物的厌氧产气是一个动态过程,而高岭土对不同微生物的影响存在差异,这也会影响最终产气量。但是,添加高岭土实验组其平均甲烷产量(159.2 μmol/g)高于对照组(139.0 μmol/g),说明添加适量的高岭土能够促进煤的生物产气。
M.L.Ali 等[24]研究高岭土添加量对牛粪发酵产甲烷的影响,发现添加的高岭土质量分数为0.6%时可以明显促进甲烷的生成,因为高岭土在厌氧消化过程中溶解释放的微量元素有助于提高微生物的生长活性,提高微生物之间的协同作用,促进CH4产生。不同高岭土添加量对于产气的影响不同,与微生物对于无机矿物的需求有关。从目前的结果来看,高岭土的添加并不是越多越好,这可能与高岭土对体系中不同微生物的影响存在差异,由于本次实验所用的混合菌中含有大量微生物,由于其产生甲烷的途径并不单一,不同途径中起作用的微生物不同,所以不同添加量的高岭土会造成甲烷总产量的差异。
另外,高岭土等黏土矿物具有较好的缓冲能力和吸附能力,可以调节体系的pH 值或者吸附溶液中微生物代谢产生的有毒代谢物,可以较好维持微生物活性,因此对生长代谢过程有促进作用。Chen Hao等[25]研究认为蒙脱石和高岭石表面可以与细菌代谢过程中产生的氢离子进行交换,此过程可以间接影响微生物的活性,矿物质可以通过将微生物所处环境的pH 值保持在生长的最佳生理范围内,从而对附着在上面的细菌产生刺激作用。Wu Huayong 等[26]研究发现蒙脱石吸收了恶臭假单胞菌生长过程中产生的抑制剂,显著提高其代谢活性。本次研究中高岭土添加量对产甲烷量也有促进作用,尤其是在发酵后期生成的酸对产甲烷菌存在抑制,而高岭土的添加对体系具有缓冲作用,促进甲烷生成,提高甲烷产量。
2.2 VFAs 质量浓度
VFAs 主要指小分子酸类物质,它是在有机质降解过程中形成的主要中间代谢产物,通常情况下,VFAs 以乙酸、丙酸和丁酸为主,存在少量的戊酸和异戊酸等物质[27]。VFAs 是影响厌氧产气稳定性的重要因素之一,通过测定产气末端产物中VFAs 含量,可以判断产气原料水解后是否完全转换为乙酸等供给产甲烷菌利用,以及体系是否发酵完全。一般,体系中的VFAs 浓度需要控制在某个范围内,当VFAs 质量浓度高于400 mg/L,厌氧发酵体系便会受到轻度抑制,当VFAs 高于1 000 mg/L,厌氧发酵体系受到中度抑制[28]。
由图2 可知,添加高岭土的煤样,其生物产气体系中,VFAs 水平皆在10 mg/L 以下,对厌氧发酵体系均不产生抑制。这也说明在50 d 的发酵周期中,有机物的发酵都比较彻底,没有过多的VFAs 残留。随着体系中高岭土添加量的增加,丙酸浓度呈先增大后减小趋势,而乙酸和VFAs 的变化也存在2 个变化区间,在0~1.0%和2.0%~8.0%添加量内均呈现先减后增趋势,在0.5%和4%时乙酸和VFAs 含量最低。这可能是由于较低量的高岭土能够吸附反应体系中产生的毒性物质,从而减轻其对产气功能菌群的毒害作用,促进了酸的生成,而较高含量的高岭土能够作为酸碱缓冲剂,改善酸环境,抑制酸的产生。除了8.0%的实验组乙酸浓度高于对照组外,其余均比对照组低,说明高岭土的添加提高了乙酸的利用率,高岭土添加量增加到8.0%后,产气结束时培养液中残留的乙酸含量较高,这可能是由于产气结束时培养瓶内累积了大量甲烷,而甲烷会抑制产甲烷反应过程,故而造成乙酸量累积。在高岭土添加量为0.5%和4.0%时乙酸浓度均较小,这可能与2 组发酵液中产乙酸菌的丰度有关。
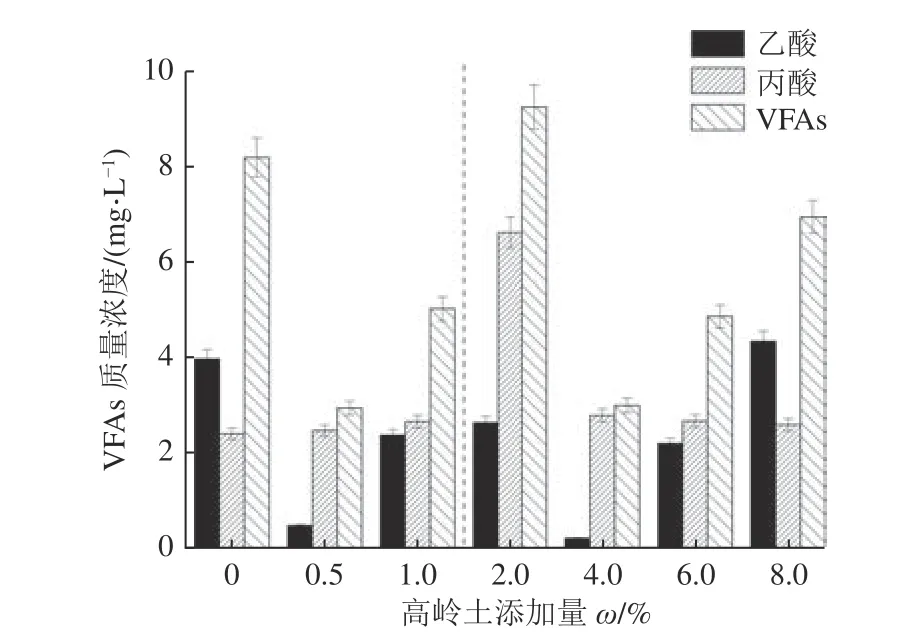
图2 高岭土添加量对VFAs 质量浓度的影响Fig.2 Effect of kaolin addition on VFAs content
根据图2 可知,高岭土质量分数为2.0%的实验组中,发酵液中VFAs 含量最高,说明煤被生物利用产甲烷的程度也最高,因此,推测此时最有利于煤被微生物降解。结合图1a 结果来看,该添加量条件下第36 天之后,产甲烷含量快速上升,第50 天时与8.0%和0.5% 添加量下产甲烷接近。但是,其累积产甲烷量(图1b)较低,可能原因有两点:其一,本研究中仅分析了反应50 d 体系中VFAs 的含量,而对整个动态过程并没有进行分析,所以仅能表明在该产气周期内,2.0%添加量中VFAs 量最高,但是VFAs 被其他微生物利用产气存在一定滞后性;其二,生物产气是微生物协同作用的过程,高岭土对体系中的微生物存在不同程度的影响,在2.0%的添加量体系中产VFAs 的微生物可能较活跃。
2.3 辅酶F420 质量浓度
辅酶F420是产甲烷菌特有的物质,主要是作为低电位电子转移载体,在甲烷形成过程中起着重要作用,辅酶F420含量作为评价厌氧消化器中产甲烷菌的活力指标[29]。由图3 可以看出,辅酶F420含量在添加不同高岭土实验组之间波动不大,但整体均高于对照组,并且其波动也可分为0~1.0%与2.0%~8.0%2 个区间,在添加量区间内呈现先增后减趋势。结合VFAs 变化趋势也可发现,F420活性高时,体系中乙酸和VFAs 浓度较低,这说明高岭土影响发酵液中产甲烷菌的活性,体系中乙酸和VFAs 的消耗是产甲烷菌消耗所致。另外,高岭土中含有的微量元素等物质是产甲烷过程中各种反应所需要酶的重要组成部分,能够抑制同型产乙酸菌的活性,刺激产甲烷菌的生长,使产甲烷菌在混合菌体中有较高的竞争优势。在高岭土添加量为4.0%时其辅酶F420活性最高,达到48.93 ng/L,较对照组提高15.43%,表明在2.0%~8.0%添加区间内,4.0%为高岭土的最适宜添加量。

图3 辅酶F420 质量浓度随高岭土添加量的变化Fig.3 Changes in the concentration of Coenzyme F420 with the content of added minerals
2.4 有机官能团
煤的大分子结构非常复杂,包括芳香族和脂肪族碳氢化合物以及氮、硫和氧的杂环化合物,煤结构的复杂性严重影响微生物的直接作用效率,影响生物煤层气的产率[30]。研究表明,煤与甲烷的生物转化在很大程度上依赖于煤中有机组分的生物有效性[31]。
本文利用红外光谱(FT-IR)技术对煤及产气后残煤的官能团进行分析。图4 中为3 种高岭土添加量与原煤的FT-IR 谱图对比。选取这几种进行测试是考虑到其之间梯度较大,理论上其变化会更明显。整体而言,3 个添加量实验组之间,红外光谱的出峰位置并没有明显区别,说明不同高岭土添加量的产气体系中,煤被微生物利用过程中官能团的变化大体相同。对比原煤和产气后残煤的红外吸收光谱,可以看出,实验组产气后残煤在波长3 420 cm-1处均未出峰,而在原煤的相同位置确有一宽峰。根据煤样的红外特征吸收峰[32],3 420 cm-1附近对应醇、酚-OH 及-NH-和-NH2的伸缩振动,说明产气过程中煤相应的官能团被微生物利用。此外,G-4 的残煤在1 900 cm-1处未出峰,而原煤和其他组在1 900 cm-1处均有峰,1 900 cm-1附近对应C=O 伸缩振动,说明高岭土添加量为2.0%时煤中C=O 更易被微生物利用。产气前后代表矿物质(如Si-O-Si、Si-O-Al 等)的吸收峰(1 014、1 018、1 041 cm-1)均未减少,说明产气过程中矿物并未直接参与反应过程。以上分析也表明,煤中的小分子结构易于被产甲烷微生物利用,而大分子芳环则难以被降解。
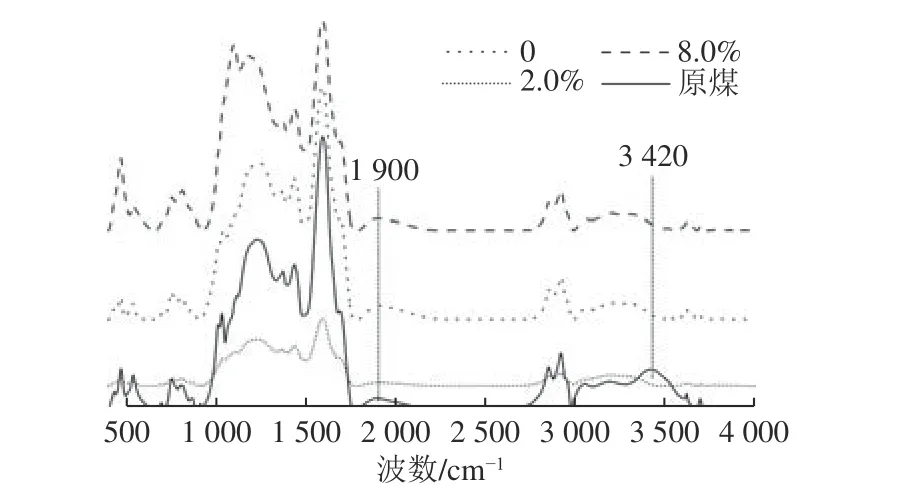
图4 不同高岭土添加量样品产气后红外光谱吸收峰对比Fig.4 Comparison of infrared spectrum absorption peaks between samples with different concentration of kaolin
2.5 微生物群落组成的变化
1)多样性指数
产气结束后,7 组样品高通量测序结果共得到309 071条细菌和328 252 条古菌16S rRNA 基因序列。细菌和古菌的序列平均长度分别是416.87 bp 和429.75 bp。表2 列出了7 组样品的Alpha 多样性指数,从表中可以看出,对于添加高岭土实验组而言,前3 组(G-1、G-2和G-3) 的细菌丰度实际观测值、Chao 指数和Ace指数均最高,说明前3 组产气体系中细菌的丰度较高,由此可以看出当培养基中不添加或者添加较少(0.5%,1.0%)的高岭土时,产气体系中细菌的种类较为丰富。G-3 的古菌丰度实际观测值和Chao 指数均最高,表明产气体系中古菌的种类最丰富。同时,Shannon 指数和Simpson 指数说明G-4 细菌和G-3 古菌多样性最高。此外,全部样品的覆盖度指数范围在0.998 以上,表明各样品中微生物序列均被测出,可以代表样品中微生物的种群结构。
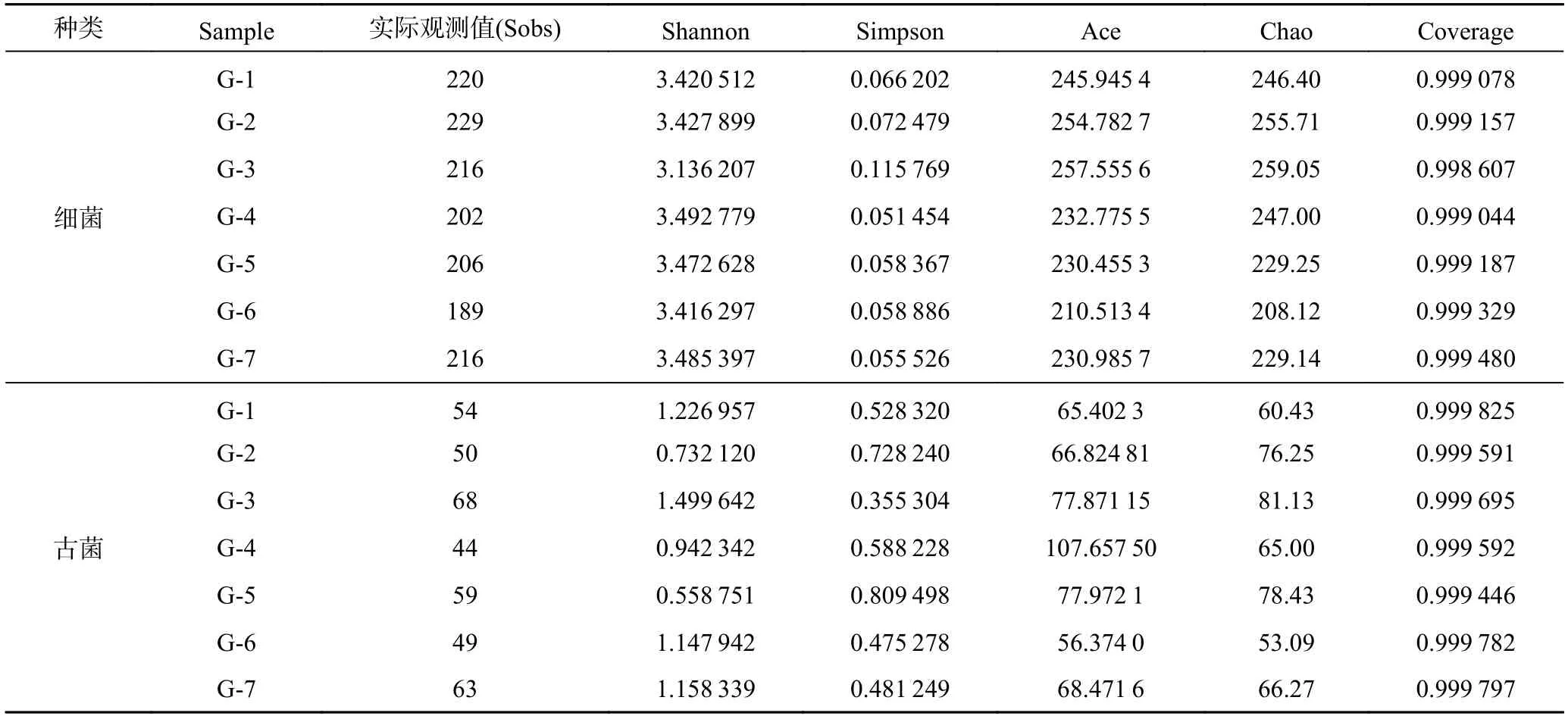
表2 高岭土实验组的Alpha 多样性指数Table 2 Alpha diversity index of kaolin test group
根据测序结果显示,细菌共有291 个OTU(Operational Taxonomic Unit),可以分为18 个门、145 个属。图5 为空白组与添加高岭土实验组中细菌在门水平和属水平的群落分布柱状图。
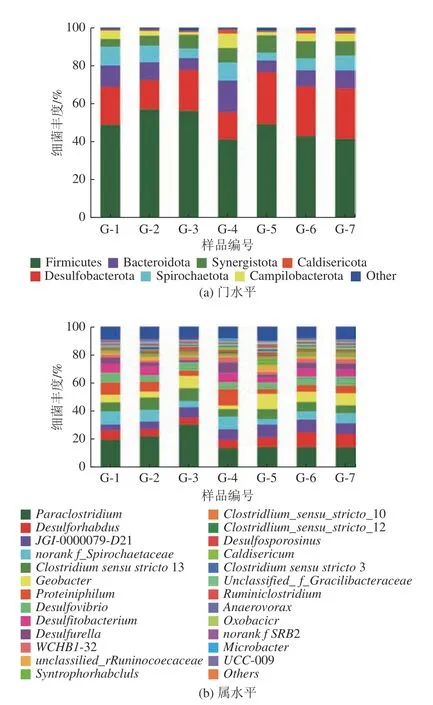
图5 添加高岭土实验组细菌群落结构Fig.5 Bacteria community histogram of the kaolin test group
2) 细菌群落组成
由图5a 可知,在门水平以Firmicutes(厚壁菌门)最为丰富(41.25%~56.94%),其次分别是Desulfobacterota(脱硫菌门)(14.31%~27.22%)、Bacteroidota(拟杆菌门)(6.13%~16.66%)、Spirochaetota(螺旋菌门)(4.12%~9.99%)、Synergistota(3.99%~9.09%)、Campilobacterota(弯曲菌门)(1.33%~7.49%)、Caldisericota(0.34%~2.13%)等。从结果来看,高岭土添加量在0~1.0%和2.0%~8.0%时,Firmicutes 的丰度先增后减,该菌门中微生物主要参与一些混合酸、醇和中性物质的生成,可见高岭土添加量为0.5% 和4.0% 时对提高煤中有机质降解有促进作用。Bacteroidota 是一类化能自养型微生物,它们能参与苯酚等有机物的降解产生琥珀酸、乙酸、甲酸、乳酸和丙酸等过程[33]。
从图5 可以看出,2.0%高岭土添加量,第50 天时该菌门丰度最高,该结果与VFAs 的变化较为一致,可见该添加量体系对拟杆菌门的活性有促进作用,使得VFAs 含量上升。Desulfobacterota 中大多为硫酸盐还原菌,利用有机质同时可将硫酸盐还原为H2S[34],大多数添加高岭土实验组中,该菌门丰度均高于对照组,说明高岭土添加可以提高脱硫菌门丰度。
从属水平来看(图5b),群落结构变化规律并不明显。由图中可以发现,Paraclostridium(梭菌属)是细菌中丰度最高的菌属(13.69%~30.47%),接下来丰度较高的菌属依次为Desulforhabdus(杆状脱硫菌属)(4.90%~10.62%)、JGI-0000079-D21(3.99%~9.09%)、norank fSpirochaetaceae(未分类螺旋体属)(3.96%~9.51%)、Clostridium sensu stricto13(狭义梭菌属13)(5.38%~8.79%)、Geobacter(地杆菌属)(2.62%~8.76%)、Proteiniphilum(嗜蛋白菌属)(3.36%~11.28%)、Desulfovibrio(脱硫弧菌属)(4.53%~6.72%)、Desulfitobacterium(脱硫杆菌属)(0.24%~6.71%)、Desulfurella(硫还原菌属)(1.34%~7.49%)等。Paraclostridium在一些淀粉、纤维质、几丁质等的解聚、混合酸、醇和中性物质的生成中起着重要作用[35],添加少量高岭土(0.5% 和1.0%) 可以提高该属微生物丰度,结合VFAs 数据来看,它们之间没有明显的关联,梭菌属在该体系中参与生成的可能是其他有机化合物。Geobacter(地杆菌属)是在厌氧环境中以膜结合蛋白和导电Ⅳ型菌毛来进行直接胞外电子传递的代表性微生物[36],从结果来看,添加高岭土的实验组中该菌属丰度大部分高于对照组,尤其是在1.0%和4.0%添加组中丰度最高。由于高岭土本身不导电,所以推测其丰度变化与煤中少量的半导体矿物含量变化有关,具体原因有待进一步研究。Clostridium是厌氧芽孢杆菌属,在恶劣环境下能产芽孢,代谢有机物产生小分子酸或醇等,属于产酸菌[37],该菌属在所有添加高岭土的实验组中丰度较为接近,说明这类细菌丰度受高岭土影响不大。
整体上来看,尽管高岭土添加对细菌种群丰度影响变化不明显,但是某些门和属的微生物在产气第50天后其丰度发生了变化,并且不同种属丰度变化呈现明显差异性,这也进一步证实了高岭土对不同微生物的影响不同,其具体原因有待进一步研究。
3) 古菌群落组成
7 组样品中测序得到的古菌共有117 个OTU,可以分为6 个门、19 个属。图6 为高岭土实验组古菌在门水平和属水平的群落分布。可以看出,在门水平(图6a),Euryarchaeota(广古菌门)占比最大(57.89%~91.55%),其次分别是Halobacterota(海拉古菌门)(3.29%~31.75%)、Thermoplasmatota(热原体门)(3.36%~11.61%) 以及Crenarchaeota(泉古菌门)(0~1.65%)。整体上来看,其菌门丰度变化趋势也可分为0~1.0%和2.0%~8.0%2 个区间,在2 个区间内Euryarchaeota 呈先升后降趋势,添加高岭土量为0.5%和4.0%时Euryarchaeota 丰度最高,对应的累积产甲烷量和F420含量也高于对照组,说明在这两种添加量的体系中,细菌和古菌具有较好的协同性,能促进甲烷生成。而Halobacterota 在高岭土添加量为1.0%时丰度虽然最高,但该体系中甲烷产量和F420量在所有实验组中最低,可见该菌门在体系中贡献不大。
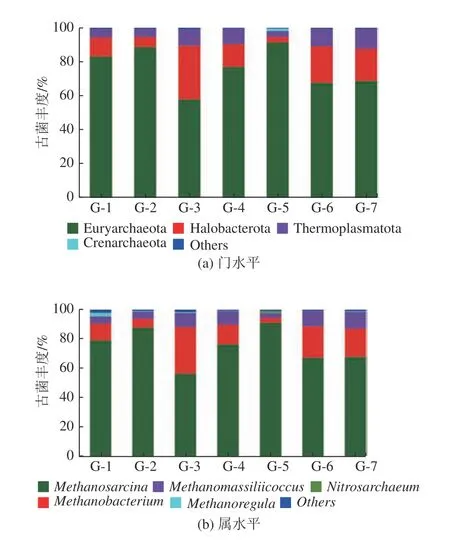
图6 添加高岭土实验组古菌的群落结构Fig.6 Archaeal community histogram of the kaolin test group at the phylum level and the genus level
从属水平上(图6b),广古菌门Methanosarcina(甲烷八叠球菌属)数量占比最为丰富(56.46%~91.06%),其余依次为广古菌门Methanobacterium(甲烷杆菌属)(3.29%~31.75%)、Methanomassiliicoccus(第七产甲烷古菌目)(3.33%~11.61%)、广古菌门的Methanoregula(甲烷微菌属)(0.19%~2.47%) 及Nitrosarchaeum(0~1.37%) 等。添加0~1.0%和2.0%~8.0%高岭土实验组,古菌Euryarchaeota 和Methanosarcina丰度变化趋势和F420含量变化一致,但和VFAs 变化趋势正好相反,其中0.5%和4.0%添加量时的菌丰度和F420含量均为最高,而乙酸和VFAs 含量却最低。从属水平上来看,Methanobacterium变化趋势与Methanosarcina正好相反,随着高岭土添加量的增加呈先降后升趋势,其中0.5%和4.0%时其相对含量最低。Methanosarcina和Methanobacterium是较常见的产甲烷菌,其中Methanosarcina是混合营养型产甲烷菌,既可以利用氢气产甲烷,也可以利用乙酸产甲烷,Methanobacterium为氢营养型产甲烷菌,可利用H2/CO2产生甲烷。
有研究表明石灰石能够显著提高细菌数量,利于微生物的降解作用[38],本实验的微生物多样性结果也表明,添加适量高岭土能提高细菌和古菌的丰度;从群落结构上也可以发现,高岭土的添加增加了对产甲烷起作用的微生物丰度。有理由推测是高岭土对煤降解过程中微生物的活性和丰度产生促进作用,由VFAs结果可以分析,高岭土影响了产酸微生物的活性,从而影响甲烷的生成。结合乙酸、VFAs 和F420变化趋势来看,两者在消耗体系中酸与氢气产甲烷时相互抑制。0.5%和4.0%添加量将有利于提高Methanosarcina活性,提升甲烷含量。
3 结 论
a.高岭土添加量为0~8.0%体系可以明显分为2个区间,在低质量分数添加量(0~1.0%)和相对较高添加量(2.0%~8.0%) 区间内,甲烷产量、累积甲烷量和F420均呈先增后减的变化趋势;0.5%和4.0%添加量时相应值均最高,而在添加量范围内,乙酸、VFAs 的变化趋势正好相反,呈先减后增趋势。高岭土添加量较低时(0~1.0%)反应第50 天后累积产甲烷量和F420最高分别达216 μmol/g 煤和48.93 ng/L,较空白组提高55.4%和15.43%。高岭土添加有利于煤中醇和酚-OH,-NH-和-NH2被微生物利用,当高岭土添加量为2.0%时煤中C=O 更易被微生物利用。
b.高岭土添加对细菌种群结构影响不明显,而对古菌影响呈现规律性变化。在低质量分数添加量(0~1.0%) 和相对较高添加量(2.0%~8.0%) 区间内Firmicutes、Euryarchaeota 和Methanosarcina和产甲烷量、F420变化趋势一致,而Methanobacterium和乙酸和VFAs 变化一致。这说明Firmicutes 和Euryarchaeota 在体系中具有较好的协同性,能促进甲烷生成,而Methanosarcina和Methanobacterium在产甲烷时存在相互抑制作用。
c.煤的生物产气体系中微生物种类众多,代谢过程复杂,高岭土是煤中分布较多的代表性矿物,矿物的添加会影响生物产气过程。由于本研究中没有对整个产气过程中相应参数进行动态监控,且所用微生物为混合菌群,而高岭土对不同微生物生长代谢的影响存在差异,所以目前的结果还难深入阐明其对不同微生物的具体影响机理。但本研究成果对后阶段开展煤中无机矿物组分对生物产气的影响提供了新的思路和参考依据。
