短链脂肪酸通过抑制HDAC8/9促进PD小鼠肠道细胞炎症反应
2022-07-01乔晨萌孙孟菲徐一诺贾雪冰王增妹张博枰赵丽萍申延琴
乔晨萌,孙孟菲,李 阳,徐一诺,贾雪冰,王增妹,张博枰,赵丽萍,崔 春,申延琴*
(1. 江南大学医学院神经退行和损伤研究室,江苏 无锡 214122;2.华南农业大学农学院,广东 广州 510642)
帕金森病(Parkinson's disease,PD)是发病率第二的中枢神经系统退行性疾病,其发病与年龄相关,高发人群年龄段为65~70 岁,且随年龄增长患病风险成倍增加[1]。目前认为,PD 的发病与年龄因素、遗传因素(α-突触核蛋白,Parkin、DJ-1、PINK1、LRRK2等突变)和环境因素如1-甲基-4-苯基-1,2,3,6-四氢吡啶(1-methyl-4-phenyl-1,2,3,6-tetrahy dropyridine,MPTP)、鱼藤酮、除草剂/杀虫剂、蛋白酶体抑制剂,等密切相关,然而其具体的发病机制仍不清楚且缺乏行之有效的治疗手段[2-3]。近年发现,肠道菌群失衡在PD 的发生发展中具有重要作用[4-6],但机制尚不清楚。多项研究[7-8]表明肠道菌群组成变化和菌群代谢产物,如短链脂肪酸(short-chain fatty acids,SCFA)的改变与PD 的发病机制和临床表现相关。Sampson 等[9]发现给无菌小鼠喂食肠道菌群代谢物SCFA 会加剧其运动障碍。本课题组前期研究也发现,利用粪菌移植法纠正MPTP 诱导PD小鼠的肠道菌群紊乱的同时,伴随其粪菌中SCFA异常升高现象的显著缓解[10]。以上研究均提示SCFA可能参与影响PD疾病的进展。
SCFA 是指碳链为1~6的有机脂肪酸,主要包括乙酸、丙酸和丁酸等,三者总含量约占SCFA的90%~95%。作为肠道菌群的主要代谢物之一,SCFA对肠道炎症的调节发挥着至关重要的作用。研究[11]发现,SCFA 能够调节肠道的免疫应答,能通过抑制组蛋白乙酰化酶(Histone deacetylase,HDAC)调节基因表达(如抑制COLO205细胞中IL-8和巨噬细胞中TNF-α、IL-6和IL-12等促炎因子的表达,促进抗炎因子IL-10的表达)[12]。2016年,Sanford和他的同事发现SCFA 丁酸对单核细胞中Toll 样受体(Toll-like receptor,TLR)诱导的细胞因子的产生具有抑制作用,而对角质细胞中细胞因子的产生则具有促进作用,并且HDAC8 和HDAC9 控制这些促炎因子的表达[13]。以上提示SCFA 能通过HDAC 途径参与调节炎症反应。
越来越多的证据表明肠道炎症会加剧PD 的进程。Gil-Martínez 等[14]发现,在帕金森病啮齿类动物模型中,胃肠道损伤引发全身性炎症会加剧多巴胺能神经元的死亡。提示结肠炎症能够影响MPTP处理的小鼠黑质纹状体多巴胺能神经元变性的进展。Villumsen 等[15]针对1977至2014年的队列研究发现,炎症性肠道疾病的患者罹患PD 的风险更高。因此,肠道炎症与PD的发生发展关系密切。
基于上述研究背景,本研究提出科学问题:肠道菌群代谢产物SCFA 是否通过HDAC 途径参与调节PD 模型小鼠肠道炎症?本研究分别观察了SCFA 对帕金森病模型小鼠的肠道炎症以及对肠内分泌细胞炎症的影响,并且利用小核糖核酸干扰技术进行作用机制的验证,旨在阐明SCFA 参与PD 肠道炎症的作用机制。
1 材料与方法
1.1 动物、细胞系和试剂
本实验所用SPF级的7周龄C57BL/6J雄性小鼠购于昭衍(苏州)新药研究中心有限公司。STC-1细胞系购于赛百慷(上海)生物技术股份有限公司。MPTP 盐酸盐、乙酸钠、丙酸钠、丁酸钠、多巴胺盐酸盐、3,4-二羟基苯乙酸(3,4-dihydroxyphenylacetic acid,DOPAC)、高香草酸(homovanillic acid,HVA)、5-羟色胺(serotonin,5-HT)、5-羟吲哚乙酸(5-hydroxyindoleacetic acid,5-HIAA)均购于美国Sigma公司;四甲基偶氮唑盐(methyl thiazolyl tetrazolium assay,MTT)、甲醇(HPLC 级)、乙腈(HPLC 级)购于北京百灵威科技有限公司;0.9%无菌生理盐水购于华润双鹤药业股份有限公司;高氯酸(AR 级)、多聚甲醛购于上海国药集团化学试剂有限公司;DMEM高糖培养基、胎牛血清、PBS 溶液、青链霉素双抗购于Gibco 公司;qPCR 相关试剂购自TaKaRa 公司;TRIzol试剂和Lipofectamine 2000购于Thermo公司。
1.2 MPTP 诱导PD 小鼠模型的构建与短链脂肪酸处理
1.2.1 MPTP 诱导的亚急性PD 小鼠模型构建 将MPTP盐酸盐溶于无菌生理盐水中,浓度为3 mg/mL。按照30 mg/kg·d 的给药剂量对8 周龄雄性C57BL/6J小鼠连续进行5 d 腹腔注射。对照组小鼠在同等操作下注射相同体积的无菌生理盐水(即每10 g 小鼠体重对应100 μL无菌生理盐水),见图1。

图1 动物实验流程示意图
1.2.2 短链脂肪酸处理 将乙酸钠、丙酸钠、丁酸钠分别溶解于无菌水中,浓度分别为150、150、100 mmol/L;混合酸溶液包含67.5 mmol/L 乙酸钠、40 mmol/L 丙酸钠和25.9 mmol/L 丁酸钠[9]。所有短链脂肪酸溶液均现配现用。灌胃的剂量为每10 g小鼠体重对应100 μL短链脂肪酸溶液,对照组为相同体积的无菌水。
1.2.3 实验组别 将小鼠随机分为6 组,分别为:①空白对照组小鼠:连续5 d 腹腔注射无菌生理盐水(与MPTP 溶液等体积),之后连续7 d灌胃无菌水(与SCFA 溶液等体积);②PD 模型组:连续5 d腹腔注射MPTP 溶液,之后连续7 d 灌胃无菌水;③乙酸处理组:连续5 d 腹腔注射MPTP 溶液,之后连续7 d灌胃乙酸钠溶液;④丙酸钠处理组:连续5 d腹腔注射MPTP 溶液,之后连续7 d 灌胃丙酸钠溶液;⑤丁酸钠处理组:连续5 d 腹腔注射MPTP 溶液,之后连续7 d 灌胃丁酸钠溶液;⑥混合酸处理组:连续5 d腹腔注射MPTP 溶液,之后连续7 d 灌胃混合酸溶液。上述腹腔注射和灌胃给药的体积均为每10 g小鼠体重对应100 μL溶液。
1.3 高效液相色谱(HPLC)检测小鼠纹状体多巴胺含量
1.3.1 HPLC 样品准备 称重后,按照每10 mg 纹状体加入100 μL高氯酸溶液,使用注射器进行物理捣碎,使用杯式超声波细胞粉碎仪充分破碎组织(注意全程保持仪器腔体为冰水混合物状态)。破碎结束后,在高速离心机中,4℃,13 000 rpm,离心10 min,所得上清液经水性滤膜(0.22 μm)过滤后置于进样瓶内衬管中,-80 ℃保存待检测。
1.3.2 检测条件 采用Waters 2 695 分离单元串联Waters 2 475 荧光检测器对小鼠纹状体内神经递质DA 的含量进行检测。色谱条件:Waters Atlantis T3 色谱柱(150 mm×4.5 mm,5 μm)。流动相:流速为0.8 mL/min,乙腈-水-0.01 mol/L PBS(pH 4.0)梯度洗脱。上样量:20 μL。荧光检测条件:激发与吸收波长分别为280 nm和320 nm。
1.4 细胞培养与处理
1.4.1 细胞培养 小鼠STC-1 肠内分泌细胞培养条件为DMEM 培养基+10%胎牛血清+100 U/mL 青霉素/100 μg/mL 链霉素,培养箱条件为37 ℃,含5%CO2。
1.4.2 细胞分组 将对数生长期的小鼠STC-1 肠内分泌细胞接种于12 孔板贴壁生长过夜后,随机分为5 组:①对照组:培养基处理组;②乙酸钠组:乙酸钠溶液处理24 h;③丙酸钠组:丙酸钠溶液处理24 h;④丁酸钠组:丁酸钠溶液处理24 h;⑤混合酸组:混合酸溶液处理24 h。其中,单一酸的浓度均为1 mmol/L,混合酸为:乙酸钠1 mmol/L、丙酸钠1 mmol/L:丁酸钠1 mmol/L。
1.5 细胞毒性检测
采用MTT 检测细胞的活力来表征不同SCFA 的细胞毒性。首先,将STC-1 细胞按照5×105细胞/孔接种于96孔板贴壁过夜生长,之后向孔内加入浓度分别为0.05、0.1、0.2、0.5或1 mmol/L 的乙酸钠、丁酸钠、丙酸钠或混合酸(乙酸钠∶丙酸钠∶丁酸钠=1∶1∶1)。在37 ℃,5%CO2培养箱中共培养24 h 后,先向孔内各加入20 μL MTT 工作液(5 mg/mL 溶解于PBS中),继续在培养箱孵育4 h后弃上清,每孔加入150 μL 二甲基亚砜(dimethyl sulfoxide,DMSO)混匀。使用全功能微孔板检测仪在490 nm 处测定吸光度,并以处理后的培养物与未处理的对照培养物的吸光度百分比来确定细胞活力。
1.6 小干扰RNA(Small interfering RNA,siRNA)转染
1.6.1 siRNA 的核酸序列 HDAC8-Mus-391,正义链:CCAGCCACAGAAGGGAUAUTT;反义链:AUAUCCCUUCUGUGGCUGGTT;HDAC8-Mus-609,正义链:GGAUUUGGAUCUACACCAUTT;反义链:AUGGUGUAGAUCCAAAUCCTT;HDAC8-Mus-892,正义链:GCCGGAGAUCCAAUGUGUUTT;反义链:AACACAUUGGAUCUCCGGCTT;HDAC9-Mus-404,正义链:GCAACUGCAGCAAGAGUUATT;反义链:UAACUCUUGCUGCAGUUGCTT;HDAC9-Mus-1013,正义链:GCGGAAGGAUGGAAAUCUUTT;反义链:AAGAUUUCCAUCCUUCCGCTT;HDAC9-Mus-1576:正义链:GCAUUAGAGGUACCCACAATT;反义链:UUGUGGGUACCUCUAAUGCTT。
1.6.2 细胞转染 将靶向沉默HDAC8 和HDAC9的siRNA分别与脂质体载体Lipofectamine 2000混合后室温静置复合30 min。之后将复合物加入细胞中,于细胞培养箱中转染4 h后弃上清换新鲜细胞培养基,继续培养24 h后收集细胞RNA,用于后续qPCR检测。
1.7 RNA提取和实时定量PCR(qPCR)
使用TRIzolTM试剂提取结肠组织与STC-1 细胞的总RNA[16]。使用反转录试剂盒(PrimeScriptTM RT 试剂盒)将mRNA 逆转录成cDNA。采用SYBR Premix Ex Taq Ⅱ试剂盒进行qPCR 检测。使用的引物序列见表1。
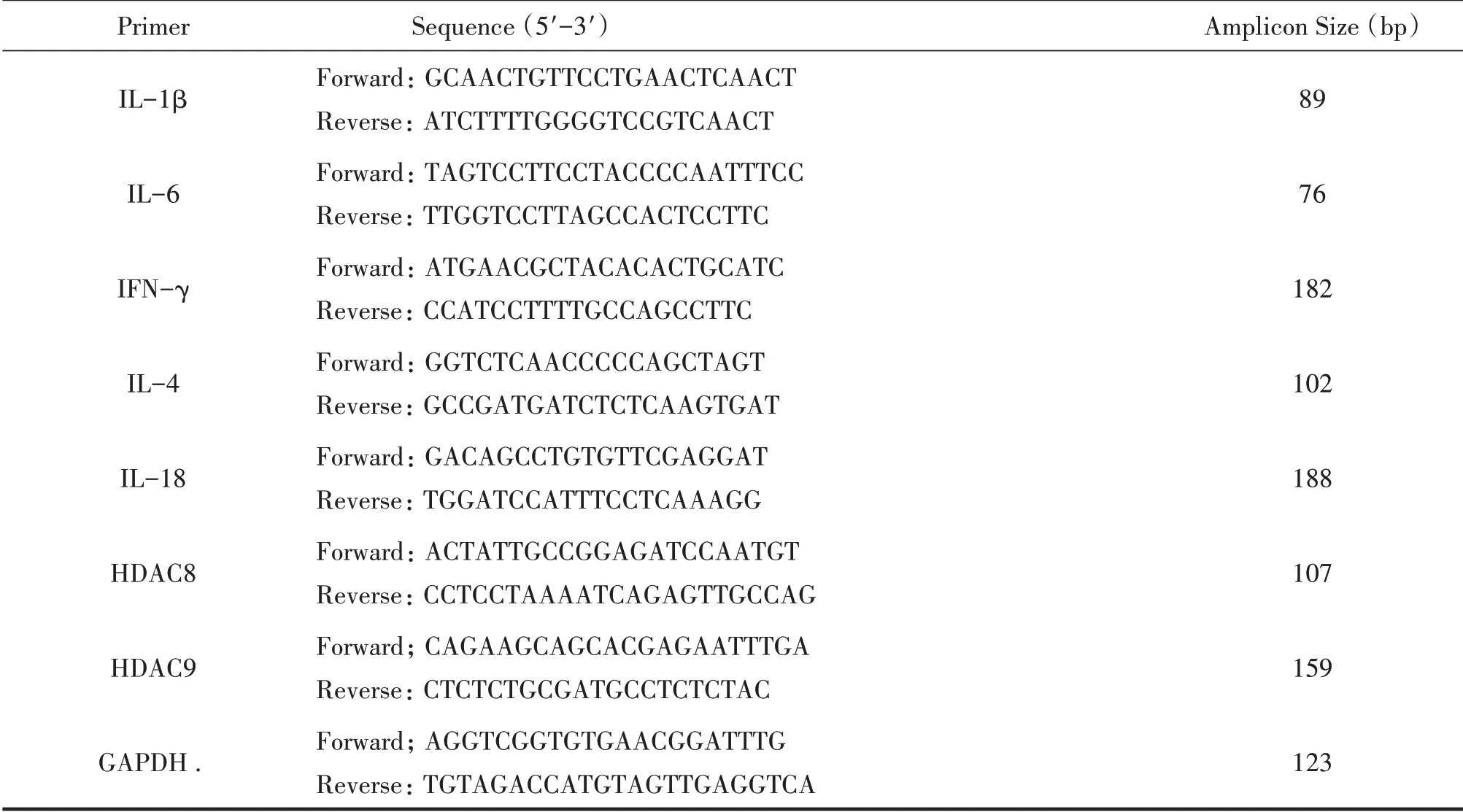
表1 qPCR引物序列
1.8 统计学方法
所有实验均采用SPSS 22.0 软件进行统计学分析。多组之间的比较使用单因素方差分析,LSD事后比较或Dunnett's T3事后比较。数据以(± s)表示,P<0.05为显著性阈值。
2 结果
2.1 不同SCFA 对MPTP 诱导的PD 模型小鼠神经递质的影响
为探索不同SCFA 对MPTP诱导的亚急性PD 模型小鼠纹状体内神经递质的影响,本研究采用HPLC法检测了各组小鼠纹状体内神经递质DA 含量。如HPLC结果所示(图2),与空白对照组小鼠相比,模型组小鼠纹状体内DA含量显著下降。利用不同SCFA处理后发现,相较于模型组小鼠,丙酸处理组和丁酸处理组小鼠纹状体DA含量进一步显著下降,而乙酸处理组和混合酸处理组小鼠纹状体内DA 含量出现下降但无显著性。提示丙酸和丁酸能加剧MPTP 诱导的PD小鼠纹状体内神经递质多巴胺的丢失。

图2 SCFA降低MPTP诱导的PD小鼠纹状体多巴胺
2.2 不同SCFA 对MPTP 诱导的PD 模型小鼠结肠促炎因子的影响
为了探讨SCFA 是否促进MPTP 诱导的PD 小鼠结肠炎症因子的表达,本研究对结肠中促炎因子进行检测。结果发现,与模型组小鼠相比,乙酸处理组和丁酸处理组小鼠结肠IFN-γ 的表达显著上调(图3A);乙酸处理组和丙酸处理组小鼠结肠中促炎因子IL-4 的表达显著上调(图3B),提示SCFA 引起的肠道炎症可能与神经递质丢失的加剧有关。
2.3 不同SCFA 对MPTP 诱导的PD 模型小鼠结肠HDACs的影响
多项研究表明,SCFA 能够抑制HDAC 的表达[17-20],而HDAC 与肠道炎症之间关系密切[21]。为了探索SCFA 对MPTP诱导的PD小鼠肠道炎症的促进作用是否与HDAC 的表达相关,本研究观察了小鼠结肠中HDAC8 和HDAC9 的表达。结果显示,丙酸处理组、丁酸处理组与混合酸处理组小鼠结肠中HDAC8 和HDAC9 的表达较PD 模型组小鼠均显著下降(图4A 和4B)。提示SCFA 促进MPTP 诱导的PD 模型小鼠结肠中炎症因子的表达可能与HDAC8和HDAC9的下调相关。
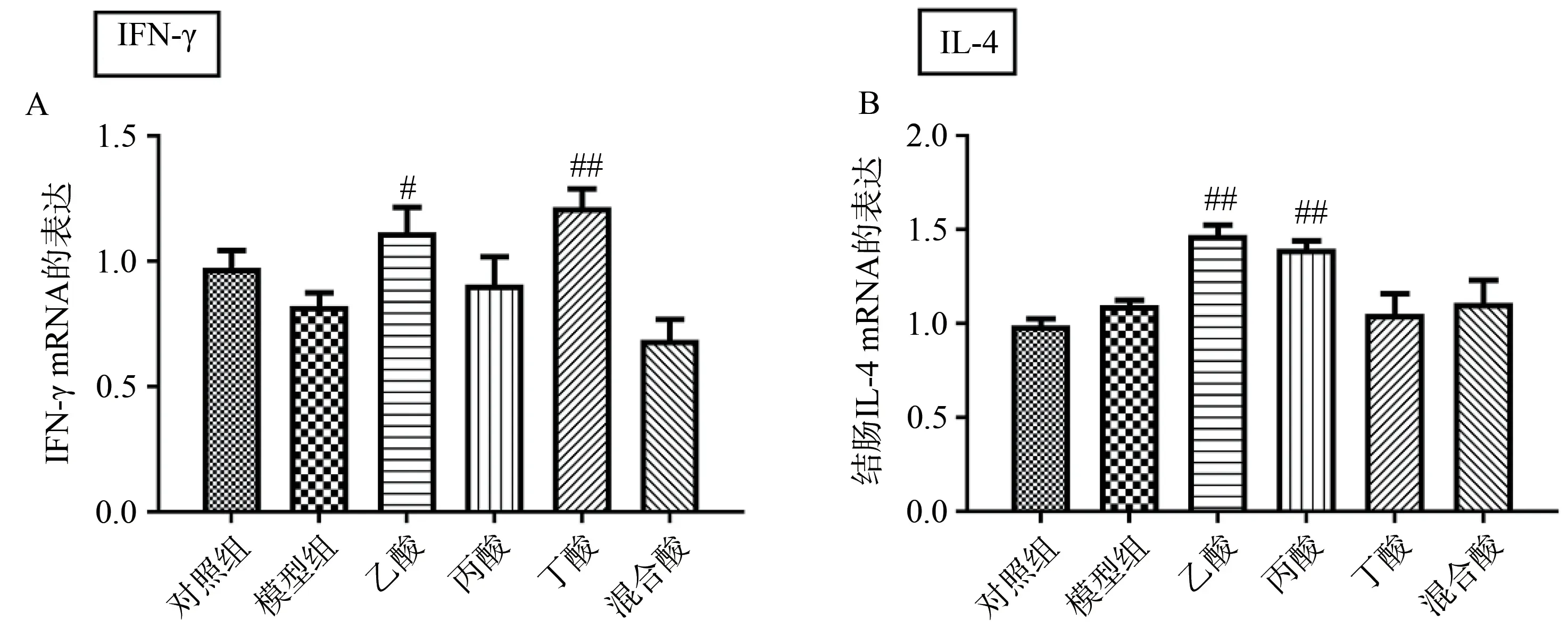
图3 SCFA促进MPTP诱导PD模型小鼠结肠IFN-γ mRNA和IL-4 mRNA的表达
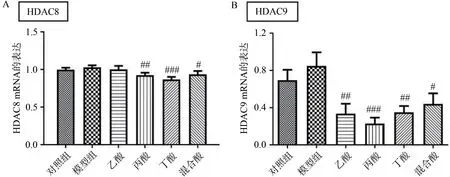
图4 SCFA抑制PD模型小鼠结肠HDAC8 mRNA和HDAC9 mRNA的表达
2.4 不同SCFA对STC-1细胞毒性的影响
为了观察SCFA 对肠道细胞的影响,本研究使用STC-1 细胞株模拟体内肠内分泌细胞进行体外实验。利用MTT 法考察了不同浓度体系SCFA 对STC-1 肠内分泌细胞的细胞毒性影响。检测结果发现,不同浓度的单一或混合SCFA 与STC-1 共培养12 h和24 h后,其细胞存活率均无明显下降(图5A和5B),表明所选浓度SCFA对STC-1无细胞毒性。
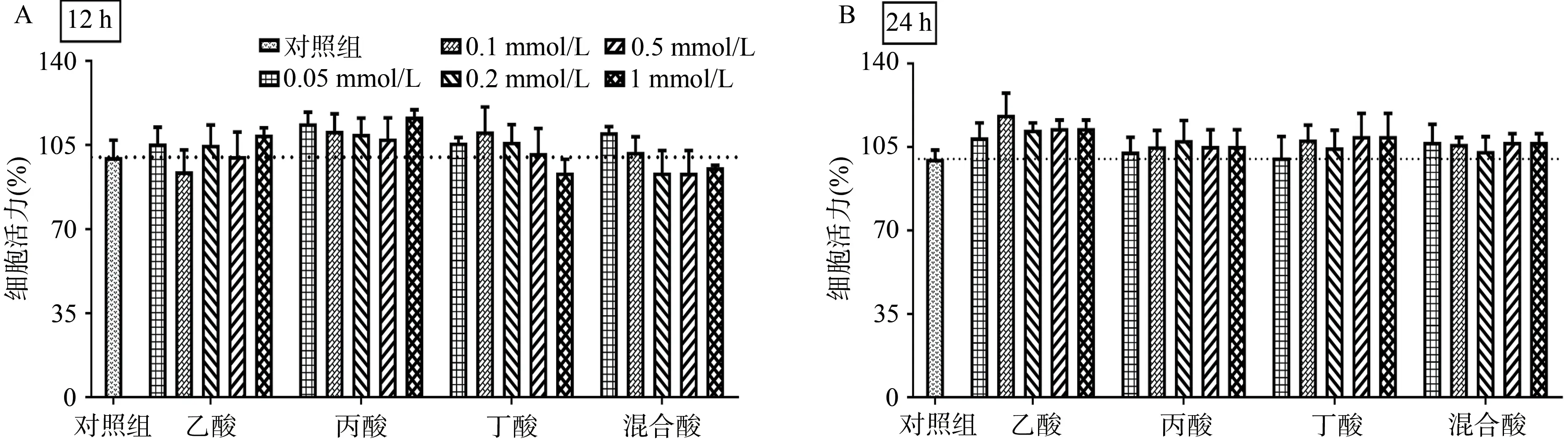
图5 SCFA与STC-1细胞共同培养12 h和24 h后的细胞活力值
2.5 不同SCFA对STC-1细胞促炎因子的影响
体外细胞实验结果发现,乙酸显著促进了IL-6的表达,IL-1β 有所升高但无显著性;丙酸显著促进了IL-1β、IL-6 和IL-18 的表达;丁酸显著促进了IL-1β 和IL-18 的表达,IL-6 有所升高但是无显著性;混合酸显著促进了IL-1β 和IL-18 的表达(图6A-6D)。上述结果提示,不同SCFA 能显著上调肠内分泌细胞中促炎细胞因子的表达。

图6 不同酸处理后STC-1细胞IL-1β,IFN-γ,IL-6和IL-18 mRNA的表达
2.6 不同SCFA对STC-1细胞HDACs的影响
体外细胞实验结果也发现,与对照组相比,丁酸显著抑制了HDAC8 和HDAC9 的表达(图7)。而乙酸,丙酸和混合酸对HDAC8 的表达有抑制作用,但无统计学意义(图7A);乙酸和丙酸对HDAC9 的表达无影响而混合酸抑制了HDAC9 的表达(图7B)。提示丁酸可能通过抑制HDAC8 和HDAC9 的表达参与影响STC-1细胞中炎症因子的表达。
2.7 敲 除HDAC8 或/和HDAC9 对STC-1 细 胞 促炎因子的影响
为了进一步验证HDAC8和HDAC9参与丁酸对STC-1 细胞的促炎作用,本研究使用RNA 干扰技术(RNA interfering,RNAi)靶向沉默HDAC8和HDAC9基因后(图8A和8B),观察是否出现类似丁酸诱导的促炎因子表达上调的现象。与动物实验的结果相一致,丁酸组STC-1 细胞中促炎因子IFN-γ 和IL-1β均显著上调,而IL-6 的表达没有变化(图8)。当沉默HDAC8 时(siHDAC8 组),IL-1β 的表达显著上调,IFN-γ 表达虽略有上升但无显著性(图8C 和8D);当沉默HDAC9 时(siHDAC9 组),则显著上调IFN-γ 和IL-1β(图7C 和7D);同时沉默HDAC8 和HDAC9时(siHDAC8+siHDAC9组),显著上调IFN-γ和IL-1β 的表达(图8C 和8D),各组细胞中IL-6 的表达与对照组均无显著变化(图8E)。提示,特异性沉默HDAC8 或/和HDAC9 均能有效诱导促炎因子的分泌。
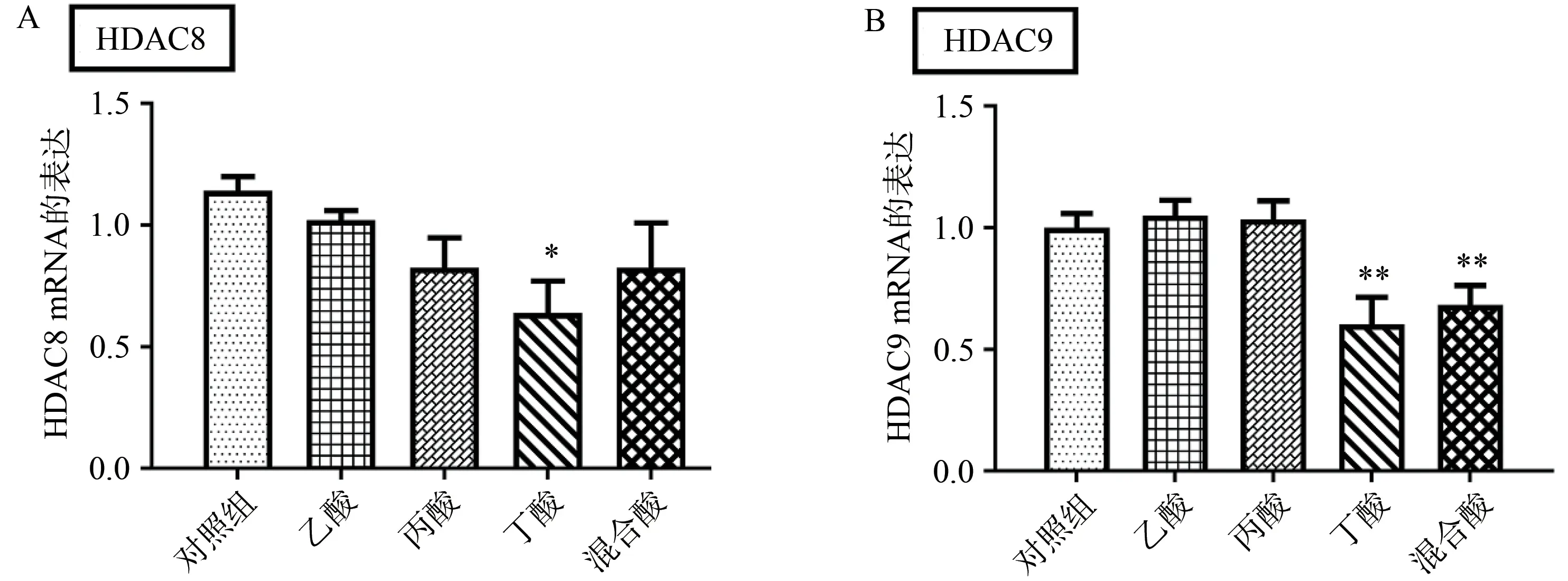
图7 丁酸抑制STC-1细胞中HDAC8和HDAC9 mRNA的表达

图8 丁酸通过HDAC8和HDAC9途径调节STC-1细胞中炎性因子的表达
3 讨论
近期研究表明,肠道病理参与了PD 的发病过程。Scheperjans 等发现肠道菌群失调可能与PD 的发生和发展相关[4]。Villumsen 等的调研结果显示,患炎症性肠道疾病(inflammatory bowel disease,IBD)的患者其患PD 的风险比无IBD 的人群高22%[15]。Matheoud等发现将肠道感染模型引入到PD模型中,能够阐明既往研究中pink1-/-小鼠因缺少炎症性干预而未呈现PD 症的原因[22]。上述研究均提示肠道炎症与PD的病程发展密切相关。
SCFA 是肠道菌群的主要代谢物之一,肠道菌群能够通过SCFA 参与调节肠道免疫应答[23-24],在肠道炎症的调节过程中具有重要作用。因此,首先考察了SCFA 对PD模型小鼠的影响。以MPTP诱导的亚急性PD 模型作为PD 模型,通过考察小鼠纹状体内神经递质DA的变化判断SCFA对MPTP诱导的PD 小鼠的影响。HPLC 结果表明,丙酸和丁酸均显著加剧了MPTP 诱导的小鼠纹状体内神经递质多巴胺的丢失;乙酸和混合酸虽然也进一步加剧了DA的丢失但差异无统计学意义。同时观察到,丁酸显著上调结肠中促炎因子IFN-γ 的表达,乙酸和丙酸显著上调促炎因子IL-4 的表达。这些结果均提示SCFA可加剧PD小鼠结肠中炎症因子的表达。
SCFA 是HDAC 抑制剂的一类,已被报道能够调 节 多 种 基 因 的 表 达[20,25-27]。为 了 进 一 步 探 讨SCFA是否通过HDAC途径促进PD小鼠肠道炎症因子的表达,本研究观察了不同组小鼠结肠中HDACs分子的表达。结果显示,与PD 组小鼠相比,丙酸、丁酸均能显著抑制HDAC8 和HDAC9 的表达;乙酸抑制HDAC9 的表达;混合酸抑制HDAC8 的表达。提示SCFA 可能通过抑制HDAC8 和HDAC9 参与促进PD小鼠肠道促炎因子的表达。
本研究首先使用SCFA 处理肠内分泌细胞STC-1,之后分别考察细胞中促炎细胞因子、HDAC8 和HDAC9 的表达。有趣的是,体外研究中SCFA 同 样 显 著 抑 制HDAC8 和HDAC9 的 表 达;促炎细胞因子(IL-1β、IL-6和IL-18)的表达也显著上调,这一结果与体内结果相一致,提示SCFA 通过抑制HDAC8 和HDAC9 促进STC-1 促炎细胞因子的表达。为了验证促炎因子的上调是否与HDACs 的抑制有关,我们利用siRNA 技术靶向性基因沉默STC-1 细胞中的HDAC8 和HDAC9 的表达。结果发现在STC-1 细胞中,与HDAC 抑制剂SCFA 的作用类似,无论抑制HDAC8 或/和HDAC9 的表达均能诱导促炎细胞因子的显著增加,提示SCFA 能通过抑制HDAC 的表达促进肠内分泌细胞中促炎因子的表达,这可能与肠道炎症加剧以及PD 的发展相关。
综上所述,本研究显示SCFA 可能通过抑制HDAC8 和HDAC9 促进肠道炎症细胞因子IFN-γ,IL-4 的表达,进而参与PD 的发展。本研究为SCFA通过HDAC 途径促进肠道细胞炎症反应进而影响PD 增加了理论依据,为开发基于干预SCFA 的PD治疗新方案提供了新的思路。
