RhoA/ROCK-NFκB信号传导通路在内脂素引起心肌细胞肥大中的作用
2022-06-30常亮杨蓉刘素云李拥军
常亮 杨蓉 刘素云 李拥军
心肌肥大指心脏为适应机体做功的不断增加而发生的适应性反应,这种反应具有一定的代偿效果,能够维持甚至增加心输出量,但随着心肌肥大的发展,心肌氧耗量也会进一步增加,“代偿性”肥大终将发展为“失代偿性”心肌肥厚并出现心力衰竭。心肌肥大是高血压、冠心病、心肌病等多种心血管疾病的共同病理生理变化,发生发展涉及到诸多因素,机制尚未完全阐明。脂肪细胞因子是由脂肪组织分泌的一种血管活性物质,包括瘦素、肿瘤坏死因子、抵抗素、脂联素、白细胞介素等。内脂素是新近发现的一种脂肪细胞因子,具有促炎、促动脉粥样硬化及降低斑块稳定性等多种作用,是冠心病的独立危险因素[1]。近年有研究发现,血清脂联素、内脂素可作为临床预测PCI术后发生心力衰竭的指标[2]。但目有关内脂素在心肌细胞肥大过程中的作用研究较少。本研究通过动物实验,观察内脂素对心肌细胞肥大的影响及相关机制,结果如下。
1 材料与方法
1.1 实验动物 清洁级2~3 d日龄SD乳鼠,雌雄不限,由河北医科大学实验动物中心提供。
1.2 主要试剂 多聚甲醛、辛伐他汀,美国Sigma公司;重组大鼠内脂素,Abcam公司;多聚-L-赖氨酸,Amresco公司;SP免疫组化试剂盒,美国ZYMED公司;DMEM培养基,GIBCO公司白酶干粉,Hyclone公司;胎牛血清,北京索来宝公司;双抗Invitrogen公司;5-溴脱尿苷,美国santa cruz公司;总RNA 提取试剂(Trizol),北京SBS公司;ROCK2,RhoA,Iκbα,p65,SIRT1兔抗鼠一抗及FK866、SN50、Y27632,美国santa cruz公司BNP兔抗鼠一抗,美国Abcam公司;琼脂糖凝胶,北京北方同正生物技术发展有限公司。
1.3 主要仪器 倒置显微镜,日本尼康公司;无菌洁净工作台,北京半导体设备一厂;THZ-C台式恒温振荡器,江苏省太仓市实验设备厂;TGL-16B高速台式离心机,上海安亭科学仪器厂;ABI StepOne荧光定量PCR仪,美国应用生物系统(ABI)公司; GDS-8000 凝胶成像分析系统,美国UVP 公司。
1.4 研究方法
1.4.1 心肌细胞提取及培养:在无菌条件下,取2~3 d日龄SD乳鼠的心脏,取心尖区心室肌剪碎,用混合消化酶于37℃恒温振荡进行反复短时间的多次消化,每次消化后加入含10%胎牛血清的DMEM 培养基重悬细胞沉淀。结束消化过程后,收集离心后的心肌细胞,充分重悬、过滤,转入培养皿中,置于含5% CO2细胞培养箱中37℃培养90 min。参照文献利用差速贴壁法分离出心肌细胞,收集细胞悬液,常规使用5-BrdU抑制成纤维细胞的干扰[3]。
1.4.2 分组及干预方法:常规进行心肌细胞原代培养48 h后,换为无血清的培养基培养24 h,之后将六孔板上的细胞每6孔分为一组,换培养基的同时进行分组及干预。①正常对照组,10、50、100 ng/ml重组内脂素,分别干预24 h;②正常对照组,重组内脂素100 ng/ml分别干预12 h、24 h、48 h、72 h;③正常对照组、重组内脂素100 ng/ml干预组、SN50(20 μmol/L)组、SN50(20 μmol/L)组+重组内脂素100 ng/ml组,分别干预48 h;④正常对照组、重组内脂素100 ng/ml、Y27632(10 μmol/L)组、Y27632(10 μmol/L) +重组内脂素100 ng/ml、辛伐他汀组(1 μmol/L)、辛伐他汀(1 μmol/L)+重组内脂素100 ng/ml,分别干预48 h。
1.4.3 Real-time PCR法检测
1.4.3.1 心肌细胞总RNA提取及cDNA第一链合成:分别吸取细胞培养板中培养液,每细胞培养孔中加入1 ml Triozol,按照Trizol总RNA抽提试剂盒说明书进行心肌细胞总RNA 的提取,用分光光度计测定所抽提RNA 的浓度和纯度,使用前调整总RNA浓度为1 μg/μl。取上述总RNA 1~5 μg,按照说明书进行cDNA 合成。
1.4.3.2 Real-time PCR反应:取反转录产物进行Real-time PCR反应。按以下体系进行real time PCR反应:2×ALL-in-One qPCR Mix 10 μl,ALL-in-One qPCR primer 2 μl,1st strand cDNA(5倍稀释液)2 μl,50×Rox Reference Dye 0.4 μl ddH2O 5.6 μl,Final Volume 20 μl。反应条件:95℃ 10 s;60℃ 20 s;72℃ 15 s,共40个循环。PCR 产物分析,行3%琼脂糖凝胶电泳反应,结束后行融解曲线分析。以GAPDH为内参基因,采用相对定量2-ΔΔCt计算mRNA相对表达量。各检测基因引物序列均由美国复能基因公司提供。
1.4.4 Western blot 法检测:收集胰酶消化的心肌细胞,冰上裂解细胞并抽提蛋白,BCA试剂盒定量,煮沸变性后加至上样孔中,进行SDS-PAGE 凝胶电泳,染色,然后转印至PVDF 膜,封闭液室温封闭1 h,加相应抗体4℃孵育过夜,TBST洗膜,加相应二抗室温杂交,TBST洗膜,ECL显色,曝光,显影,定影。使用GDS-8000 凝胶成像分析系统进行定量,结果以GAPDH为内参。
1.4.5 免疫细胞化学检:NFκB核转位情况 常规细胞爬片固定,参照免疫组化SP法说明书免疫组化,DAB 显色,在倒置显微镜下观察结果。
1.4.6 心肌细胞表面积测定 心肌细胞以1×104个/cm2密度种植于24孔板内,按照实验方法处理细胞,Nikon倒置显微镜下采集图像,随机选取5个视野,每个视野选取10个细胞,采用Image-Pro Plus图像分析软件检测细胞表面积,取均值。

2 结果
2.1 不同浓度内脂素对心肌细胞RhoA、ROCK2及IκB-α蛋白表达的影响 与正常对照组比较,10 ng/ml,50 ng/ml和100 ng/ml内脂素预处理24 h的心肌细胞中,RhoA, ROCK2蛋白表达升高,IκB-α蛋白表达降低(P<0.05)。与正常对照组比较,100 ng/ml内脂素预处理24、48、72 h的心肌细胞中,RhoA ROCK2 蛋白表达升高,IκB-α蛋白表达降低(P<0.05)。即随着内脂素干预浓度的增加和干预时间的延长,心肌细胞RhoA和ROCK2蛋白水平随之升高,100 ng/ml内脂素干预48 h最高;IκB-α蛋白水平降低,100 ng/ml内脂素干预48 h最低。见表1、2。
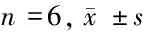
表1 不同浓度内脂素对心肌细胞RhoA、ROCK2及IκB-α蛋白表达的影响
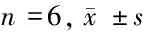
表2 100 ng/ml内脂素不同作用时间对心肌细胞RhoA、ROCK2及IκB-α蛋白表达的影响
2.2 SN50、Y27632和辛伐他汀对心肌细胞表面积及BNP mRNA、蛋白水平的影响 SN50+内脂素、辛伐他汀+内脂素、Y27632+内脂素预处理48 h的心肌细胞表面积,BNP mRNA和蛋白表达与内脂素干预比较降低(P<0.05),与正常对照组比较升高(P<0.05)。加用辛伐他汀+内脂素、Y27632+内脂素和SN50+内脂素干预的心肌细胞细胞表面积,BNP mRNA和蛋白水平均明显低于单纯的内脂素干预组(P<0.05),但高于正常对照组(P<0.05)。细胞免疫组化观察,与正常对照组相比,100 ng/ml内脂素干预48 h组心肌细胞大量NFκB p65从胞浆转位至胞核中。见表3、4,图1。
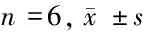
表3 SN50对心肌细胞表面积及BNP mRNA、蛋白水平的影响
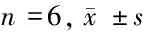
表4 Y27632和辛伐他汀对心肌细胞表面积及BNP mRNA、蛋白水平的影响
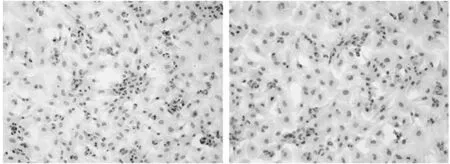
图1 内脂素对心肌细胞中NFκBp65位置的影响(免疫组化×200)
2.3 RhoA/ROCK2和NFκB的关系 与单纯内脂素干预组比较,辛伐他汀+内脂素和Y27632+内脂素干预组心肌细胞ROCK2蛋白水平明显低于内脂素干预组(P<0.01),IκB-α蛋白水平明显升高(P<0.01),但与正常对照组比较无明显差异(P>0.05);SN50+内脂素干预组心肌细胞ROCK2蛋白水平高于正常对照组(P<0.01),与内脂素干预组比较无明显差异(P>0.05);IκB-α蛋白水平明显高于内脂素干预组(P<0.01),较正常对照组没有明显差异(P>0.05)。细胞免疫组化结果显示,辛伐他汀+内脂素和Y27632辛伐他汀+内脂素干预组NFκB p65核转位现象较之内脂素干预组明显减少。见表5,图2。
表5 辛伐他汀、Y27632和SN50对心肌细胞ROCK2、IκB-α蛋白表达的影响
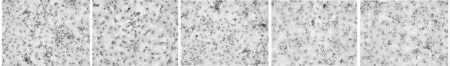
图2 RhoA/ROCK2和NFκb信号抑制剂对心肌细胞NFκbp65定位的影响(免疫组化×200)
3 讨论
内脂素可以促进血管平滑肌细胞成熟并能致血管重构,调节脂肪代谢,参与动脉粥样硬化的病理过程[4]。本研究前期实验证实,在Ang Ⅱ诱导的心肌细胞肥大中,内脂素表达在一定范围内随Ang Ⅱ刺激浓度和时间的增加而增高,且外源性的内脂素可以独立引起心肌细胞肥大[5]。
NFκB是一种至关重要的细胞核转录因子,调节细胞内如免疫炎症、细胞凋亡和细胞殖和分化相关基因等多种基因的表达[6]。另外,NFκB在调节细胞生长中也发挥重要作用。近年来研究发现,NFκB信号传导通路在心肌细胞肥大的病理过程中有着重要的作用[7,8]。NFκB可以被多种脂肪细胞因子激活,如TNFs、瘦素和内脂素,进而促进NFκB进入细胞核,激活一系列细胞炎症、生长和存活所需基因的表达,诱导心肌细胞肥大[9]。NFκB抑制蛋白(IκB)是调节NFκB的激活及转录的重要蛋白。目前研究认为,IκBα是IκB家族中的重要成员,是IκB 家族中降解速度最快,抑制NFκB活性的最重要成分[10]。在静息状态下,IκBα与NF-κB 杂二聚体以结合形式位于细胞质中,抑制NFκB 活化。当各种刺激因子如脂多糖、病毒蛋白等刺激细胞时,级联信号速激活IκB 激酶复合物,导致IκBα磷酸化、降解,促进NFκB 磷酸化、核转录,进入细胞核[9]。BNP属利钠肽家族的成员,主要在心室的心肌细胞合成,是左心室心肌肥厚和心功能不全的强预测因子,动物离体实验发现,在心肌细胞的肥大过程中,BNP 水平可持续分泌。本研究显示,在内脂素诱导的心肌细胞肥大过程中,随着内脂素浓度的升高和干预时间的延长,IκBα蛋白水平降低;细胞免疫组化检测显示,在内脂素的干预下,NFκB出现了明显的核转位。而用NFκB信号通路特异性阻断剂SN50阻断NFκB信号通路后,内脂素的作用下的心肌细胞细胞表面积和BNP蛋白水平均显著降低,NFκB未出现明显的核转位。以上研究结果说明,NFκB信号传导通路与内脂素诱导的心肌细胞肥大密切相关,内脂素通过NFκB信号通路引起心肌细胞肥大。
研究显示,小G 蛋白超家族,尤其是其亚家族成员RhoA及其下游信号分子ROCK,是参与心肌肥大重塑的重要信号通路。RhoA/ROCK 可能通过激活ERK1/2-GATA 通路促进心肌细胞肥大。王丽君RhoA 基因沉默能够抑制RhoA 的活性,从而阻止心肌细胞肥大进程[11]。RhoA是Rho 3个亚型中研究最多的一个;ROCK是与细胞凋亡相关的激酶,有ROCKl和ROCK2 2个亚型,二者在人类心血管系统中广泛表达[12]。高糖诱导的心肌细胞肥大伴有RhoA的激活,抑制RhoA活性可对抗心肌细胞肥大[13]。静息状态下的ROCK没有酶活性,在成年大鼠心肌细胞中,压力过度负荷可以引起ROCK的快速激活[14]。心肌梗死后伴有心肌细胞肥大,ROCK激酶抑制剂法舒地尔及辛伐他丁能抑制Rho/Rock信号转导通路的活性,进而抑制这种肥大[15,16]。说明ROCK在心肌梗死后的心脏重构中发挥重要作用。本研究发现,心肌细胞RhoA和ROCK2蛋白水平随着内脂素干预浓度和干预时间的延长逐渐升高,证实RhoA 及其激酶ROCK 是内脂素诱导的心肌细胞肥大信号转导通路中的重要环节。辛伐他汀为RhoA特异性抑制剂,Y-27632为嘧啶衍生物,是一种近年来合成的特异性ROCK抑制剂[17]。本研究分别应用辛伐他汀和Y27632阻断预干预,发现在辛伐他汀和Y27632的预干预后,内脂素作用下的心肌细胞细胞表面积及BNP mRNA和蛋白水平均显著降低。证明内脂素通过RhoA/ROCK信号通路引起心肌细胞肥大,应用RhoA/ROCK信号通路抑制剂可能抑制心肌肥大。
NFκB作为ROCK的另一下游信号分子,同时也是调控各种炎性因子分泌的重要转录因子之一。研究表明,肿瘤NFκB的激活可以通过抑制Rho-NFκB得到抑制,提示Rho/ROCK可以调控NFκB的活化[18]。ROCK1与RhoB能够协同激活NFκB,且通过遗传或抑制剂抑制ROCK-I的活性可阻断NFκB的激活。溶血磷脂酸(LPA)是RhoA/Rho激酶信号通路的有效激活剂,ROCK2通过激活人内皮细胞中的NFκB途径促进LPA诱导的CAM表达[19]。本研究发现,辛伐他汀和Y27632预干预后,在内脂素作用下心肌细胞的,ROCK2蛋白水平明显降低;而NFκB抑制蛋白IκBα蛋白水平未见明显降低,未见明显NFκB核转位,提示IκBα蛋白磷酸化和降解得到抑制。以上结果证实,辛伐他汀和Y27632能阻断RhoA/ROCK及下游信号NFκB通路。进一步应用NFκB抑制剂SN50干预心肌细胞,结果显示,IκBα蛋白水平较正常对照组无明显变化,细胞免疫组化也未见明显的NFκB核转位。这一结果证明,SN50能够阻断心肌肥大过程中 NFκB信号通路。综合上分析认为,在内脂素诱导的心肌细胞肥大中,NFκB为RhoA/ROCK信号通路的下游信号通路。
本研究初步证实,RhoA/ROCK-NFκB信号通路在内脂素引起的心肌细胞肥大过程中发挥作用。
