中草药提取物在糖尿病肾病中抑制TLR4 的相关信号通路
2022-06-30李蓉李丹杜宇娜
李蓉,李丹,2,杜宇娜
(1.江西省人民医院 南昌医学院第一附属医院;2.南昌大学基础医学院微生物教研室,江西 南昌 330006)
1 引言
糖尿病肾病(Diabetic nephropathy, DN)是糖尿病最常见、最严重的微血管并发症之一[1]。 大约三分之一以上的糖尿病患者会发展为DN,并最终发展为终末期肾病(End stage renal disease, ESRD),这是导致糖尿病病人残疾甚至死亡的主要原因[2]。根据国际糖尿病联盟(Interational Diabetes Federation, IDF) 的数据统计,2017年全世界18~99 岁的人口中就有4.51 亿DN 患者,预计到2045年这部分人群中患DN 的人数将增加到6.93 亿[3]。 DN 的发病机制目前尚未完全阐明, 现代医学认为其主要机制与糖脂代谢紊乱、血流动力学改变、细胞因子、炎症反应[4]、氧化应激[5]、遗传[6]等因素有关,其主要的病理改变为肾小球足细胞数量减少、 肾小球基底膜增厚、肾小球系膜增生,最后发展为肾小球硬化和肾间质纤维化[7]。 高血糖刺激下多种信号通路的激活及其相关炎性因子的分泌失调是DN发生发展的主要原因[8]。 糖尿病肾病的发生与炎性因子的参与密切关联, 能通过激活Toll 样受体4(Toll Like Receptor 4, TLR4) 相关信号通路引发糖尿病肾病并加重患者病情[9]。 TLR4 受体与多种疾病密切相关, 并参与疾病的发生发展及炎症反应的诱导激活,如类风湿性关节炎[10]、肝癌[11]、前列腺癌[12]、败血症[13]等。研究表明,在DN 的发生发展中,TLR4 起着至关重要的作用,TLR4 的激活能诱发糖尿病及其并发症的炎症级联反应[14-17]。 通过抑制与TLR4 相关的信号通路可在动物模型或细胞水平改善相关症状。 目前临床上用于治疗糖尿病肾病的药物大部分属于以下几类: 控制血糖和血脂的相关药物[18]、抗氧化剂[19]、血管紧张素转换酶抑制剂和钙拮抗剂等, 早期使用血管紧张素转换酶抑制剂(angiotensin converting enzyme inhibitor, ACEI)或血管紧张素受体阻滞剂(angiotensin receptor blockers, ARB), 目前控制血糖和降脂治疗仍然是DN 的临床一线治疗方法[20]。 但这些治疗也有着难以规避的缺点:如ACEI/ARB 严禁用于治疗严重肾损害患者,有严重副作用[21];控制血糖过度可导致低血糖[22];评估他汀类药物对DN 肾保护作用的研究有矛盾的发现[23]等。除此之外,DN 作为一种复杂的难治性肾病,具有多因素发病机制的特点,这决定了其治疗应考虑多个靶点[24]。当前的西药只是通过在疾病的早期控制血糖、血脂和血压来延缓DN的发展,并未从源头上阻断DN 的发生[25],并且只通过单一靶点或通路进行治疗, 因此目前这些药物在临床上的治疗效果和运用尚有不足之处。 与单分子靶点特异性化学药物相比, 中草药是多成分复合药物,能够与多种靶点相互作用,含有不同成分的中草药对DN 的治疗具有明显的协同作用优势[24]。 为了避免中药配方的毒性和副作用,人们对单一中药特别是单一中药单体对DN 的研究越来越感兴趣[26]。 已有研究发现,黄连素、淫羊藿苷、熊果酸、 伞形酮等几种中草药提取物具有抑制TLR4 相关信号通路的作用。 同时,本文利用网络药理学对这几种中草药提取物进行分析。 因此,本文主要围绕TLR4 的结构组成、TLR4 相关信号通路及中草药提取物等方面进行概述, 以期通过对以上内容的概述及讨论为今后的糖尿病肾病中草药治疗研究提供理论依据及展望。
2 TLR4 的结构及通路
2.1 TLR4 的结构组成 在固有免疫中,Toll 样受体对病原相关分子模式(pathogen-associated molecule pattern, PAMP)的识别具有重要作用,它能够激活树突状细胞使之表达共刺激分子, 树突状细胞的表面表达主要组织相容性复合体(major hiscompatibility complex, MHC)二类分子携带的抗原,随后T细胞对其进行识别并发挥适应性免疫应答,因此,在固有免度和适应性免疫应答过程中,Toll 样受体发挥着桥梁作用[27]。 TLR4 作为Toll 样受体家族的一员,也属于模式识别受体,可识别PAMP,在天然免疫中发挥着重要作用[28]。 TLR4 在Toll 样受体大家族中是发现较早的成员之一,其分布于B 细胞、树突状细胞、单核/巨噬细胞、平滑肌细胞等细胞表面, 能够广泛地识别危险信号分子, 如脂多糖(Lipopolysaccharide, LPS)等[29]。 此外,TLR4 是一型跨膜蛋白,由三部分组成——胞外域、胞浆区和跨膜区。 亮氨酸富集的重复序列组成胞外域,参与对PAMP 的识别,跨膜区将信号转导入细胞内。 由于胞浆区与白介素-1 受体(interleukin 1 receptor, IL-1R)家族成员的胞浆区高度同源,因此也称为Toll/IL-1 受体(Toll/IL-1 receptor, TIR)结构域,这一部分的功能是募集含有TIR 结构域的衔接蛋白,从而进行下游的信号转导[30]。
2.2 TLR4 的相关通路 TLR4 的信号通路可以分为髓样分化蛋白88(myeloiddifferentiation factor 88,MyD88)依赖性和非依赖性两种通路[31]。依赖性途径的特点在于[32],TLRs 胞外区域与相应配体结合后,TIR 会发生二聚化,MyD88 与二聚化后的TIR 进行结合,形成TIR-MyD88 活性复合体,继而活性复合体会募集IL-1 受体相关激酶1 和IL-1 相关蛋白激酶2, 诱导磷酸化后的IL-1 受体相关激酶与MyD88 发生脱离, 结合并活化其下游的TNF 受体相关因子6(TNF receptor associated factor, TRAF6),由此引起两条不同的通路信号转导: 一条是致使丝裂原激活蛋白激酶发生磷酸化, 可诱导激活p38-MAPK 通路,该通路在调节神经元方面具有重要作用[33];另一条是促使NF-κB 抑制蛋白(inhibitior of kappaB, IκB)磷酸化[34]去激活IκB 抑制剂激酶, 磷酸化后的抑制蛋白不仅能够分离细胞质内的NF-κB 而且可以促使其转移到细胞核内。 通过这两条信号通路,多种炎症因子被激活和释放,完成炎症信号的转导[35]。 MyD88 依赖与非依赖途径之间最大的不同是在非依赖途径中, 需要中间介质TIR 结构域衔接蛋白 (TIR-domain-containing adaptor inducing interferon-β, TRIF)才能完成活化后的TLR 与TIR 端之间的连接,并且需要TRIF 激活干扰素调节因子3 (Interferon regulatory factor3,IRF3),才能再激活下游炎性细胞因子的转录[36]。
2.2.1 TLR4/MAPK 信号通路 MAPK 的激活在DN发展中发挥着重要作用[37]。MAPK 家族包括细胞外调节蛋白激酶(extracellular regulated protein kinases, ERK)、c-Jun 氨基末端激酶 (c-Jun N-terminal kinase, JNK)和p38-MAPK 三个亚科,在细胞肥厚、炎症和肾纤维化过程中发挥着关键作用[38]。 p38-MAPK 在参与炎症介质产生的过程中是关键分子,激活的磷酸化p38-MAPK 可应对包括高糖在内的应激刺激和炎症。 在DN 中,p38-MAPK 在人肾系膜细胞、 大鼠近端肾小管细胞和小鼠足突细胞中均可被高糖激活[39]。 磷酸化p38-MAPK 能够调节多种转录因子,并诱导编码促炎因子的基因表达,引发多种促炎因子的产生和分泌, 包括肿瘤坏死因子α(Tumour necrosis factor-α, TNF-α )、白细胞介素-1β (Interleukin-1β,IL-1β) 和白细胞介素-6(Interleukin-6, IL-6 )等[40]。 MAPK 家族在细胞凋亡相关的信号通路中也同样发挥着重要的作用,已有研究证明,ERK、JNK 和p38-MAPK 在肾脏细胞凋亡中被激活[41],p38-MAPK 的激活会调节凋亡基因B 淋巴细胞瘤-2 基因(B-cell lymphoma-2, Bcl-2)、B 淋巴细胞瘤-XL (B-cell lymphoma-XL, Bcl-XL)和BCL2-Associated X 的蛋白质(BCL2-Associated X, Bax)的表达并诱导线粒体功能障碍,随后释放凋亡蛋白,激活caspase-3,诱导细胞凋亡[42]。因此,针对p38-MAPK 信号通路来开发抗炎性、抗凋亡药物可能是一种新的治疗策略。
2.2.2 TLR4/NF-κB 信号通路 炎症反应是DN 肾组织损伤的重要原因,DN 患者血液中高血糖可激活肾组织多条介导炎症的信号通路, 除上述提及的TLR4/MAPK 信号通路外,TLR4/NF-κB 信号通路也是非常重要的胞内信号转导通路之一。 在高糖因素的刺激下,细胞膜上的TLR4 被激活,通过相关接头蛋白如:MyD88、IL-1 受体相关激酶-2(interleukin-1 receptor associated kinase-2, IRAK2)、IL-1 受体相关激酶-4( interleukin-1 receptor associated kinase-4, IRAK4) 等介导胞内信号传递,TLR4 的 活 化 使 得IκB 激 酶 复 合 物 (IκB kinase,IKK)激活并发生磷酸化。 IκB 与NF-κB 在正常生理条件下以复合物的形式存在于胞质中, 然而随着IKK 的激活,IκB 也被激活并发生磷酸化, 从复合物中脱落随后发生泛素化。 同时,由于IκB 的脱落,NF-κB 被激活并发生磷酸化,从而被运转到细胞核内转录、翻译[43-46],因此诱导了大量细胞因子例如单核细胞趋化蛋白1(Monocyte chemoattractant protein-1, MCP-1 )、IL-1、TNF-α 等 被 释 放 入血[47-48]。MCP-1 进入血液后可诱导巨噬细胞等免疫细胞聚集在肾组织中,增加细胞外基质沉积[49-50],TNF-α 可以改变肾小球基底膜的通透性, 刺激成纤维细胞增殖,引起肾脏血管结构改变[51-53],IL-1也参与介导中性粒细胞浸润,引发内皮细胞损伤,同时诱导其他炎症因子的释放, 形成级联反应[54],这些炎症因子的释放加快了DN 的发生发展。越来越多的研究从TLR4/NF-κB 信号通路出发来探索治疗糖尿病肾病的新疗法。
3 中草药提取物治疗
使用SwissTarget Prediction (http://www.swisstargetprediction.ch/) 确定中草药提取物的潜在靶点。此外,使用Metascape (https://metascape. org/)进行gene ontology (GO) 和Kyoto Encyclopedia of Genes and Genomes (KEGG)分析。 利用Cytoscape绘制出药物—靶点—通路网络图。
3.1 黄连素 目前已发现较多药物可通过抑制NF-κB 信号通路达到减轻糖尿病肾病肾损害的程度。 黄连素,亦称小檗碱,是从中药黄连中分离出的一种季铵生物碱,是黄连抗菌的主要成分,可抑制TLR4/NF-κB 通路, 并且可以缓解链脲佐菌素(streptozotocin, STZ) 诱导的DN 大鼠的炎症反应和高糖诱导的足细胞的凋亡[7]。 另外,TLR4 抑制剂瑞沙托维(resatorvid, TAK-242)或NF-κB 抑制剂吡咯烷二硫代氨基甲酸盐(pyrrolidine dithiocarbamate,PDTC)可阻断TLR4/NF-κB 通路,能加强黄连素对高糖诱导的足细胞炎症反应和凋亡的抑制作用,具有协同作用。 图1A 为黄连素的三维结构式;图1B 是黄连素的作用靶点类别, 主要作用于A 型G蛋白偶联受体,激酶和水解酶等靶点;图1C 为通过SwissTarget Prediction 确定的100 个具体的潜在靶点,其中包括ACHE、MAPK10、MAK14、JAK2等。 图1D 为黄连素与糖尿病肾病的共同靶基因韦恩图,黄连素与糖尿病肾病的共同靶基因有11 个,分别为ROCK1、NR3C2、ADRA2C、PTPN1、BCHE、ICAM1、SELE、CYP19A1、AOC3、PTGS2、F3; 图1E、图1F 为通过GO 和KEGG 分析上述共同靶基因所得, 与管径的调节、 白细胞黏附于血管内皮细胞、类固醇激素的反应、内肽酶活性的调控、调控防御反应、氧化还原酶活性相关。 此前,也有研究者通过相关实验发现全反式维A 酸可通过减弱TLR4/NF-κB 的炎症信号,减少细胞间黏附分子-1(intercellular cell adhesion molecule-1, ICAM-1)的表达[55]。

图1 黄连素的网络药理学分析
3.2 淫羊藿苷 淫羊藿苷,是淫草霍的主要活性成分,为8-异戊烯基黄酮苷类化合物,可显著抑制肾组织中TLR4、p-NF-κB p65、TNF-α 和IL-6 的表达,可能通过抑制TLR4/NF-κB 信号通路减轻肾组织内的炎症反应, 对STZ 诱导的DN 小鼠肾脏起到保护作用[56]。 图2A 为淫羊藿苷的三维结构式;从图2B 淫羊藿苷的作用靶点类别可知,裂解酶、酶、A 型G 蛋白偶联受体为其主要作用靶点;图2C 表示淫羊藿苷的潜在作用靶点, 如CD38、TNF、IL2 等 。 ADRA2C、PRKCB、IL2、AKR1B1、PRKCD、TNF、PTGS2 为淫羊藿苷与糖尿病肾病的共同靶基因,见图2D,与细胞对有机氮化合物的反应,正向调控蛋白磷酸化,肽反应,激酶-信号转导及转录激活蛋白(Janus kinase-signal transducer and activator of transcription, JAK-STAT)受体信号通路,血液循环调节,信号释放等都密切相关,见图2E、图2F。 其中,糖尿病肾病患者的前列腺素内过氧化物合酶2 (prostaglandin-endoperoxide synthase 2, PTGS2) 与高迁移率族蛋白B1(high-mobility group box-1, HMGB1)水平均显著增加,可通过抑制HMGB1 降低PTGS2,长链酰基辅酶a 合成酶4 (long-chain acyl-CoA synthetase 4 , ACSL4)和NADPH 氧化酶1(NADPH oxidase 1, NOX1),恢复细胞增殖, 阻止活性氧(reactive oxygen species ,ROS)和乳酸脱氢酶(lactate dehydrogenase , LDH)的生成, 增加肾组织系膜细胞内的谷胱甘肽过氧化物酶4(glutathione peroxidase 4, GPX4)水平。 并且,下调HMGB1 可抑制高糖诱导的TLR4/NF-κB 轴的激活, 促进转录因子核红系2 相关因子2(transcription factor nuclear-erythroid 2-related factor 2,Nrf2)及其下游靶点的表达,包括血红素氧合酶-1(Heme Oxygenase-1, HO-1)、磷酸酰胺腺嘌呤二核苷酸醌氧化还原酶(NADPH quinineoxidoreductase-1, NQO-1)、 谷氨酸半胱氨酸连接酶催化亚基(catalytic submit of glutamylcysteine ligase, GCLC)和谷氨酸-半胱氨酸连接酶调节亚基 ( glutamatecysteine ligase modifier subunit, GCLM)[57]。
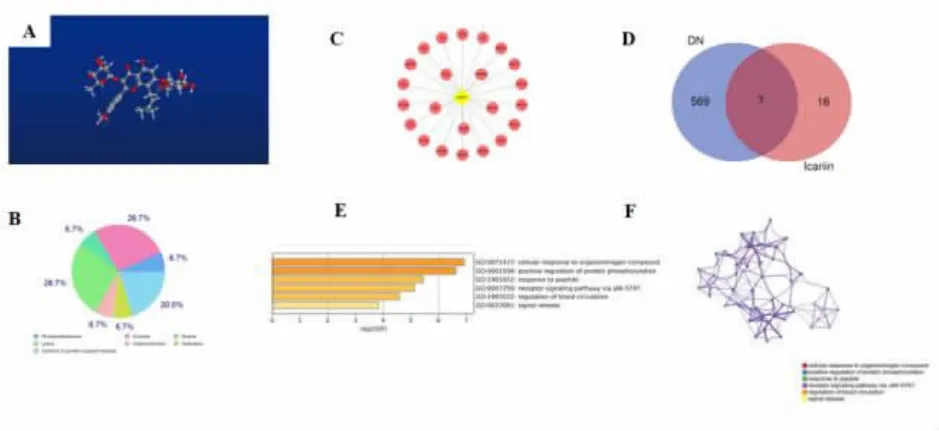
图2 淫羊藿苷的网络药理学分析
3.3 熊果酸 熊果酸是从杜鹃花科常绿蔓生灌木熊果中提取的一种五环三萜类化合物, 能够下调炎性因子TNF-α、IL-1β、IL-6 和IL-18 的水平并减轻肾细胞的损伤。 此外,熊果酸还能抑制糖尿病肾病小鼠TLR4、MyD88 和NF-κB 的表达[58]。 图3中熊果酸的3D 分子结构见图3A; 熊果酸的主要作用靶点类别为酶和磷酸酶等,见图3B;从图3C,可知熊果酸被预测可作用于包含CD81、TLR9、AR等75 个潜在作用靶点。 熊果酸与糖尿病肾病的共同 靶 基 因 有 18 个,PPARD、HMGCR、NR3C2、NOS2、PTPN1、PPARA、CYP2C19、FABP1、SHBG、PPARG、CYP19A1、ACP1、FABP4、PTGS2、ESR1、PTGS1、AR、CES1(见图3D);与核受体活性,正向调控小分子代谢过程,脂质运输,细胞内信号转导的负调控,细胞凋亡信号通路的负调控等有关,见图3E、图3F。 醛糖还原酶(Aldose reductase, AR)首次被发现通过多元醇途径参与糖尿病的发展, 血液中过表达的AR 引起山梨糖醇的积累和通过激活多元醇途径使NADPH 降低, 从而导致细胞损伤,诱发慢性糖尿病并发症的发生。 AR 和TLR4 作为糖尿病的生物标志物可能不同程度地参与炎症反应,影响DN 的发展。 因此,AR 与TLR4 之间是否存在某种联系是十分值得探究的。 也已有研究表明了AR 和TLR4 在糖尿病大鼠肾组织中同时存在过表达现象[59]。

图3 熊果酸的网络药理学分析
3.4 伞形酮 伞形酮广泛存在于自然界,尤其是伞形科或芹科植物中, 具有显著改善肾组织病理改变,下调上皮-间充质转化相关分子标志物Podocin和CD2AP 的表达的功能。 此外, 伞形酮可抑制TLR4、MyD88 的表达和NF-κB 的活化,并显著降低下游其他炎症分子(TNF-α、IL-6、IL-1β)的水平[60]。伞形酮的三维分子结构式,见图4A;伞形酮的作用靶点类型为裂解酶、激酶、氧化还原酶、酶和A 型G 蛋白偶联受体, 见图4B; 其具体的潜在靶点有64 种,其中包含MIF、CA12、XDH 等,见C 图;伞形酮与糖尿病肾病的共同靶基因有GSR、KDR、IGF1R、AKR1B1、INSR、AKT1、MIF、NFKB1、ESR1、SK3B、PARP1,见图4D;与应激激活蛋白激酶信号级联反应,细胞内信号转导的负调控等相关,见图4E、图4F。 已有研究表明,胰岛素生长因子1 受体(insulin growth factor 1 receptor , IGF-1R)抑制剂可通过降低TLR4 蛋白的表达来减轻糖尿病肾病,可能通过抑制高迁移率组核小体结合蛋白(High mobility group nucleosome-binging domain-containing protein 1,HMGN1)/TLR4 通路对DN 有治疗作用[61]。
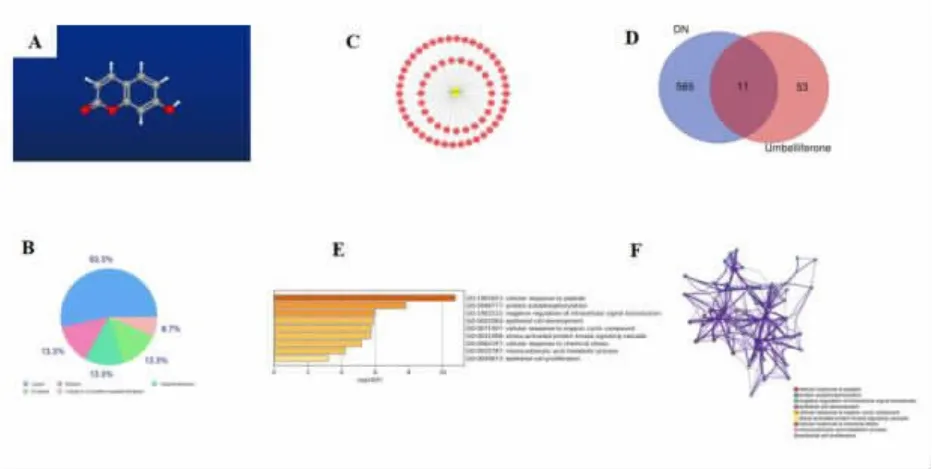
图4 伞形酮的网络药理学分析
3.5 黄芩苷 黄芩苷是从双叶子唇形科植物黄芩的干燥根中提取分离出来的一种黄酮类化合物,通过转录因子核红系2 相关因子2(transcription factor nuclear-erythroid 2-related factor 2, Nrf2)和MAPK 信号通路减轻糖尿病肾病的氧化应激和炎症反应[62],同时,黄芩苷能够通过提高DN 中miR-124的表达, 并使TLR4/NF-κB 通路的下游失活,从而预防肾纤维化[63]。 黄芩苷的三维分子结构式,见图5A;黄芩苷的主要作用靶点类型为A 型G 蛋白偶联受体、酶、分泌型蛋白、氧化还原酶、激酶和水解酶,见图5B;AKR1B1、ADORA1、TNF、IL2、XDH、RPS6KA3、EGFR、ACHE、NQO2、NMUR2、DRA2A、ADRA2C、NOX4、ALDH2 被预测为黄芩苷的潜在作用靶点, 见图5C;ADRA2C、IL2、AKR1B1、TNF 为黄芩苷与糖尿病肾病的共同靶基因,见图5D,与激酶-信号转导及转录激活蛋白(Janus kinase-signal transducer and activator of transcription, JAK-STAT)受体信号通路,正向调控激酶活性相关,见图5E、图5F。
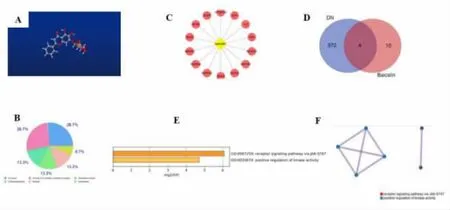
图5 黄芩苷的网络药理学分析
3.6 甘草素 甘草素主要存在于甘草根茎中,可通过抑制NF-κB 和NLRP3 相关的胞内炎症途径,减轻高糖诱导的一系列反应,例如细胞外基质积聚、氧化应激和炎症[64]。甘草酸的3D 分子结构式,见图6A; 甘草酸的主要8 个作用靶点类型为裂解酶、酶、核受体和细胞色素P450 等,见图6B,其被预测具体靶点共有100 个, 其中包含SIRT2、VEGFA、BCHE、MMP9 等,见图6C;甘草素与糖尿病肾病的共同靶基因有28 个,分别为MMP2、KDR、ABCG2、PTPN1、MMP3、FGFR1、PGF、PIK3CA、SHBG、BCHE、EDNRA、IGF1R、AKR1B1、PPARG、HNF4A、SERPINE1、CYP19A1、INSR、SLC5A2、CYP2C9、ESR1、PTGS1、F3、VE GFA、GSK3B、CES1、CYP3A4、MMP9,见图6D;与跨膜受体蛋白酪氨酸激酶信号通路,细胞激素的代谢过程,正向调控水解酶活性,细胞凋亡信号通路的调控等相关,见图6E、图6F。 已有研究结果表明,间充质干细胞(adipose-derived mesenchymal stem cells, ADSCs) 来源的细胞外囊泡 (extracellular vesicles, EVs) 递送miR-26a-5p 通过靶向TLR4 缓解DN 的病理症状, 随后使其下游的NF-κB/血管内皮生长因子A(vascular endothelial growth factor A, VEGFA) 信号通路失活[65]。
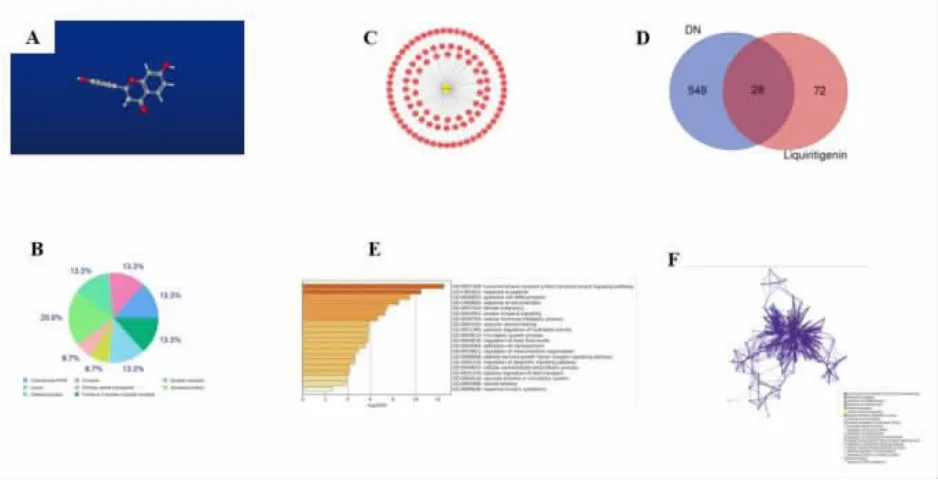
图6 甘草素的网络药理学分析
3.7 鞣花酸 鞣花酸,又称三羟基甲酸,广泛存在于坚果、茶叶、浆果等食品中,也是石榴皮等天然药物的主要活性成分。 人和动物的实验表明,鞣花酸具有多种生物活性,特别是抗氧化、抗炎、抗癌,对心血管等慢性疾病和神经退行性疾病具有潜在的预防或治疗作用。 鞣花酸在研究中可以通过抑制HMGB1-TLR4-NF-кB 通路改善STZ 诱导的肾损伤,改善小鼠的日常状态和体重;降低血糖、细胞因子TNF-α 和血清肌酐的水平; 提高抗氧化酶活性;抑制DN 小鼠TLR4、IRAK4、TRAF6、IKK-β、NF-κBp65、HMGB1 蛋白表达上调[66]。 鞣花酸的三维结构式,见图7A;激酶、裂解酶、酶、A 型G 蛋白偶联受体和其他细胞质蛋白为鞣花酸的主要作用的5 靶点类型,见图7B;鞣花酸被预测有57 种作用靶点,见图7C,鞣花酸与糖尿病肾病的共同靶基因为XDH,ALOX5,LYN,TEK,AKR1B1,SRC,PDG FRB,INSR,AKT1,PTGS2,HSPA1A,SR2,见图7D;与脂质代谢过程的正调控,肽反应,对流体切割应激的反应, 正向调控平滑肌细胞增殖, 对热的反应,血管形态发生,液泡裂解,细胞质核周区域,伤口愈合,对雌二醇的反应,细胞间连接,正调控细胞周期过程, 对细胞增长的监管, 葡萄糖稳态相关,见图7E、图7F。

图7 鞣花酸的网络药理学分析
4 结语
糖尿病肾病因其复杂的免疫学及分子机制,成为危害人类健康的难题, 给全球卫生健康情况带来极大的负面影响。 目前,研究者们对于炎症机制是介导糖尿病肾病的发生发展的关键因素这一观点的认同度较高,其中TLR4 受体对促进下游炎症因子的释放、 介导糖尿病肾病的发生发展具有重要作用也已得到广泛认可。 糖尿病肾病的治疗,除了抗氧化剂、 血管紧张素转换酶抑制剂和钙拮抗剂等这些药物外, 中草药的治疗作用正逐渐受到关注。 而与TLR4 相关的信号通路主要有TLR4/MAPK 信号通路、TLR4/NF-κB 信号通路等, 这些信号通路的状态可进一步调控机体炎症反应及免疫应答,从而影响疾病的发生发展。 从TLR4 相关的信号通路着手, 寻找具有治疗糖尿病肾病潜能的中草药是极具探索前景的新策略。
