采供血机构血液HBV 筛查策略改进的探讨
2022-06-30陈丹王芳张鹏飞郭新宇庄养林
陈丹,王芳,张鹏飞,郭新宇,庄养林
(1.江西省职业病防治研究院检验科;2.江西省血液中心检验科,江西 南昌 330006)
为减少经血传播病毒风险, 我国所有采供血机构在原有血清学试剂检测病毒感染标志物的基础上,全面增加病毒核酸检测已有5年余,有效降低了乙型肝炎病毒(HBV)、丙型肝炎病毒(HCV)及艾滋病病毒(HIV)经血传播风险[1-4]。为进一步提升血液安全水平,国家卫生健康委也印发了《血站技术操作规程(2019 版)》,其中4.2.4 检测策略中指出:HIV、HBV 和HCV 感染标志物应至少采用核酸和血清学试剂各进行1 次检测[5]。 目前本地区血液筛查模式为1 次核酸检测加2 种血清学试剂检测, 此检测模式具体为2 种血清学试剂检测结果为阴性情况下, 即实验样本吸光度值/临界值(Sample optical density/Cut-off,S/CO) 小于临界值(cut-off)时,再使用罗氏公司血液筛查核酸试剂进行病毒核酸检测。 而在血液筛查过程中,工作人员发现当2 种血清学试剂检测结果S/CO 同时处在50%~80% cut-off 之间时, 根据试剂判定规则,此类标本血清学检测结果会被判定为阴性, 将直接进行核酸检测, 但罗氏核酸检测模式6 混样检测取样量较少(每人份167 μL),若检测样本中HBV DNA 浓度较低, 吸取到病毒颗粒进行扩增概率大为降低,容易造成病毒漏检,从而造成乙肝病毒经血传播的可能。 在发现了上述情况后,本实验室及时优化了相关检测策略,现将有关工作介绍如下。
1 材料与方法
1.1 标本来源 选自2018年1月1日至2020年12月31日南昌地区221 191 份无偿献血者标本。
1.2 主要仪器 瑞士哈密尔顿全自动酶免检测仪FAME, 罗氏公司COBAS s 201 核酸检测系统,瑞士Hamlton 全自动STAR 加样仪, 长沙湘麓DL-6M 大容量低温离心机。
1.3 主要试剂 核酸检测试剂盒:COBAS TaqScreen MPX V2.0 test 核酸检测试剂盒 (瑞士Roche 公司,批号:215559、232401 等),该试剂可同时定性检测人类血浆中的HIV-1,2 RNA、HCV RNA 和HBV DNA;HBsAg 酶联免疫检测试剂盒(厦门新创生物科技有限公司、北京万泰生物药业有限公司, 批号:2019115136、2019095125、B20191141、B20190932 等)。
1.4 实验方法 对无偿献血标本进行2 种血清学试剂检测乙肝表面抗原(HBsAg),对HBsAg 检测结果均为阴性的标本 (包括初次检测反应性复查为阴性的标本)进行核酸检测。
1.4.1 对2 种HBsAg 血清学试剂检测S/CO 均小于50% cut-off 或1 种血清学试剂检测S/CO 在50%~80% cut-off 的标本(以下称常规核酸检测标本) 按常规核酸检测方式进行检测, 即在全自动STAR 加样仪上先汇集6 人份血清学试剂检测结果为阴性的血清(每人份167 μL)到1 管(共汇集1 mL)中进行6 混样检测(以下称PP6),若检测结果为阴性则代表此6 人份样本核酸检测结果为阴性,若检测结果为反应性,则需对此6 人份样本进行拆分/单检(以下称PP1)(1 mL),以明确哪一人份血清为HBV DNA 反应性。统计PP6 反应性循环阈值(Cycle threshold values,Ct 值)和PP1 反应性Ct 值、HBV DNA 阳性率、拆分成功率。
1.4.2 对2 种HBsAg 血清学试剂检测S/CO 均在50%~80% cut-off 的标本,直接进行PP1 检测。 统计PP1 反应性Ct 值。
1.5 统计学方法 采用Excel 软件对数据进行整理,计算各组Ct 值均值(x)、标准差(s)及拆分成功率,运用SPSS 10.0 软件对数据进行分析,各组间Ct 值比较采用t 检验, 各组阳性率比较采用χ2检验,检验水准P=0.05。
2 结果
2.1 2018年至2020年PP6 反应性Ct 值中位数分别为37.8、37.5、37.3 , 三年PP6 检测Ct 值两两比较差异无统计学意义(P>0.05),见表1。

表1 2018年至2020年PP6 Ct 值比较
2.2 2018年至2020年PP6 Ct 值在37.1 以上时,其PP1 检测结果为阳性的情况分别为52.13%(49/94)、38.78%(19/49)、46.39%(45/97),2018年至2020年PP6 Ct 值在37.0 以下时,其PP1 检测结果为阳性的情况分别为86.67%(26/30)、76.92%(20/26)、70.77%(46/65),其中2018年至2020年PP6 Ct 值在37.1 以上与37.0 以下比较差异有统计学意义(P<0.05),见表2,PP6 Ct 值在37.1 以上与37.0 以下其PP1 检测阳性率比较,差异有统计学意义(P<0.05),见表3。
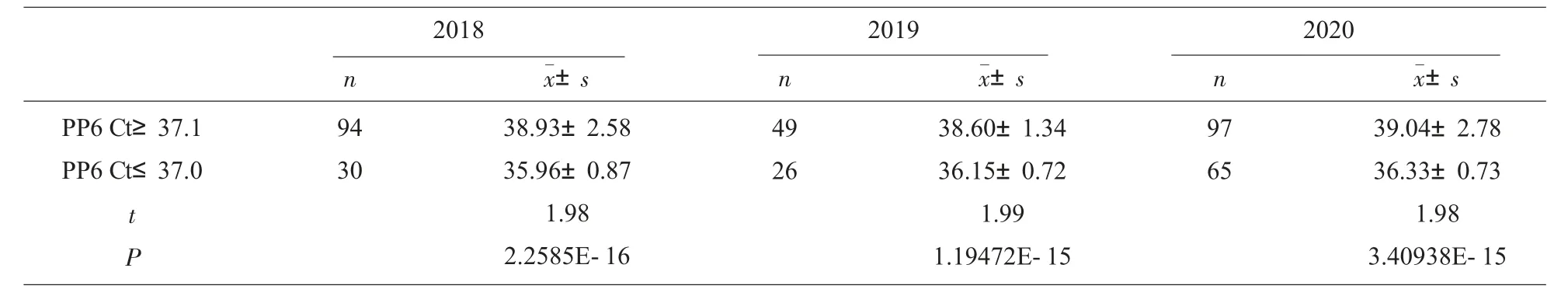
表2 2018年至2020年PP6 Ct 值在37.1 以上与37.0 以下比较

表3 2018年至2020年PP6 Ct 值在37.1 以上与37.0 以下其PP1 检测阳性率比较
2.3 两种HBsAg 血清学检测S/CO 均在50%~80%cut-off 的标本,直接进行PP1 检测结果。三年两种HBsAg 血清学检测S/CO 均在50%~80%cut-off的标本共收集15 份,PP1 检测均为反应性。三年此类标本PP1 检测Ct 值均值分别为35.23、37.04、34.08,此类标本PP1 检测Ct 值在36.0 以上标本占比此类PP1 检测总数的53.33%, 显示这类标本多数HBV DNA 浓度处于较低水平, 其中2019年标本9 和标本10 的PP1 检测Ct 值达到40.7 和38.8,见表4,在另行的PP6 检测中,标本4、6、10、11 检测为无反应性,PP6 检测Ct 值与PP1 检测Ct值差异有统计学意义(P<0.05),见表4。

表4 2018年至2020年S/CO 均在50%~80%cut-off 的标本检测结果
3 讨论
在国内采供血机构采用罗氏MPX V2.0 试剂进行血液筛查时, 都是对无偿献血标本进行2 种血清学试剂检测HBsAg 结果均为阴性的标本行核酸检测, 即先汇集6 人份血清学试剂检测结果为阴性的血浆 (每人份167 μL) 到1 管 (共汇集1 mL)中进行PP6 检测,若此管检测结果为阴性则代表此6 人份样本核酸检测结果为阴性, 若检测结果为反应性, 则需对此6 人份样本分别进行PP1检测,以拆出具体哪一人份血清为HBV DNA 反应性。 但PP6 反应性标本大多数经证实为OBI 献血者或处于血清学检测窗口期, 此类标本HBsAg 往往检测为阴性,病毒载量往往较低[6],若标本病毒载量低于核酸试剂混样检测下限, 其PP6 检测很大概率检测为无反应性。
从近三年常规核酸检测标本PP6 检测Ct 值、PP1 检测Ct 值及PP6 反应性进一步拆分成功率统计结果来看,PP6 Ct 值在37.0 以下时,其拆分检测PP1 结果为阳性的情况分别在86.67%(26/30)、76.92%(20/26)、70.77%(46/65),其中PP6 Ct 值在35.0 以下时, 三年PP1 检测结果为阳性均为100%。PP6 Ct 值区间在35.1~36.0 时,2020年常规核酸检测出现了两次PP6 Ct 值为35.9 和36.0,而PP1 检测结果为阴性的情况,故2020年PP6 Ct 值在35.1~36.0 之间的标本PP1 拆分成功率仅在78%。另外除2018年,其余两年PP1 检测阳性率均低于Wang 等[7]报道的PP6 Ct 值小于等于37.0 时拆分阳性率为80%, 这可能与检测试剂或常年进行核酸筛查有关:Wang 等 进行PP6 检测所用试剂为罗氏一代试剂MPX, 而本文所用试剂为二代试剂MPX V2.0, 两种试剂特异性及灵敏度均存在差异, 另一个原因可能与长期进行血液核酸筛查,HBsAg-/HBV DNA+高病毒载量的标本已筛出,近几年血液筛查标本以低病毒载量为主。 这从PP6 反应性标本多数处在Ct 值为36.1~39.0 之间,2018年至2020年此区间标本分别占比PP6 反应性总数的70.97%、73.33%和74.69%。曾劲峰等[8]通过确证实验得出,25 例HBsAg-/HBV DNA+标本病毒载量介于不可检出到至108.9 IU/mL, 欧山海等[9]对62 例HBsAg-/HBV DNA+标本进行检测,发现其中93.5%(58/62)的HBV DNA 是小于100 IU/mL。 因此对HBsAg-/HBV DNA+进行PP6 检测,应慎之又慎,蒋瑞馨等[10]建议当PP6 Ct 值≤37 时可考虑重复PP1 检测。
在日常检测中, 工作人员发现个别PP6 反应性标本进行PP1 检测时呈反应性, 同时查阅血清学检测过程, 发现其2 种血清学试剂检测结果S/CO 同时处在50%~80% cut-off 之间, 然而根据试剂说明书规则, 此类标本血清学检测结果会判定为阴性,按照筛查策略将此类标本进行PP6 检测,恰巧PP6 检测呈反应性。 鉴于目前进入PP6 检测的标本以低HBV DNA 载量标本为主,因此工作人员对待此类标本进行HBV DNA 检测开始谨慎起来, 因将此类标本进行PP6 检测, 能否检出HBV DNA 是个疑问。 为降低因HBV DNA 载量过低而超出核酸试剂检测下限,造成病毒漏检的风险,本实验室调整了检测策略, 即将2 种血清学试剂检测结果S/CO 同时处在50%~80% cut-off 之间的标本直接进行PP1 检测。 根据统计结果, 此类标本PP1 检测Ct 值在36.0 以上标本占比此类PP1 检测总数的53.33%, 显示这类标本多数HBV DNA浓度处于较低水平。 以常规PP1 检测反应性Ct 值在36.0 以上,其对应的PP6 反应性Ct 值应在37.1以上, 而近三年PP6 Ct 值在37.1 以上时, 其PP1检测结果为阳性的情况分别为52.13%(49/94)、38.78%(19/49)、46.39%(45/97), 表现为较低的拆出阳性率。 其中2019年标本9 和标本10 的PP1检测Ct 值达到40.7 和38.8,以及在另行的PP6 检测中,标本4、6、10、11 检测为无反应性,此种情况更加印证了我们将2 种血清学试剂检测结果S/CO同时处在50%~80% cut-off 之间的标本,由PP6 检测调整为直接进行PP1 检测的必要。
目前罗氏血液筛查模式未有改变, 出于对进入核酸检测的标本均为2 遍血清学检测为阴性结果及检测成本因素的考虑, 我国采供血机构采用罗氏MPX V2.0 进行血液筛查仍是PP6 模式,未直接采用PP1 的模式, 但2 种血清学试剂检测结果S/CO 同时处在50%~80% cut-off 之间的标本对于此种模式仍是挑战。 此类标本若采用罗氏既定的筛查模式,一种结果是混样结果阴性,标本放行,即病毒漏检。 另一种结果是混样阳性进入PP1 检测,即增加10 份核酸试剂用于PP1 检测。 为兼顾检测成本及降低传染风险,让此类标本单独成为1个pool 即可在PP6 模式下对此份标本进行PP1 检测,节约10 份用于PP1 检测的核酸试剂(以本实验室2018年至2020年数据统计可节约150 份核酸试剂,约4.5 万元),按此种筛查模式在现行的检测策略中既能更好地降低乙肝病毒经血传播风险,又可以节约检测成本。
