血清MIF、IL-17A 水平与肝癌患者TACE治疗预后的相关性
2022-06-30谢金锋徐明洲王晓东
谢金锋,徐明洲,王晓东
(1.内乡县人民医院介入科,河南 内乡 474350;2.南阳医学高等专科学校第一附属医院介入科,河南 南阳 473003;3.南阳市第二人民医院介入科,河南 南阳 473001)
经导管肝动脉化疗栓塞术(Transcatheter arterial chemoembolization,TACE) 是临床治疗中晚期原发性肝癌 (Primary Hepatocellular Carcinoma,PHC)重要非手术治疗方式之一,可有效控制肿瘤进展[1]。但受多种因素影响,部分PHC 患者经TACE治疗后效果并不理想, 存在较大的生存期差异[2]。因此寻找客观的指标评估PHC 患者TACE 治疗预后,对早期治疗干预、寻找新的治疗靶点具有重要意义。 巨噬细胞移动抑制因子(Macrophage migration inhibitory factor,MIF)是具有多种激素、细胞因子功能的多效能蛋白分子,可促进肿瘤细胞增殖,导致肿瘤进展[3]。白细胞介素-17A(Interleukin-17A,IL-17A)为强力促炎因子,可促使炎细胞聚集,并且可通过多种途径促进肿瘤细胞生长[4]。结合MIF、IL-17A 对肿瘤细胞的作用机制, 推测二者可能与PHC 患者TACE 治疗预后有关。 鉴于此,本研究就PHC 患者TACE 治疗预后与血清MIF、IL-17A 水平的关系做以下分析。
1 对象与方法
1.1 研究对象 经医学伦理委员会批准,选择2018年11月至2020年8月医院收治的75 例PHC 患者作为研究对象。患者家属签署知情同意书。纳入标准:(1)PHC 符合 《原发性肝癌规范化病理诊断指南(2015年版)》[5]中相关诊断,经肝穿刺活检病理检查确诊;(2)肝癌巴塞罗那分期(Barcelona Clinic Liver Cancer,BCLC)[6]为Ⅱb 期-Ⅲb 期;(3)Child-Pugh 分级[6]为A-B 级;(4)符合TACE 适应症,且存在肝切除禁忌症。 排除标准:(1)入组前接受过PHC 相关治疗;(2)合并血管性、自身免疫性等其他肝脏疾病;(3)合并其他恶性肿瘤;(4)合并严重心肺、肝肾功能不全或脑器质性疾病;(5)合并失代偿期肝硬化。 75 例患者中男41 例,女34 例;年龄48~66 岁,平均年龄(56.35±3.67)岁;有大量饮酒史30 例;BCLC 分期为Ⅱb 期27 例, Ⅲa 期33例,Ⅲb 期15 例。
1.2 研究方法
1.2.1 治疗方法 全部患者均接受TACE 治疗,参照 《原发性肝细胞癌经导管肝动脉化疗性栓塞治疗技术操作规范专家共识》[7]进行操作:经皮行股动脉穿刺,将导管置入肝固有动脉后,经造影观察肿瘤部位、最大径等情况;经超选择插管将化疗药物注入肿瘤供血动脉进行栓塞;3~4 周后重复1次,共治疗2 次。
1.2.2 基线资料收集 设计患者基线资料调查表,包括患者年龄、性别(男、女)、大量饮酒史(男性每日超过40 g,女性每日超过20 g)、合并高血压(收缩压/舒张压≥140/90 mmHg)、合并糖尿病(餐后2 h 或随机血糖≥11.1 mmol/L, 空腹≥6.2 mmol/L)、合并高脂血症 (甘油三酯≥2.3 mmol/L, 总胆固醇≥6.2 mmol/L)、BCLC 分期(Ⅱb 期、Ⅲa 期、Ⅲb期)、肿瘤最大径(治疗前经超声、磁共振等影像学检查测定)、Child-Pugh 分级(A 级、B 级)。
1.2.3 实验室指标检测 治疗前采集患者空腹静脉血5 mL,离心分离15 min(离心半径8 cm,转速3000r/min),留取血清待检:(1)采用化学发光法测定血清乙型肝炎表面抗原 (Hepatitis B surface antigen,HBsAg),试剂盒购自科美诊断技术股份有限公司;(2)使用生化分析仪(深圳湃尔生物科技有限公司,PR-7300 型) 测定血清中谷丙转氨酶(Alanine aminotransferase,ALT)、 谷草转氨酶(Aspartate aminotransferase,AST)、 白蛋白水平;(3)采用酶联免疫吸附法测定血清甲胎蛋白(Alpha fetoprotein,AFP)、MIF、IL-17A 水平,试剂盒购自上海纪宁生物科技有限公司。
1.3 预后评估及分组方法 全部患者均接受为期12 个月的随访,每3 个月嘱患者回院复诊1 次,每个月电话随访1 次,以病死作为终点事件,记录患者生存时间。 根据治疗后患者12 个月内生存情况将患者分为病死组与存活组。
1.4 统计学方法 用SPSS 25.0 统计学软件处理数据, 采用Shapiro-Wilk 正态分布检验计量资料正态性,±s 表示符合正态分布计量资料, 组间比较行独立样本t 检验; 偏态分布计量资料用[M(P25,P75)]表示;n(%)表示计数资料,用χ2检验;用COX回归分析检验BCLC 分期、Child-Pugh 分级、 治疗前血清AFP、MIF、IL-17A 水平对PHC 患者TACE治疗预后的影响;绘制ROC 曲线,计算AUC,分析治疗前血清MIF、IL-17A 水平对PHC 患者TACE治疗预后的预测价值,AUC<0.5 无价值,0.5≤AUC <0.7 价 值 较 低,0.7 <AUC ≤0.9 价 值 中 等,AUC>0.9 价值高;P<0.05 为差异有统计学意义。
2 结果
2.1 PHC 患者TACE 治疗预后情况 75 例PHC 患者治疗后随访1年,以病死作为终点事件,随访时间为2~12 个月,平均随访时间12.00(7.00,12.00)个月;75 例患者中病死35 例, 病死率为46.67%(35/75)。 见图1。

图1 PHC 患者TACE 治疗后生存分析
2.2 基线资料比较 病死组患者BCLC 分期、Child-Pugh 分级高于存活组, 差异有统计学意义(P<0.05); 组间其他资料比较差异无统计学意义(P>0.05)。 见表1。

表1 基线资料比较
2.3 实验室指标比较 病死组患者治疗前血清AFP、MIF、IL-17A 水平高于存活组,差异有统计学意义(P<0.05);组间HbsAg 阳性占比及ALT、AST、白蛋白、总胆红素水平比较差异无统计学意义(P>0.05)。 见表2。
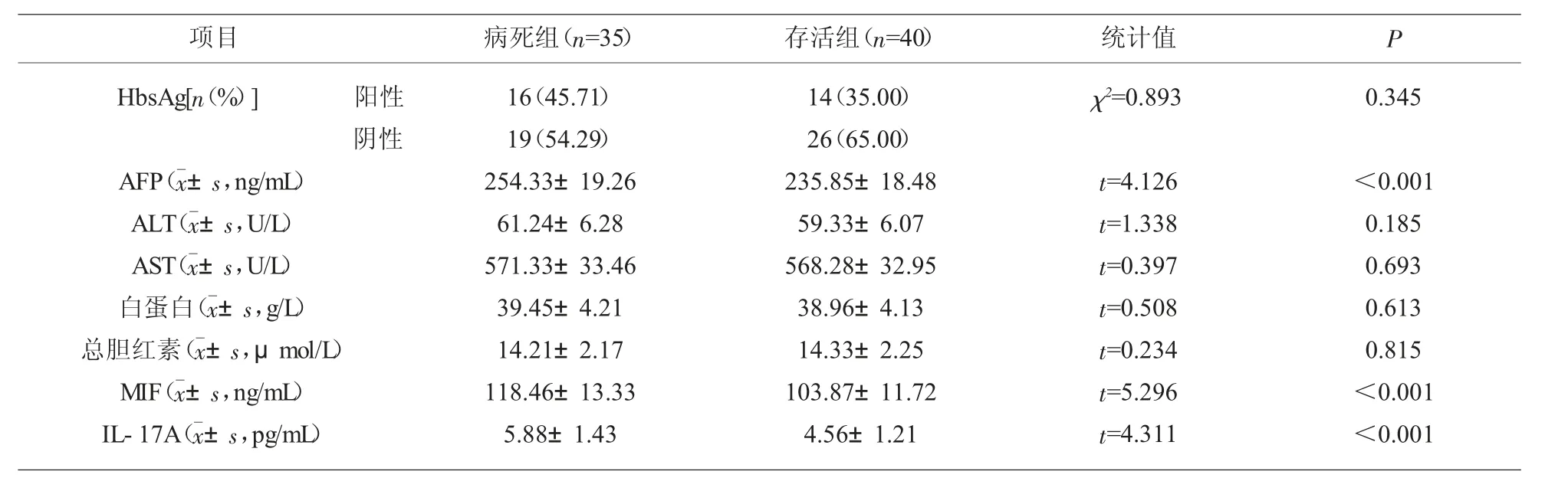
表2 实验室指标比较
2.4 各因素影响PHC 患者TACE 治疗预后的COX回归分析 将PHC 患者TACE 治疗预后作为因变量(1=病死,0=存活),将结果2.2、2.3 中差异有统计学意义的变量纳入作为自变量(BCLC 分期为分类变量,0=Ⅱb 期,1=Ⅲa 期,2=Ⅲb 期;Child-Pugh分级为分类变量,0=A 级,1=B 级;AFP、MIF、IL-17A 为连续变量), 经COX 回归分析结果显示,BCLC 分期高、Child-Pugh 分级高、 治疗前血清AFP、MIF、IL-17A 水平高是PHC 患者TACE 治疗预后的危险因素(OR>1,P<0.05)。 见表3、图2。
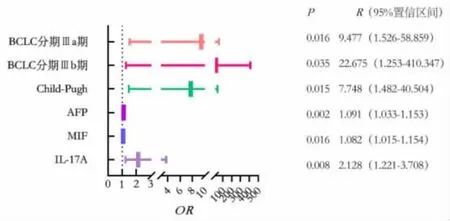
图2 各因素影响PHC 患者TACE 治疗预后的森林图
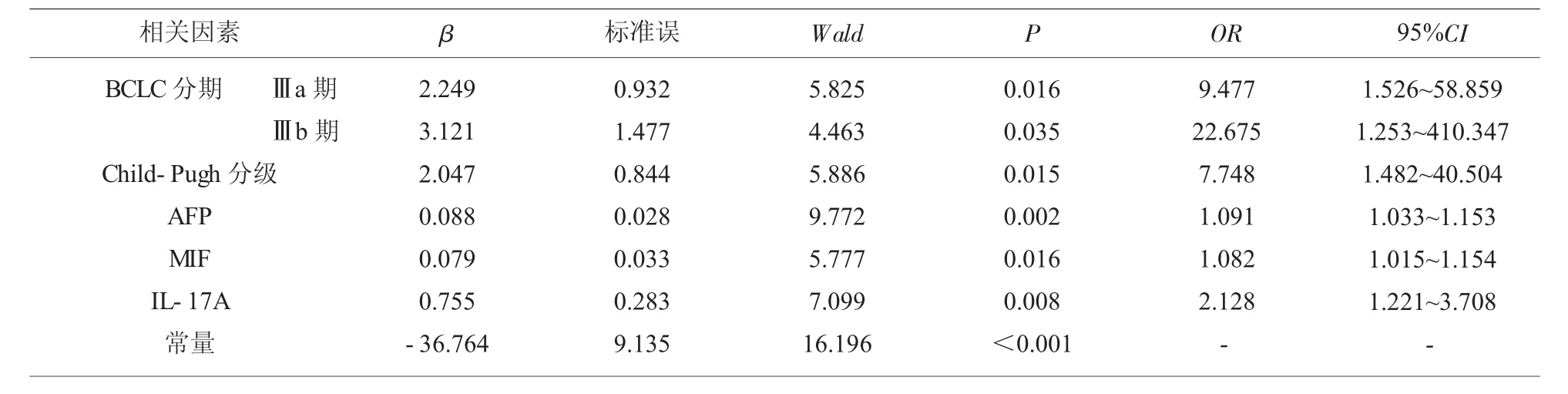
表3 各因素影响PHC 患者TACE 治疗预后的COX 回归分析
2.5 治疗前血清MIF、IL-17A 水平对PHC 患者TACE 治疗预后的预测价值 将治疗前血清MIF、IL-17A 水平作为检验变量,将PHC 患者TACE 治疗预后作为状态变量(1=病死,0=存活),绘制ROC曲线,见图3。结果显示,血清MIF、IL-17A 水平单独及联合预测PHC 患者TACE 治疗预后的AUC>0.7,具有一定的预测价值。 见表4。
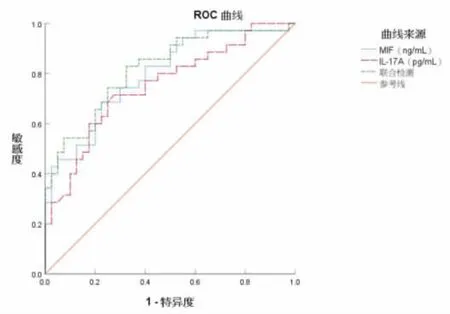
图3 治疗前血清MIF、IL-17A 水平预测PHC 患者TACE 治疗预后的ROC 曲线

表4 治疗前血清MIF、IL-17A 水平对PHC 患者TACE 治疗预后的预测价值
3 讨论
TACE 通过将化疗药物持续注入PHC 患者肿瘤的供血动脉,靶向栓塞肿瘤血管,使肿瘤缺血坏死,但由于受医疗技术、肿瘤分期等因素影响,部分患者预后并不理想[8]。 方旭东等[9]研究中98 例原发性肝癌患者随访1年生存率为53.10%。 本研究中75 例患者病死率达46.67%, 与上述研究相近,说明PHC 患者TACE 术后病死风险较高。 因此寻找客观指标评估PHC 患者TACE 治疗预后, 并寻找新的治疗靶点,对提高患者生存率、延长患者生存期至关重要。
BCLC 分期、Child-Pugh 分级在临床评估PHC患者预后中具有重要意义, 但PHC 的发生发展受多种因素影响,仅通过肿瘤分期、肝功能评估缺乏特异性。 AFP 为临床常用于诊断肝癌的指标,已被临床证实其浓度与肝癌患者肿瘤大小、 预后等密切相关[10]。 同时张泽亮等[11]研究发现,AFP 升高不仅是肿瘤发展过程中的伴随现象, 同时也可促进肝癌细胞增殖。但AFP 升高也可见于睾丸癌、胰腺癌、肺癌等其他恶性肿瘤,在良性肝病患者体内也会呈一过性升高, 因此用来评估PHC 患者TACE预后存在一定局限。
MIF 是T 淋巴细胞产生的具有吞噬、黏附等多种功能的细胞因子,不仅可加重机体肝脏损伤,也在肝癌的发生、发展中起重要作用[12]。 IL-17A 为辅助性T 细胞17 分泌,可促进非小细胞癌、宫颈癌、肝癌等多种恶性肿瘤生长[13]。 结合MIF、IL-17A 的作用机制, 推测二者可能与PHC 患者TACE 治疗预后有关。 本研究发现,治疗前血清MIF、IL-17A水平高是PHC 患者TACE 治疗预后的危险因素。分析原因在于,MIF 水平升高可激活丝裂原活化蛋白激酶,促进血管内皮细胞因子释放,有利于新生血管形成,进而促使肿瘤细胞生长,导致肿瘤组织浸润、转移,增加PHC 患者病死风险[14]。 同时Charan M 等[15]通过动物实验研究发现,小分子MIF抑制剂还能通过激活半胱氨酸蛋白酶、 改变线粒体膜电位,抑制癌细胞生长,说明MIF 过表达可影响PHC 患者预后。此外,MIF 也是一种促进炎症的因子,可依赖性诱导白细胞介素分泌,刺激血管生成,进而增强肝癌细胞的迁移性,导致PHC 转移,影响患者预后[16]。 IL-17A 表达升高可激活丝氨酸/苏氨酸蛋白激酶/IL-6/Janus 激酶2/活化信号转导通录激活因子3 信号通路对肝癌细胞产生刺激,促使癌细胞侵袭,导致远处转移,增加患者病死风险[17]。 同时IL-17A 表达升高后还能通过激活核因子κB 信号通路, 增加多种基质金属蛋白酶释放,进而对肿瘤微环境产生影响,促进肝细胞癌转移,影响患者TACE 治疗预后[18]。
最后绘制ROC 曲线,结果显示,血清MIF、IL-17A 水平单独及联合预测PHC 患者TACE 治疗预后的AUC>0.70, 具有一定的预测价值; 当二者cut-off 值分别取110.385 ng/mL、5.225 pg/mL 时,可获得最佳预测价值。这进一步说明血清MIF、IL-17A 水平可能与PHC 患者TACE 治疗预后有关。临床可考虑早期检测PHC 患者血清MIF、IL-17A水平, 有利于早期评估患者预后, 同时可考虑将MIF、IL-17A 作为PHC 新的治疗靶点,为临床治疗PHC 提供参考。
综上所述,PHC 患者TACE 治疗预后可能与治疗前血清MIF、IL-17A 水平有关,可根据二者水平预测患者预后,并采取有效的治疗措施,降低患者MIF、IL-17A 水平, 进而降低患者病死风险,延长患者生存时间。
