HBV 相关DLBCL 患者的病理学特点及AID 表达差异及与预后关系的多因素分析
2022-06-30杨青华耿东方李小亚李印平
杨青华,耿东方,李小亚,李印平
(濮阳市安阳地区医院1.医学检验科;2.感染性疾病科;3.病理科,河南 安阳 455000)
病毒感染可使恶性肿瘤的发生风险明显增加, 其中恶性肿瘤中增长最快的肿瘤之一是非霍奇金淋巴瘤, 以弥漫性大B 细胞淋巴瘤(diffuse large B-cell lymphoma ,DLBCL)最为常见,其在组织形态、遗传特征、免疫表型、临床表现对化疗的反应和预后方面高度异质[1]。乙肝病毒(Hepatitis B virus ,HBV)感染是全球性的公共卫生问题,DLBCL 中的HBV 感染率高于普通人群,并且患者预后较差[2]。 然而,在DLBCL 发生和发展过程中HBV的病因机制仍不清楚。 活化诱导胞嘧啶脱氨酶(activation induced cytosine deaminase ,AID) 是一种DNA / RNA 编辑酶, 主要诱导胞嘧啶脱氨酶变成尿嘧啶以参与体细胞生发中心B 细胞免疫球蛋白基因的超突变 (somatic hypermutation ,SHM)和抗体的类别转换重组 (class.switch recombination CSR)过程[3-4]。SHM 和CSR 的异常出现导致目标基因突变和染色体易位, 这在大多数B 细胞淋巴瘤的发生中起重要作用[5],因此,AID 在DLBCL 的发病机理中起重要作用。为了探讨HBV 相关DLBCL患者病理学特点及AID 表达差异及与预后关系的多因素分析,本研究选取2018年1月至2020年3月在我院治疗的DLBCL 患者110 例进行研究。
1 资料与方法
1.1 一般资料 选取2018年1月至2020年3月在我院治疗的DLBCL 患者110 例, 其中男性60例,女性50 例;年龄18~71 岁,<50 岁62 例,≥50岁48 例。 入选标准:(1)诊断符合WHO 制定的淋巴造血系统肿瘤分类标准;(2) 有乙肝五项检查;(3)接受CHOP 方案或RCHOP 化疗方案;(4)临床随访资料保存完整。 排除标准:(1)合并有其他病毒性肝炎、HIV 感染;(2) 合并其他系统恶性肿瘤;(3)有心、肝、肾等重要脏器疾病。
1.2 实验室检查 免疫组化法检测AID 表达:手术切除的标本组织经10%甲醛固定24~48 h, 之后行石蜡包埋。将石蜡标本切成厚度约为4 mm 的连续组织切片4 张, 60℃烘烤3 h,常规脱蜡,加3%H2O2在室温下孵育10 min,PBS 洗涤3 次, 每次3 min,柠檬酸溶液修复,PBS 洗涤3 次,每次3 min,加上一抗(抗AID)孵育过夜,PBS 洗涤,添加聚合物增强剂,在室温下孵育20 min,PBS 洗涤,添加酶标记的抗小鼠聚合物 (二抗), 在室温下孵育30 min 用PBS 洗涤3 次,每次3 min,DAB 显色,用水冲洗,用苏木精复染,常规脱水封片。
AID 抗体购自美国Abcam 公司(ab59361);DAB 显色试剂盒、EDTA 修复液、柠檬酸盐修复液、PBS 缓冲液均购自北京中杉金桥公司。
1.3 统计学处理 数据统计采用SPSS 22.0 软件,AID 表达、 性别等资料采用频数或百分比表示,组间比较使用χ2检验; 生存分析采用Kaplan-Meier法; 采用Cox 回归分析预后因素。 检验水准α 为0.05。
2 结果
2.1 伴和不伴HBsAg 感染患者临床病理特征比较伴HBsAg 感染患者年龄<50 岁、 临床分期Ⅲ~Ⅳ、ALT>40 U/L、AST>40 U/L、脾脏受累的比例明显高于不伴HbsAg 感染患者(P<0.05);伴和不伴HBsAg 感染患者性别、结节外受累区域、肝脏受累、IPI评分、ECOG 评分和治疗方案比较差异无统计学意义(P>0.05)。 见表1。
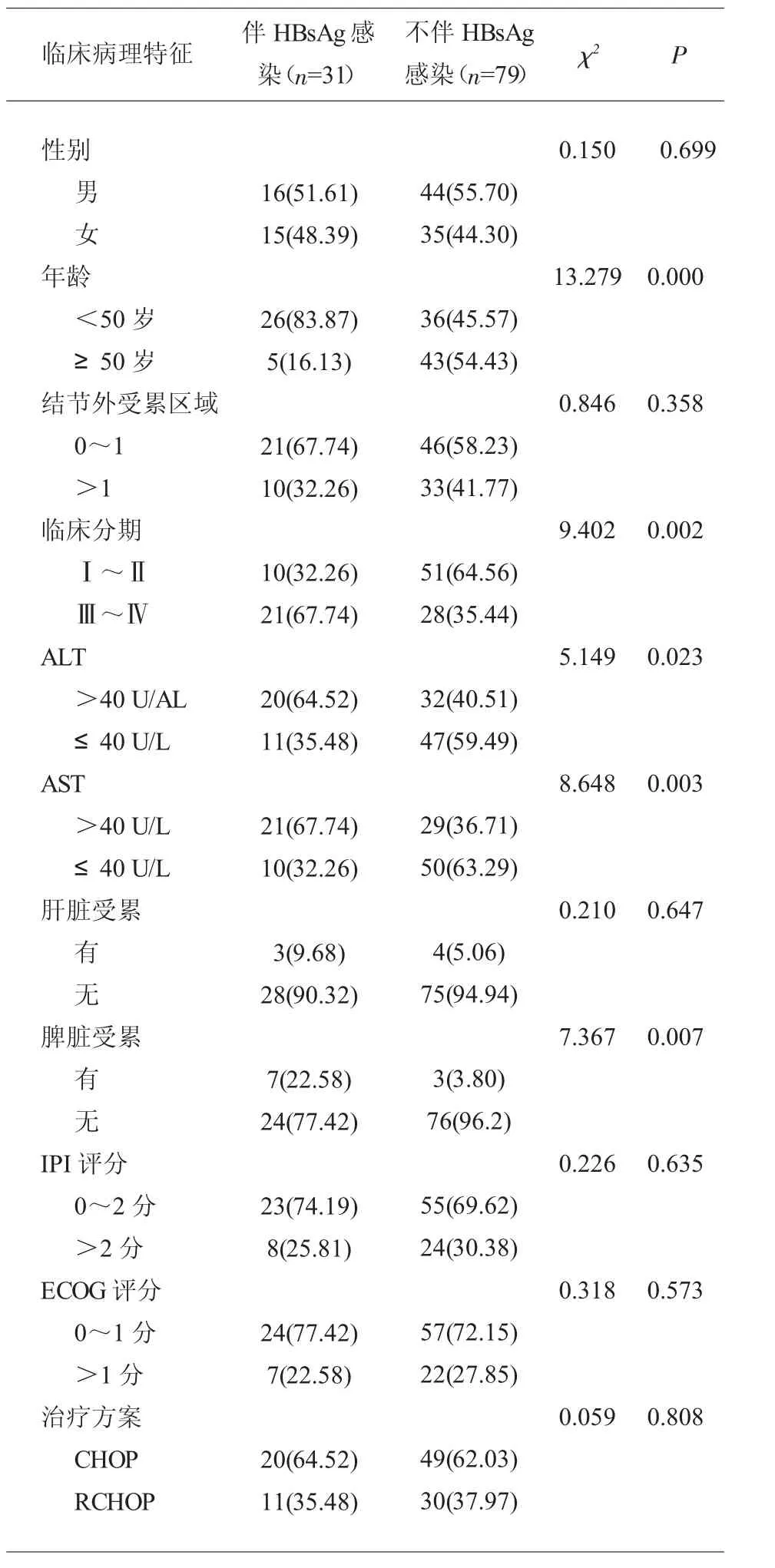
表1 伴和不伴HBsAg 感染患者临床病理特征比较
2.2 伴和不伴HBsAg 感染患者AID 表达情况 伴HBsAg 感染患者AID 阳性表达率明显高于不伴HBsAg 感染患者(P<0.05),见表2;AID 蛋白主要表达于细胞质,呈棕褐色,见图1。

表2 伴和不伴HBsAg 感染患者AID 表达情况
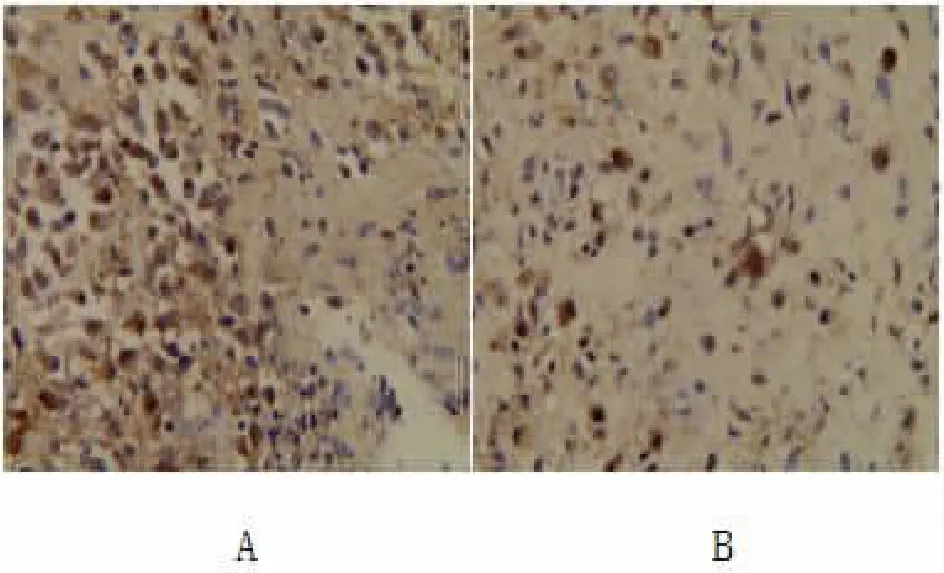
图1 免疫组化染色图
2.3 HBsAg、AID 表达与患者预后关系 HBsAg(+)和AID(+)患者中位生存时间为23 个月(95%CI:21.68~24.32),明显少于HBsAg(+)和AID(-)、HBsAg(-)和AID(+)、HBsAg(-)和AID(-)患者的35个月 (95%CI:32.95 ~37.05)、36 个月 (95%CI:33.10~37.75)和35 个月(95%CI:32.35~37.65)( χ2=8.294、41.769 和14.626,P<0.05)。
HBsAg(+)和AID(-)、HBsAg(-)和AID(+)、HBsAg(-)和AID(-)患者中位生存时间比较差异无统计学意义( χ2=1.921、0.822 和1.022,P>0.05),见图2。
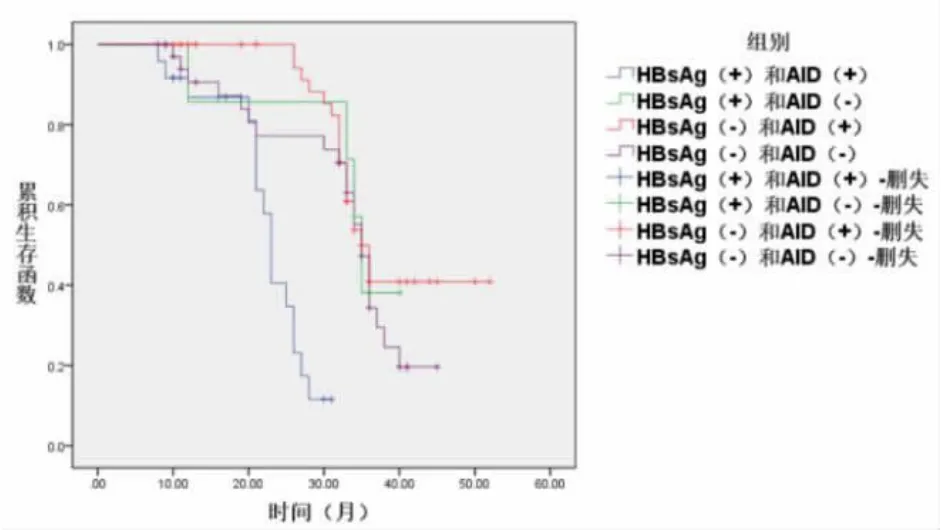
图2 生存曲线图
2.4 多因素分析 Cox 比例风险回归分析结果显示:HbsAg 和AID 双阳性、 临床分期和IPI 评分是DLBCL 患者预后的影响因素(HR=2.101、1.882 和2.011,P<0.05),见表3。
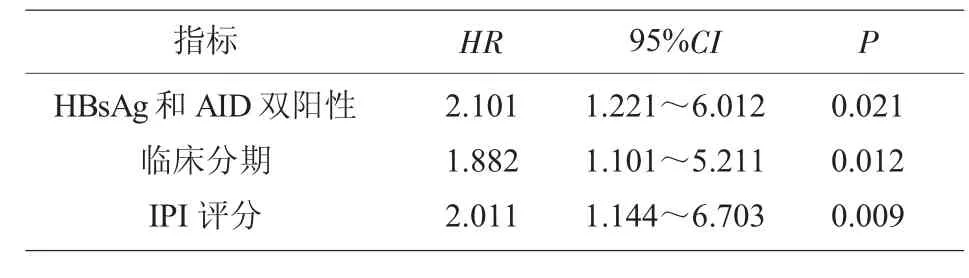
表3 Cox 比例风险回归分析结果
3 讨论
淋巴瘤是淋巴造血系统肿瘤, 目前认为其发生与病毒感染、自身免疫状态和环境因素有关[6-7]。近年来,DLBCL 发生与病毒感染之间的关系越来越受到关注, 特别是合并有HBV 感染的DLBCL患者的临床预后比单纯DLBCL 患者差[8-10]。淋巴瘤患者的免疫功能异常,导致HBV 感染的概率明显高于健康人[11]。 HBV 分布较广,研究HBV 感染与DLBCL 之间的关系具有重要意义。
本研究结果显示,伴HBsAg 感染患者年龄<50岁、 临床分期Ⅲ~Ⅳ、ALT>40 U/L、AST>40 U/L、脾脏受累的比例明显高于不伴HbsAg 感染患者。结果表明与阴性组相比,HBsAg 阳性组发病年龄小、临床分期晚、脾脏侵袭频率高,其他研究[12-14]也有类似的结果。HBV 具有肝细胞吞噬作用,是肝癌最重要的危险因素, 同时也具有淋巴细胞吞噬作用并引起淋巴系统感染, 一旦发生慢性HBV 感染,长期的抗原刺激而导致DLBCL 的发生有其生物学合理性。 因此,HBV 感染可能是DLBCL 发病机理中的重要危险因素之一[15]。
AID 在生发中心表达。 在正常情况下,免疫球蛋白基因的体细胞SHM 和CSR 促进抗体亲和力成熟和B 细胞表面受体亚型的改变, 导致体细胞异常突变或基因结构改变,最终发展为肿瘤[16-17]。AID 在滤泡性淋巴瘤、黏膜相关性淋巴瘤、慢性淋巴细胞性白血病、 弥漫性大B 细胞淋巴瘤等多种B 细胞肿瘤中表达[18]。AID 导致B 细胞淋巴瘤的机制可能与病原体或发炎性因子通过核转录因子KB 信号通路的活化而导致AID 的上调有关[19]。 本研究结果显示,伴HBsAg 感染患者AID 阳性表达率明显高于不伴HBsAg 感染患者。 尽管不同文献报道的DLBCL 患者的HBV 阳性率略有不同,但这些研究都结果表明DLBCL 患者的HBV 阳性率高于健康对照者。结果表明DLBCL 中的AID 与HBV感染具有相关性,AID 可能与DLBCL 中HBV 感染的致病过程有关。 据推测,在HBV 相关的DLBCL中,HBV 感染可以通过慢性刺激连续刺激AID 的表达,从而促进肿瘤的形成,而HBV 感染是否通过某种机制上调AID 的表达, 进一步改变下游靶基因,促进DLBCL 的发生和发展,仍有待进一步研究。
本研究HBsAg(+)和AID(+)患者中位生存时间明显少于HBsAg(+)和AID(-)、HBsAg(-)和AID(+)、HBsAg(-)和AID(-)患者。 这说明AID 可能会加速肿瘤的进展并缩短患者的生存时间,进一步表明AID 对于DLBCL 感染HBV 的预后不良。 多因素分析结果显示,HbsAg 和AID 双阳性、临床分期和IPI 评分是DLBCL 患者预后的影响因素。DLBCL 患者需要在治疗期间密切监测HBV 血清标志物和AID 指标的动态变化,并警惕HBV 再次激活引起的严重肝损害。
DLBCL 发病机制复杂, 且存在多种多样的分子异常,不同的分子异常表达构成了DLBCL 的高度异质性[20]。本研究通过对患者AID 蛋白水平进行检测,表明HBV 也可能通过与AID 相互作用影响DLBCL 发生发展及预后, 支持HBV 可能是DLBCL 发病的重要危险因素之一的假说, 这为HBV相关DLBCL 提供一个可能的研究方向。 由于样本量较少,治疗随访的不一致性、数据的选择偏移等回顾性研究的缺陷, 目前仍然需要一些前瞻性的研究对本结论的进一步证实。
综上所述,伴HBV 感染和不伴HBV 感染DLBCL 患者临床病理学特征有所差异,AID 表达与HBV 感染相关,同时HBV 感染影响患者预后。
