改良皮肤牵张器联合VSD 技术治疗四肢大面积皮肤缺损的效果
2022-06-30王松松任佳杨宁宁
王松松, 任佳, 杨宁宁
(郑州大学第一附属医院 急诊医学部, 河南 郑州 450040)
四肢大面积皮肤缺损是临床常见的急危重症, 患者病情多较严重, 并且皮肤通常无法自愈[1]。 四肢大面积皮肤缺损可影响患者外观, 严重者甚至引起功能障碍, 故积极治疗意义重大。皮肤牵张器及负压封闭引流 (VSD) 是临床治疗大面积皮肤缺损的有效方式, VSD 通过负压引流缩短创面的清创及愈合时间, 并且可为创面提供湿润环境利于生长因子的合成分泌[2]。皮肤牵张器可利用皮肤的弹性作用为缺损的皮下组织修复提供植皮创面床, 并且可缩小创面的面积, 对减少皮肤移植范围及降低并发症发生率具有积极作用[3]。 然而皮肤牵张过程中需在深筋膜上方或下方游离增加皮肤的活动度, 对于严重冲压等引起的皮肤缺损, 皮下游离并不适用。 因此, 本研究采用改良皮肤牵张器与VSD 治疗四肢大面积皮肤缺损, 探讨其临床效果。
1 资料与方法
1.1 一般资料选取2018 年10 月至2021 年10 月我院收治的90 例四肢大面积皮肤缺损患者为对象, 按照入组的单双顺序分为观察组与对照组, 每组45 例。 观察组年龄20 ~60 (37.16 ±7.56) 岁, 男性28 例、 女性17 例, 创面面积 (64.23 ± 5.21)cm2, 伤后至入院时间 (12.19 ± 1.64) h, 体质量指数 (BMI)(21.64 ± 2.46) kg/m2。 对照组年龄22 ~60 (37.50 ± 7.41) 岁,男性31 例、 女性14 例, 创面面积 (64.80 ± 5.18) cm2, 伤后至入院时间 (12.13 ± 1.67) h, BMI (21.68 ± 2.39) kg/m2。 两组的一般资料比较, 差异无统计学意义 (P>0.05)。
1.2 入选标准纳入标准: ①符合大面积皮肤缺损的诊断标准;②无法一期闭合; ③受创后24 h 内入院。 排除标准: ①合并血管闭塞性疾病者; ②患有重度糖尿病者; ③合并严重感染者。
1.3 治疗方法入组患者均接受对症 (抗感染、 细菌培养、 营养支持) 治疗。 对照组采用VSD 治疗, 根据创面制作一次性负压引流器材, 孔径400 ~600 L, 保证可完全覆盖创面。 覆盖后连接负压 (-15.96 ~-10.64 kPa), 给予患者持续的负压引流,密切观察引流液的颜色、 性状等。 观察组采用改良皮肤牵张器联合VSD 治疗, 皮肤牵张器为1 对不锈钢杆 (长度可选11/14/17 cm), 两端带有螺母、 弹簧标尺、 抓钩, 并配备调节杆。具体操作: 首先在深筋膜上/下方游离 (游离范围不超过创缘5 cm), 后置入牵张器。 用2-0 尼龙线沿缺损长轴预关闭。 将克氏针沿缺损长轴两侧平行置入真皮下层。 克氏针距皮缘1 ~1.5 cm, 两端穿出皮肤用于旋装螺母、 抓钩、 弹簧标尺。 安装完成后, 调整两端的螺母调节牵引力, 帮助缺损部位快速拉拢关闭。 为保持牵引拉力, 每天根据皮肤的情况调节牵张器, 牵引过程持续1 ~2 周。 每天应用生理盐水清洗未闭合的创面。 牵引获得足够的皮肤后, 在局麻下进行二期手术, 彻底清洗创面, 依次关闭皮下组织、 真皮层、 外层皮肤。
1.4 观察指标采集治疗前后创面分泌物2 mL, 离心分离, 定量检测细菌计数, 采用酶联免疫法检测透明质酸 (HA)、 血管内皮生长因子 (VEGF) 水平。 利用温哥华瘢痕评分[4]评价患者的创面恢复情况, 从创面色泽、 血管分布、 厚度、 柔软度4个维度进行评价, 采用Linkert 4 级评分 (0 ~3 分), 分值越高则创面恢复越佳。
1.5 统计学方法采用SPSS 25.0 统计软件处理数据。 计数资料以n (%) 表示, 采用χ2检验; 正态分布的计量资料以± s表示, 组间比较采用独立样本t 检验, 组内比较采用配对样本t 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组的创面细菌计数以及HA、 VEGF 水平比较治疗后,两组的细菌计数均少于治疗前, HA、 VEGF 水平均高于治疗前(P<0.05); 观察组的各指标均优于对照组 (P<0.05)。 见表1。
表1 两组治疗前后的创面细菌计数以及HA、 VEGF 水平比较 (±s)
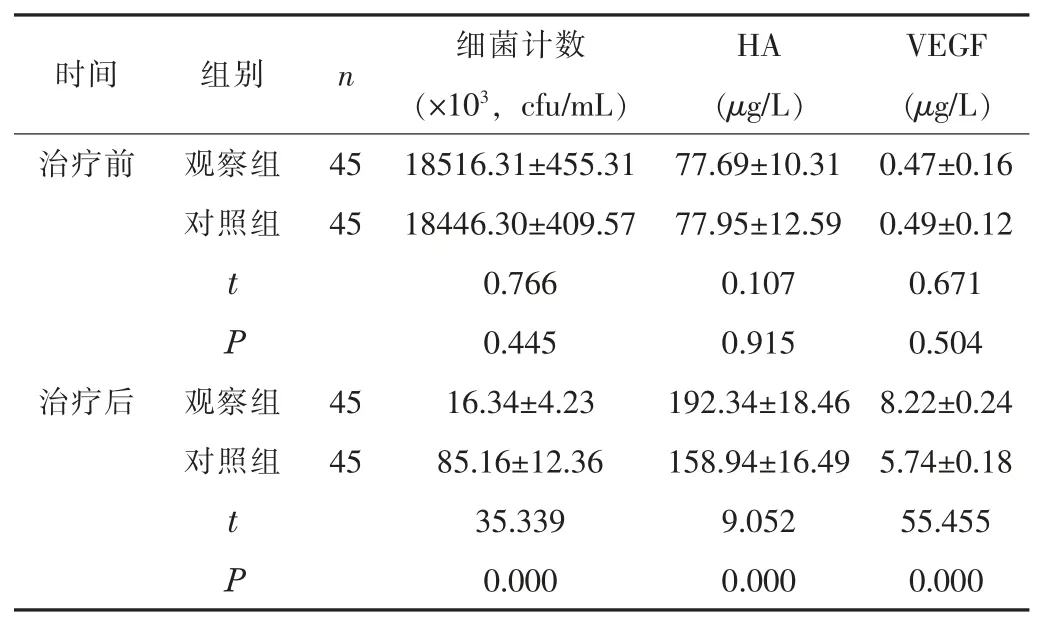
表1 两组治疗前后的创面细菌计数以及HA、 VEGF 水平比较 (±s)
?
2.2 两组的创面恢复情况比较观察组的创面色泽、 血管分布、厚度、 柔软度评分均高于对照组 (P<0.05)。 见表2。
表2 两组的创面恢复情况比较 (±s, 分)

表2 两组的创面恢复情况比较 (±s, 分)
?
3 讨论
四肢大面积皮肤缺损的治疗方式包括清创、 换药、 植皮等, 可取得一定的效果, 然而上述治疗措施的周期较长, 花费较高, 加上创面区域复杂, 继发植皮坏死及创面感染的风险较高。 VSD 是一种新型治疗方法, 通过负压作用可促进创面区域肉芽组织的生长, 并且具有压力均匀及引流效果好的优点[5]。皮肤牵张器是创伤外科近年来探究的热点, 可刺激创面分泌促进组织愈合的细胞因子。 然而传统的皮肤牵张器存在一定的局限性, MIAMI 及Sure closure 是广泛应用的牵张器, 是将闭合创面需要的牵引力作用于穿过皮肤的缝线或抓钩, 在手术需要的牵引力较大或牵引时间较长时, 会对皮肤造成损伤[6]。Topaz 等[7]利用TopClosure, 该种牵张器需将多个连接板缝合至缺损两侧皮肤, 术后会形成明显的瘢痕。
本研究应用改良的皮肤牵张器, 将克氏针置入皮下, 利用外部的挂钩调节牵引力, 可将创面所需的牵引力均匀分布, 术后瘢痕较小。 本研究结果显示, 治疗后, 观察组的创面细菌计数少于对照组, 提示改良牵张器联合VSD 治疗的效果较好, 可减少细菌感染, 其原因可能为改良牵张器与VSD 发挥协同作用, VSD 可吸取失活及感染组织的渗出液体, 减轻创面组织的高压, 缓解创面水肿; 而皮肤牵张器可增加皮肤的弹性, 降低创面缺损面积, 最终降低细菌感染发生率。 本研究中, 观察组治疗后的HA、 VEGF 水平均高于对照组, 提示改良牵张器联合VSD 治疗可加速机体分泌细胞生长因子, 促进创面愈合, 可能与皮肤牵张器及VSD 对皮肤的刺激作用有关。 细胞外基质在创面愈合过程发挥重要作用, HA 含量丰富的细胞外基质可促进细胞的增殖及迁移。 VEGF 具有促进内皮细胞强化分裂及增殖的作用, 在创面愈合及血管生成方面具有重要调节作用。 VSD可促使创面产生有益的细胞渗液, 而新的渗液中含有创面愈合所需要的HA 及VEGF, 促进肉芽组织的生长。 皮肤牵张器通过机械刺激创面大量分泌HA、 VEGF, 共同促进创面愈合。 本研究中观察组的创面色泽、 血管分布、 厚度、 柔软度情况均优于对照组, 原因在于, 本研究应用的改良皮肤牵张器, 通过每天的牵引力调节, 可保持皮肤均匀松弛, 通过机械蠕变获得需要的皮肤组织, 通过该种牵引获得的皮肤与缺损部位的颜色相近, 质地与厚度基本相同, 因此患者术后创面皮肤恢复效果优于单纯VSD 治疗。
综上所述, 改良皮肤牵张器联合VSD 治疗四肢大面积皮肤缺损患者可减少创面细菌, 刺激HA 及VEGF 的分泌, 促进创面皮肤恢复。
