紫杉醇联合顺铂及洛铂用于中晚期宫颈癌的疗效及对癌组织人源性多肽的影响
2022-06-30龚小倩陈亚军乔伶俐李丽琴邱芳华
龚小倩,陈亚军,乔伶俐,李丽琴,邱芳华
(1.韶关市妇幼保健院妇产科,广东韶关 512026;2.韶关市妇幼保健院遗传中心,广东韶关 512026;3.广州医科大学附属中医院医院办公室,广东广州 510000)
宫颈癌早期缺乏特异性症状[1],部分患者在确诊时已经发展至中晚期,这增加了中后期的治疗难度。近年来,为提升临床疗效,国内外选择采用紫杉醇联合顺铂(DDP)治疗中晚期宫颈癌[2],临床有效率高。DDP为第1代铂类药物,应用范围广、疗效稳定且价格低廉,是当前临床中使用频率最高的抗癌药物。但DDP肾毒性较强,肾脏不良反应较多[3]。洛铂(LBP)为第3代铂类药物,从抗肿瘤活性上来讲,与DDP并无差别,优点是与DDP无交叉耐药性,对患者肾脏毒性较小[4]。因此,本研究探讨紫杉醇联合LBP用于中晚期宫颈癌的疗效及对癌组织人源性多肽(DCD)的影响,以期明确这一治疗手段的临床应用价值。
1 资料与方法
1.1 一般资料 选取2018年3月至2021年8月韶关市妇幼保健院和广州医科大学附属中医院收治的60例中晚期宫颈癌患者为研究对象,按照随机数字表法分为观察组和对照组,各30例。观察组患者年龄41~63岁,平均年龄(49.75±7.11)岁;体质量指数(BMI)17~23 kg/m2,平均BMI(20.38± 2.21)kg/m2;肿瘤最大直径3.7~5.9 cm,平均肿瘤直径(4.93±0.72)cm;病例类型:角化型23例,非角化型4例,腺癌3例;病理分期:ⅡA期5例,ⅡB期16例,ⅢA期8例,Ⅲ B期1例。对照组患者年龄41~64岁,平均年龄(49.67±7.23)岁;BMI 17~23 kg/m2,平均BMI(20.15±2.18)kg/m2;肿瘤最大直径3.8~6.0 cm,平均肿瘤直径(5.04±0.71)cm;病例类型:角化型25例,非角化型4例,腺癌1例;病理分期:ⅡA期5例,ⅡB期11例,Ⅲ A期9例,Ⅲ B期5例。两组患者一般资料比较,差异无统计学意义(P>0.05)。本研究经韶关市妇幼保健院医学伦理委员会批准,患者及其家属均对研究知情并签署知情同意书。纳入标准:①符合《妇产科学》[5]中宫颈癌的诊断标准;②临床分期为ⅠB期~Ⅲ B期;③经妇科检查或CT测量可测量出肿瘤病灶;④无既往放化疗史;⑤预计生存期≥6个月;⑥卡氏(Karnofsky)评分≥70分。排除标准:①患有其他恶性肿瘤;②试验开始前1个月内曾进行过其他药物研究;③妊娠或哺乳期的妇女;④试验期内拒绝避孕的育龄妇女;⑤严重过敏史或对铂类药物过敏;⑥心功能不全、脑血管疾病或者肝、肾脏器功能不全患者。
1.2 治疗方法 两组患者在入院后进行血、尿常规以及生化等相关检查排除患者的化疗禁忌,均选用调强放射治疗(IMRT)放疗方案。患者均在第1天给予同步化放疗,1次/周,共放化疗4~5次。观察组:紫杉醇联合LBP进行化疗。分别在紫杉醇给药前12 h、6 h肌内注射地塞米松(成都天台山药业,国药准字H51020723,规格:1 mL∶5 mg/支)20 mg,在紫杉醇给药前30 min口服西咪替丁(四川太平洋药业有限责任公司,国药准字H51021483,规格:200 mg/片)200 mg与苯海拉明(山西太原药业有限公司,国药准字H14022436,规格:25 mg/片)50 mg,避免患者出现过敏现象,并使用常规止吐药物昂丹司琼(石家庄四药有限公司,国药准字H10980185,规格:8 mg/粒)放化疗前1~2 h静脉注射8 mg预防患者出现消化道反应。第1天紫杉醇(北京协和药厂,国药准字H10980069,规格:5 mL∶30 mg/支)按照患者体表面积130 mg/m2进行静脉滴注,滴入时密切观测患者血氧饱和度与血压情况;于紫杉醇滴注3 h后给予患者LBP(海南长安国际制药有限公司,国药准字H20050308,规格:50 mg/支)治疗,按照患者体表面积30 mg/m2进行静脉滴注。对照组:紫杉醇联合DDP治疗。对照组患者在紫杉醇给药前、紫杉醇给药方面与观察组治疗方法相同,同时也予以止吐、水化的对症处理。于紫杉醇滴注3 h后给予患者DDP(山东罗欣药业集团股份有限公司,国药准字H20046375,规格:10 mg/支)治疗,按照患者体表面积50 mg/m2进行静脉滴注。21 d为1个周期,两组患者均治疗2个周期。
1.3 观察指标 ①疗效评价标准:在2个治疗周期后,参照RECIST实体瘤疗效评价标准[6],将近期疗效分为完全缓解(CR):病灶完全消除且未出现新病灶;部分缓解(PR):病灶体积缩小50%及以上并持续时长超过1个月;疾病稳定(SD):病灶体积缩小50%以下,或病灶增大在25%以下;疾病进展(PD):病灶无消失、病灶体积增大25%以上或出现新病灶;总有效率=(CR+PR)例数/总例数×100%。②肿瘤标记物:于治疗前和1个治疗周期结束之后,抽取患者清晨空腹静脉血5 mL,以3 300 r/min转速离心10 min,采用酶联免疫测定(ELISA)试剂盒(上海越研生物)进行癌胚抗原(CEA)、鳞状上皮癌相关抗原(SCC-Ag)、糖类抗原72-4(CA72-4)、细胞角蛋白19片段抗原21-1(CRFRA211)、糖类抗原125(CA125)的检测。③比较两组患者治疗前后DCD阳性率。于治疗前和2个治疗周期结束之后测定DCD水平,参考免疫组织化学评分(HSCORE),利用免疫组织化学(IHC)染色法,收集患者癌组织,对病理切片进行分析与评定,将其分为阳性和阴性(阳性判定标准为在显微镜照片下表现为棕褐色、棕黄色以及淡黄色)。④比较两组患者不良反应发生情况。按照WHO抗肿瘤药物急性及亚急性毒性反应分度标准[7](Ⅰ~Ⅳ)判定。
1.4 统计学分析 采用SPSS 22.0统计学软件处理数据,计量资料以(x)表示,组间比较采用独立样本t检验,组内对比采用配对样本t检验;计数资料以[例(%)]表示,组间比较采用χ2检验,其中等级资料比较采用秩和检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者疗效比较 治疗后,两组患者总有效率比较,差异无统计学意义(P>0.05),见表1。
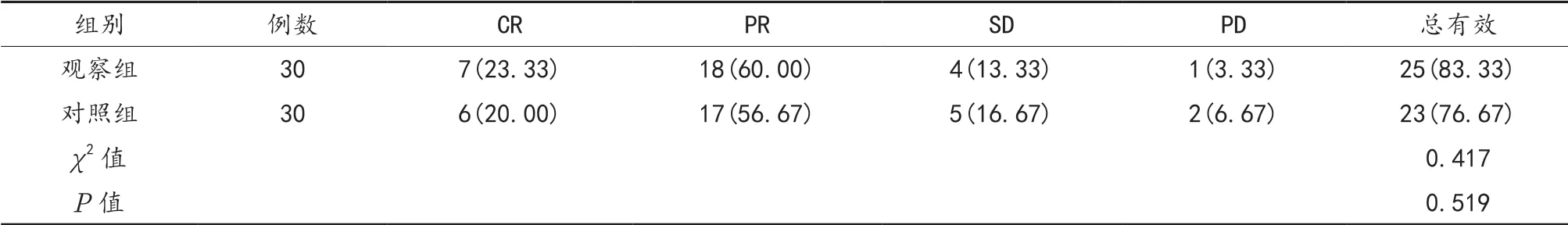
表1 两组患者疗效比较[例(%)]
2.2 两组患者治疗前后血清肿瘤标记物水平比较 治疗前,两组患者CA125、CEA、SCC-Ag、CRFRA211、CA72-4比较,差异无统计学意义(P>0.05);两组患者治疗后CA125、CEA、SCC-Ag、CRFRA211、CA72-4水平均显著低于治疗前,差异有统计学意义(P<0.05);治疗后,两组患者CA125、CEA、SCC-Ag、CRFRA211、CA72-4水平比较,差异无统计学意义(P>0.05),见表2。

表2 两组患者治疗前后血清肿瘤标记物水平比较(x)
2.3 两组患者治疗前后DCD阳性率比较 两组患者治疗前及治疗后DCD阳性、阴性率比较,差异无统计学意义(P>0.05),见表3。

表3 两组患者治疗前后DCD阳性率比较[例(%)]
2.4 两组患者化疗后不良反应比较 化疗后观察组患者的肝肾功能损伤、肌肉关节疼痛发生率显著低于对照组,差异有统计学意义(P<0.05);两组患者化疗后呼吸困难、消化道反应、脱发、血红蛋白降低、骨髓抑制发生率比较,差异无统计学意义(P>0.05),见表4。
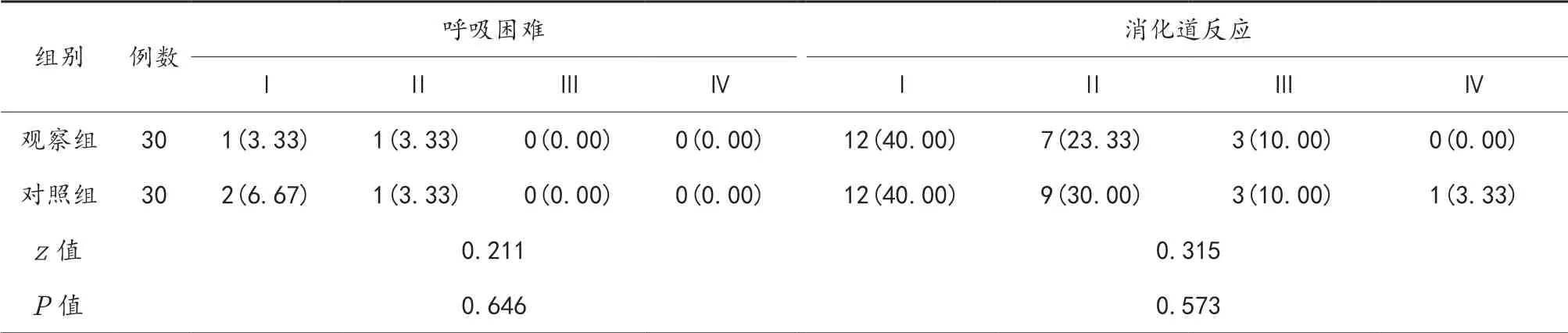
表4 两组患者化疗后不良反应比较[例(%)]
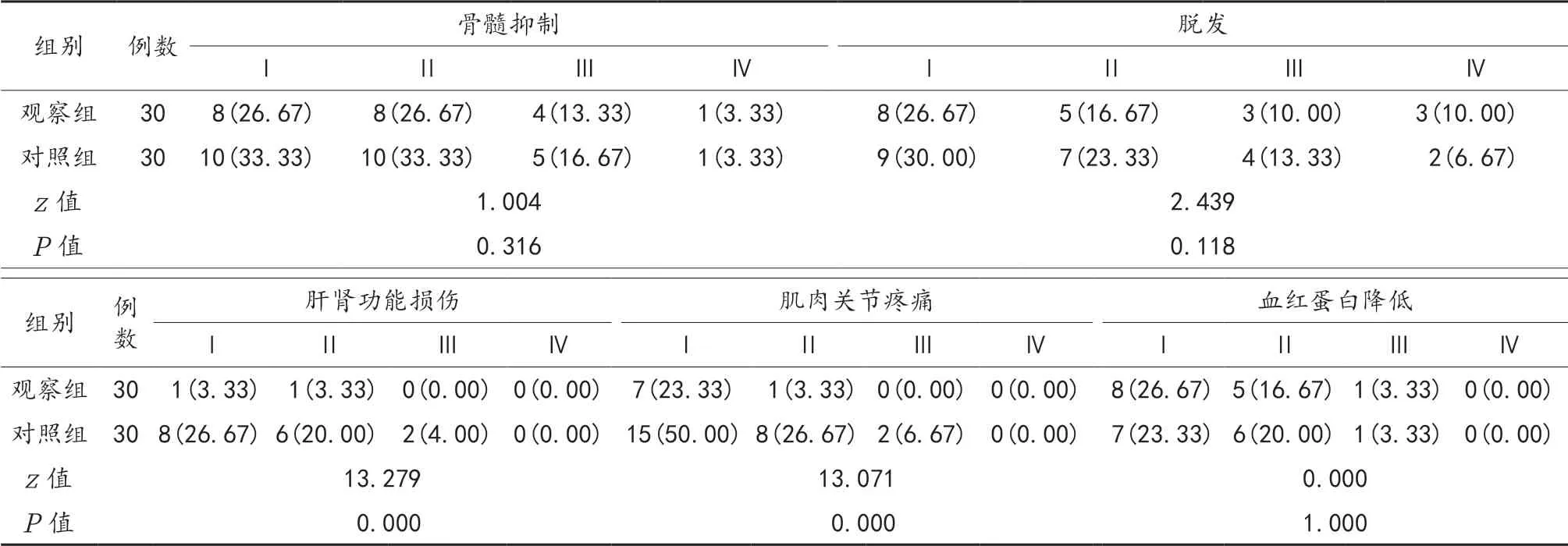
续表
3 讨论
宫颈癌作为妇科常见恶性肿瘤,不仅有着高发病率、高死亡率的特征,近年来还表现出发病率日益增长的趋势[8],宫颈癌发病群体逐渐年轻化,中晚期宫颈癌更是有着易复发、易扩散转移、手术难度大的特征。手术与化放疗作为常用宫颈癌治疗方法,近年来,在药物治疗上多是采用紫杉醇结合DDP来进行中晚期宫颈癌的治疗,既发挥出紫杉醇作为抗微管药物所具有的阻止肿瘤细胞分裂的作用,还发挥出铂类药物抗癌谱广、疗效确切、能与多种抗肿瘤药物协同应用的特点。但DDP不良反应极为常见,患者肌肉关节疼痛反应极为明显。而LBP作为新研发的第3代铂类药物,目前在临床应用中疗效较好,且研究显示不良反应少,尤其是肾毒性相比其他铂类药物更低[9]。
本研究显示,两组患者总有效率、血清肿瘤标记物水平比较,差异无统计学意义,提示LBP、DDP用于中晚期宫颈癌均有一定效果,且基本相当;另本研究观察患者组织内DCD水平,经免疫组织化学法检测发现治疗后阳性率基本相当,DCD作为与肿瘤转移有关联的新蛋白,与癌细胞增殖、分化存在关系,提示从分子蛋白学角度看LBP与DDP在抗肿瘤效果比较,差异无统计学意义。这主要是由于LBP抗癌指数大于或等于DDP,并无交叉耐药性,更具有着铂类抗肿瘤药物较少的肾毒性、神经毒性,多表现为骨髓抑制,但本研究两组患者骨髓移植发生率比较,差异无统计学意义,考虑与样本量较小有关。另外,LBP在化疗前无需进行顺铂所必需的水化利尿环节,且对肾脏毒性较为轻微[10-11],也意味着LBP用药后对电解质的补充需求较少。本研究显示,观察组患者肝肾功能损伤、肌肉关节疼痛发生率低于对照组,提示洛铂有更高的安全性。本研究仍存在一定局限性,受限于样本量和时间限制,尚未开展大样本的长期随访,暂缺少两组患者远期疗效的比较,还需后续深入完善研究。
综上所述,紫杉醇联合LBP或DDP用于中晚期宫颈癌临床疗效基本相当,但LBP不良反应较小,值得在临床上应用。
