免疫检查点抑制剂治疗同时性双原发癌1例
2022-06-29和梦珂郭继红
和梦珂 郭继红 李 霞 孙 健 葛 洋*
(1.北京朝阳中西医结合急诊抢救中心肿瘤综合治疗科,北京100122;2.首都医科大学附属北京朝阳医院肿瘤科,北京 100020)
多原发癌(multiple primary cancer,MPC)是指同一患者患两个及以上、无相关性的恶性肿瘤,诊断标准多参考1932年Warren等[1]的论述,国内的发生率约为0.46%~4.1%[2]。恶性肿瘤的发生与免疫监察功能紊乱密切相关,免疫逃逸是肿瘤细胞的十大特征之一[3],而多原发癌更与机体免疫功能异常、免疫逃逸关系密切[4]。双原发癌是最常见的多原发癌[5],其中间隔时间少于6个月的称为同时性双原发癌(synchronous carcinoma,SC),超过6个月的称为异时性双原发癌(metachronous carcinoma,MC)。免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)已成为癌症治疗领域最有前景的方法之一[6],其中程序性死亡受体-1(programmed cell death-1,PD-1)/程序性死亡受体配体1(programmed cell death-ligand 1,PD-L1)通路在抗肿瘤免疫调节通路上发挥重要作用[7]。
1 病例资料
李某,男性,出生于1954年1月。2019年6月无明显诱因出现咳嗽、咳痰,痰中带血,未予诊疗。2019-09-28行胸部电子计算机断层扫描(computed tomography,CT)示:左肺门占位,2019-11-05于首都医科大学附属北京朝阳医院行正电子发射计算机断层显像(positron emission tomography-CT,PET-CT)检查示:左肺门不规则软组织密度团片影及右肺上叶后段近纵隔旁结节影,均伴代谢增高,考虑恶性病变可能性大;左锁骨下纵隔及双肺门多发异常肿大淋巴结影,均伴代谢增高,不排除淋巴结转移;右侧股骨近端及右侧第6后肋局部骨密度增高,伴代谢增高,不除外骨转移。2019-11-13行无痛支气管镜取病理示:(4R)肺腺癌,ROS-1(-)、BML4-ALK融合基因(-)、EGFR(-),KRAS基因突变检测结果示:2号外显子C.34G>T(p.G12C)突变,BRAF基因突变检测结果示:BRAF基因15号外显子c.1799T>A(p.V600E)未检测到突变。2019年11月患者行肠镜检查提示直肠癌?,2020-01-02行腹腔镜下直肠癌根治术,术后病理提示:(直肠)中分化腺癌pT3N0,可见脉管癌栓及神经侵犯,免疫组织化学检查示:-7:MSH6(+),MSH2(+),PMS2(+),MLH1(+)。2020-04-07复查胸部CT示:肺门区占位明显增大,详见图1。2020-04-13、2020-05-09、2020-06-13、2020-07-08行替雷利珠单抗联合培美曲塞、顺铂治疗共4周期,出现Ⅱ度骨髓抑制白细胞减少、Ⅰ度消化道不良反应恶心伴纳差。2020-06-08,2周期替雷利珠单抗联合培美曲塞、顺铂后复查胸部CT提示:肺门占位明显缩小。2020-07-25评估胸部CT提示肺门原发灶稳定,右下肺新发转移灶,详见图2,未行穿刺无法评估肺来源抑或直肠来源。2020-07-31开始调整治疗方案为替雷利珠单抗联合贝伐珠单抗治疗12周期,2020-09-24,2周期替雷利珠单抗联合贝伐珠单抗后复查胸部CT:右下肺占位明显缩小,2021-05-06复查肠镜未见新发或肿瘤复发。患者因住院就医困难,自行延长治疗间歇期至35~42 d,治疗期间患者仅出现G1免疫相关性皮肤不良反应,包括全身散在的皮疹、瘙痒,无水疱、脱屑、苔藓化,不影响日常生活,皮肤感光敏感,耐受性良好。2021-08-25复查胸腹盆腔CT提示病情平稳,末次随访时间2021-10-03,患者生活质量良好。肿瘤诊断治疗史简述见图3。

图1 原发病灶变化情况

图2 转移灶变化情况
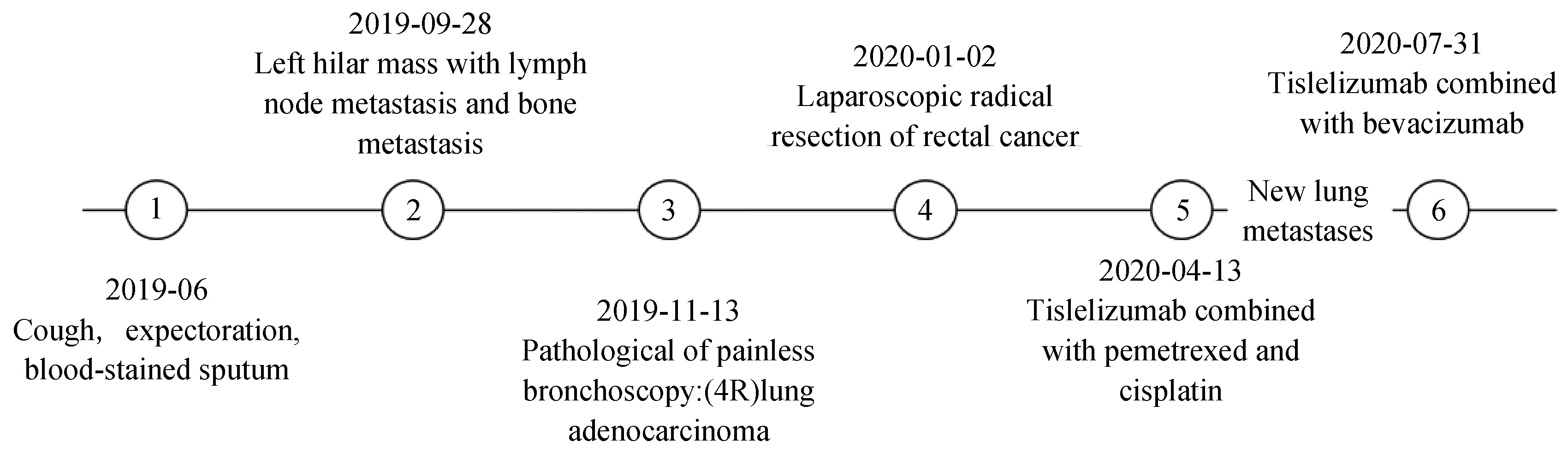
图3 肿瘤诊断治疗史
2 讨论
随着大家对体检的重视及肿瘤治疗领域的进步,多原发癌的检出率逐年升高[8]。衰老引起的体细胞突变累积及DNA损伤、免疫功能缺陷是引起多原发癌的重要因素,尤其是同时性多原发癌可能携带相同基因突变、来源于相同的癌前病变[9],“区域性癌变”理论更是常被用来解释MPC的发生原因,抑癌基因的种系突变被认为是MPC的潜在驱动因素[10]。
研究[11]显示,70.87%第二原发癌发生在第一原发癌的2个月后。临床研究显示,涉及肺癌的MPC发生率为0.9%至26.3%[12],消化道是多原发癌的好发部位,第二原发癌为消化道肿瘤者约占44%,其中结直肠更是最好发部位[13],其中含肺癌的多原发癌患者中,合并消化道肿瘤者约占71%[14]。Song等[12]从SEER数据库中提取5 253例涉及肺癌的MPC患者,发现大多数患者为65岁以上的男性,且腺癌的发生频率最高。
组织胚胎学中指出肺、气管、呼吸道腺体、消化管大多来源于内胚层,而呼吸道黏膜与肠道黏膜更是构成了公共黏膜免疫系统[15]。p53、KRAS的基因突变与肺癌、肠癌的发生密切相关。机体免疫系统可以识别自己,清除“异己”;对于癌变的细胞,机体通过免疫监视、免疫编辑杀灭肿瘤细胞。当免疫监察功能异常时,可诱导T细胞凋亡,降低对肿瘤细胞的杀伤。王俊等[16]对于前列腺癌并发多原发癌的外周淋巴细胞亚群分布检测发现,外周CD4+CD25+、CD3-CD(16+56)+亚群淋巴细胞的升高可能是其并发多原发癌的独立危险因素。
目前,多原发癌临床没有统一有效的治疗方法,也没有明确的指南推荐,早发现、早诊断、早治疗是改善预后的关键[17-21];其中,SC的生存期较短[22]、预后较差,因此对于多原发癌寻求更为有效的治疗尤为迫切。PD-1/PD-L1抑制剂是目前应用最广泛的ICIs,可逆转免疫逃逸,恢复抗肿瘤免疫[23]。Yasuda等[24]提及1例76岁患有多发性骨髓瘤、原发性胃癌、原发性肺癌的男性患者,使用纳武利尤单抗后胃癌、肺癌分别被评估为疾病稳定和部分缓解。
本例患者为肺癌、直肠癌同时性双原发癌患者,初始治疗时期即选择免疫检查点抑制剂联合治疗模式;4周期免疫联合化学药物治疗(以下简称化疗)后肺原发病灶明显缩小且稳定,然出现新发周围型肺转移灶,患者及家属拒绝有创伤性穿刺,因此无法明确肺转移灶来源。4周期化疗诱导免疫治疗开始起效,恐多次化疗损伤患者免疫功能,另外肺部病灶无抗血管生成治疗禁忌证,且抗血管生成药物贝伐珠单抗可调节免疫微环境提高免疫治疗疗效,因此,二线选择PD-1联合贝伐珠单抗。不添加化疗的免疫联合靶向治疗方案,减少化疗带来的骨髓抑制及消化道不良反应,使患者的骨髓功能得以修复,提高患者的耐受性。
在使用PD-1/PD-L1过程中会出现免疫相关不良反应(immune-related adverse events,irAEs),其中皮肤相关不良反应是发生率最高的irAEs,皮肤irAEs多数较轻[25],Berner等[26]研究发现,接受PD-1/PD-L1治疗的晚期非小细胞肺癌患者出现皮肤irAEs预后相对较好,且差异具有统计学意义。本例患者即出现了轻度免疫相关皮肤不良反应。另外,患者因自身原因延长治疗间歇期,治疗效果较好且没有出现严重irAEs。
研究[27]显示,含胃癌的多原发癌不同肿瘤细胞表面PD-L1表达不存在相关性,PD-L1高表达是胃癌多原发癌的独立危险因素。临床治疗中发现,延长免疫治疗间隔时间可能减少免疫相关不良反应发生率。对多原发癌患者进行肿瘤突变负荷(tumor mutation burden,TMB)、PD-L1、微卫星不稳定性(microsatellite instability,MSI)等相关标志物检测可进一步评估免疫治疗对于多原发癌的普适性,有待更进一步的临床及基础实验的证实。
