M2巨噬细胞对新生乳鼠受损心脏组织的再生和修复机制
2022-06-29张家坤李晶洁
王 茜 张家坤 刘 青 孙 琳 李晶洁*
(1.哈尔滨医科大学附属第四医院胸痛中心,哈尔滨 150001;2.天津市宝坻区人民医院心内科,天津 301800;3.哈尔滨医科大学附属第一医院心内科二病房,哈尔滨 150001)
心脏受损后心肌组织的再生和修复效率低下是造成大部分心脏疾病的原因之一,严重者短时间内就会出现心力衰竭,而心力衰竭正是世界范围内造成人类死亡的一个主要原因[1]。在新生哺乳动物[2-10],如乳鼠[4-8]和猪[9-10]中,在出生后7 d内心脏保留了将损伤心肌组织完全修复的能力,但成年哺乳动物中心脏的这种再生修复能力完全丧失。Porrello等[5]在2011年发现新生乳鼠心脏切除10%的心尖后依然具有完全再生的能力,且最近国内外多项研究[11-12]证实7 d内新生乳鼠的心脏具有再生能力,可以将其作为哺乳动物心脏再生的研究模型。在新生心肌损伤后的修复过程中免疫反应起着至关重要的作用[13-21],其中巨噬细胞的作用更是无可替代,尽管其潜在机制尚不完全清楚[22]。
巨噬细胞作为一种可塑性强的细胞群[23-25],参与了多个器官(如肠道、肺和皮肤等)的炎性反应和伤口愈合,可对心肌损伤后的环境信号作出相应反应,极化为两个功能不同的亚群,即经典活化型(M1)巨噬细胞和交替活化型(M2)巨噬细胞。心肌梗死(myocardial infarction,MI)后,M1和M2巨噬细胞均出现在受损的心肌组织中。早期炎性反应阶段,M1巨噬细胞通过分泌大量促炎因子如肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素(interleukin,IL)-1β和IL-6等浸润心肌损伤区[16,18,26-27],表现出强烈的促炎性反应表型。M1和中性粒细胞、单核细胞等降解并清除坏死的碎片和凋亡细胞,这是组织修复的必要准备。然而,如果促炎反应变得过度或不受控制,它将导致严重的炎性反应并抑制愈合过程。而M2巨噬细胞具有完全相反的功能,它可以抑制炎性反应和修复受损组织。M2巨噬细胞激活成纤维细胞,导致纤维化瘢痕形成,增强脆弱的心室壁[28-30]。因此,随着M1巨噬细胞增加的减少,心脏中M2巨噬细胞的数量增加,在MI[6-10,31]后第5~7天达到峰值。这种细胞还能在受损的心肌组织中诱导血管和交感神经生成。
M2巨噬细胞也参与诱导缺血组织中的新生血管形成。近年来多项研究[32-33]证实乳鼠心脏再生与神经、血管的形成以及细胞外基质等有关。通过RNA修饰技术促进血管内皮生长因子(vascular endothelial growth factor,VEGF)的表达,可以增强鼠心肌梗死后心脏再生能力,提示血管生成在心脏再生时发挥重要作用。White等[33]及Mahmoud等[34]通过手术切除迷走神经或者用6-羟基多巴胺氢溴酸盐(6-hydroxydopamine hydrobromide,6-OHDA)化学消融交感神经证实抑制交感神经再生可以削弱心脏损伤后再生的能力,而靶器官中神经生长因子(nerve growth factor,NGF)的表达程度决定了交感神经的支配密度[19]。这些研究[33-34]表明神经可能通过NGF参与心脏再生,但M2巨噬细胞能否通过影响神经及血管的新生促进心脏再生目前尚不清楚。因此,本研究应用乳鼠心尖切除模型研究巨噬细胞极化在哺乳动物心脏再生中的作用及部分机制,旨在揭示心脏再生时不同巨噬细胞的功能及其对血管和神经再生的影响,并进一步探究M2巨噬细胞在神经及血管再生方面的作用。
1 材料与方法
1.1 实验动物
健康6~8周龄SD雄性大鼠以及同系源出生后第1天(P1)和第7天(P7)新生SD乳鼠,取自哈尔滨医科大学第二附属医院实验动物中心[实验动物许可证号:SCXK(黑)2019-001]。所有动物实验相关操作均按照机构动物护理指南进行,并经哈尔滨医科大学第一附属医院实验动物管理委员会伦理审批,伦理审批号:2020044。动物被饲养在一个特定的无病原体动物设施中,在12 h的光-暗循环中自由获得食物和水。
1.2 试剂与抗体
ACK红细胞裂解液购自Solarbio公司(中国);粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony stimulating factor,GM-CSF)、TNF-α抗体及IL-4抗体购自Peprotech公司(美国);胎牛血清(fetal bovine serum,FBS)溶液、胰蛋白酶-EDTA购自Every Green公司(美国);脂多糖(lipopolysaccharide,LPS)抗体购自Sigma公司(日本);RNA提取试剂盒购自Axygen公司(美国);cDNA反转录试剂盒购自Roche公司(瑞士);酪氨酸羟化酶(tyrosine hydroxylase,TH)抗体、CD34抗体、NGF抗体、TH抗体、CD34抗体购自Boster公司(中国),VEGF抗体购自Bioss公司(中国),IgG-HRP二抗购自Zsbio公司(中国)。
1.3 实验方法
1.3.1 骨髓源性巨噬细胞的分离、培养和极化
原代细胞的分离和培养严格按照无菌程序进行,避免污染。采用颈椎脱位法处死6~8周龄健康雄性大鼠,固定于手术板上,收集股骨和胫骨放入75%(体积分数)乙醇消毒。割断长骨的末端,用1×PBS冲洗掉骨髓。用ACK 红细胞裂解液去除红细胞后,台式离心机(Eppendorf公司,德国)在4 ℃下离心30 min分离单核细胞,洗涤,重悬于含有10%(体积分数)热灭活的FBS,50 U/mL青霉素和50 mg/mL链霉素,10 ng/mL GM-CSF的DMEM溶液中,接种于培养皿中,密度为每10 cm培养皿中(每只乳鼠)培养细胞27×106个,并在37 ℃下在含有5%(体积分数)CO2的环境中培养过夜。第2天,将未贴壁或贴壁较弱的细胞回收,转移到新培养皿中并在上述相同条件下培养,贴壁的细胞被丢弃。每天监测培养情况,并定期补充新鲜培养基。培养7 d后,用PBS轻轻冲洗黏附的骨髓来源的巨噬细胞,并短暂暴露于胰蛋白酶-EDTA中获得巨噬细胞。LPS和TNF-α溶液培养24 h,使细胞极化至M1巨噬细胞,IL-4 溶液诱导24 h极化为M2巨噬细胞。
1.3.2 新生乳鼠建立心尖切除模型
取出生后第1天(P1)的新生乳鼠行心尖切除术,术后采用数字表法随机分为3组:对照组(仅手术组)、M1巨噬细胞植入组和M2巨噬细胞植入组。每一组至少有20只新生乳鼠。采用新生的P7乳鼠重复了所有的实验。
为了检测极化巨噬细胞对心肌再生和修复的影响,首先通过手术切除P1和P7新生乳鼠的左心室尖(约10%的心室心肌)建立心尖切除模型。切除体积。心尖切除手术模型成功的标志为心室腔暴露,心尖切口处流血,有血细胞聚集、血凝块形成,堵塞破损的心尖部缺口防止心室腔内的血液继续外流。
将P1或P7新生乳鼠置于冰床上进行低温麻醉,后固定于手术操作台上使乳鼠保持右侧卧位,在第四或第五肋间隙平行于肋间隙切开胸腔,钝性分离皮下组织及肌肉入胸,用显微手术剪剪除提起的心尖部肌肉组织,手术成功的标准为暴露出左心室腔,切除约10%心室心肌。切除结束时,将0.05 mL M1巨噬细胞局部注射到心尖切除部位作为M1巨噬细胞植入组,将0.05 mL M2巨噬细胞局部注射到心尖切除部位作为M2巨噬细胞植入组(图1),行心尖切除术但未植入巨噬细胞的作为对照组。手术后,缝合切口,并对新生乳鼠进行复温,使其完全恢复生命体征平稳。术后7 d,收集各组心脏组织进行组织学和分子分析。
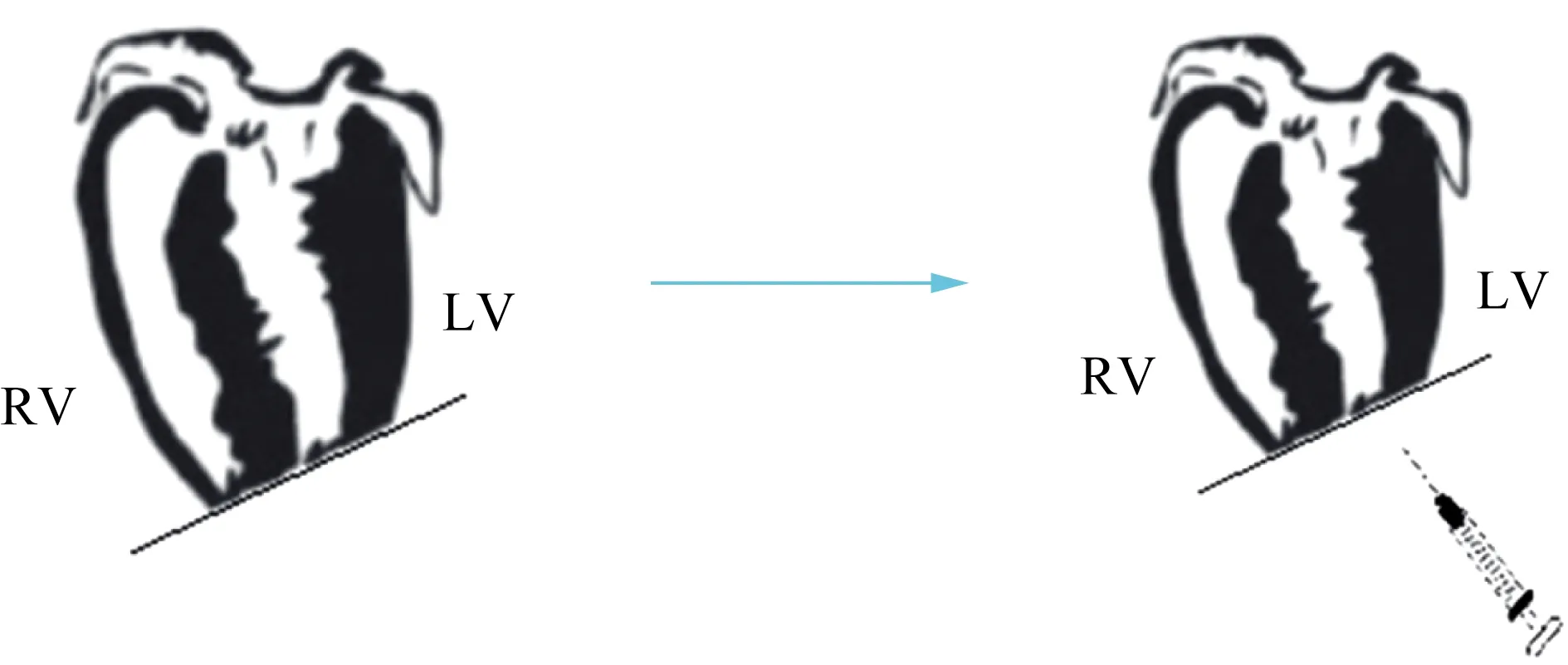
图1 新生乳鼠左心尖手术切除示意图
1.3.3 实时聚合酶链反应
使用RNA提取试剂盒从巨噬细胞或心肌组织中提取总RNA。用分光光度计测定RNA样品的数量和纯度。cDNA由罗氏第一链合成试剂盒反转录。采用实时荧光定量技术在梯度PCR仪器(赛默飞世尔科技公司,美国)上进行实时PCR。每个靶点的表达水平与管家基因β-actin或GAPDH的mRNA水平进行对照。
引物序列如下:CD163,正向: 5′-GGATTGCCCTATGACTGCTCT-3′,反向: 5′-TTGGACCGAAGATGATGAACTAC-3′;CD86,正向: 5′-GCTCGTAGTATTTTGGCAGGAC C-3′,反向: 5′-CGGGTATCCTTGCTTAGATGAGC-3′;β-actin,正向: 5′-CGTAAAGACCTCTATGCCAACA-3′,反向: 5′-CGGACTCATCGTACTCCTGCT-3′;IL-6,正向: 5′-AGAAGACCAGAGCAGATTTT-3′,反向: 5′-GAGAAAAGA GTTGTGCAATG-3′;IL-1β,正向: 5′-GGGATGATGACGA CCTGC-3′,反向: 5′-CCACTTGTTGGCTTATGTT-3′;趋化因子配体-3[chemokine(C-C motif)ligand-3,CCL-3],正向: 5′-CATGGCGCTCTGGAACGAA-3′,反向: 5′-TG CCGTCCATAGGAGAAGCA-3′;VEGF,正向: 5′-AGAAAG CCCATGAAGTGGTGA-3′,反向: 5′-CTTCATCATTGCAGCAGCCC-3′;NGF,正向: 5′-TCGCTCACTCCACTATCCA CTA-3′,反向: 5′-GACTCAACAGGGCAAGCATAC-3′; GA PDH,正向: 5′-AGATCCACAACGGATACATT-3′,反向:5′-TCCCTCAAGATTGTCAGCAA-3′。
1.3.4 HE染色
将新生乳鼠心脏组织固定在10%(质量分数)甲醛溶液中,用不同浓度乙醇(75%、85%、95%,无水)脱水,石蜡包埋,切成5 μm切片,置于载玻片上。随后常规脱蜡,苏木精-伊红染色。玻片脱水后密封,室温保存。在显微镜下观察并记录组织学形态。
1.3.5 免疫组织化学
乳鼠心脏组织在10%(质量分数)甲醛和石蜡包埋中固定至少24 h。垂直于心外膜切开4 μm的透壁切片,安装在带电载玻片上,按标准程序进行染色。简言之,将石蜡切片脱蜡并再水化。根据标准程序回收抗原。切片在4 ℃孵育过夜,一抗如下:TH抗体(1∶100),CD34抗体(1∶100),VEGF抗体(1∶400),NGF抗体(NGF,1∶10)。24 h后,冲洗玻片,室温下用IgG-HRP二抗孵育15 min。采用计算机辅助图像分析系统(Imagepro Plus 6.0软件)测定血管、神经、VEGF、NGF密度,计算积分吸光度(integral optical dens,A)平均值。
1.3.6 免疫荧光染色
心脏组织用液氮冷冻,4%(质量分数)多聚甲醛固定,切成10 μm厚的冷冻切片。切片在室温封闭液中孵育1 h,然后用TH抗体(1∶10)或CD34抗体(1∶10)在4 ℃孵育过夜。PBS冲洗3次,室温下用含0.5%(体积分数)Triton X-100的PBS溶液稀释TRITC标记的山羊抗兔IgG(H+L)孵育。1 h后,PBS冲洗3次,DAPI孵育10 min,干燥后盖上盖玻片进行评价。使用计算机辅助图像分析系统(Imagepro Plus 6.0)测量荧光强度。
1.4 统计学方法
2 结果
2.1 M1和M2巨噬细胞的极化和特征
用GM-CSF分离培养大鼠骨髓源性巨噬细胞(bone marrow-derived macrophages,BMDM)7 d。培养后1 d,大部分细胞黏附在培养板上,外观呈纺锤形、长梭形和多边形形态。培养7 d,细胞增生良好,保持梭形形态,细胞群呈放射状排列的同心圆状生长,这是巨噬细胞的典型生长特征。培养7 d后,分别加入LPS + TNF-α和IL-4,使细胞极化至M1巨噬细胞和M2巨噬细胞。LPS + TNF-α刺激24 h后,细胞呈长梭形,伪足细长,与M1巨噬细胞的形态特征一致。IL-4刺激后,细胞变大变圆,伪足变短,呈现M2巨噬细胞的特征(图2)。
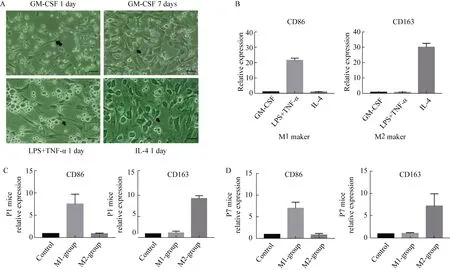
图2 M1和M2巨噬细胞体外极化结果
采用反转录聚合酶链反应(reverse transcription polymerase chain reaction,RT-PCR)检测极化后的巨噬细胞标志物,其中M1巨噬细胞为CD86,M2巨噬细胞为CD163。与形态变化一致的是,IL-4极化后的细胞显示出M2巨噬细胞标志物CD163的升高;而M1巨噬细胞的标志物CD68在IL-4的刺激下没有变化。LPS+TNF-α处理显著刺激了极化细胞中CD68的表达,而不是CD163的表达(图2B)。
2.2 M2巨噬细胞促进心脏损伤后心肌再生和修复
术后7 d,一系列的组织学分析显示,血凝块首先出现在切除部位,并逐渐被吸收,切除区域心肌组织充盈。新生心肌细胞在P1乳鼠中的排列比在P7新生儿中的排列更有序。在P1乳鼠受损心肌组织中也观察到较少的炎性反应细胞(图3A)。
术后7 d心尖切除部位再生心肌组织中,M1巨噬细胞标志物CD68 在M1巨噬细胞植入组检测到的表达水平明显高于对照组和M2巨噬细胞植入组;M2巨噬细胞标志物CD163在M2巨噬细胞植入乳鼠中显著增加,而在其他两组乳鼠中几乎不增加(图2C和2D)。
术后7 d HE染色结果显示,在P1和P7乳鼠中,M2巨噬细胞的植入显著改善了心肌的再生和修复(图3A)。与对照组相比,M2巨噬细胞的植入能显著促进受损心肌组织的再生和修复,心肌细胞组织有序,免疫细胞浸润较少,纤维化程度下降。而M1巨噬细胞植入组乳鼠心肌细胞排列紊乱,大量吞噬细胞和淋巴细胞浸润弥散分布,间质中含铁血黄素淤积。P1和P7乳鼠组织再生区心肌细胞含量按照M1植入组、对照组和M2植入组的顺序而增加;M1巨噬细胞植入组乳鼠的炎性细胞数量呈现相反的顺序:M1巨噬细胞植入组>对照组>M2巨噬细胞植入组(图3A)。
2.3 M2巨噬细胞可抑制心肌组织损伤引起的炎性反应
与对照组相比,M1巨噬细胞植入组乳鼠的3种主要炎性反应因子IL-6、IL-1β和CCL-3浓度显著升高。然而,M2巨噬细胞植入通过降低IL-6、IL-1β和CCL-3浓度来拮抗炎性反应(图3B)。
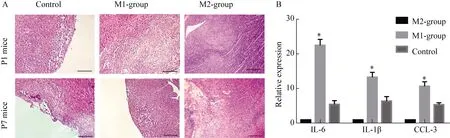
图3 M2巨噬细胞促进受损心肌组织的再生和修复
2.4 巨噬细胞极化影响血管生成和交感神经支配
P1和P7乳鼠术后7 d M2巨噬细胞植入组均显著增加新生血管和交感神经数量;M1巨噬细胞植入组乳鼠的组织再生区血管和神经较对照组少。此外,在所有实验个体中,P1乳鼠在血管和交感神经再生方面表现出比P7乳鼠更强的能力(图4)。免疫组织学观察结果表明,P1乳鼠组织再生区交感神经A平均值分别为:对照组252.30±13.56、M1巨噬细胞植入组109.90±5.17、M2巨噬细胞植入组397±14.77,M1、M2两组与对照组比较,差异有统计学意义;3组血管A平均值分别为:对照组166.7±3.93、M1巨噬细胞植入组93.37±2.52(P<0.05)、M2巨噬细胞植入组243.8±26,M1、M2两组与对照组比较,差异有统计学意义(P<0.05)。P7乳鼠组织再生区交感神经A平均值分别为:对照组145.4±3.52、M1巨噬细胞植入组56.03±8.20、M2巨噬细胞植入组216±13.07,M1、M2两组与对照组比较,差异有统计学意义(P<0.05);3组血管A平均值分别为:对照组109.8±6.37、M1巨噬细胞植入组55.51±8.07、M2巨噬细胞植入组169.8±11.91,M1、M2两组与对照组比较,差异有统计学意义(P<0.05)。
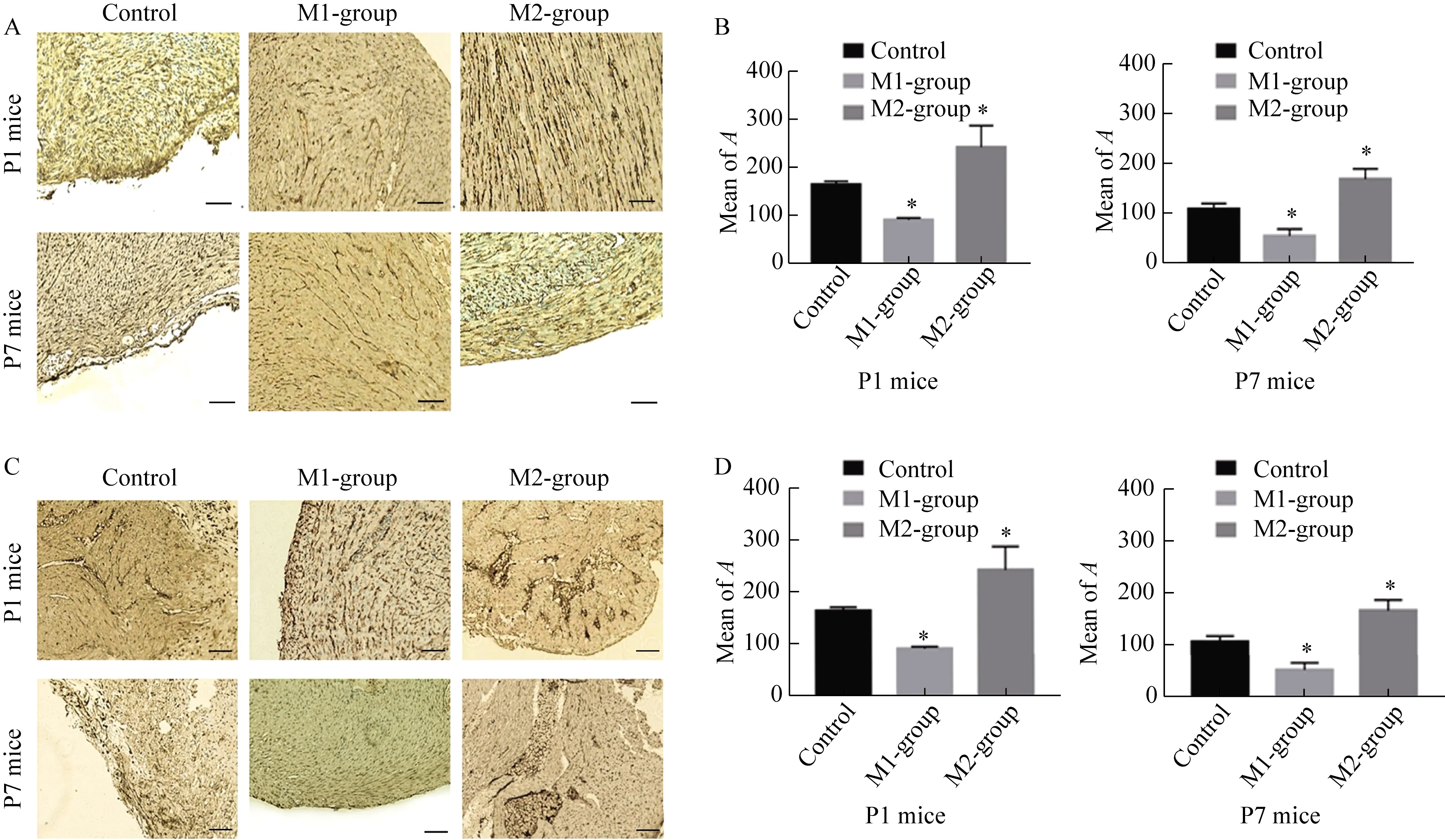
图4 M1、M2巨噬细胞植入后7 d,P1和P7乳鼠再生心肌组织血管和交感神经的变化
2.5 M2巨噬细胞通过释放生长因子促进交感神经支配和血管再生
对P7乳鼠进行心尖切除术,将等量的M2巨噬细胞植入受损心肌组织的损伤区(距切缘1 mm以内)和边界区(距切缘1~2 mm)。术后7 d,分别测定心尖损伤区和边界区交感神经和血管的分布。在损伤区,M2巨噬细胞植入可显著增加血管生成和交感神经支配。对照组和M2巨噬细胞植入组乳鼠血管A平均值分别为188.3±12.41和139.7±5.78,两组比较,差异有统计学意义(P<0.05);对照组和M2巨噬细胞植入组交感神经A平均值分别为576.3±43.32和339.7±23.9,两组比较,差异有统计学意义(P<0.05)。在边界区,M2巨噬细胞植入也触发了新生血管生成和交感神经支配,但强度较低。对照组和M2巨噬细胞植入组乳鼠边界区血管A平均值分别为100±2.52和86.33±8.01,两组比较,差异有统计学意义(P<0.05); 对照组和M2巨噬细胞交感神经A平均值分别为113±5.51和85.67±6.19,两组比较,差异有统计学意义(P<0.05)(图5)。

图5 观察P7乳鼠切除部位及边缘区M2巨噬细胞植入后血管及交感神经的变化
组织中VEGF和NGF的浓度,与对照组相比,M2巨噬细胞的植入显著提高了再生心肌组织中VEGF和NGF浓度,这两种因子浓度的增加与植入巨噬细胞的数量密切相关(图6)。
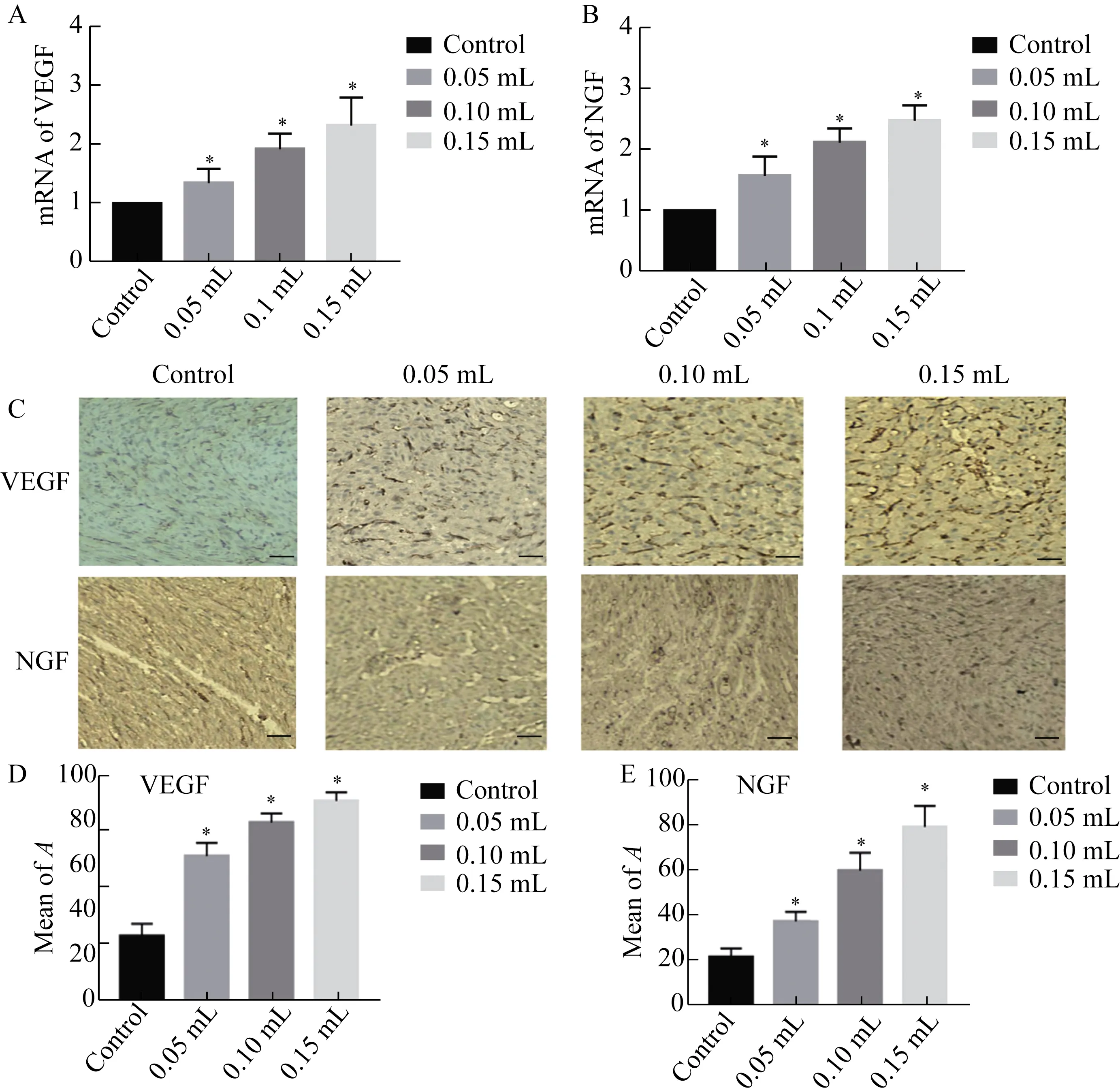
图6 M2巨噬细胞植入后再生心肌组织中VEGF和NGF变化
3 讨论
在新生哺乳动物(如乳鼠和猪)的心脏中,已经观察到心脏损伤后的有效和完整的再生[4-10],尽管这种再生能力在出生后一段时间后迅速减弱。然而,在一定条件下,成年哺乳动物心脏也可能保留心肌细胞更新的能力。例如,缺氧预处理的成年小鼠在心肌梗死后[35]有很强的再生反应和更少的纤维化,再生心肌细胞来源于原始心肌细胞。到目前为止,尚不清楚新生哺乳动物心脏为何具有再生潜能,因此,了解启动心肌再生的关键事件对于设计有效修复受损心肌组织从而恢复心功能的新方案至关重要。
巨噬细胞在心肌再生中起着关键作用,Aurora等[36]应用巨噬细胞耗竭模型证实巨噬细胞耗尽的新生乳鼠在心肌损伤后无法再生心肌并形成纤维化瘢痕,心脏功能降低。与此观察一致,本研究中M2巨噬细胞植入有利于心尖切除后心肌再生,心肌再生组织中心肌细胞增多,炎性反应细胞减少,纤维化减少。然而,M1巨噬细胞通过更多的炎性反应细胞、更少的心肌细胞和更强的纤维化抑制心脏再生。这些现象可能与两种极化巨噬细胞的固有特性有关。M1巨噬细胞是通过分泌炎性反应细胞因子的促炎表型,而M2巨噬细胞具有抗炎功能。事实上,在本研究中,当M1巨噬细胞植入心脏组织时,炎性反应因子IL-1β、IL-6和CCL-3显著升高;与对照组相比,M2巨噬细胞植入显著降低了这些炎性反应因子,可能导致更有效的心肌再生和修复。在成人心脏中,M1巨噬细胞数量在心肌梗死后第3天达到峰值,然后M2巨噬细胞数量随着M1巨噬细胞数量的减少而增加,在心肌梗死后第5~7天[6-10,31]达到峰值。M2巨噬细胞激活成年损伤心脏的成纤维细胞,导致纤维化瘢痕的形成,增强受损心脏的脆弱心室壁[28-30]。M2巨噬细胞有利于新生心脏心肌再生或触发成年心脏瘢痕形成可能取决于不同的微环境线索,有待进一步研究。
越来越多的证据[5,35]表明,心肌损伤后的再生和修复需要血管新生和交感神经支配。新生哺乳动物心脏损伤后,如心尖切除[5]、冰冻[35]、心肌梗死等,新生血管大量形成,心肌组织再生修复,心肌功能恢复。交感神经支配对心肌再生和修复也是必不可少的,因为去交感神经支配能够完全抑制新生心脏[31]损伤后的心肌再生。本研究还证实了新生血管和交感神经在P1和P7新生乳鼠心尖切除后的再生组织中的功能是强大的。此外,相比较M1巨噬细胞,M2巨噬细胞植入受损心肌组织后可显著促进新生血管生成和交感神经支配,导致更强劲的心肌再生和修复。在心肌梗死成年乳鼠中诱导VEGF表达可以诱导血管生成,从而改善组织周转和心功能恢复[37]。心脏和其他组织中的神经生长因子是决定交感神经系统[38]神经支配密度的关键因素,在手术切除的犬心脏[39]中,神经生长因子的增加可以增强交感神经支配。在本研究中,M2巨噬细胞以剂量依赖性的方式显著诱导损伤组织中VEGF和NGF的升高,这可能有助于M2巨噬细胞介导的心肌再生。
本研究结果表明巨噬细胞极化可能通过调节新生血管和交感神经支配影响新生乳鼠心肌的再生和修复。M2巨噬细胞促进心肌再生;M1巨噬细胞抑制心脏修复。因此,调控巨噬细胞M2/M1比例可能是心肌受损后心肌组织修复的新策略。
