微波辅助提取猕猴桃果渣总黄酮及其抗氧化活性
2022-06-28李金辉翁贵英朱淼张泽敏周晓玉王绪英
李金辉,翁贵英,朱淼,张泽敏,周晓玉,王绪英
(1.六盘水师范学院化学与材料工程学院,贵州 六盘水 553004;2.六盘水师范学院生物科学与技术学院,贵州 六盘水 553004)
猕猴桃(Actinidia chinensis Planch),又称奇异果,俗称毛桃、阳桃、山洋桃、毛梨桃等,为原产于中国的古老野生藤本果树。猕猴桃不但含有丰富的维生素,还含有钙、钾、硒、锌、锗等微量元素和人体所需17种氨基酸,被誉为“水果之王”[1]。果渣与鲜果相比,虽然营养组分大量流失,但仍然含有较多的蛋白质、纤维素、维生素、黄酮类化合物和矿物质等营养成分[2]。黄酮类化合物具有较强的抗氧化性、抗炎抑菌、抗肿瘤、抗辐射、抗类风湿关节炎、免疫调节、预防保护心血管等作用,临床上可用于治疗脑供血不足、脑出血所致后遗症、高黏脂血症、脑血栓、冠心病、心绞痛等疾病,且能够通过不同的信号通路调控自噬进而干预炎症、肝病、心血管疾病、神经退行性疾病等慢性疾病[3-7]。
近年来有很多关于沙棘果渣、苹果果渣、蓝莓果渣、葡萄果渣、红枣果渣以及刺梨果渣的研究,但未见猕猴桃酿酒果渣的相关研究[8-13]。贵州六盘水的红心猕猴桃有“神奇美味果,红色软黄金”的美誉,获得农业部“农产品地理标志”认证,国家质检总局批准其为“国家地理标志保护产品”。本研究采用微波辅助技术提取猕猴桃酿酒发酵后的果渣中黄酮类化合物,采用响应面法设计优化提取工艺条件,并探索猕猴桃果渣总黄酮提取物的抗氧化活性[14-18],为猕猴桃酿酒果渣“废物再利用”,开发绿色、安全的天然抗氧化剂提供参考。
1 材料与方法
1.1 材料与仪器
猕猴桃果渣(酿酒发酵后的果渣):六盘水凉都猕猴桃产业股份有限公司;芦丁标准品(色谱纯):上海源叶生物科技有限公司;抗坏血酸:上海试四赫维化工有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH):梯希爱(上海)化成工业发展有限公司;2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸[2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS]:安徽酷尔生物工程有限公司;氢氧化钠、亚硝酸钠:成都金山化学试剂有限公司;硝酸铝:天津科密欧化学试剂有限公司;无水乙醇:上海国药集团化学试剂有限公司。以上试剂均为分析纯。
双光束紫外可见分光光度计(TU-1901)、纯水仪(New Human Power I):北京普析通用仪器有限公司;常压微波合成/萃取反应工作站(MAS-II型):上海新仪微波化学科技有限公司;电热鼓风干燥箱(101型):北京科伟永兴仪器有限公司;电子天平(ME104):梅特勒-托利多仪器(上海)有限公司;高速离心机(TG18K):长沙东旺实验仪器有限公司。
1.2 方法
1.2.1 猕猴桃果渣总黄酮提取工艺
将猕猴桃果渣于50℃干燥箱中烘至恒重,粉碎后过60目筛,置于聚乙烯样袋密封保存备用。准确称取一定量猕猴桃果渣,设置常压微波合成/萃取反应工作站的微波功率为400 W,以1∶60(g/mL)的料液比加入一定浓度的乙醇溶液,在一定温度、一定时间下进行提取,提取液在6 000 r/min离心10 min后取上清液,定容至50 mL,得到猕猴桃果渣总黄酮提取液。
1.2.2 总黄酮含量测定
准确称取芦丁标准品10 mg,用60%乙醇溶液定容至100 mL,得到浓度为100 μg/mL的芦丁标准液。分别移取 100 μg/mL 芦丁标准液 0、1.0、2.0、3.0、4.0、5.0 mL于10 mL容量瓶中;分别补充60%的乙醇溶液至5.0 mL;再加入5% NaNO2溶液0.3 mL,摇匀,放置6 min后,加入10% Al(NO3)3溶液0.3 mL,再摇匀,放置6 min后,加入4% NaOH溶液4.0 mL,最后用60%乙醇溶液定容,摇匀放置15 min。于510 nm处分别测定其吸光度,绘制芦丁标准曲线,得到拟合线性方程:y=0.010 3x-0.000 8(R2=0.999 8)。移取猕猴桃果渣总黄酮提取液1 mL,按芦丁标准曲线方法步骤操作,根据下式计算猕猴桃果渣总黄酮提取率[19]。
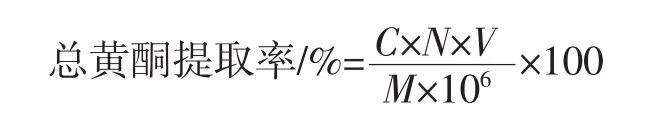
式中:C为总黄酮质量浓度,μg/mL;N为稀释倍数;V为提取液体积,mL;M为猕猴桃果渣质量,g。
1.2.3 单因素试验
将猕猴桃果渣分别按照以下3个单因素试验进行总黄酮的提取:乙醇浓度30%、40%、50%、60%、70%、80%,提取温度60℃,提取时间15 min;提取温度30、40、50、60、70、80 ℃,乙醇浓度 50%,提取时间 15 min;提取时间 5、10、15、20、25、30 min,提取浓度 50%,提取温度60℃。以上试验均固定料液比1∶60(g/mL),微波功率400 W。
1.2.4 响应面优化试验
基于单因素试验结果,以总黄酮提取率为响应值,选取乙醇浓度、提取温度、提取时间为自变量,利用Design-Expert8.05b软件进行响应面优化试验,响应面试验因素水平见表1。
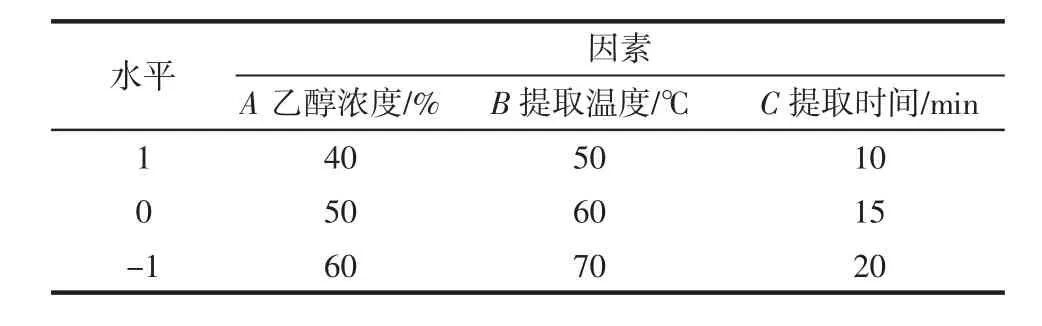
表1 响应面试验因素水平Table 1 Factors and levels of the response surface experiment
1.2.5 抗氧化试验
以DPPH·和ABTS+·清除率为指标考察猕猴桃果渣总黄酮的抗氧化活性[20]。
1.2.5.1 DPPH·清除能力测定
将猕猴桃果渣总黄酮提取物稀释至不同浓度,每个浓度的样品取1mL于比色管中,加入3mL50.0μg/mL的DPPH溶液,充分混合均匀后,在10℃避光条件下反应30 min,于517 nm处测定吸光度。根据下式计算猕猴桃果渣总黄酮的DPPH·清除率。

式中:As为样品溶液与DPPH溶液混合液的吸光度;Ac为样品溶液与无水乙醇混合液的吸光度;Ab为DPPH溶液与无水乙醇混合液的吸光度。
1.2.5.2 ABTS+·清除能力测定
称取ABTS400.0mg,过硫酸钾68.8mg,溶于100mL去离子水中,摇匀,10℃避光放置24 h后,作为ABTS母液。取适量ABTS母液,用95%乙醇稀释至734 nm处吸光度为0.70±0.02,作为ABTS测定溶液,现配现用。将猕猴桃果渣总黄酮提取物稀释至不同浓度,每个浓度的样品取0.4 mL于比色管中,加入3.6 mL ABTS溶液,充分混合均匀后,在10℃避光条件下反应5 min,于734 nm处测定吸光度。根据下式计算猕猴桃果渣总黄酮的ABTS+·清除率。

式中:Ab为ABTS溶液与95%乙醇混合液的吸光度;As为样品溶液与ABTS溶液混合液的吸光度。
1.3 数据处理
采用Excel 2016软件处理数据并绘图。采用Design-Expert8.05b软件进行响应面分析。
2 结果与分析
2.1 单因素试验结果
2.1.1 不同乙醇浓度对猕猴桃果渣总黄酮提取率的影响
乙醇浓度对总黄酮提取率的影响见图1。续试验。
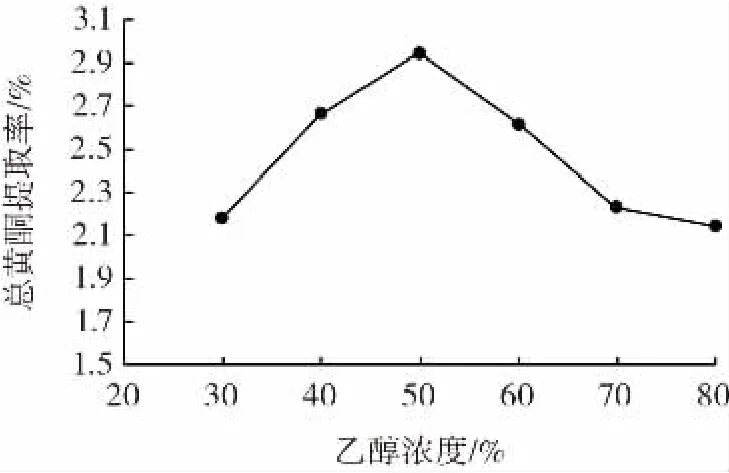
图1 乙醇浓度对猕猴桃果渣总黄酮提取率的影响Fig.1 The effect of ethanol concentration on the yield of total flavonoids from kiwi fruit residues
2.1.2 不同提取温度对猕猴桃果渣总黄酮提取率的影响提取温度对总黄酮提取率的影响见图2。
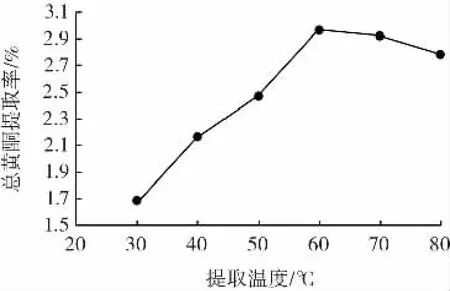
图2 提取温度对猕猴桃果渣总黄酮提取率的影响Fig.2 The effect of extraction temperatureon the yield of total flavonoids from kiwi fruit residues
由图1可知,乙醇浓度小于50%时,猕猴桃果渣总黄酮提取率随乙醇浓度的增大而提高,可能是乙醇浓度的增加有利于黄酮类物质溶出;当乙醇浓度大于50%时,总黄酮提取率随乙醇浓度的增大而降低,可能是溶剂的极性变小,导致黄酮类物质溶出量减少;乙醇浓度为50%时,猕猴桃果渣总黄酮提取率最高,为2.94%。因此,选择乙醇浓度为40%、50%、60%进行后
由图2可知,提取温度小于60℃时,猕猴桃果渣总黄酮提取率随提取温度的升高而提高,可能因为提取温度升高可加快分子扩散速率,从而促进黄酮类物质析出;当提取温度大于60℃时,总黄酮提取率随提取温度的升高反而降低,可能是因为提取温度过高会破坏部分黄酮类物质结构并促进其它非黄酮物质析出;提取温度在60℃时,猕猴桃果渣总黄酮提取率最高,为2.96%。因此,选择提取温度为50、60、70℃进行后续试验。
2.1.3 不同提取时间对猕猴桃果渣总黄酮提取率的影响
提取时间对总黄酮提取率的影响见图3。

图3 提取时间对猕猴桃果渣总黄酮提取率的影响Fig.3 The effect of extraction time on the yield of total flavonoids from kiwi fruit residues
由图3可知,提取时间小于15 min时,猕猴桃果渣总黄酮提取率随提取时间的延长而提高,这是由于提取时间短,黄酮类化合物未能充分溶出;当提取时间大于15 min时,总黄酮提取率随提取时间的延长反而降低,这是由于提取时间过长,溶出的黄酮类化合物易分解,导致总黄酮提取率下降;提取时间为15 min时,猕猴桃果渣总黄酮提取率最高,为2.93%。因此,选择提取时间为10、15、20 min进行后续试验。
2.2 响应面法优化提取工艺条件
2.2.1 回归模型的建立与分析
基于单因素试验结果,采用Box-Behnken原理设计响应面试验,试验方案及结果见表2。
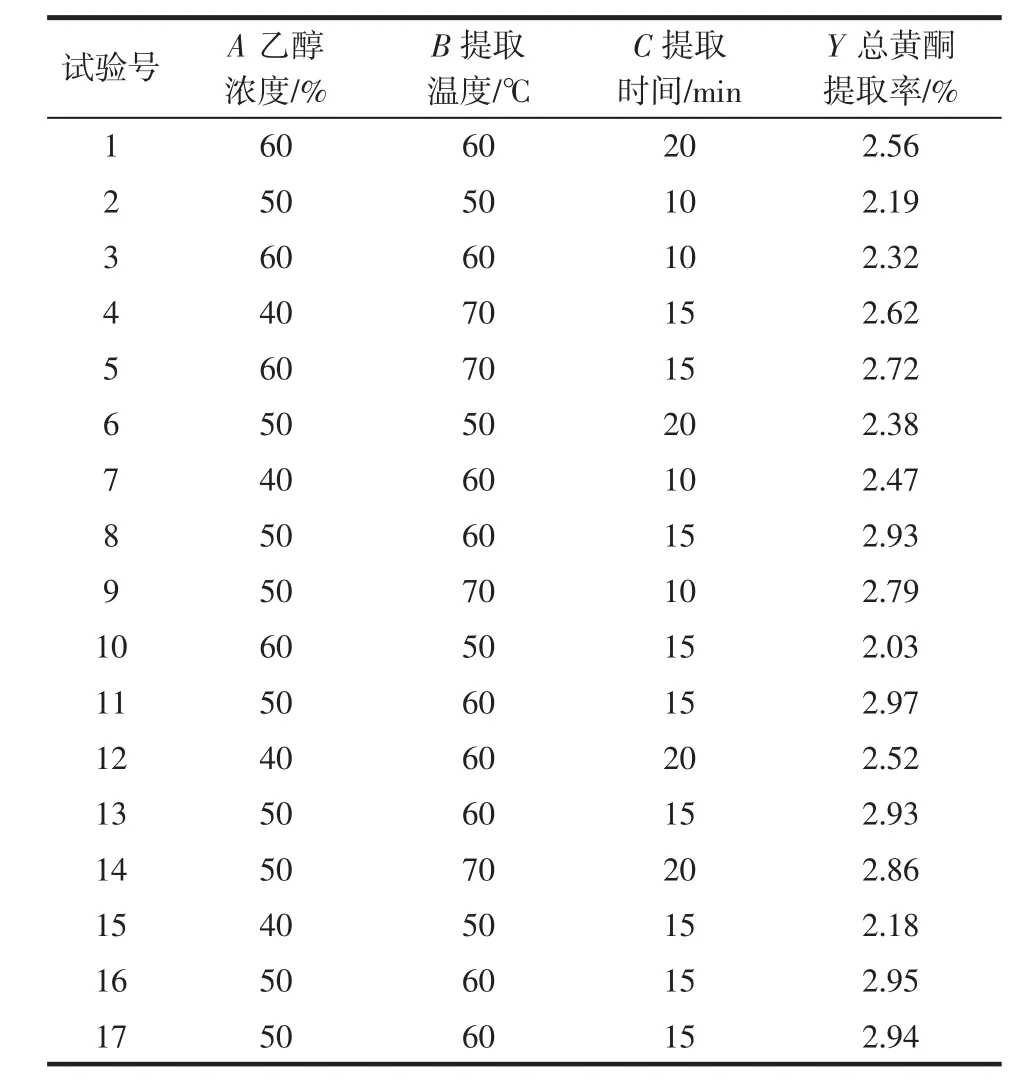
表2 响应面试验设计与结果Table 2 Design and results of response surface experiment
通过Design-Expert8.05b对数据进行分析回归拟合,得到回归方程为Y=-14.654 75+0.268 25A+0.286 78B+0.187 65C+6.250 00×10-4AB+9.500 00×10-4AC-6.000 00×10-4BC-3.220 00×10-3A2-2.345 00×10-3B2-6.18000×10-3C2。对拟合方程进行方差分析,结果见表3。
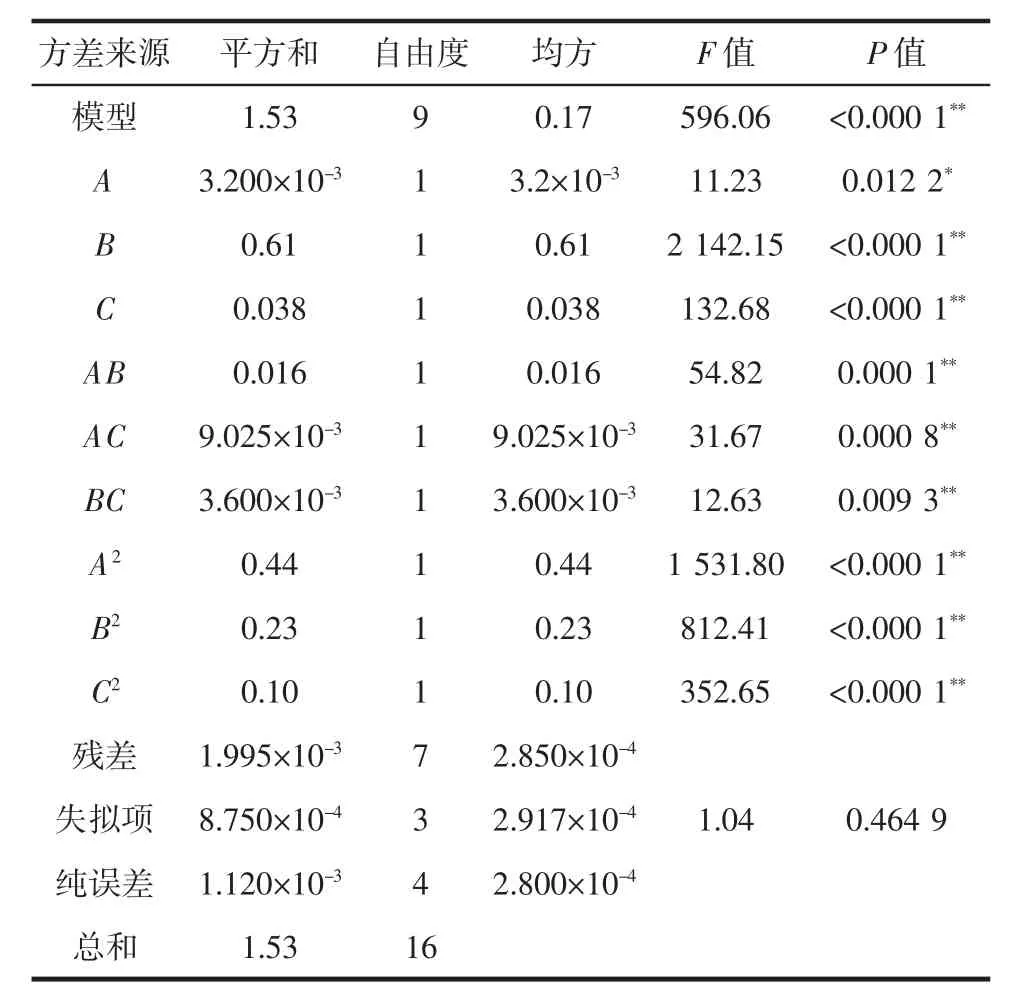
表3 回归模型方差分析Table 3 Variance analysis of regression model
由表3可知,该回归模型P<0.000 1差异极显著,失拟项P=0.464 9,没有显著性差异,表明该回归模型与真实值拟合度较高。模型中 B、C、AB、AC、BC、A2、B2、C2表现为差异极显著,A表现为差异显著,3个因素对猕猴桃果渣总黄酮提取率的影响大小顺序为B>C>A,即提取温度>提取时间>乙醇浓度。
2.2.2 响应面图与等高线图分析
各因素交互作用对总黄酮提取率影响的等高线图和响应面图见图4~图6。

图4 乙醇浓度和提取温度交互作用对总黄酮提取率的影响Fig.4 Effects of the interaction of ethanol concentration and extraction temperature on the yield of total flavonoids

图5 乙醇浓度和提取时间交互作用对总黄酮提取率的影响Fig.5 Effects of the interaction of ethanol concentration and extraction time on the yield of total flavonoids
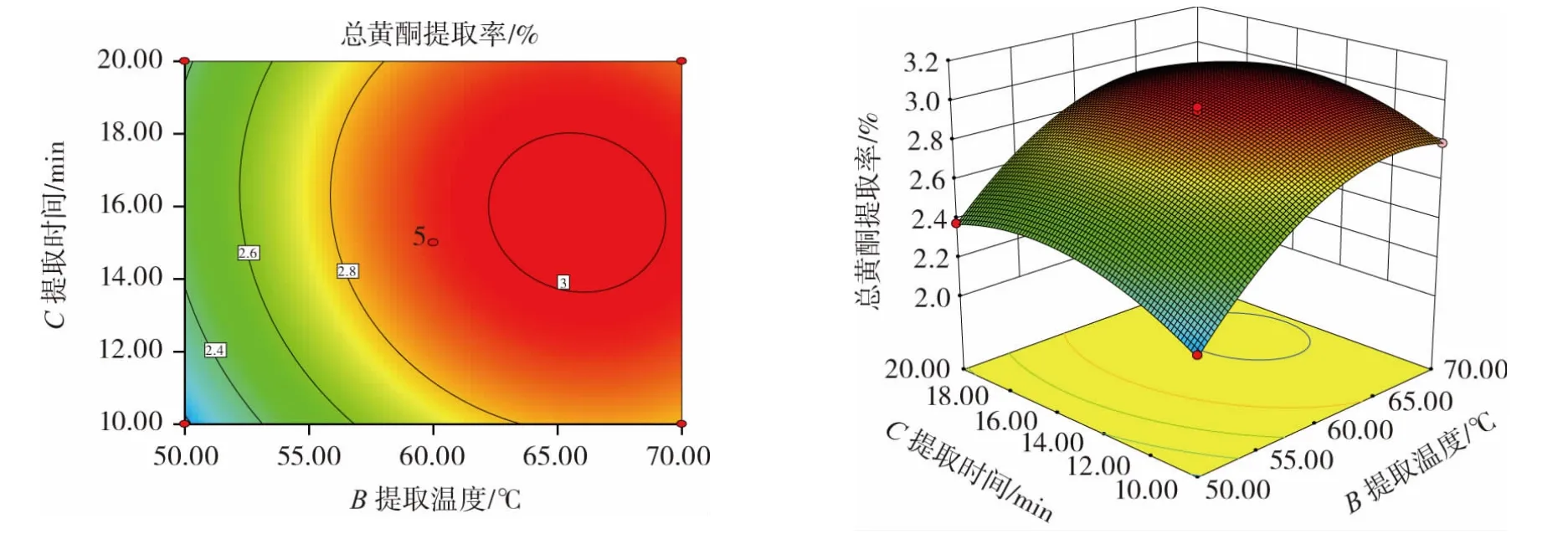
图6 提取温度与提取时间交互作用对总黄酮提取率的影响Fig.6 Effects of the interaction of extraction temperature and extraction time on the yield of total flavonoids
由图4~图6可知,AB、AC、BC交互作用的各响应面坡度陡峭,等高线均呈椭圆形,说明他们之间的交互作用对猕猴桃果渣总黄酮提取率影响较大,与方差分析结果一致。
2.3 最佳提取条件的确定及验证试验
使用Design-Expert8.05b得到猕猴果渣总黄酮最佳提取工艺为乙醇浓度50.39%、提取温度65.83℃、提取时间15.86 min,此条件下总黄酮提取率为3.03%。根据试验操作的可行性,修正提取工艺条件为乙醇浓度50%、提取温度66℃、提取时间16 min,进行3次平行试验,得到猕猴桃果渣总黄酮平均提取率为3.02%,与预测值的相对标准偏差为0.33%。
2.4 猕猴桃果渣总黄酮提取物抗氧化活性
2.4.1 DPPH·清除能力
猕猴桃果渣总黄酮提取物和VC的DPPH·清除能力见图7。
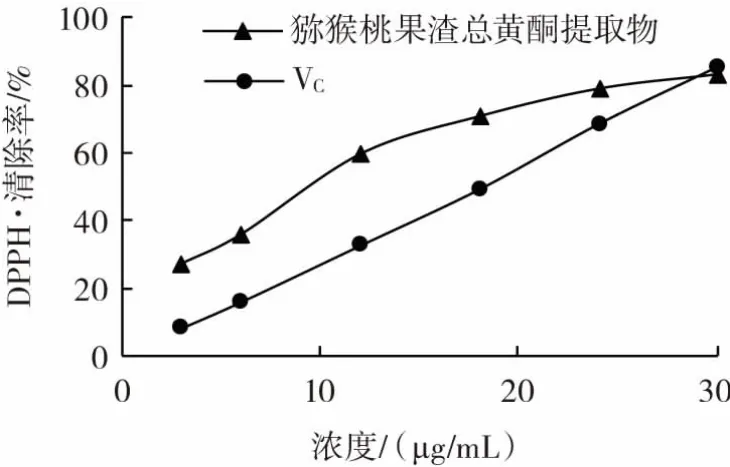
图7 猕猴桃果渣总黄酮提取物和VC的DPPH·清除能力Fig.7 DPPH·scavenging abilities of total flavonoids from kiwi fruit residues and ascorbic acid
由图7可知,猕猴桃果渣总黄酮提取物与VC对DPPH·的清除能力均随浓度的增大而增强,在浓度小于30.16 μg/mL时,猕猴桃果渣总黄酮提取物DPPH·清除能力优于同浓度VC溶液,在浓度为30.16 μg/mL时,VC溶液DPPH·清除能力较猕猴桃果渣总黄酮提取物略高。
2.4.2 ABTS+·清除能力
猕猴桃果渣总黄酮提取物和VC的ABTS+·清除能力见图8。
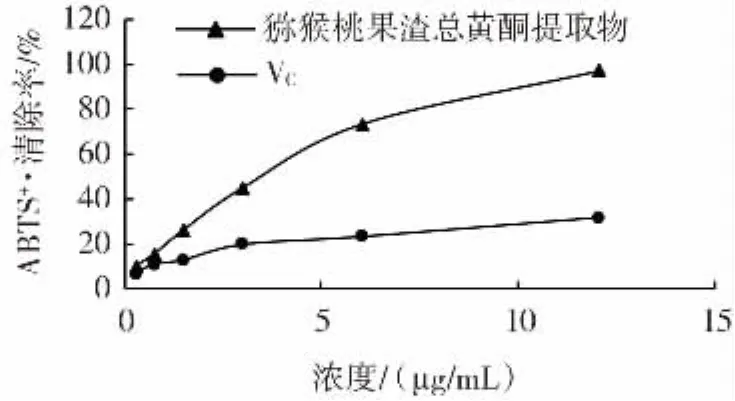
图8 猕猴桃果渣总黄酮提取物和VC的ABTS+·清除能力Fig.8 ABTS+·scavenging abilities of total flavonoids from kiwi fruit residues and ascorbic acid
由图8可知,猕猴桃果渣总黄酮提取物与VC对ABTS+·的清除能力随浓度的增大而增强,猕猴桃果渣总黄酮提取物ABTS+·清除能力优于同浓度VC溶液,在浓度为12.08 μg/mL时,猕猴桃果渣总黄酮提取物的ABTS+·清除率为 97.36%,VC溶液ABTS+·清除率为31.71%。猕猴桃果渣总黄酮提取物对ABTS+·清除能力远大于VC溶液。
3 结论
本试验以猕猴桃酿酒发酵后的果渣为研究对象,采用微波辅助法提取总黄酮,在考察乙醇浓度、提取温度、提取时间3个单因素基础上,通过响应面法对猕猴桃果渣总黄酮提取工艺进行优化。猕猴桃果渣总黄酮最佳提取工艺条件为乙醇浓度50%、提取温度66℃、提取时间16 min。在此条件下,总黄酮提取率为3.02%。猕猴桃果渣总黄酮提取物对DPPH·、ABTS+·具有不同程度的清除作用。表明猕猴桃酿酒发酵后的果渣具有较好的抗氧化活性,可为猕猴桃果渣再利用提供一定的参考依据。
