丛枝菌根真菌对玉米生育期土壤N2O排放的影响
2022-06-28张学林何堂庆张晨曦田明慧李晓立吴梅周亚男郝晓峰
张学林,何堂庆,张晨曦,田明慧,李晓立,吴梅,周亚男,郝晓峰
丛枝菌根真菌对玉米生育期土壤N2O排放的影响
张学林,何堂庆,张晨曦,田明慧,李晓立,吴梅,周亚男,郝晓峰
河南农业大学农学院/省部共建小麦玉米作物学国家重点实验室/2011河南粮食作物协同创新中心,郑州 450002
【目的】明确丛枝菌根真菌(arbuscular mycorrhizal fungi,AMF)影响玉米生育期土壤氧化亚氮(N2O)排放的机制,为增加玉米产量、提高氮素利用效率、减少温室气体排放提供理论依据。【方法】采用分室(生长室和菌丝室)箱体装置,盆栽设置氮肥用量(N1:180 kg N·hm-2;N2:360 kg N·hm-2)和丛枝菌根真菌(M0:作物根和AMF均不能从生长室进入菌丝室;M1:只有丛枝菌根真菌能从生长室进入菌丝室;M2:作物根和丛枝菌根真菌均能从生长室进入菌丝室)双因素试验,测定玉米生长期间植株生物量、植株氮素积累量、N2O排放量;采用Illumina平台Hiseq 2500 PE250高通量测序技术分析土壤细菌群落结构和多样性对丛枝菌根真菌的响应。【结果】氮肥用量和丛枝菌根真菌均显著影响玉米产量、植株生物量、植株氮素积累量和N2O排放量。不同氮肥用量条件下接种丛枝菌根真菌均显著增加玉米籽粒产量、植株生物量和氮素积累量。与M0相比,N1条件下M1和M2处理产量均值分别增加38%和82%,地上部氮素积累量增加30%和52%,无机氮含量减少26%和65%;N2条件下M1和M2处理籽粒产量分别增加16%和48%;地上部氮素积累量增加9%和33%,无机氮含量减少34%和55%。与M0相比, N1条件下M1和M2处理N2O累积排放量分别降低17%和40%,N2O排放强度分别降低41%和67%;而N2条件下N2O累积排放量降低26%和45%,排放强度分别降低28%和57%。NMDS 分析表明,施肥和丛枝菌根真菌均对细菌群落结构有较大影响。与N1均值相比,N2处理门水平变形菌门(Proteobacteria)和芽单胞菌门(Gemmatimonadetes)相对丰度分别降低6%和15%,而放线菌门(Actinobacteria)增加32%;属水平链霉菌()增加27%,芽单胞菌属()降低8%。与M0相比,N1条件下M1和M2处理的分别增加64%和205%,细菌丰度分别增加31%和53%;N2条件下M1和M2处理的分别增加10%和93%,M1处理的细菌丰度降低2%,M2处理细菌丰度增加56%。土壤中和与N2O排放量呈显著负相关,而与玉米产量呈显著正相关。【结论】不同氮肥水平玉米接种丛枝菌根真菌均能显著降低土壤N2O排放量,这种影响主要通过提高玉米氮素的吸收利用和改善土壤细菌群落组成实现的,其中主要增加了土壤链霉菌属和芽单胞菌属的相对丰度。
氮肥;丛枝菌根真菌;玉米;土壤氧化亚氮排放通量;土壤细菌
0 引言
【研究意义】氧化亚氮(N2O)是一种重要的温室气体,其温室效应约是CO2的298倍,对全球变暖的贡献约占全部温室气体的5%—6%[1-2];N2O还参与光化学反应,破坏大气臭氧层,增强紫外线辐射影响人体健康[3-5]。丛枝菌根真菌(arbuscular mycorrhizal fungi,AMF)能与地球上80%的植物包括各种作物形成丛枝菌根共生体,共生体不仅增强植物抗逆性,而且促进宿主植物吸收土壤磷、氮等养分,提高产量[6-8]。明确丛枝菌根真菌在土壤N2O排放方面的作用,对于提高作物产量、减少氮素流失具有重要意义。【前人研究进展】目前,国内外有关丛枝菌根真菌对土壤N2O等温室气体排放方面的研究相对较少,研究结果也不一致。CAVAGNARO等[9]在田间原位条件下利用15N示踪技术,以番茄突变体(不能被AMF侵染)和番茄野生型76R为材料,研究发现AMF显著促进了植物生长和养分获取,对N2O排放没有影响。BENDER等[10-11]分别设置灭菌土壤播种多花黑麦草后接种AMF或不接种AMF、添加AMF菌剂的土壤种植番茄野生型或番茄突变体两个完全不同的试验,发现接种AMF主要通过增加微生物固持氮素和植株氮素吸收显著降低N2O 的排放;LAZCANO等[12]采用盆栽试验,比较了不同含水量条件下野生型番茄和其突变体接种AMF后对N2O排放的影响,发现较高水分含量条件下AMF主要是提高了番茄水分利用效率,而不是促进了氮素吸收所致。ZHANG等[13]把接种AMF的水稻秧苗移栽到大田后进行原位测定,发现水稻田N2O排放通量降低。GUI等[14]利用分室箱体培养装置,以玉米为寄主植物,发现AMF通过降低土壤全氮含量,改变氮代谢相关基因的丰度,降低与反硝化过程相关的细菌类群的丰度,从而降低了玉米土壤N2O的排放。AMF一方面可能通过促进宿主植物侧根的形成和伸长,提高宿主对无机氮(NH4+)的吸收利用,降低转化为N2O的底物浓度,减少N2O的排放[15-17]。另一方面AMF 可能通过改变根际土壤微生物群落组成,影响土壤硝化和反硝化过程,进而调控N2O的排放[18]。土壤微生物尤其是细菌在陆地生态系统中负责调节养分生物地球化学循环,促进植物生长,维持生态系统稳定性[19-21]。【本研究切入点】针对AMF影响土壤N2O排放的机制,国内外科研人员主要从菌根改善植株生长和养分吸收入手,开展了大量研究[22-24]。土壤N2O排放是微生物介导的氮素生物地球化学循环过程[10,25],其中细菌在氮素循环过程中的作用是研究的关键[3]。目前关于土壤细菌对AMF响应的研究相对较少,AMF作用下细菌群落组成的变化与N2O排放之间的关系尚不明确。【拟解决的关键问题】采用盆栽试验,系统研究氮肥用量和丛枝菌根真菌交互作用对N2O排放的影响,分析土壤细菌群落组成对AMF的响应以及细菌群落组成变化在调控N2O排放方面的作用,为充分发挥AMF在降低温室气体排放、减少氮素流失、提高作物产量和氮素利用效率方面的作用,进而优化生物肥料管理提供理论依据。
1 材料与方法
1.1 试验地点和试验材料
本试验于2016和2017年6—10月玉米生育期,在河南省西平县二郎乡张尧村(114°02′E,33°20′N,平均海拔49 m)进行盆栽试验,土壤类型为砂姜黑土。该地区处于黄淮海平原南部,属于亚湿润大陆性季风气候,年平均气温15.2℃,无霜期220 d,年平均降雨量为852 mm。供试土壤取自于长期定位试验不施肥处理0—20 cm的耕层,避光自然风干后过2 mm筛备用。供试土壤基本理化性质为:全氮2.76 g·kg-1,有机质8.17 g·kg-1,碱解氮110 mg·kg-1,速效磷20 mg·kg-1,速效钾330 mg·kg-1,pH 6.81,砂粒39.09%,粉(砂)粒21.35%,黏粒39.56%。
供试菌种为摩西斗管囊霉(),由北京市农林科学院植物营养与资源研究所“AMF种质资源库”(Bank of glomeromycota in China,BGC)提供,以玉米为寄主植物进行扩繁,产生的菌剂包括相应的培养基质、孢子、根外菌丝以及植物根段等,其中菌剂孢子密度为30个/g。
1.2 试验设计
本试验为氮肥用量和丛枝菌根真菌(AMF)双因素设计,其中氮肥用量包括180 kg N·hm-2(N1)和360 kg N·hm-2(N2)两个水平。试验采用有机玻璃做成的分室箱体培养装置[25-26],装置规格为60 cm×20 cm×20 cm,中间用通透程度不同的隔板分成两个隔室:一个为生长室(HOST),用来种植宿主植物玉米,供试玉米品种为伟科702;另一个为菌丝室(TEST),接种AMF后用来测试菌根的功能。根据中间挡板薄膜通透性,将菌根因素分为3个水平,即对照(M0):生长室和菌丝室之间用网孔0.45 μm薄膜隔离,玉米根和AMF只能在生长室生长,不能通过挡板进入菌丝室;AMF处理(M1):生长室和菌丝室之间用网孔20 μm薄膜隔开,只允许AMF菌丝通过挡板进入菌丝室;有根有菌处理(M2):生长室和菌丝室之间用网孔0.46 cm尼龙网隔开,AMF和玉米根均可通过挡板进入菌丝室。共计6个处理,4次重复。试验开始前,按照土壤2 000 t·hm-2,小麦秸秆全量还田为6 700 kg·hm-2,计算出每个箱体的秸秆还田量,小麦秸秆、风干土与菌剂混合均匀后分布于箱体生长室和菌丝室并调整土壤容重为1.2 g·cm-3,每个箱体风干土总重为24 kg左右。玉米播种前挑选大小均匀一致的种子,用10 %的H2O2表面消毒,蒸馏水冲洗干净后于每年6月10日播种,每个生长室播种4粒种子,于三叶期留苗两株。全部磷肥(90 kg·hm-2)和钾肥(120 kg·hm-2)作为底肥于播种前与土壤充分混合施入,50%的氮肥于拔节期(播种后30 d)溶于蒸馏水追施,50%的氮肥于大喇叭口期(播种后60 d)溶于蒸馏水追施;玉米成熟期(10月5日)收获,并进行相关参数的测定分析。
1.3 样品采集与测定
N2O采用密闭式静态箱法采集。气体采样箱由箱体和底座组成。箱体为有机玻璃材质的长方体(规格为12 cm×12 cm×15 cm),箱体顶部安装一个通气阀;箱体底座(12 cm×12 cm×6 cm)上表面周围有1 cm宽的凹槽。采集气体时,首先将底座插入菌丝室土壤内,在凹槽中加上水,然后罩上箱体,形成一个密闭环境,用20 mL针筒从通气阀处抽取气体样品。播种后的第30、31、32、33、34、35、60、61、62、63、64、65、90、105天采集气体样品。一般于早上8:00罩上箱体,记录箱体内温度,密封1 h后,每个处理采集50 mL气体,装入气瓶带入实验室,用日本岛津气相色谱仪GC-2010 测定N2O的浓度。
(1)N2O排放通量计算公式为:
F=×H×Δc/Δt×273/(273+T)
式中,F为N2O排放通量(μg·m-2·h-1);为N2O标准状态下的密度(1.964 kg·m-3);H为采样箱高度(m);Δc/Δt为单位时间静态箱内的N2O气体浓度变化率(μg·L-1·h-1);T为测定时箱体内的平均温度(℃);
(2)N2O累积排放量计算公式为:
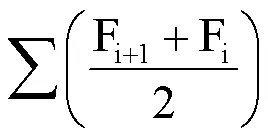
式中,M为N2O累积排放量(mg·m-2);F为N2O排放通量μg·m-2·h-1;i为采样次数;t为采样时间(d);24为一天小时数;
(3)N2O排放强度为:
I = M/Y×10
式中,I为N2O排放强度(kg·t-1),M为N2O累积排放量(mg·m-2),Y 为不同处理单位面积玉米籽粒平均产量(kg·hm-2)。
玉米收获后测定籽粒产量,植株地上部和根系生物量用烘箱105℃杀青30 min后,70℃烘干至恒重并称重。植株地上部和根系样品粉碎后用H2SO4- H2O2消煮,流动分析仪(AA3,SEAL-Analytical, Germany)测定全氮含量,并用植株生物量及其全氮含量计算玉米地上部和根系氮素积累量。采用流动分析仪测定玉米成熟期菌丝室(TEST室)土壤铵态氮和硝态氮含量;采用PHS-3E测定土壤pH,水土比为2.5﹕1。
1.4 DNA 提取、PCR扩增、测序和信息分析
将2016年玉米成熟期相同处理菌丝室土壤混合均匀并随机取土,采用CTAB 或SDS 方法对样本的基因组DNA 进行提取,之后利用琼脂糖凝胶电泳检测DNA的纯度和浓度,取适量的样品于离心管中,使用无菌水稀释样品至1 ng·µL-1。以稀释后的基因组DNA 为模板,选择鉴定细菌多样性的16S V4区引物(515F和806R)测序区域,使用带Barcode 的特异引物,New England Biolabs 公司的Phusion® High- Fidelity PCR Master Mix with GC Buffer,和高效高保真酶进行PCR扩增,并确保扩增效率和准确性。根据PCR产物浓度进行等量混样,充分混匀后使用2%的琼脂糖凝胶电泳检测PCR产物,对目的条带使用qiagen公司提供的胶回收试剂盒回收产物。
使用TruSeq® DNA PCR-Free Sample Preparation Kit建库试剂盒进行文库构建,构建好的文库经过Qubit和Q-PCR定量,文库合格后,由北京诺禾致源科技股份有限公司使用HiSeq 2500 PE250测序平台进行上机测序。
根据Barcode序列和PCR扩增引物序列从下机数据中拆分出各样品数据,进行去杂、拼接、过滤以及去除嵌合体等,得到有效序列(Effective tags),利用Uparse软件(Uparse v 7.0)对全部Effective Tags进行聚类,按照97%的相似性划分OTUs (Operatinal Taxonomic Units),同时选取OTUs出现频率最高的序列作为OTUs的代表序列,并基于软件Mothur(version 1. 36. 1)与SILVA(http://www.arb-silva.de/)的SSUrRNA数据库进行物种注释分析(设定阈值为0.8—1),获得不同分类水平上各样本的群落组成。使用MUSCLE(Version 3.8.31,http://www.drive5.com/ muscle/)软件进行快速多序列比对,得到所有OTUs代表序列的系统发生关系。最后,以样品中数据量最少的为标准进行均一化处理,后续的Alpha多样性分析和Beta多样性分析都是基于均一化处理后的数据。采用Qiime软件(Version 1.7.0)计算Alpha多样性指数如物种数(Observed-species),Chao1,香农指数(Shannon),辛普森指数(Simpson),覆盖度(Goods- coverage)等,其中Shannon 值越大说明物种的多样性越大;Simpson值越大,说明物种的均匀度越大;Chao1与ACE值越高说明种群物种的丰富度越高。Beta多样性分析采用Qiime软件(Version 1.7.0)计算Unifrac距离、构建UPGMA样品聚类树。
1.5 统计分析
采用Two way ANOVA分析氮肥用量和菌根处理之间玉米籽粒产量、植株氮素积累量、N2O排放总量和排放强度的差异显著性,并采用LSD进行多重比较。采用One way ANOVA 比较不同处理之间土壤细菌α多样性参数,如Species、OTU 数、Chao 1、Shannon和Simpson、Coverage。采用非度量多维尺度分析(non-metric multidimensional scaling,NMDS)确定细菌的群落结构差异(R 语言,v 3.6.3)。采用Pearson Correlation分析细菌门、纲、目、科、属5个水平的细菌群落多样性与玉米产量和N2O排放量之间的相关性,并做相关性热图。方差分析通过SPSS 25软件完成,并采用Sigmaplot 12.5进行作图。
2 结果
2.1 氮肥用量和菌根真菌对玉米产量、植株氮素积累量和土壤无机氮含量的影响
2016和2017两个试验年度氮肥用量和丛枝菌根真菌均显著影响玉米籽粒产量(表1)。与N1处理相比,2个试验年度N2处理玉米籽粒产量均值增加40%。与M0相比,N1条件下M1和M2处理产量均值分别增加38%和82%;N2条件下M1和M2处理籽粒产量分别增加16%和48%;AMF在N1和N2条件下对籽粒的贡献量分别为38%和16%。说明不同氮肥用量条件下AMF均能增加玉米籽粒产量,其中,低氮肥(N1)条件下AMF对产量的贡献量相对较高。与M0相比,N1条件下M1和M2两个处理地上部氮素积累量增加30%和52%,根系氮素积累量增加13%和66%;N2条件下M1和M2两个处理地上部氮素积累量增加9%和33%,根系氮素积累量增加9%和32%。表明不同氮肥用量条件下AMF均可以提高玉米植株氮素积累量,其中N1条件下AMF对植株氮素吸收的贡献量高于N2。
*, **, and ***分别表示0.05,0.01和0.001水平差异性。同列数据后不同字母表示处理间< 0.05水平差异显著性。下同
*, **, and *** Indicate the significant difference at the 0.05, 0.01 and 0.001 levels, respectively. Different letters after the data in the same column indicate significant difference in< 0.05 level among treatments. The same as below
地上部氮素积累量Aboveground N accumulation (ANA);根系氮素积累量Root N accumulation (RNA)
氮肥用量和丛枝菌根真菌显著影响土壤无机氮含量。与M0相比,N1条件下M1和M2两个处理土壤硝态氮含量分别减少37%和64%,无机氮含量分别减少26%和65%;N2条件下M1和M2两个处理土壤硝态氮含量分别减少44%和55%,无机氮含量分别减少34%和55%。表明玉米接种丛枝菌根真菌显著促进土壤无机氮的吸收利用。
2.2 氮肥用量和丛枝菌根真菌对N2O排放的影响
2016和2017两个试验年度玉米生育期土壤N2O排放通量呈动态变化(图1)。与N1相比,两个试验年度N2条件下N2O排放通量均值增加17%,N2O累积排放量增加13%,N2O排放强度降低25%(图2)。与M0相比,N1条件下M1和M2两个处理N2O排放通量分别降低9%和37%,N2O累积排放量降低17%和40%,N2O排放强度降低41%和67%;N2条件下N2O排放通量降低17%和45%,累积排放量降低26%和45%,排放强度降低28%和57%。表明接种丛枝菌根真菌能显著降低土壤N2O排放通量、累积排放量和排放强度,且不同氮肥用量条件下AMF对N2O排放的影响程度不同,N1处理AMF降低N2O排放量的能力小于N2,但降低N2O排放强度的能力高于N2。
2.3 氮肥用量和丛枝菌根真菌对土壤细菌群落组成的影响
2016年每个土壤样品的所有序列被聚类为操作分类单位(OTU),具有超过97%的同一性(表2)。Chao 1用于反映细菌群落的丰富度,但M0、M1和M2处理之间OTU数和Chao 1差异均不显著,说明玉米接种AMF后不会改变土壤细菌的丰富度。Shannon和Simpson指数用于评价细菌群落多样性,细菌群落多样性受丰富度和均匀度的影响,更好的多样性对应于更高的Shannon和更低的Simpson指数,与M0相比,N1条件下M1和M2处理的Shannon指数分别提高8%和6%,N2条件下分别提高2%和1%,说明低氮(N1)和高氮(N2)条件下接种丛枝菌根真菌均表现出相对较高的多样性,但降低了均匀度,其中低氮条件下细菌多样性较高。
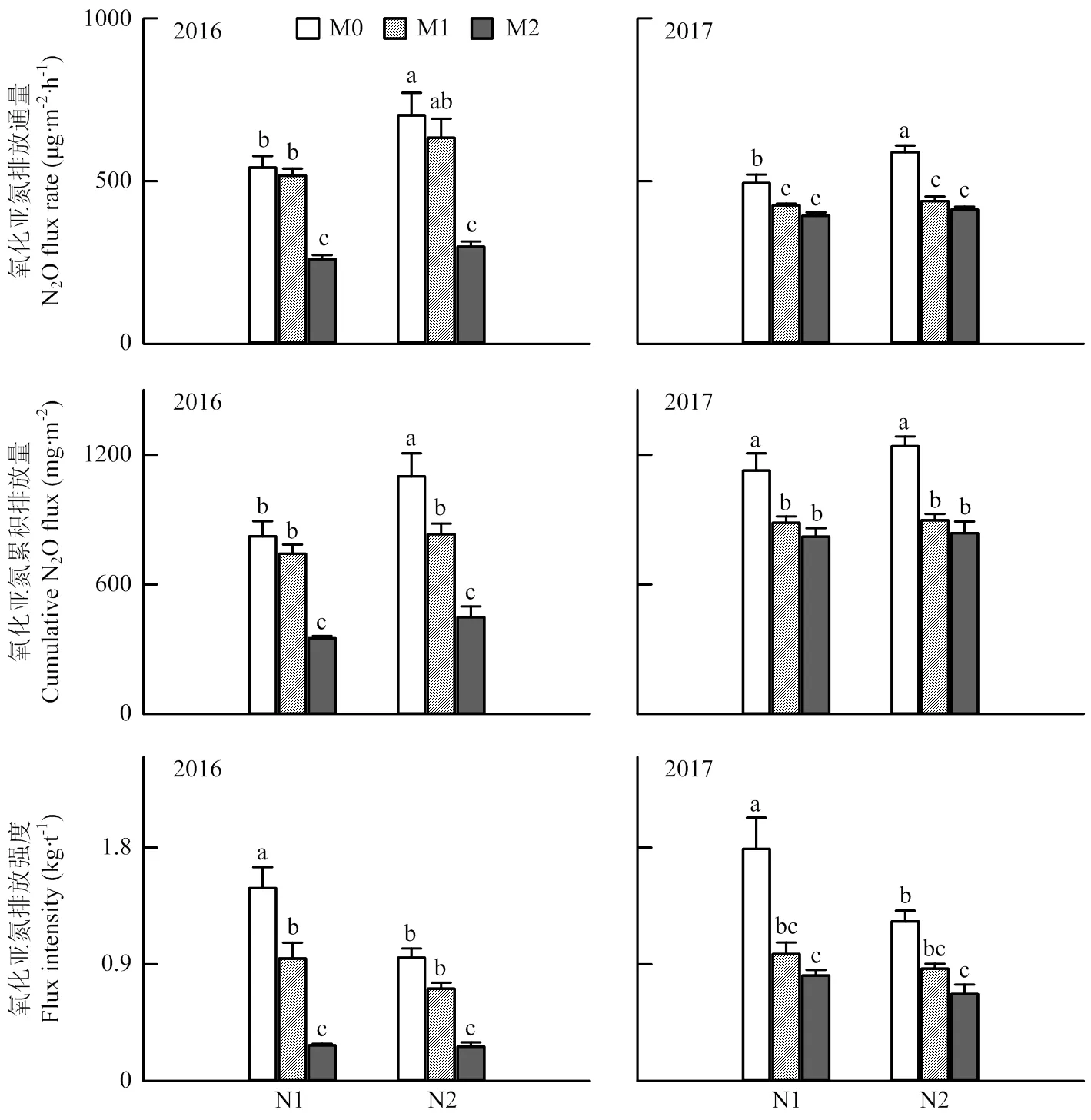
图2 不同处理之间土壤氧化亚氮排放通量、累积排放量和排放强度的比较
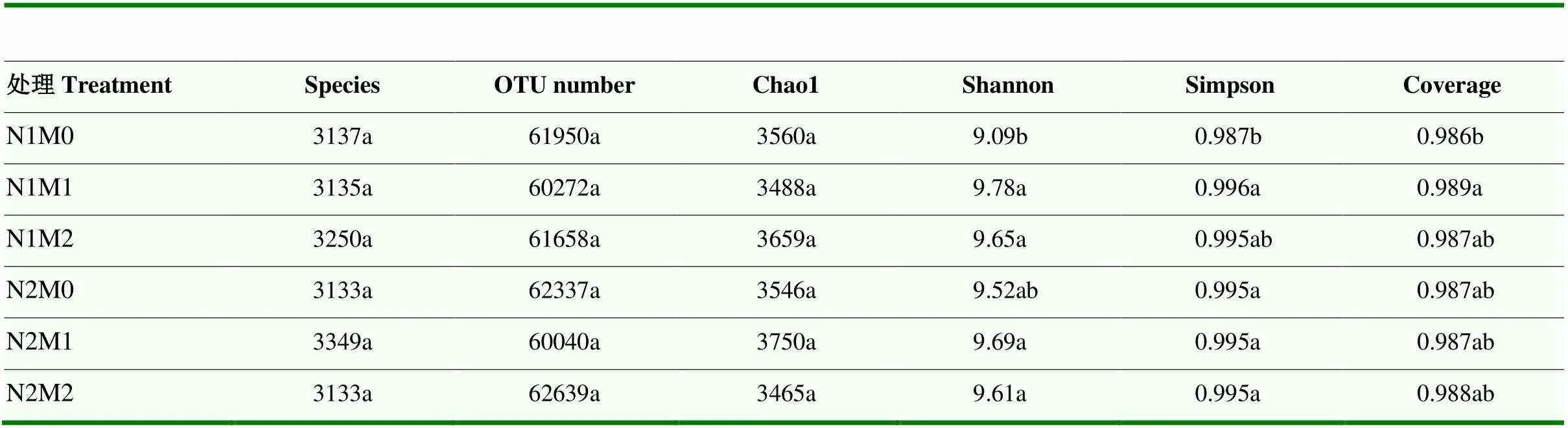
表2 2016年不同处理间细菌观测物种、OTU数、估计指数(Chao 1、Shannon和Simpson)和覆盖度的比较
各处理细菌群落相对丰度超过1%、位列前10的细菌门分别为变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)、芽单胞菌门(Gemmatimonadetes)、绿弯菌门(Chloroflexi)、拟杆菌门(Bacteroidetes)、奇古菌门(Thaumarchaeota)和疣微菌门(Verrucomicrobia)(图3-A)。与N1均值相比,N2水平Proteobacteria、Gemmatimonadetes和 Bacteroidetes相对丰度分别降低6%、15%和22%,Actinobacteria增加32%。与M0处理相比,N1条件下M1和M2处理Proteobacteria丰度分别降低15%和10%,Bacteroidetes降低24%和4%,Actinobacteria分别增加54%和68%,Gemmatimonadetes丰度增加99%和89%;N2条件下Proteobacteria降低0.5%和4%,Bacteroidetes降低13%和20%,Actinobacteria分别增加3%和26%,Gemmatimonadetes增加21%和51%。
各处理相对丰度位列前10的优势细菌纲为α-变形菌纲(Alphaproteobacteria)、γ-变形菌纲(Gammaproteobacteria)、unidentified_Acidobacteria、芽孢杆菌纲(Bacilli)、β-变形菌纲(Betaproteobacteria),嗜热油菌纲(Thermoleophilia)、unidentified_ Actinobacteria、δ-变形菌纲(Deltaproteobacteria)、unidentified_ Gemmatimonadetes和全噬菌纲(Holophagae)(图3-B)。与N1均值相比,N2水平Gammaproteobacteria和Betaproteobacteria相对丰度降低25%和4%;Thermoleophilia和unidentified_ Actinobacteria分别增加49%和38%。与M0相比,N1条件下M1和M2处理Gammaproteobacteria丰度分别降低45%和40%,Betaproteobacteria降低26%和14%,而Thermoleophilia分别增加20%和31%,unidentified_Actinobacteria增加62%和92%;N2条件下Gammaproteobacteria相对丰度降低2%和23%,而Betaproteobacteria分别增加1%和7%,unidentified_Actinobacteria增加6%和46%。
各处理优势细菌目为芽孢杆菌目(Bacillales)、酸杆菌目(Acidobacteriales)、鞘脂单胞菌目(Sphingomonadales)、根瘤菌目(Rhizobiales)、芽单胞菌目(Gemmatimonadales)、红螺菌目(Rhodospirillales)、盖勒氏菌目(Gaiellales)和黄色单胞菌目(Xanthomonadales)(图3-C)。与N1均值相比,N2水平Acidobacteriales和Gemmatimonadales丰度分别降低20%和16%。与M0相比,N1条件下M1和M2处理Acidobacteriales丰度分别降低35%和32%,Gemmatimonadales分别增加93%和88%;N2条件下Acidobacteriales分别降低16%和19%,而Gemmatimonadales分别增加19%和53%。
各处理优势细菌科为Acidobacteriaceae_. Subgroup_1、鞘脂单胞菌科(Sphingomonadaceae)、芽单胞菌科(Gemmatimonadaceae)、芽孢杆菌科(Bacillaceae)、ABS-19和unidentified_Acidobacteria(图3-D)。与N1均值相比,N2水平Acidobacteriaceae_. Subgroup_1和Gemmatimonadaceae丰度分别降低20%和16%。与M0相比,N1条件下M1和M2处理Acidobacteriaceae_.Subgroup_1丰度分别降低35%和32%;Gemmatimonadaceae增加93%和88%;N2条件下,Acidobacteriaceae_.Subgroup_1丰度分别降低36%和19%;Gemmatimonadaceae增加19%和53%。
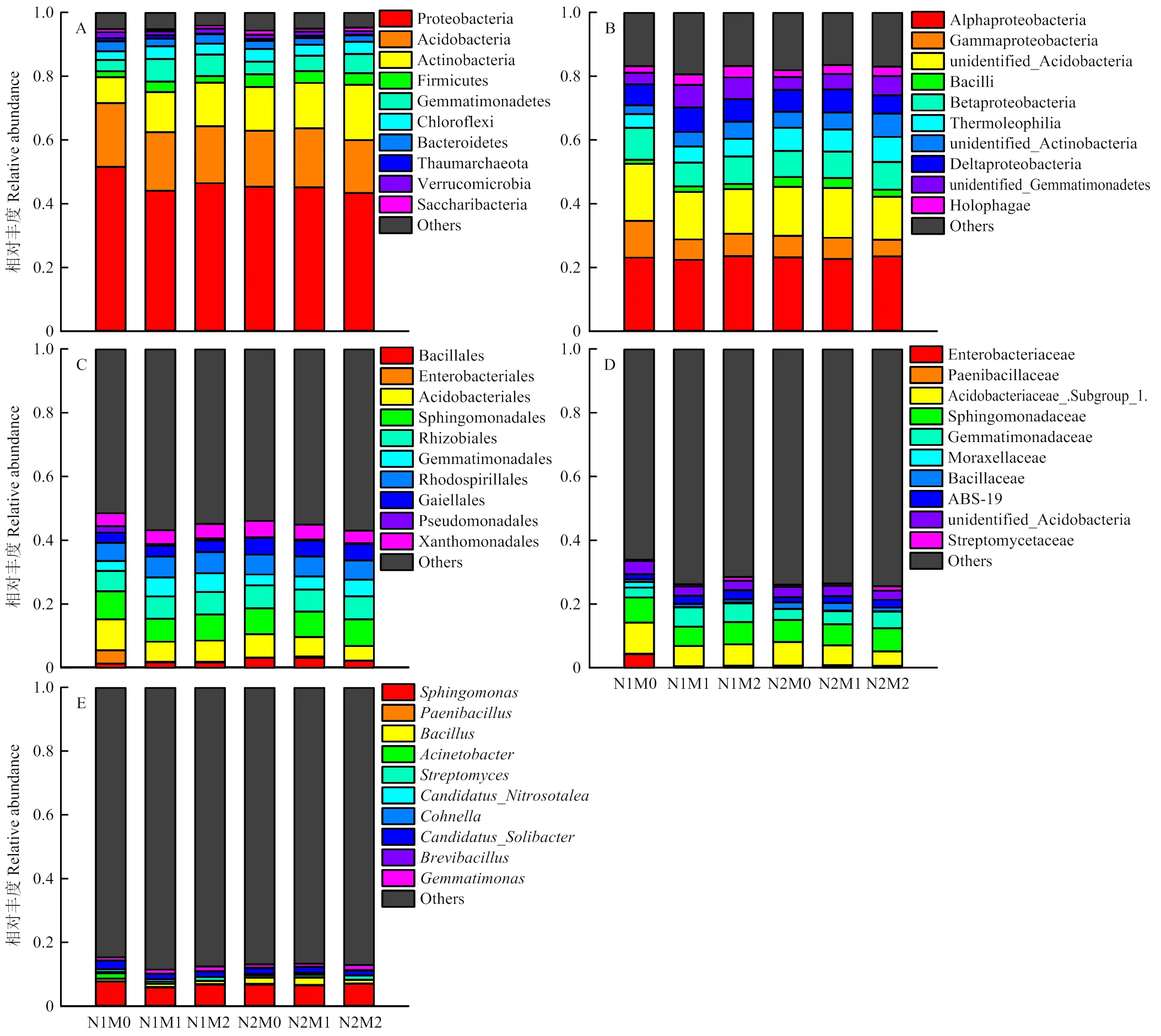
图3 不同处理之间门(A)、纲(B)、目(C)、科(D)、属(E)分类水平下土壤细菌群落相对丰度
各处理优势细菌属为鞘脂单胞菌属()、芽孢杆菌属()、_属和芽单胞菌属()(图3-E)。与N1均值相比,N2水平链霉菌()相对丰度增加27%,和分别降低13%和8%。与M0相比,N1条件下M1和M2处理丰度分别增加64%和205%,增加31%和53%,降低39%和37%;N2条件下M1和M2处理丰度分别增加10%和93%,M1处理的降低2%,M2处理增加56%。
低氮肥土壤细菌群落结构与高氮肥处理差异显著(图4)。而低氮肥和高氮肥条件下M0、M1和M2处理之间细菌群落结构之间分离明显, 说明丛枝菌根真菌对细菌群落结构变化影响显著。
相关分析结果表明(图5),细菌门水平的Gemmatimonadetes以及属水平的和的相对丰度与土壤N2O的排放量呈显著负相关;而属水平的和的相对丰度与玉米产量呈显著正相关。
3 讨论
本研究发现低氮(180 kg N·hm-2)和高氮(360 kg N·hm-2)条件下玉米接种丛枝菌根真菌均显著降低了土壤N2O排放通量和排放量(图1和2)。STORER等[25]采用分室装置研究发现,玉米寄主接种丛枝菌根真菌后,共生菌丝比生长缓慢的硝化细菌具有较强的竞争铵的优势,减少了通过硝化作用形成N2O的底物——铵的含量,降低了N2O的排放量。丛枝菌根真菌降低土壤N2O排放,一方面可能是因为寄主根际形成一个相对较大的外胚根菌丝网络,而且每克土壤的菌丝密度高达10 m,这种广泛的吸收网络可以延伸到距离根表面10 cm以上的区域,到达根系周围形成的根际养分消耗区之外,使AMF定殖的根系获得更大体积的土壤,扩大了土壤中的养分吸收范围[26-28],增加了植株氮素积累量,减少了转化形成N2O的底物−土壤可利用性氮素的含量。丛枝菌根真菌能够直接吸收土壤中的 NH4+和NO3-以及小分子有机氮,如甘氨酸及难降解的有机质壳聚糖等[29-30],并迅速传递给植物;丛枝菌根真菌对NH4+的吸收利用限制了硝化作用,对土壤 NO3-的吸收限制了反硝化作用[31-32],从而降低N2O的排放。另一方面,丛枝菌根还能够通过调节土壤团聚体,促进土壤聚合,调节土壤的通气状况,进而影响硝化和反硝化作用之间的平衡[33]。丛枝菌根对硝化作用的影响还可能与丛枝菌根真菌的分泌物有关,丛枝菌根真菌的分泌物可降低土壤 pH,使硝化作用减弱,导致土壤中NO3-含量减少[32]。本试验中玉米植株氮素积累量显著增加和菌丝室内土壤无机氮含量显著降低(表1),表明丛枝菌根真菌从土壤中吸收了氮素并转运给玉米植株,是降低N2O排放的主要原因[29]。
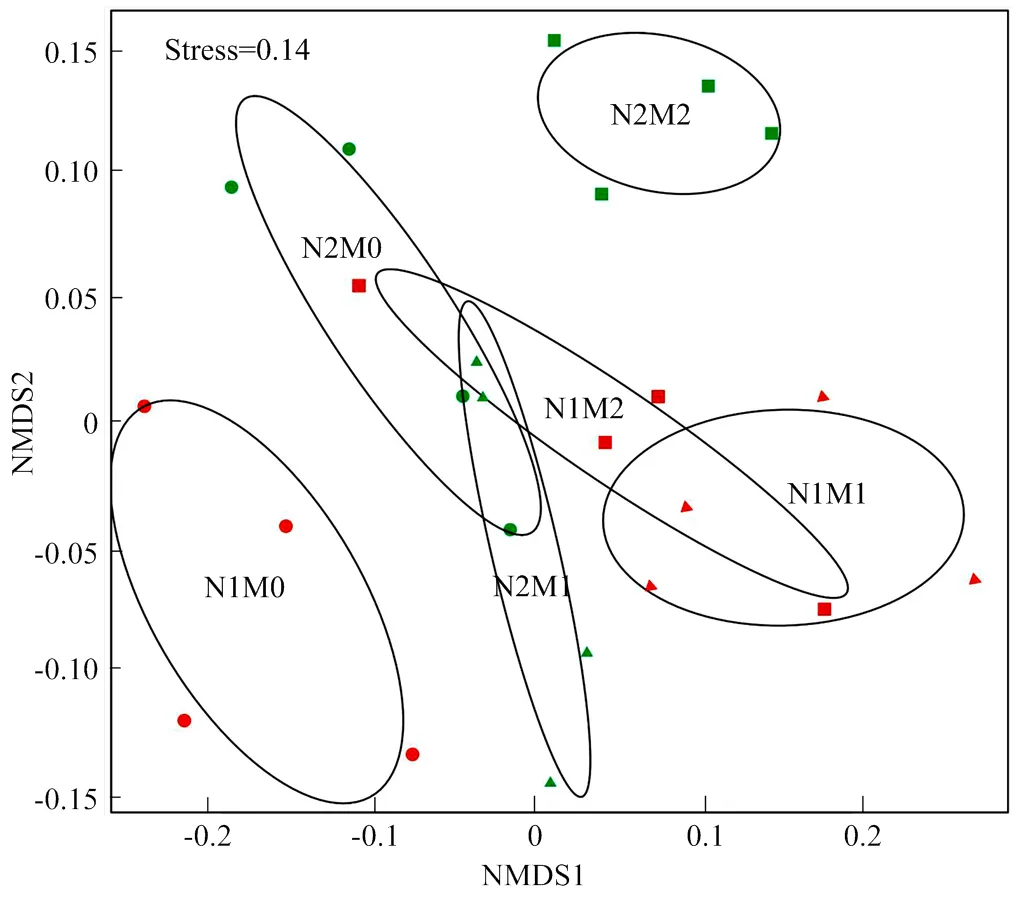
椭圆代表特定处理中OTU分布的95%置信区间。N1M0:红色圆点;N1M1:红色三角;N1M2:红色长方形;N2M0:绿色圆点;N2M1:绿色三角;N2M2:绿色长方形
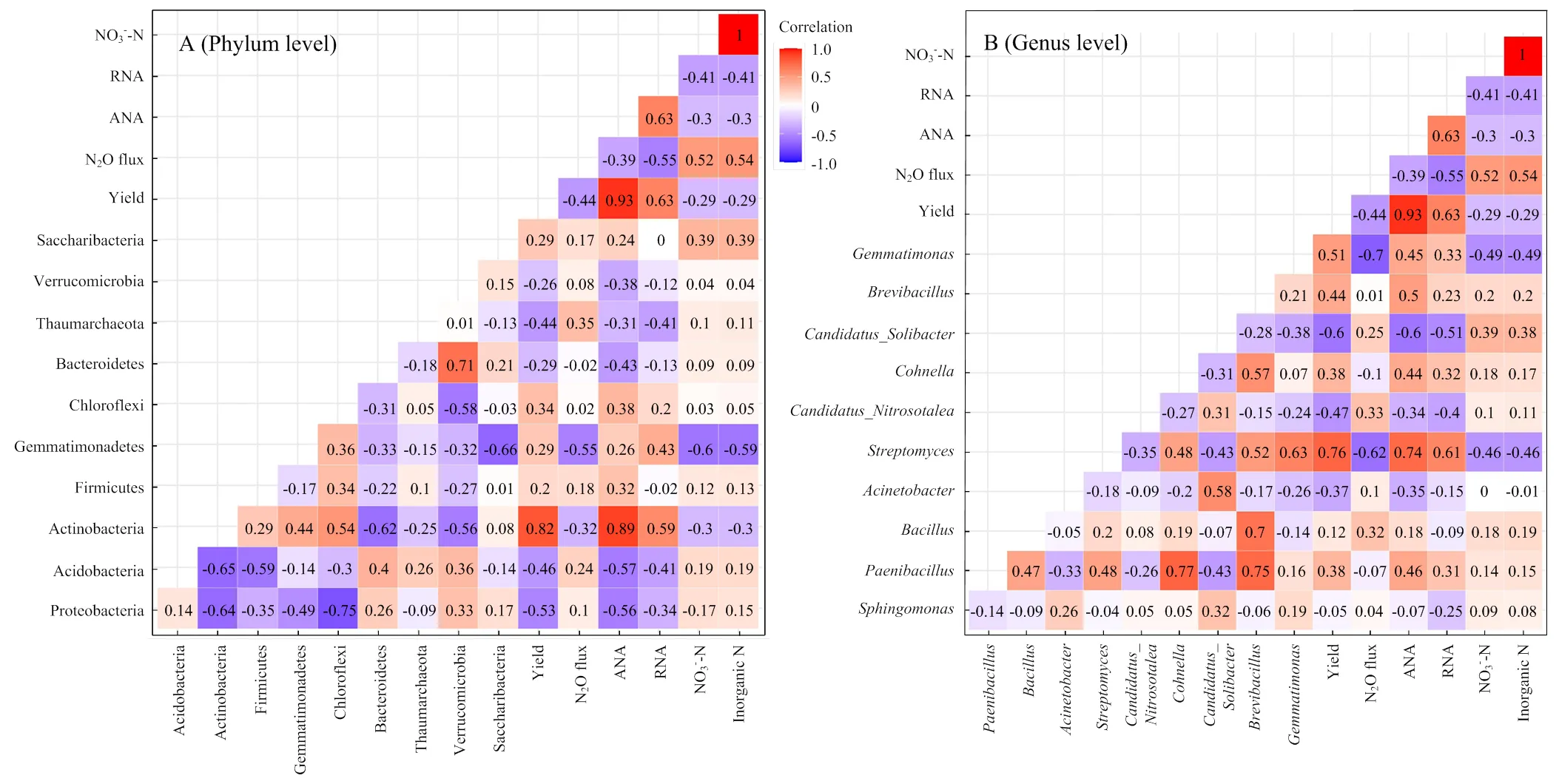
图5 玉米籽粒产量、N2O排放通量等参数与门水平(A)和属水平(B)细菌相对丰度的相关热图
细菌与丛枝菌根真菌之间的相互作用在土壤氮循环,尤其是N2O形成过程中起着非常关键的调控作用。丛枝菌根真菌通过调控土壤细菌群落组成,尤其是参与硝化、反硝化过程的微生物群落组成,影响N2O的排放[10, 12, 25]。CHEN等[34]和VERESOGLOU等[32]发现丛枝菌根真菌抑制氨氧化微生物对NH4+的利用,造成氨氧化古菌(AOA)与氨氧化细菌(AOB)丰度和土壤硝化速率降低,减少了硝化过程中产生的N2O。本研究发现玉米接种丛枝菌根真菌均增加了和相对丰度,且和细菌丰度均与N2O排放通量呈显著负相关。其中属具有较强的解磷能力,能够提高植物的抗病性和抗逆性、促进植物生长[35-36];Gemmatimonadetes门是一类光养细菌,它利用有机碳进行生长和新陈代谢,将各种糖分子转化为维生素,并且与土壤NH4+-N含量呈显著负相关性[37-39]。因此,AMF增加Gemmatimonadetes的丰度,可能是通过减少形成N2O的底物——NH4+-N的供应,从而降低N2O的排放。这表明玉米接种丛枝菌根真菌,主要是提高了有利于作物养分吸收的细菌相对丰度,降低了转化形成N2O的底物含量,减少了温室气体的排放量。N2O也可能被反硝化细菌所消耗,导致排放量减少[40]。BENDER等[10-11]研究发现丛枝菌根真菌通过诱导土壤反硝化微生物群落变化来调控N2O的排放,其中丛枝菌根真菌丰度与N2O产生的关键基因()丰度呈负相关,而与N2O消耗基因()丰度呈正相关。
施肥直接为土壤硝化与反硝化作用提供氮源,是影响土壤N2O排放最重要的因素之一[41]。SHCHERBAK等[2]分析了78篇相关文献,指出土壤N2O 排放随着施氮量的增加呈指数增长。另一方面,施肥促进作物根系分泌物增加,改善土壤微生物种群组成,调控温室气体排放途径[42]。有研究发现潮棕壤上长期单施化肥显著降低了细菌数量和多样性[43-44];而在砂姜黑土和灌溉土长期平衡施用化肥会显著增加土壤细菌数量以及提高细菌群落的多样性和丰富度[42,44-45]。本研究发现增施氮肥主要是增加了属的相对丰度,降低了属细菌丰度,其中土壤中和属与N2O的排放总量呈显著负相关。说明氮肥用量通过改善细菌群落组成影响N2O排放。不同氮肥用量条件下,丛枝菌根真菌调控N2O排放的能力存在差异[46-47]。本研究发现,低氮(180 kg N·hm-2)条件下丛枝菌根真菌减少N2O的排放量相对较高,这可能是较低的土壤养分条件下有利于菌根定殖、孢子形成和菌丝的发育[48-49]。而丛枝菌根真菌在高氮(360 kg N·hm-2)条件下的作用也表明,即使是在相对较高的土壤养分条件下,丛枝菌根真菌也能够与玉米根系建立良好的共生关系,促进养分吸收,提高其产量,减少氮素流失。这为丛枝菌根真菌作为生物肥料不受土壤肥力高低的制约,充分发挥其提高养分吸收、减少氮素流失和温室气体排放的生态作用,实现其在养分管理方面的应用拓宽了前景。
4 结论
不同氮肥用量条件下,玉米接种丛枝菌根真菌均能够降低土壤N2O的排放。玉米接种丛枝菌根真菌一方面通过扩大菌丝养分吸收面积,提高玉米氮素积累量,降低温室气体排放量;另一方面通过改变土壤细菌群落组成,主要是降低Proteobacteria和Bacteroidetes门,增加了Actinobacteria和Gemmatimonadetes细菌门水平的相对丰度,尤其是增加了和细菌属水平的丰度,降低N2O的排放量,其中180 kg N·hm-2施肥条件下接种丛枝菌根对降低N2O排放的贡献相对较大。
[1] RAVISHANKARA A R, DANIEL J S, PORTMANN R W. Nitrous oxide (N2O): the dominant ozone-depleting substance emitted in the 21st century. Science, 2009, 326(5949): 123-125. doi:10.1126/science. 1176985.
[2] SHCHERBAK I, MILLAR N, ROBERTSON G P. Global metaanalysis of the nonlinear response of soil nitrous oxide (N2O) emissions to fertilizer nitrogen. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(25): 9199-9204. doi:10.1073/pnas.1322434111.
[3] 张玉铭, 胡春胜, 张佳宝, 董文旭, 王玉英, 宋利娜. 农田土壤主要温室气体(CO2、CH4、N2O)的源/汇强度及其温室效应研究进展. 中国生态农业学报, 2011, 19(4): 966-975.
ZHANG Y M, HU C S, ZHANG J B, DONG W X, WANG Y Y, SONG L N. Research advances on source/sink intensities and greenhouse effects of CO2, CH4and N2O in agricultural soils. Chinese Journal of Eco-Agriculture, 2011, 19(4): 966-975. (in Chinese)
[4] FIRESTONE M K, FIRESTONE R B, TIEDJE J M. Nitrous oxide from soil denitrification: factors controlling its biological production. Science, 1980, 208(4445): 749-751. doi:10.1126/science.208.4445. 749.
[5] QIU Y P, JIANG Y, GUO L J, ZHANG L, BURKEY K O, ZOBEL R W, REBERG-HORTON S C, SHEW H D, HU S J. Shifts in the composition and activities of denitrifiers dominate CO2stimulation of N2O emissions. Environmental Science & Technology, 2019, 53(19): 11204-11213. doi:10.1021/acs.est.9b02983.
[6] SMITH S E, SMITH F A. Roles of arbuscular mycorrhizas in plant nutrition and growth: new paradigms from cellular to ecosystem scales. Annual Review of Plant Biology, 2011, 62: 227-250. doi:10.1146/annurev-arplant-042110-103846.
[7] 陈永亮, 陈保冬, 刘蕾, 胡亚军, 徐天乐, 张莘. 丛枝菌根真菌在土壤氮素循环中的作用. 生态学报, 2014, 34(17): 4807-4815. doi:10.5846/stxb201309242346.
CHEN Y L, CHEN B D, LIU L, HU Y J, XU T L, ZHANG S. The role of arbuscular mycorrhizal fungi in soil nitrogen cycling. Acta Ecologica Sinica, 2014, 34(17): 4807-4815. doi:10.5846/ stxb201309242346. (in Chinese)
[8] HODGE A, STORER K. Arbuscular mycorrhiza and nitrogen: implications for individual plants through to ecosystems. Plant and Soil, 2015, 386(1/2): 1-19. doi:10.1007/s11104-014-2162-1.
[9] CAVAGNARO T R, BARRIOS-MASIAS F H, JACKSON L E. Arbuscular mycorrhizas and their role in plant growth, nitrogen interception and soil gas efflux in an organic production system. Plant and Soil, 2012, 353(1/2): 181-194. doi:10.1007/s11104-011-1021-6.
[10] BENDER S F, PLANTENGA F, NEFTEL A, JOCHER M, OBERHOLZER H R, KÖHL L, GILES M, DANIELL T J, VAN DER HEIJDEN M G. Symbiotic relationships between soil fungi and plants reduce N2O emissions from soil. The ISME Journal, 2014, 8(6): 1336-1345. doi:10.1038/ismej.2013.224.
[11] BENDER S F, CONEN F, VAN DER HEIJDEN M G A. Mycorrhizal effects on nutrient cycling, nutrient leaching and N2O production in experimental grassland. Soil Biology and Biochemistry, 2015, 80: 283-292. doi:10.1016/j.soilbio.2014.10.016.
[12] LAZCANO C, BARRIOS-MASIAS F H, JACKSON L E. Arbuscular mycorrhizal effects on plant water relations and soil greenhouse gas emissions under changing moisture regimes. Soil Biology and Biochemistry, 2014, 74: 184-192. doi:10.1016/j.soilbio.2014.03.010.
[13] ZHANG X, WANG L, MA F, SHAN D. Effects of arbuscular mycorrhizal fungi on N2O emissions from rice paddies. Water, Air, & Soil Pollution, 2015, 226(7): 1-10. doi:10.1007/s11270-015-2493-4.
[14] GUI H, GAO Y, WANG Z H, SHI L L, YAN K, XU J C. Arbuscular mycorrhizal fungi potentially regulate N2O emissions from agricultural soils via altered expression of denitrification genes. Science of the Total Environment, 2021, 774: 145133. doi:10.1016/j. scitotenv.2021.145133.
[15] HODGE A, FITTER A H. Substantial nitrogen acquisition by arbuscular mycorrhizal fungi from organic material has implications for N cycling. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(31): 13754-13759. doi:10. 1073/pnas.1005874107.
[16] PELLEGRINO E, ÖPIK M, BONARI E, ERCOLI L. Responses of wheat to arbuscular mycorrhizal fungi: a meta-analysis of field studies from 1975 to 2013. Soil Biology and Biochemistry, 2015, 84: 210-217. doi:10.1016/j.soilbio.2015.02.020.
[17] LEIGH J, HODGE A, FITTER A H. Arbuscular mycorrhizal fungi can transfer substantial amounts of nitrogen to their host plant from organic material. New Phytologist, 2009, 181(1): 199-207. doi:10. 1111/j.1469-8137.2008.02630.x.
[18] VERESOGLOU S D, CHEN B D, RILLIG M C. Arbuscular mycorrhiza and soil nitrogen cycling. Soil Biology and Biochemistry, 2012, 46: 53-62. doi:10.1016/j.soilbio.2011.11.018.
[19] JANSSON J K, HOFMOCKEL K S. Soil microbiomes and climate change. Nature Reviews Microbiology, 2020, 18(1): 35-46. doi:10. 1038/s41579-019-0265-7.
[20] 赵明明, 赵鑫盟, 希尼尼根, 于景丽. 农田土壤nirK和nirS型反硝化微生物的研究进展. 微生物前沿, 2018, 7(2): 65-72. doi: 10.12677/AMB.2018.72008.
ZHAO M M, ZHAO X M, XI N N G, YU J L. Advances in nirK and nirS type denitrifying microbes of agricultural soils. Advances in Microbiology, 2018, 7(2): 65-72. doi:10.12677/amb.2018.72008. (in Chinese)
[21] 曹文超, 宋贺, 王娅静, 覃伟, 郭景恒, 陈清, 王敬国. 农田土壤N2O排放的关键过程及影响因素. 植物营养与肥料学报, 2019, 25(10): 1781-1798. doi:10.11674/zwyf.18441.
CAO W C, SONG H, WANG Y J, QIN W, GUO J H, CHEN Q, WANG J G. Key production processes and influencing factors of nitrous oxide emissions from agricultural soils. Journal of Plant Nutrition and Fertilizers, 2019, 25(10): 1781-1798. doi:10.11674/zwyf. 18441. (in Chinese)
[22] ATUL-NAYYAR A, HAMEL C, HANSON K, GERMIDA J. The arbuscular mycorrhizal symbiosis links N mineralization to plant demand. Mycorrhiza, 2009, 19(4): 239-246. doi:10.1007/s00572- 008-0215-0.
[23] 赵乾旭, 史静, 夏运生, 张乃明, 宁东卫, 岳献荣, 杨海宏. AMF与隔根对紫色土上玉米||大豆种间氮竞争的影响. 中国农业科学, 2017, 50(14): 2696-2705. doi:10.3864/j.issn.0578-1752.2017.14.006.
ZHAO Q X, SHI J, XIA Y S, ZHANG N M, NING D W, YUE X R, YANG H H. Effect of AMF inoculation on N uptake of interspecific competition between maize and soybean growing on the purple soil. Scientia Agricultura Sinica, 2017, 50(14): 2696-2705. doi:10.3864/j. issn.0578-1752.2017.14.006. (in Chinese)
[24] 邓胤, 申鸿, 罗文倩, 郭涛. 不同氮素形态比例条件下接种AMF对玉米氮同化关键酶的影响. 植物营养与肥料学报, 2009, 15(6): 1380-1385. doi: 10.11674/zwyf.2009.0619.
DENG Y, SHEN H, LUO W Q, GUO T. Effects of AMF on key enzymes of nitrogen assimilation in maize under different ammonium to nitrate ratios. Journal of Plant Nutrition and Fertilizers, 2009, 15(6): 1380-1385. doi: 10.11674/zwyf.2009.0619. (in Chinese)
[25] STORER K, COGGAN A, INESON P, HODGE A. Arbuscular mycorrhizal fungi reduce nitrous oxide emissions from N2O hotspots. New Phytologist, 2018, 220(4): 1285-1295. doi:10.1111/nph.14931.
[26] WALDER F, NIEMANN H, NATARAJAN M, LEHMANN M F, BOLLER T, WIEMKEN A. Mycorrhizal networks: common goods of plants shared under unequal terms of trade. Plant Physiology, 2012, 159(2): 789-797. doi:10.1104/pp.112.195727.
[27] MIRANSARI M. Arbuscular mycorrhizal fungi and nitrogen uptake. Archives of Microbiology, 2011, 193(2): 77-81. doi:10.1007/s00203- 010-0657-6.
[28] 张学林, 李晓立, 何堂庆, 张晨曦, 田明慧, 吴梅, 周亚男, 郝晓峰, 杨青华. 丛枝菌根真菌对玉米籽粒产量和氮素吸收的影响. 作物学报, https://kns.cnki.net/kcms/detail/11.1809.s.20210301.1319.006. html.
ZHANG X L, LI X L, HE T Q, ZHANG C X, TIAN M H, WU M, ZHOU Y N, HAO X F, YANG Q H. Effects of arbuscular mycorrhizal fungi on grain yield and nitrogen uptake in maize. Acta Agronomica Sinica,https://kns.cnki.net/kcms/detail/11.1809.s.20210301.1319.006. html. (in Chinese)
[29] BARRETT G, CAMPBELL C D, FITTER A H, HODGE A. The arbuscular mycorrhizal funguscan capture and transfer nitrogen from organic patches to its associated host plant at low temperature. Applied Soil Ecology, 2011, 48(1): 102-105. doi:10. 1016/j.apsoil.2011.02.002.
[30] 韦莉莉, 卢昌熠, 丁晶, 俞慎. 丛枝菌根真菌参与下植物-土壤系统的养分交流及调控. 生态学报, 2016, 36(14): 4233-4243.
WEI L L, LU C Y, DING J, YU S. Functional relationships between arbuscular mycorrhizal symbionts and nutrient dynamics in plant-soil-microbe system. Acta Ecologica Sinica, 2016, 36(14): 4233-4243.(in Chinese)
[31] REYNOLDS H L, HARTLEY A E, VOGELSANG K M, BEVER J D, SCHULTZ P A. Arbuscular mycorrhizal fungi do not enhance nitrogen acquisition and growth of old-field perennials under low nitrogen supply in glasshouse culture. New Phytologist, 2005, 167(3): 869-880. doi:10.1111/j.1469-8137.2005.01455.x.
[32] VERESOGLOU S D, SEN R, MAMOLOS A P, VERESOGLOU D S. Plant species identity and arbuscular mycorrhizal status modulate potential nitrification rates in nitrogen-limited grassland soils. Journal of Ecology, 2011, 99(6): 1339-1349. doi:10.1111/j.1365-2745.2011. 01863.x.
[33] 彭思利, 申鸿, 袁俊吉, 魏朝富, 郭涛. 丛枝菌根真菌对中性紫色土土壤团聚体特征的影响. 生态学报, 2011, 31(2): 498-505.
PENG S L, SHEN H, YUAN J J, WEI (C)F, GUO T. Impacts of arbuscular mycorrhizal fungi on soil aggregation dynamics of neutral purple soil. Acta Ecologica Sinica, 2011, 31(2): 498-505. (in Chinese)
[34] CHEN Y L, CHEN B D, HU Y J, LI T, ZHANG X, HAO Z P, WANG Y S. Direct and indirect influence of arbuscular mycorrhizal fungi on abundance and community structure of ammonia oxidizing bacteria and archaea in soil microcosms. Pedobiologia, 2013, 56(4-6): 205-212. doi:10.1016/j.pedobi.2013.07.003.
[35] VIAENE T, LANGENDRIES S, BEIRINCKX S, MAES M, GOORMACHTIG S.as a plant's best friend? FEMS Microbiology Ecology, 2016, 92(8): fiw119. doi:10.1093/femsec/ fiw119.
[36] 高桂凤, 党博, 蔡柯, 霍勤. 1株解磷菌株鉴定及影响其解磷能力因素. 东北林业大学学报, 2020, 48(1): 102-104, 109. doi:10.13759/ j.cnki.dlxb.2020.01.018.
GAO G F, DANG B, CAI K, HUO Q. Identification of Aphosphorus-solubilizing strain and the factors affecting phosphorus-solubilizing ability. Journal of Northeast Forestry University, 2020, 48(1): 102-104, 109. doi:10.13759/j.cnki.dlxb.2020. 01.018. (in Chinese)
[37] 李莹, 夏丽丹, 包明琢, 张燕林, 周垂帆. 铁氧化物影响下生物质炭对土壤细菌群落结构的影响. 福建农林大学学报(自然科学版), 2021, 50(1): 115-124. doi:10.13323/j.cnki.j.fafu(nat.sci.).2021.01.016.
LI Y, XIA L D, BAO M Z, ZHANG Y L, ZHOU C F. Effects of biochar on the composition of bacterial community in brown soil under the influence of iron oxides. Journal of Fujian Agriculture and Forestry University (Natural Science Edition), 2021, 50(1): 115-124. doi:10.13323/j.cnki.j.fafu(nat.sci.).2021.01.016. (in Chinese)
[38] 徐佳迎, 周金蓉, 吴杰, 王珏, 程粟裕, 赵鸽, 蒋静艳. 磺胺二甲嘧啶对稻田土壤微生物的中长期效应. 农业环境科学学报, 2020, 39(8): 1757-1766. doi:10.11654/jaes.2020-0123.
XU J Y, ZHOU J R, WU J, WANG J, CHENG S Y, ZHAO G, JIANG J Y. Medium-and long-term effects of the veterinary antibiotic sulfadiazine on soil microorganisms in a rice field. Journal of Agro-Environment Science, 2020, 39(8): 1757-1766. doi:10.11654/ jaes.2020-0123. (in Chinese)
[39] KOBLÍŽEK M, DACHEV M, BÍNA D, NUPUR, PIWOSZ K, KAFTAN D. Utilization of light energy in phototrophic Gemmatimonadetes. Journal of Photochemistry and Photobiology B: Biology, 2020, 213: 112085. doi:10.1016/j.jphotobiol.2020.112085.
[40] HERMAN D J, FIRESTONE M K, NUCCIO E, HODGE A. Interactions between an arbuscular mycorrhizal fungus and a soil microbial community mediating litter decomposition. FEMS Microbiology Ecology, 2012, 80(1): 236-247. doi:10.1111/j.1574- 6941.2011.01292.x.
[41] 张枝盛, 汪本福, 李阳, 杨晓龙, 胡杨, 王泠菲, 程建平. 氮肥模式对稻田温室气体排放和产量的影响. 农业环境科学学报, 2020, 39(6): 1400-1408. doi:10.11654/jaes.2019-1185.
ZHANG Z S, WANG B F, LI Y, YANG X L, HU Y, WANG L F, CHENG J P. Effects of different nitrogen regimes on greenhouse gas emissions and grain yields in paddy fields. Journal of Agro- Environment Science, 2020, 39(6): 1400-1408. doi:10.11654/jaes. 2019-1185. (in Chinese)
[42] 刘平静, 肖杰, 孙本华, 高明霞, 张树兰, 杨学云, 冯浩. 长期不同施肥措施下土细菌群落结构变化及其主要影响因素. 植物营养与肥料学报, 2020, 26(2): 307-315. doi:10.11674/zwyf.19102.
LIU P J, XIAO J, SUN B H, GAO M X, ZHANG S L, YANG X Y, FENG H. Variation of bacterial community structure and the main influencing factors in Eum-orthic Anthrosols under different fertilization regimes. Plant Nutrition and Fertilizer Science, 2020, 26(2): 307-315. doi:10.11674/zwyf.19102. (in Chinese)
[43] 徐永刚, 宇万太, 马强, 周桦. 长期不同施肥制度对潮棕壤微生物生物量碳、氮及细菌群落结构的影响. 应用生态学报, 2010, 21(8): 2078-2085. doi:10.13287/j.1001-9332.2010.0288.
XU Y G, YU W T, MA Q, ZHOU H. Effects of long-term fertilizations on microbial biomass C and N and bacterial community structure in an aquic brown soil. Chinese Journal of Applied Ecology, 2010, 21(8): 2078-2085. doi:10.13287/j.1001-9332.2010.0288. (in Chinese)
[44] 孙瑞波, 郭熙盛, 王道中, 褚海燕. 长期施用化肥及秸秆还田对砂姜黑土细菌群落的影响. 微生物学通报, 2015, 42(10): 2049-2057. doi:10.13344/j.microbiol.china.150031.
SUN R B, GUO X S, WANG D Z, CHU H Y. The impact of long-term application of chemical fertilizers and straw returning on soil bacterial community. Microbiology China, 2015, 42(10): 2049-2057. doi:10.13344/j.microbiol.china.150031. (in Chinese)
[45] 马琳, 孙本华, 孙瑞, 高明霞, 杨学云, 张树兰. 长期不同施肥对塿土细菌群落多样性的影响. 西北农业学报, 2015, 24(6): 162-170. doi:10.7606/j.issn.1004-1389.2015.06.026.
MA L, SUN B H, SUN R, GAO M X, YANG X Y, ZHANG S L. Effects of long-term different fertilization on bacterial community diversity in an anthropogenic lou soil. Acta Agriculturae Boreali- occidentalis Sinica, 2015, 24(6): 162-170. doi:10.7606/j.issn.1004- 1389.2015.06.026. (in Chinese)
[46] ZHANG S J, LEHMANN A, ZHENG W S, YOU Z Y, RILLIG M C. Arbuscular mycorrhizal fungi increase grain yields: a meta-analysis. New Phytologist, 2019, 222(1): 543-555. doi:10.1111/nph.15570.
[47] 冯固, 白灯莎, 杨茂秋, 李晓林, 张福锁, 李生秀. 盐胁迫下AM真菌对玉米生长及耐盐生理指标的影响. 作物学报, 2000, 26(6): 743-750.
FENG G, BAI D S, YANG M Q, LI X L, ZHANG F S, LI S X. Influence of inoculating arbuscular mycorrhizal fungi on growth and salinity tolerance parameters of maize plants. Acta Agronomica Sinica, 2000, 26(6): 743-750. (in Chinese)
[48] TOLJANDER J F, SANTOS-GONZÁLEZ J C, TEHLER A, FINLAY R D. Community analysis of arbuscular mycorrhizal fungi and bacteria in the maize mycorrhizosphere in a long-term fertilization trial. FEMS Microbiology Ecology, 2008, 65(2): 323-338. doi:10. 1111/j.1574-6941.2008.00512.x.
[49] BAKHSHANDEH S, CORNEO P E, MARIOTTE P, KERTESZ M A, DIJKSTRA F A. Effect of crop rotation on mycorrhizal colonization and wheat yield under different fertilizer treatments. Agriculture, Ecosystems & Environment, 2017, 247: 130-136. doi:10.1016/j.agee. 2017.06.027.
Effects of Arbuscular Mycorrhizal Fungi on Soil N2O Emissions During Maize Growth Periods
ZHANG XueLin, HE TangQing, ZHANG ChenXi, TIAN MingHui, LI XiaoLi, WU Mei, ZHOU YaNan, HAO XiaoFeng
AgronomyCollege, Henan Agricultural University/State Key Laboratory of Wheat and Maize Crop Science /Collaborative Innovation Center of Henan Grain Crops for 2011, Zhengzhou 450002
【Objective】The aim of this study was to understand the mechanism of arbuscular mycorrhizal fungi (AMF) on soil nitrous oxide (N2O) emissions, so as to provide the theoretical basis for increasing maize yield, improving nitrogen (N) use efficiency and reducing greenhouse gas emissions. 【Method】A 2-factorial greenhouse experiment was established during maize growth periods in 2016 and 2017. The factors were as follows: (1) N fertilizer rates (180 kg N·hm-2(N1) and 360 kg N·hm-2(N2)), and (2) three mycorrhizae treatments, including a control (M0, neither roots nor AMF could enter the hyphal chamber from the growth chamber), an AMF treatment (M1, only AMF can enter the hyphal chamber from the growth chamber), and a root treatment (M2, both roots and AMF can enter the hyphal chamber from the growth chamber). Maize grain yield, plant biomass and their N accumulation, and soil N2O flux were measured. Soil bacterial community structure and diversity at maize maturity stage was determined by using the high throughput sequencing technique on Hiseq 2500 PE250. 【Result】Both N fertilizer rates and mycorrhizae treatments significantly affected maize yield, plant N accumulation and soil N2O flux. Compared with M0, maize yield under M1 and M2 under the conditions of N1 input increased by 38% and 82%, by 30% and 52% for aboveground N accumulation, respectively, and reduced by 26% and 65% for soil inorganic N, respectively. However, under the conditions of N2 input, the maize yield under M1 and M2 increased by 16% and 48%, by 9% and 33% for aboveground N accumulation, and reduced by 34% and 55% for soil inorganic N, respectively. Compared with the M0, the total N2O emission of M1 and M2 treatments reduced by 17% and 40% under the conditions of N1 input, and by 41% and 67% for the N2O emission intensity, respectively; while under the conditions of N2 input, the total N2O emission reduced by 26% and 45%, and by 28% and 57% for the N2O emission intensity, respectively. Nonmetric multidimensional scaling analysis showed that both N fertilizer rates and mycorrhizae treatments had significant effects on bacterial communities’ composition. Compared with N1, the relative abundance of Proteobacteria and Gemmatimonadetes under N2 treatment on phyla level reduced by 6% and 15%, increased by 32% for Actinobacteria, while on genera level, theincreased by 27%, and reduced by 8% for. Compared with M0 under the conditions of N1 input, the relative abundance ofunder M1 and M2 increased by 64% and 205%, by 31% and 53% for; however, under the conditions of N2 input, the relative abundance ofunder M1 and M2 increased by 10% and 93%, respectively, thefor M1 reduced by 2%, and increased by 56% for M2. Moreover, the relative abundance of soilandwas negatively related with soil N2O emission, but positively related with maize yield. 【Conclusion】Arbuscular mycorrhizal fungi could reduce soil N2O emission under both higher and lower N fertilizer application rate by increasing the maize N uptake, and regulating the bacterial composition, especially increasing the relative abundance ofand.
nitrogen fertilizer; arbuscular mycorrhizal fungi; maize; soil N2O flux; soil bacteria
2021-03-19;
2021-06-10
河南省自然科学基金(182300410013)、国家重点研发计划课题(2018YFD0200605)
张学林,Tel:13643867669;E-mail:xuelinzhang1998@163.com;zxl1998@henau.edu.cn
10.3864/j.issn.0578-1752.2022.10.010
(责任编辑 李云霞)
