LKB1基因对卵巢颗粒细胞类固醇激素生成相关基因的调控作用
2022-06-28张静张姬越岳永起赵丹范依琳马妍熊燕熊显荣字向东李键杨丽雪
张静,张姬越,岳永起,赵丹,范依琳,马妍,熊燕,熊显荣,字向东,李键,杨丽雪
LKB1基因对卵巢颗粒细胞类固醇激素生成相关基因的调控作用

1青藏高原动物遗传资源保护与利用教育部重点实验室,成都 610041;2青藏高原动物遗传资源保护与利用四川省重点实验室,成都 610041;3动物科学国家民委重点实验室,西南民族大学,成都 610041
【背景】颗粒细胞类固醇激素的合成能力对卵泡发育及成熟具有重要作用,但其关键的调控因子尚不完全清楚。笔者前期的研究表明肝激酶B1(liver kinase B1,LKB1)基因参与细胞的脂类代谢,类固醇激素的合成与脂类代谢密切相关,并且有研究结果亦显示敲除可引起小鼠卵巢早衰,表明对维持卵巢的功能很关键,其在颗粒细胞的确切功能需要进一步研究。【目的】探究在牛卵泡中的表达模式及其对颗粒细胞类固醇激素生成相关基因的调控作用, 为母牛繁殖生理调控研究提供理论依据。【方法】采用免疫组织化学染色对LKB1蛋白在卵泡中进行定位研究;同时分离培养牛原代颗粒细胞,并以促卵泡素受体(follicle stimulating hormone receptor, FSHR)蛋白作为标记基因,细胞免疫荧光染色鉴定颗粒细胞及纯度;然后以原代颗粒细胞为模型,采用siRNA沉默的技术,利用qRT-PCR方法检测功能缺失对类固醇激素合成相关基因表达的影响,另一方面采用腺病毒过表达,qRT-PCR和Elisa技术验证对类固醇激素合成相关基因表达的调控作用及雌二醇分泌。【结果】1) LKB1蛋白在卵泡中的细胞均表达,但颗粒细胞的染色信号强于膜细胞,进一步的定量分析显示颗粒细胞的表达量显著高于卵泡膜细胞。2) 分离培养的牛原代卵泡颗粒细胞贴壁生长、细胞形态多呈圆形,能被颗粒细胞标志基因FSHR抗体标记。3) RNAi技术能显著抑制的表达。与对照相比,siRNA1和siRNA2干扰的效率分别为48% (<0.05)和52% (<0.05);沉默显著降低颗粒细胞类固醇激素合成基因(<0.01)、(<0.01)和(<0.05)的表达,分别下调了约为对照组的60%、80%和50%。4)过表达腺病毒及对照组对颗粒细胞均具有高的感染效率,过表达效率高达10倍(<0.01);过表达显著上调(<0.01)、(<0.01)和(<0.05)的表达,进一步研究显示LKB1基因功能获得促进颗粒细胞雌二醇的分泌(<0.05)。【结论】在卵泡颗粒细胞中高表达,促进类固醇激素生成基因、和的表达和雌二醇的分泌。本研究将为调控牛颗粒细胞类固醇激素合成的功能提供直接的理论依据。
;牛;颗粒细胞;类固醇激素;卵巢
0 引言
【研究意义】卵巢是雌性生殖系统中的重要器官,在下丘脑-垂体-卵巢轴(hypothalamic-pituitary-ovarian axis,HPOA)的调节下,参与卵泡的生长和排卵等生物学过程。颗粒细胞(granulosa cells,GCs)作为卵巢中重要的功能细胞之一,在HPOA的调节下,发生增殖、分化和凋亡等一系列变化[1-2]。研究表明颗粒细胞通过旁分泌、自分泌和缝隙连接信号等与卵母细胞发生相互作用[3]。同时颗粒细胞主要负责合成类固醇激素,如雌二醇和孕酮[4-5],调节卵泡的生长、发育和闭锁。然而,目前关于牛颗粒细胞类固醇激素生成的关键调控因子尚不完全清楚[6]。【前人研究进展】肝激酶B1(Liver kinase B1,)又称丝氨酸/苏氨酸蛋白激酶11(Serine/threonine kinase 11,),作为肿瘤抑制因子被发现[7]。目前的研究已探索了在其他细胞类型上的功能。例如,调控人胚胎肾脏细胞的细胞周期[8]及间充质干细胞的细胞凋亡[9];在成年β细胞中缺失促进葡萄糖诱导β细胞分泌胰岛素[10];脂肪组织特异敲除增加机体能量代谢及脂代谢[11-13]。在人类生殖或动物繁殖领域的研究报道自然突变导致个体罹患黑斑息肉综合征(peutz-Jeghers syndrome,PJS),该患者在输卵管、卵巢和子宫颈等器官易发生肿瘤[14-15]。此外,中一个SNP(单核苷酸多态性)的C等位基因会阻止二甲双胍治疗的多囊卵巢综合症患者的排卵[16]。并且在雄激素诱导的多囊卵巢综合症小鼠模型中,雌激素水平下降,伴随着表达水平显著降低[17]。综上所述可知与激素分泌、能量代谢相关。【本研究切入点】最近研究表明卵母细胞特异敲除,导致原始卵泡过度激活,卵巢早衰[18]。卵泡的生长发育与颗粒细胞的类固醇激素合成分泌密切相关,是否参与牛卵巢颗粒细胞类固醇激素合成的功能尚不清楚。【拟解决的关键问题】首先采用免疫组化检测蛋白在牛卵泡中的表达模式,检测其在卵泡颗粒细胞和膜细胞的表达差异。然后以体外培养的牛原代卵泡颗粒细胞为模型,采用siRNA介导基因沉默和腺病毒过表达的方法,探索对牛卵泡颗粒细胞类固醇激素合成相关基因表达及雌二醇分泌的影响。为作为母牛繁殖生理调控的新靶点提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 样本采集 样本采集时间为2019年9—12月,均采自成都青白江屠宰场,以健康的母黄牛(4—5岁)为试验动物。屠宰后,使用灭菌的医用剪刀快速采集卵巢组织,灭菌生理盐水冲洗3次,将牛卵巢置于37℃灭菌的生理盐水(含10 IU·mL-1双抗)中,2 h内带至西南民族大学青藏高原动物遗传资源保护与利用教育部重点实验室细胞房,备用。
1.1.2 主要试剂 DMEM/F12培养基购自Gibco公司;胎牛血清FBS购自CLARK公司;RNAiso Plus、RT reagent Kit With gDNA Eraser均购自Takara公司;胰蛋白酶、青链霉素混合液(100×)均购自Biosharp公司;Lipofectamine®3 000转染试剂盒、绿色免疫荧光二抗Goat anti-Rabbit IgG(H+L)Cross-Adsorbed Secondary Antibody(A-11034)均购自Invitrogen公司;牛血清白蛋白(BSA)购自Sigama公司;一抗Rabbit Anti-antibody(bs-3948R)、Rabbit Anti-FSH receptor antibody(bs-20658R)均购自北京博奥森生物技术有限公司;DAPI染料购自上海碧云天生物技术有限公司;2×Plus SYBR real-time PCR premixture购自北京百泰克生物技术公司;MaxVisionTMHRP-Polymer anti-Mouse/Rabbit IHC Kit购自福州迈新生物技术开发有限公司。
1.2 试验方法
1.2.1 免疫组织化学检测在卵巢表达与定位 采集5头健康母牛的卵巢,使用眼科剪与手术刀剥取直径为2—13 mm正常卵泡,4%多聚甲醛固定牛卵泡组织24 h,4℃保存,每隔6 h晃动组织固定液,使其各个部位充分接触固定液,经脱水、透明、浸蜡包埋制作成5 µm厚切片,根据MaxVisionTMHRP- Polymer anti-Mouse/Rabbit IHC Kit检测试剂盒说明书进行免疫组化染色,试验组滴加的一抗为Rabbit Anti-antibody(稀释浓度为1﹕400),对照组则滴加相同体积的PBS缓存液。染色完成后并封片,在显微镜下观察并拍照,用Image Pro软件进行免疫组化的定量分析。
1.2.2 颗粒细胞的分离培养与鉴定 颗粒细胞的分离培养:用预热37℃的PBS冲洗卵巢3次,移入无菌操作台中。用10 mL注射器吸取少量培养基,吸取直径大小为2—13 mm卵泡的卵泡液,避免吸入血细胞。将吸出的卵泡液,使用400目细胞筛过滤,收集液体至1.5 mL离心管中,1 000 r/min 离心5 min。吸去上清液,加入含10% FBS和1%双抗的DMEM/F12完全培养基重悬牛卵巢颗粒细胞,1 000 r/min离心5 min,重复3次。最后将沉淀收集在10 mL离心管中,加入适量完全培养基混悬、细胞以30%汇合度接种至细胞培养板中,八字形移动细胞培养板,移至显微镜下观察,细胞均匀分布,将培养板放入5% CO2恒温(37℃)培养箱中培养。待牛卵巢颗粒细胞培养12 h,观察颗粒细胞贴壁良好,PBS冲洗2次,去除杂质,添加完全培养基,继续培养。
颗粒细胞的鉴定:FSHR在颗粒细胞中特异性表达,采用免疫荧光法鉴定分离培养的牛卵巢颗粒细胞。将牛卵巢颗粒细胞以0.5×106个/孔接种于35 mm细胞培养皿中,在CO2培养箱中恒温(37℃)培养。培养24 h后,弃去培养基,PBS洗涤1—2次,用4%多聚甲醛液固定颗粒细胞20 min。然后用PBS洗涤3次,每次5 min;用0.2%的Triton X-100溶液孵育20 min,PBS洗涤3次,每次5 min;滴加3% 山羊血清封闭1 h;再加入稀释好的一抗FSHR,4℃孵育过夜,PBS洗3遍,每次5 min;在室温下加入上述荧光标记(Alexa Fluor 488)的二抗及DAPI孵育1 h(注意避光),PBS洗3次,每次5 min。加入Mounting Medium进行封片,并用荧光显微镜观察拍照。
1.2.3 siRNA的设计及siRNA的细胞转染 根据CDS区序列,Invitrogen公司设计并合成2对干扰siRNA序列;分别命名为-siRNA-1和-siRNA-2,各siRNA序列见表1。
1.2.4 腺病毒感染颗粒细胞 将分离出的第1代牛卵巢颗粒细胞接种于12孔细胞培养板中(分离方法见1.2.2),待细胞融合率达到50%,加入适量的腺病毒,同时在培养液中加入10 μg·mL-1的聚凝胺,提高病毒的吸附作用,从而提高感染效率。试验设置3个生物学重复,静置培养48 h,收集细胞进行后续检测。

表1 靶向LKB1的siRNA序列
1.2.5 总RNA的提取及其反转录 将细胞用细胞刮收集于1.5 mL的无RNAase的EP管中,加入1 000 µL RNAiso裂解细胞,按照Takara公司的RNAiso Plus说明书进行RNA抽提。操作步骤如下:加入氯仿200 µL,涡旋离心15 s,室温静止5 min,12 000 r/min、4℃离心15 min,吸取400 µL上清液于新的离心管中。加入500 µL的异丙醇,室温放置10 min。然后12 000 r/min、4℃离心10 min,弃去上清液。再用 75%的乙醇(DEPC水配置)洗涤RNA沉淀,4℃、12 000 r/min离心5 min,弃上清,在室温静置约10 min。最后加入30 µL DEPC水溶解RNA,测定RNA的浓度。细胞的总RNA通过 RT reagent Kit With gDNA Eraser试剂盒进行反转录,获得细胞的cDNA,-20℃冷冻保存。
1.2.6 荧光定量PCR 根据 GenBank 利用 NCBI 中 BLAST 软件设计、细胞色素P450家族11亚家族A成员1()、细胞色素P450家族17亚家族A成员1()、细胞色素P450家族19亚家族A成员1()、类固醇生成急性调节蛋白()等基因的荧光定量引物(表2),以为内参基因。采用qRT-PCR技术检测干扰或过表达基因后类固醇激素分泌相关基因在牛颗粒细胞中的表达差异。qRT-PCR反应体系为15 µL:2×Plus SYBR real-time PCR premixture 7.5 µL,上游引物(10 µmol·L-1)1 µL,下游引物(10 µmol·L-1)1 µL,cDNA 2 µL,补充ddH2O至15 µL。反应程序:95℃ 3 min;95℃ 10 s,60℃ 30 s,72℃ 45 s共40个循环。颗粒细胞的培养设置3个生物学重复,每个样本设3个技术重复。
1.2.7 雌激素的测定 感染过对照腺病毒和过表达腺病毒的颗粒细胞,48 h后更换为无血清培养基,培养24 h后,收集培养液上清。配置标准品,按照上海邦奕生物公司酶联免疫ELISA试剂盒操作说明检测标准品及样本反应后的吸光度,用标准品的浓度与OD值计算出标准曲线的直线回归方程式,将样品的OD值代入方程式,计算出样品中雌二醇的浓度。

表2 荧光定量PCR检测基因的引物序列
1.2.8 数据处理与分析 荧光定量数据采用2-ΔΔCT方法进行处理,SPSS 23.0软件分析免疫组化定量、荧光定量PCR结果及雌激素含量的显著性水平,实验数据以平均值±标准误差(S.E.M)表示,采用双尾t检验确定统计学意义。
2 结果
2.1 LKB1在牛卵泡中的表达与定位
将有腔卵泡制备石蜡切片(图1-E),并做LKB1蛋白的免疫组织化学染色(设置不加抗体孵育的阴性对照)。LKB1抗体孵育结果显示牛卵泡中不同细胞类型均有棕色信号,说明在这些细胞中均有表达,蓝色箭头表示颗粒细胞,红色箭头表示膜细胞(图1-A—D)。相反的,免疫组化的阴性对照组显示细胞中无棕色信号,细胞核被苏木精染为蓝色(图1-A—D),表明图中的棕色染色为LKB1蛋白的特异性显色。研究表明颗粒细胞与膜细胞是卵泡中主要的细胞类型,颗粒细胞特异分泌雌激素,而膜细胞特异分泌雄激素,因此比较LKB1蛋白在这两种细胞中的表达差异。结果显示颗粒细胞的染色信号强于膜细胞(图1-A—D),进一步采用Image Pro软件对LKB1蛋白的特异性染色进行半定量分析,显示颗粒细胞的染色信号强度极显著高于膜细胞(图1-F),表明LKB1蛋白在卵泡中的颗粒细胞高表达,提示LKB1蛋白在维持牛卵巢颗粒细胞的生物学功能具有重要作用。

A-D:有腔卵泡的LKB1蛋白免疫组织化学染色,A:卵泡直径为2 mm,B:卵泡直径为3 mm, C:卵泡直径为5 mm,D:卵泡直径为7 mm。蓝色箭头:牛卵泡颗粒细胞,红色箭头:卵泡膜细胞。E:不同大小的卵泡形态。F:LKB1在颗粒细胞及膜细胞中信号强度的定量分析。误差线:S.E.M。** P < 0.01,双尾t检验法。切片比例尺:500 µm
2.2 原代颗粒细胞的分离与鉴定
收集卵泡液内的颗粒细胞,均匀接种于35 mm培养皿中,牛卵巢颗粒细胞大部分贴壁生长,原代颗粒细胞多呈圆形,如图2-A所示。此外,研究表明FSHR蛋白为卵巢颗粒细胞的特异分子标记,因此采用免疫荧光的方法鉴定卵巢颗粒细胞,如图2-B所示,绿色表示FSHR蛋白,被绿色标记的细胞为颗粒细胞;蓝色表示被DAPI染色的细胞核。通过统计可得颗粒细胞纯度达到95%以上。表明细胞纯度较高,可用于后续试验。
2.3 干扰LKB1下调颗粒细胞类固醇激素合成相关基因的表达
将2对靶向的siRNAs转染原代颗粒细胞,采用qRT-PCR检测的干扰效率。结果如图3所示,-和均可有效干扰的表达,干扰效率分别为48%(<0.05)和52%(<0.05)。因此,选用干扰效率更高的--进行后续试验。
颗粒细胞接种至12孔板,待细胞融合度至80%,将siRNAs转染牛卵巢颗粒细胞,培养48 h后收集细胞,qRT-PCR检测与类固醇激素分泌相关基因,包括。其中调控胆固醇从细胞质向线粒体的转运,干扰极显著下调的表达,与对照相比下调了56%(<0.01,图4-A);为类固醇合成过程中将胆固醇转化为孕烯醇酮,的表达量决定着类固醇激素的合成能力,与对照相比沉默下调了79%的mRNA表达量(<0.01,图4-B);特异分布于卵泡膜细胞,可将孕酮催化形成雄烯二酮,干扰对的表达量无影响(>0.05, 图4-C);可将颗粒细胞中睾酮转化为雌二醇,与对照相比沉默下调了约50%的mRNA表达量(<0.05,图4-D)。以上研究结果表明干扰的功能下调颗粒细胞类固醇激素合成基因的表达。
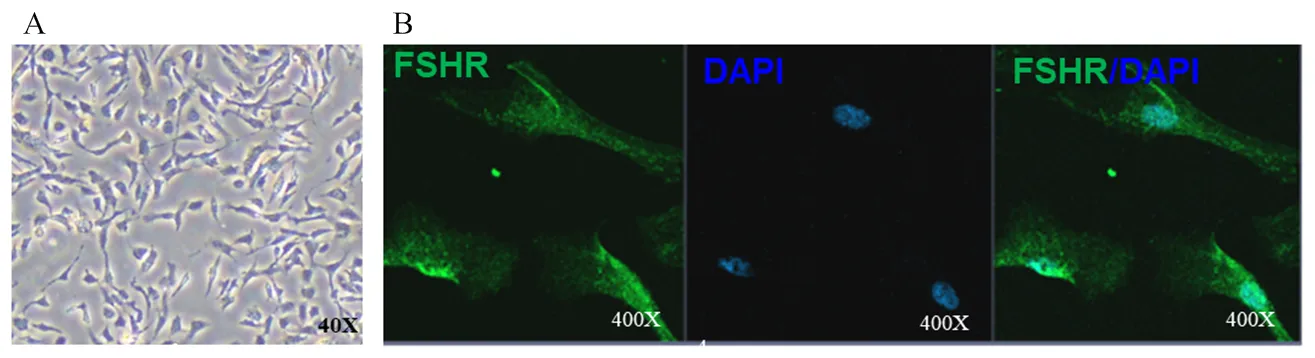
A:原代颗粒细胞的体外培养形态观察;B:绿色荧光标记FSHR蛋白,DAPI核染色

误差线:S.E.M,* P < 0.05,双尾t检验法
2.4 过表达LKB1促进类固醇激素合成基因的表达及雌二醇的分泌
将实验室保存的过表达腺病毒和对照腺病毒分别感染颗粒细胞,48 h后观察细胞均有绿色荧光蛋白表达(图5-A)。同时收集细胞,qRT-PCR检测的过表达效率。如图5-B所示,过表达处理组的表达量极显著升高。与对照组相比,的mRNA水平均升高约10倍(<0.01),表明腺病毒成功介导的过表达。
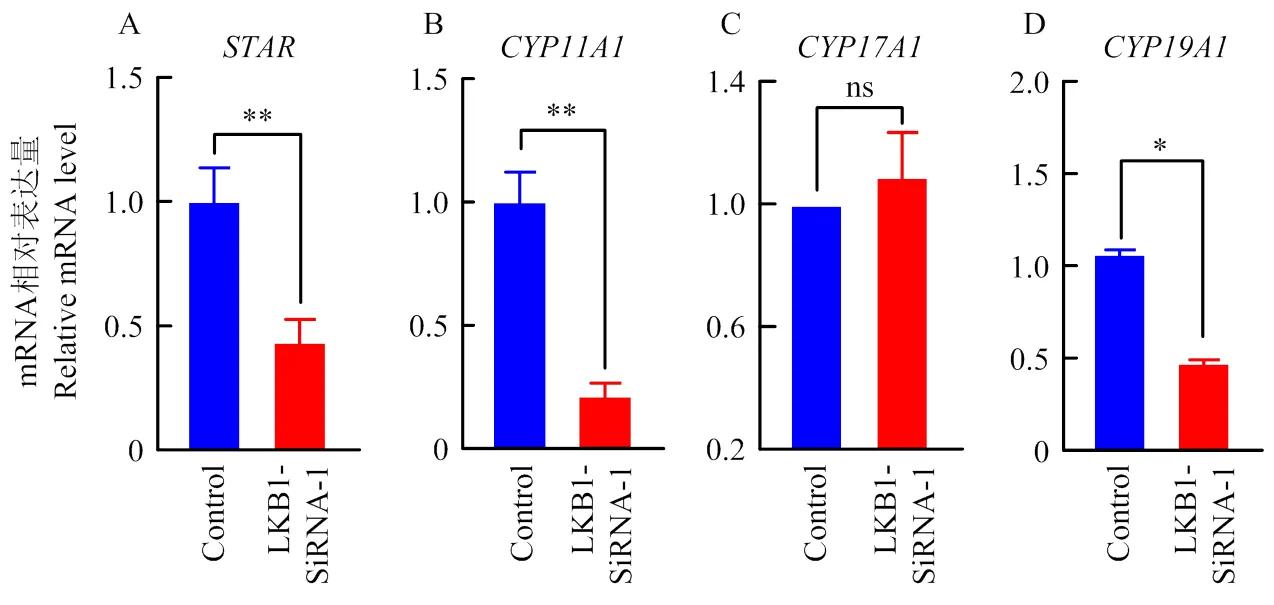
* P < 0.05, ** P < 0.01, ns P > 0.05,双尾t检验法。下同

A:Control和LKB1-OE处理组颗粒细胞中绿色荧光蛋白的表达;B:LKB1的过表达效率检测
待细胞融合度至80%,腺病毒感染牛卵巢颗粒细胞,培养48 h后收集细胞,qRT-PCR检测与雌激素生产相关的基因。研究结果显示过表达显著上调的表达,与对照相比,分别上调了约2.5、1.5倍(<0.01,图6-A和B),然而,过表达对的表达量没有影响(图6-C),过表达对显著上调了约3倍(图6-D)同时收集颗粒细胞的培养液上清,检测颗粒细胞雌二醇的分泌,结果显示过表达显著提高培养基中雌二醇的浓度(<0.05,图6-E)。以上研究结果表明过表达提高了颗粒细胞类固醇合成基因的表达及雌二醇的分泌。

图6 过表达LKB1对类固醇激素合成相关基因表达及E2分泌的影响
3 讨论
3.1 LKB1蛋白在卵泡颗粒细胞中高表达
首先对牛的卵泡进行免疫组织化学分析,发现在牛卵泡上均有表达,但在卵泡颗粒细胞的表达量显著高于卵泡膜细胞。在卵泡中,颗粒细胞之间通过同源缝隙相连,使整个卵泡(包括卵母细胞)形成一个功能合胞。颗粒细胞一方面通过缝隙连接为卵母细胞提供营养、代谢前体和信号分子[19];另一方面颗粒细胞将卵泡膜细胞分泌的雄激素,经过芳香化酶的作用合成雌激素[20-22],对卵泡的发育和成熟起关键作用。然而,颗粒细胞类固醇激素分泌功能异常,将会导致多囊卵巢综合症[23]、卵巢早衰[24]和子宫内膜异位[25]等症状。本试验发现在整个卵泡中,LKB1蛋白在颗粒细胞的表达量较高,提示在颗粒细胞类固醇激素的合成功能中具有重要作用。
3.2 LKB1基因在动物卵泡发育中的调控作用
近年来,功能的研究主要集中在肿瘤发生、细胞周期与极性的调控[26-30]以及机体能量代谢[31-32]。在调控卵巢功能方面,目前已证明在人、果蝇和小鼠卵巢中均表达[33],果蝇中调控卵巢上皮卵泡干细胞的极性[33]。在线虫中的研究显示,未成熟的卵母细胞具有较高的LKB1激酶活性,磷酸化AMPK的T172位点,激活AMPK的活性;相反的,成熟的卵母细胞中及AMPK的活性下降[34]。以基因敲除小鼠为模型,特异敲除原始卵泡卵母细胞中,导致原始卵泡被过度激活,提前激活的卵泡发育异常不能成熟,且大量死亡,导致原始卵泡库过早耗竭从而引发卵巢早衰,表明LKB1基因是体内卵母细胞成熟的必需调控因子[18]。以上研究显示LKB1基因可在卵巢中不同细胞类型发挥生物学功能,但其在卵泡颗粒细胞中的功能未知。
3.3 LKB1基因对颗粒细胞雌激素生成的作用
为了探究颗粒细胞类固醇激素生成的调控,本研究培养牛原代颗粒细胞。前人的研究表明促卵泡激素受体(FSHR)是颗粒细胞的标志蛋白[35-36]。因此,采用FSHR抗体的细胞免疫荧光方法鉴定颗粒细胞,颗粒细胞的纯度达95%。以该细胞为实验材料,干扰LKB1基因,抑制类固醇激素合成相关基因的表达。相反的,过表达LKB1基因,促进这些基因的表达,并提高了雌二醇的分泌能力。2019年XU等的研究与本研究结果一致,显示小鼠颗粒细胞中转染过表达质粒,上调雌激素合成关键基因的表达,促进颗粒细胞雌激素的分泌;而沉默抑制雌激素的分泌[17]。此外,该研究也发现膜细胞过表达,下调雄激素合成关键基因的表达,抑制雄激素的合成[17]。本研究中也检测了的表达量,虽然qPCR技术检测CT值超过32,发现颗粒细胞中的表达没有变化,但也从侧面印证笔者分离的细胞不是膜细胞。上述在颗粒细胞与膜细胞的功能研究与本研究LKB1基因在牛卵泡中两种细胞类型的表达差异吻合。在卵泡成熟过程中,需要大量雌激素的合成,故本研究发现在卵泡颗粒细胞中的表达量显著高于膜细胞。
3.4 LKB1基因影响颗粒细胞雌激素合成潜在的信号通路
大量研究发现腺苷酸活化蛋白激酶(adenosine 5′-monophosphate(AMP)-activated protein kinase,AMPK)是LKB1激酶的经典靶标,其可增强AMPK的磷酸化水平,提高AMPK激酶活性,参与多种生物学过程[7]。在牛和大鼠中,使用二甲双胍处理卵巢颗粒细胞可增强AMPK的酶活,但降低类固醇激素合成相关基因的表达,减少雌二醇和孕酮的分泌[37-39]。然而,本研究发现过表达提高了类固醇合成相关基因及雌二醇的分泌,研究结果提示调控牛卵巢颗粒细胞的功能可能不通过调控AMPK激酶的活性发挥作用。小鼠的颗粒细胞研究结果显示,过表达提高胰岛素信号通路关键分子胰岛素受体底物(insulin receptor substrate,IRS)、胰岛素样生长因子1(insulin like growth factor1,IGF1)的磷酸化水平,促进雌激素的合成与分泌,阻断胰岛素信号通路,促进雌激素合成的能力减弱[17]。在牛卵巢颗粒细胞中,是否通过IGF1信号通路影响类固醇激素合成及分泌,有待进一步的研究。
4 结论
LKB1蛋白在卵泡颗粒细胞中的表达量显著高于膜细胞;沉默LKB1基因,抑制颗粒细胞类固醇激素合成相关基因(STAR 和CYP11A1)的表达。相反的,过表达LKB1基因促进上述基因的表达水平,并提高了颗粒细胞雌二醇的分泌能力。本研究为LKB1基因作为母牛繁殖生理调控的新靶点提供理论依据。
[1] ALAM M H, MIYANO T. Interaction between growing oocytes and granulosa cells. Reproductive Medicine and Biology, 2019, 19(1): 13-23. doi:10.1002/rmb2.12292.
[2] EL-HAYEK S, YANG Q, ABBASSI L, FITZHARRIS G, CLARKE H J. Mammalian oocytes locally remodel follicular architecture to provide the foundation for germline-soma communication. Current Biology: CB, 2018, 28(7): 1124-1131.e3. doi:10.1016/j.cub.2018.02. 039.
[3] SAADELDIN I M, ELSAYED A, KIM S J, MOON J H, LEE B C. A spatial model showing differences between juxtacrine and paracrine mutual oocyte-granulosa cells interactions. Indian Journal of Experimental Biology, 2015, 53(2): 75-81.
[4] FANG L L, YU Y P, ZHANG R Z, HE J Y, SUN Y P. Amphiregulin mediates hCG-induced StAR expression and progesterone production in human granulosa cells. Scientific Reports, 2016, 6: 24917. doi:10.1038/srep24917.
[5] WU S G, SUN H X, ZHANG Q, JIANG Y, FANG T, CUI I, YAN G J, HU Y L. microRNA-132 promotes estradiol synthesis in ovarian granulosa cells via translational repression of Nurr1. Reproductive Biology and Endocrinology: RB&E, 2015, 13: 94. doi:10.1186/ s12958-015-0095-z.
[6] REDDY P, ZHENG W J, LIU K. Mechanisms maintaining the dormancy and survival of mammalian primordial follicles. Trends in Endocrinology and Metabolism: TEM, 2010, 21(2): 96-103. doi:10. 1016/j.tem.2009.10.001.
[7] SHACKELFORD D B, SHAW R J. The LKB1–AMPK pathway: metabolism and growth control in tumour suppression. Nature Reviews Cancer, 2009, 9(8): 563-575. doi:10.1038/nrc2676.
[8] LIANG X Y, WANG P L, GAO Q, TAO X H. Exogenous activation of LKB1/AMPK signaling induces G1arrest in cells with endogenous LKB1 expression. Molecular Medicine Reports, 2014, 9(3): 1019-1024. doi:10.3892/mmr.2014.1916.
[9] LIU M L, CHEN J D, HUANG H F, ZENG Y, FENG X M, SHI M X. Lkb1 is an important regulator of Treg differentiation and proliferation of amniotic mesenchymal stem cells. Biochemical and Biophysical Research Communications, 2020, 521(2): 434-440. doi:10.1016/j.bbrc. 2019.09.129.
[10] SWISA A, GRANOT Z, TAMARINA N, SAYERS S, BARDEESY N, PHILIPSON L, HODSON D J, WIKSTROM J D, RUTTER G A, LEIBOWITZ G, GLASER B, DOR Y. Loss of liver kinase B1 (LKB1) in beta cells enhances glucose-stimulated insulin secretion despite profound mitochondrial defects. The Journal of Biological Chemistry, 2015, 290(34): 20934-20946. doi:10.1074/jbc.M115.639237.
[11] SHAN T Z, XIONG Y, ZHANG P P, LI Z G, JIANG Q Y, BI P P, YUE F, YANG G S, WANG Y Z, LIU X Q, KUANG S H. Lkb1 controls brown adipose tissue growth and thermogenesis by regulating the intracellular localization of CRTC3. Nature Communications, 2016, 7: 12205. doi:10.1038/ncomms12205.
[12] TIMILSHINA M, YOU Z W, LACHER S M, ACHARYA S, JIANG L Y, KANG Y, KIM J A, CHANG H W, KIM K J, PARK B, SONG J H, KO H J, PARK Y Y, MA M J, NEPAL M R, JEONG T C, CHUNG Y, WAISMAN A, CHANG J H. Activation of mevalonate pathway via LKB1 is essential for stability of treg cells. Cell Reports, 2019, 27(10): 2948-2961.e7. doi:10.1016/j.celrep.2019.05.020.
[13] 熊燕. Lkb1调控棕色脂肪组织的功能及机制研究[D]. 杨凌: 西北农林科技大学, 2017.
XIONG Y. Investigating the role and mechanism of LKb1 in brown adipose tissue[D]. Yangling: Northwest A & F University, 2017. (in Chinese)
[14] HEMMINKI A. The molecular basis and clinical aspects of Peutz- Jeghers syndrome. Cellular and Molecular Life Sciences: CMLS, 1999, 55(5): 735-750. doi:10.1007/s000180050329.
[15] ZHOU F, LV B J, DONG L F, WAN F, QIN J L, HUANG L L. Multiple genital tract tumors and mucinous adenocarcinoma of colon in a woman with Peutz-Jeghers syndrome: a case report and review of literatures. International Journal of Clinical and Experimental Pathology, 2014, 7(7): 4448-4453.
[16] LEGRO R S, BARNHART H X, SCHLAFF W D, CARR B R, DIAMOND M P, CARSON S A, STEINKAMPF M P, COUTIFARIS C, MCGOVERN P G, CATALDO N A, GOSMAN G G, NESTLER J E, GIUDICE L C, EWENS K G, SPIELMAN R S, LEPPERT P C, MYERS E R, NETWORK F T R M. Ovulatory response to treatment of polycystic ovary syndrome is associated with a polymorphism in the STK11 gene. The Journal of Clinical Endocrinology & Metabolism, 2008, 93(3): 792-800. doi:10.1210/jc.2007-1736.
[17] XU Y, GAO Y X, HUANG Z F, ZHENG Y, TENG W J, ZHENG D Y, ZHENG X H. LKB1 suppresses androgen synthesis in a mouse model of hyperandrogenism via IGF-1 signaling. FEBS Open Bio, 2019, 9(10): 1817-1825. doi:10.1002/2211-5463.12723.
[18] JIANG Z Z, HU M W, MA X S, SCHATTEN H, FAN H Y, WANG Z B, SUN Q Y. LKB1 acts as a critical gatekeeper of ovarian primordial follicle pool. Oncotarget, 2016, 7(5): 5738-5753. doi:10.18632/oncotarget. 6792.
[19] YAMOCHI T, HASHIMOTO S, MORIMOTO Y. Mural granulosa cells support to maintain the viability of growing porcine oocytes and its developmental competence after insemination. Journal of Assisted Reproduction and Genetics, 2021, 38(10): 2591-2599. doi:10.1007/ s10815-021-02212-2.
[20] CLARKE H J. Regulation of germ cell development by intercellular signaling in the mammalian ovarian follicle. Wiley Interdisciplinary Reviews: Developmental Biology, 2018, 7(1): e294. doi:10.1002/ wdev.294.
[21] 张金璧, 姚望, 潘增祥, 刘红林. FSH处理对猪颗粒细胞中类固醇合成酶基因的表达及其调控区组蛋白H3修饰的影响. 中国农业科学, 2018, 51(18): 3582-3590. doi:10.3864/j.issn.0578-1752.2018. 18.014.
ZHANG J B, YAO W, PAN Z X, LIU H L. Effects of FSH treatment on steroidogenic enzymes expression and histone H3 modification in pig granulosa cells. Scientia Agricultura Sinica, 2018, 51(18): 3582-3590. doi:10.3864/j.issn.0578-1752.2018.18.014. (in Chinese)
[22] 李海军, 靳木子, 张睿彪, 杜晨光, 刘东军, 仓明. 卵丘细胞凋亡与增殖对牛卵母细胞体外发育的影响. 中国农业科学, 2011, 44(8): 1702-1709.
LI H J, JIN M Z, ZHANG R B, DU C G, LIU D J, CANG M. Effect of cumulus cell apoptosis and proliferation on bovine oocyte development. Scientia Agricultura Sinica, 2011, 44(8): 1702-1709. (in Chinese)
[23] YILMAZ B, VELLANKI P, ATA B, YILDIZ B O. Metabolic syndrome, hypertension, and hyperlipidemia in mothers, fathers, sisters, and brothers of women with polycystic ovary syndrome: a systematic review and meta-analysis. Fertility and Sterility, 2018, 109(2): 356-364.e32. doi:10.1016/j.fertnstert.2017.10.018.
[24] LV S J, HOU S H, GAN L, SUN J. Establishment and mechanism study of a primary ovarian insufficiency mouse model using lipopolysaccharide. Analytical Cellular Pathology, 2021, 2021: 1781532. doi:10.1155/2021/1781532.
[25] TANG Z R, ZHANG R, LIAN Z X, DENG S L, YU K. Estrogen-receptor expression and function in female reproductive disease. Cells, 2019, 8(10): 1123. doi:10.3390/cells8101123.
[26] BYEKOVA Y A, HERRMANN J L, XU J M, ELMETS C A, ATHAR M. Liver kinase B1 (LKB1) in the pathogenesis of UVB-induced murine basal cell carcinoma. Archives of Biochemistry and Biophysics, 2011, 508(2): 204-211. doi:10.1016/j.abb.2011.01.006.
[27] MARTELLI A M, CHIARINI F, EVANGELISTI C, OGNIBENE A, BRESSANIN D, BILLI A M, MANZOLI L, CAPPELLINI A, MCCUBREY J A. Targeting the liver kinase B1/AMP-activated protein kinase pathway as a therapeutic strategy for hematological malignancies. Expert Opinion on Therapeutic Targets, 2012, 16(7): 729-742. doi:10.1517/14728222.2012.694869.
[28] ALESSI D R, SAKAMOTO K, BAYASCAS J R. LKB1-dependent signaling pathways. Annual Review of Biochemistry, 2006, 75: 137-163. doi:10.1146/annurev.biochem.75.103004.142702.
[29] SPICER J, ASHWORTH A. LKB1 kinase: master and commander of metabolism and polarity. Current Biology, 2004, 14(10): R383-R385. doi:10.1016/j.cub.2004.05.012.
[30] LAI D M, CHEN Y F, WANG F Y, JIANG L Z, WEI C S. LKB1 controls the pluripotent state of human embryonic stem cells. Cellular Reprogramming, 2012, 14(2): 164-170. doi:10.1089/cell.2011.0068.
[31] SHAN T Z, ZHANG P P, LIANG X R, BI P P, YUE F, KUANG S H. Lkb1 is indispensable for skeletal muscle development, regeneration, and satellite cell homeostasis. Stem Cells, 2014, 32(11): 2893-2907. doi:10.1002/stem.1788.
[32] LI Z, WANG C H, ZHU J, BAI Y, WANG W, ZHOU Y F, ZHANG S Z, LIU X X, ZHOU S, HUANG W T, BI Y Y, WANG H. The possible role of liver kinase B1 in hydroquinone-induced toxicity of murine fetal liver and bone marrow hematopoietic stem cells. Environmental Toxicology, 2016, 31(7): 830-841. doi:10.1002/tox.22094.
[33] NATH-SAIN S, MARIGNANI P A. LKB1 catalytic activity contributes to estrogen receptor alpha signaling. Molecular Biology of the Cell, 2009, 20(11): 2785-2795. doi:10.1091/mbc.e08-11-1138.
[34] STRICKER S A. Potential upstream regulators and downstream targets of AMP-activated kinase signaling during oocyte maturation in a marine worm. Reproduction (Cambridge, England), 2011, 142(1): 29-39. doi:10.1530/REP-10-0509.
[35] 凌英会, 朱露, 吴昊, 陈青, 权青, 刘勇, 李文雍, 张运海. 山羊FST慢病毒载体构建及其对卵巢卵泡颗粒细胞增殖的影响. 畜牧兽医学报, 2019, 50(9): 1888-1896. doi:10.11843/j.issn.0366-6964. 2019.09.017.
LING Y H, ZHU L, WU H, CHEN Q, QUAN Q, LIU Y, LI W Y, ZHANG Y H. Construction of goat FSTvectors and its effect on the proliferation of ovarian follicular granulosa cells. Acta Veterinaria et Zootechnica Sinica, 2019, 50(9): 1888-1896. doi:10. 11843/j.issn.0366-6964.2019.09.017. (in Chinese)
[36] 朱丽, 郭成志, 邓思君, 鲁银, 魏强, 袁慧. 猪卵巢颗粒细胞分离培养及鉴定. 中国兽医杂志, 2011, 47(4): 21-22, 98. doi:10. 3969/j.issn.0529-6005.2011.04.008.
ZHU L, GUO C Z, DENG S J, LU Y, WEI Q, YUAN H. Isolation, culture and identification of porcine ovary granulose cells. Chinese Journal of Veterinary Medicine, 2011, 47(4): 21-22, 98. doi:10. 3969/j.issn.0529-6005.2011.04.008. (in Chinese)
[37] TOSCA L, CHABROLLE C, UZBEKOVA S, DUPONT J. Effects of metformin on bovine granulosa cells steroidogenesis: possible involvement of adenosine 5' monophosphate-activated protein kinase (AMPK). Biology of Reproduction, 2007, 76(3): 368-378. doi:10. 1095/biolreprod.106.055749.
[38] TOSCA L, RAMÉ C, CHABROLLE C, TESSERAUD S, DUPONT J. Metformin decreases IGF1-induced cell proliferation and protein synthesis through AMP-activated protein kinase in cultured bovine granulosa cells. Reproduction (Cambridge, England), 2010, 139(2): 409-418. doi:10.1530/REP-09-0351.
[39] TOSCA L, SOLNAIS P, FERRÉ P, FOUFELLE F, DUPONT J. Metformin-induced stimulation of adenosine 5' monophosphate- activated protein kinase (PRKA) impairs progesterone secretion in rat granulosa Cells. Biology of Reproduction, 2006, 75(3): 342-351. doi:10.1095/biolreprod.106.050831.
Regulates Steroids Synthesis Related Genes Expression in Bovine Granulosa Cells

1Key Laboratory of Qinghai-Tibetan Plateau Animal Genetic Resource Reservation and Utilization, Ministry of Education,Chengdu 610041;2Key Laboratory of Qinghai-Tibetan Plateau Animal Genetic Resource Reservation and Utilization, Chengdu 610041;3Key Laboratory of Animal Science of State Ethnic Affairs Commission, Southwest Minzu University, Chengdu 610041
【Background】The Steroids synthesis capacity of ovarian granulosa cells plays the important roles in the development and maturation of follicles, however, the key regulators were involved in this process remains largely unknown. Our previously research reported that Liver kinase B1 (LKB1) influenced the cellular lipid metabolism, which is close associated with steroids synthesis. Further, another study showed that knockout ofcaused premature ovarian failure in mice. 【Objective】The aim of this study was to study the expression pattern of,and provided a theoretical basis for the research of the reproductive physiological regulation in the cow.【Method】The expression pattern of LKB1 in follicle was detected by immunohistochemically assay. Then the primary follicular granulosa cells were isolated and identified by immunofluorescence staining incubated by follicle stimulating hormone receptor (FSHR) antibody. Next, these verified granulosa cells were used as the cell model. On one hand, LKB1 loss-of-function was mediated by siRNAs. qRT-PCR was performed to measureregulation of steroid hormone synthesis related genes expression. On the other hand, LKB1 gain-of-function was mediated by adenovirus. qRT-PCR and ELISA analysis were carried out to confirm the changes of above detected genes influenced by LKB1 and estradiol (E2) secretion, respectively. 【Result】The data showed that: 1) LKB1 protein expressed in all cell types of follicles and the positive signal in granulosa cells is significantly higher than that of theca cells, which is verified by quantitative analysis. 2) The morphology of isolated bovine follicular granulosa cells was shape of round, which were specifically labeled by follicle stimulating hormone receptor (FSHR) using immunofluorescence staining, with 95% of positive cells. 3) The interference efficiency of LKB1 treated by siRNA1 and siRNA2 was respectively 48% (<0.05) and 52% (<0.05) to that of control. Knockdown of LKB1 significantly down-regulated mRNA levels of(<0.01),(<0.01) and<, with the 60%, 80% and 50% decrease to those of the control. 4) The highly infected efficiency was observed infected by LKB1-OE and control adenovirus. In contrast, overexpression ofdramatically increased mRNA levels of(<0.01),(<0.01) and<, which was associated with elevation of E2 secretion. 【Conclusion】In summary,was highly expressed in follicular granulosa cells, which promoted the expression of steroids synthesis related genes and E2 secretion. This result provides directly theoretical evidence for theregulation of steroids hormone synthesis in bovine.
; bovine; granulosa cells; steroid hormone; ovary
2021-04-07;
2022-03-29
四川省科技计划(2019YJ0258)、国家自然科学基金(31902154)、国家重点研发专项(2018YFD0502304)、西南民族大学中央高校基本科研业务费专项(2021PTJS20&2021PTJS26)
张静,Tel:17844618658;E-mail:zjing2513338252@163.com。通信作者熊燕,E-mail:xiongyan0910@126.com。通信作者杨丽雪,E-mail:yanglixue_79@163.com
10.3864/j.issn.0578-1752.2022.10.015
(责任编辑 林鉴非)
