藜麦蛋白Pickering乳液添加对鱼糜蛋白凝胶冻融稳定性的影响
2022-06-28冯潇张帆陈颖成佳欣岑凯悦汤晓智
冯潇,张帆,陈颖,成佳欣,岑凯悦,汤晓智
藜麦蛋白Pickering乳液添加对鱼糜蛋白凝胶冻融稳定性的影响

南京财经大学食品科学与工程学院/江苏省现代粮食流通与安全协同创新中心/江苏高校粮油质量安全控制及深加工重点实验室,南京 210023
【目的】基于藜麦蛋白Pickering乳液的冻融稳定性,探究其加入到鱼糜蛋白凝胶中提高鱼肉蛋白凝胶冻融稳定性的可行性,拟解决运输存储中温度波动造成鱼糜蛋白凝胶产品质量受损的问题。【方法】制备藜麦蛋白Pickering乳液,分散于鱼糜中并加热制备成蛋白凝胶,然后对鱼糜蛋白凝胶进行3次冻融循环,分别测量冻融前后鱼糜蛋白凝胶的质构、色度和水分分布,测定3次冻融后的汁液流失以及凝胶中的冰晶分布。【结果】藜麦蛋白Pickering乳液添加在提高鱼糜凝胶亮度和白度的同时,抑制了冻融循环引起的色度变化,并且延缓了凝胶在冻融中硬度和咀嚼度的变化速率。藜麦蛋白Pickering乳液的添加对于冻融前鱼糜凝胶的水分分布没有影响,但是显著增加了冻融循环后鱼糜凝胶中不易流动水的比例,减少了自由水的比例,从而减少了鱼糜凝胶冻融后的汁液流失。冰晶结果显示,乳液的添加可以显著降低冰晶的直径,从而减少冰晶对肌肉组织造成的损害以及自由水的生成。【结论】藜麦蛋白Pickering乳液的添加削弱了冻融对凝胶颜色及质构的影响,保持了凝胶的网络结构,提高了鱼糜凝胶的冻融稳定性,保持了冷冻鱼糜产品的品质及营养价值。藜麦蛋白Pickering乳液有望成为新型的抗冻剂应用于冷冻食品中。
藜麦蛋白;Pickering乳液;冻融稳定性;蛋白凝胶
0 引言
【研究意义】鱼糜凝胶制品营养价值高、脂肪含量低、食用方便,深受消费者喜爱[1-2]。冷冻是长期保存鱼糜凝胶制品的一种普遍方式[3],但在实际储藏、运输过程中,温度的浮动使鱼糜凝胶制品经历多次冻融循环,使肌肉组织在冰晶反复形成和融化的过程中被破坏,导致质构和内部水分分布的变化,造成汁液流失,严重影响鱼糜凝胶的品质[4-5]。因此,除了尽量减少鱼糜产品反复冻融的次数外,还应寻找合适的绿色添加物,可以有效抑制鱼糜蛋白凝胶因冻融循环引起的品质下降。【前人研究进展】蔗糖的添加可以提高鱼糜制品的冻融稳定性,但是热量高、甜度大。GAO等[6]发现可溶性大豆多糖在鱼糜中的添加及液氮冷冻处理(-80℃)可以显著减少大冰晶的生成并减少肌球蛋白重链在冷冻过程中的降解,但液氮的成本较高。LIN等[7]研究表明鳙鱼腮部蛋白的水解物可以防止鱼糜在冷冻中的变性。大豆卵磷脂脂质体与海藻糖作为抗冻剂也可以提高鳕鱼肌肉蛋白凝胶的保水性,但是大豆卵磷脂脂质体通过介入蛋白质之间的相互作用阻碍了分子间键的形成,影响了凝胶网络结构的形成,从而降低了鱼肉蛋白凝胶的凝胶强度[8]。肖旭华[9]研究米渣及米渣蛋白对鱼肉蛋白凝胶反复冻融后的影响,发现虽然添加米渣蛋白能改善鱼肉蛋白凝胶特性,但不能扭转或延缓鱼肉蛋白凝胶冻融后颜色变化、保水性下降、质构劣变的趋势。藜麦蛋白中氨基酸种类丰富,含有人体必需的9种氨基酸及其他非必需氨基酸,可以制备较稳定的Pickering乳液,并具有良好的冻融稳定性[10],乳液加热凝胶后由于界面蛋白的交联使界面更加稳定,也具备良好的冻融稳定性[11]。【本研究切入点】基于藜麦蛋白Pickering乳液及其凝胶具有良好的冻融稳定性,探究藜麦蛋白Pickering乳液在鱼糜中的均匀分散是否可以提高鱼糜凝胶的冻融稳定性及其机理。国内外尚未有关于添加Pickering乳液影响鱼糜凝胶冻融稳定性的报道,本研究有望为开发新型抗冻剂提供理论支持。【拟解决的关键问题】阐释藜麦蛋白Pickering乳液对鱼肉蛋白凝胶冻融循环过程中冰晶形成、水分迁移及分布的影响机制,分析Pickering乳液对鱼糜凝胶汁液流失、质构和颜色的影响,改善鱼糜凝胶的冻融稳定性。
1 材料与方法
试验于2020年6月至2021年6月在南京财经大学食品科学与工程学院进行。
1.1 材料与试剂
试剂:金线鱼鱼糜由佰腾国际贸易有限公司(青岛,中国)提供。玉米油、食用盐、玉米淀粉购于本地超市(南京,中国),藜麦蛋白(纯度≥90%)购于西安全奥生物科技有限公司(西安,中国)。鱼明胶购于武汉鹏垒生物科技有限公司,FSC22包埋剂购于美国徕卡公司。无水乙醇、福尔马林、曙红染色液均为分析纯试剂。
1.2 仪器与设备
高速剪切均质器T18,德国IKA公司;超声波分散仪Scientz-1500F,宁波新芝科技股份有限公司;高效冷冻离心机Avanti J-26XP,美国Beckman Coulter公司;TA-XT Plus质构仪,英国Stable Micro System公司;NM120-Analyst低场核磁共振仪,上海纽迈电子科技有限公司;色度仪,日本Konica Minolta公司;荧光显微镜Axio Scope A1,德国Carl Zeiss公司。
1.3 试验方法
1.3.1 藜麦蛋白Pickering乳液的制备 制备藜麦蛋白Pickering乳液参考文献[12],具体如下:称取4 g藜麦蛋白,溶解于200 mL去离子水中,再加入3.5 g NaCl,使盐离子浓度为300 mmol∙L-1,放在磁力搅拌器上搅拌,以900 r/min的速度搅拌4 h,用pH计调节溶液pH为7。在超声分散仪中以450 W超声处理20 min后加入玉米油,使水油比为1﹕3,用高速分散机均质,转速22 000 r/min,时间为3 min,即得到藜麦蛋白Pickering乳液。
1.3.2 不同乳液添加量的鱼糜蛋白凝胶制备 将制备好的藜麦蛋白Pickering乳液分别以2.5%、5%、7.5%和10%(w/w)的量加入到鱼糜中制得鱼糜蛋白凝胶,并以不添加乳液的作为对照组,每组凝胶的水分含量一致。鱼糜蛋白凝胶各组的成分见表1。
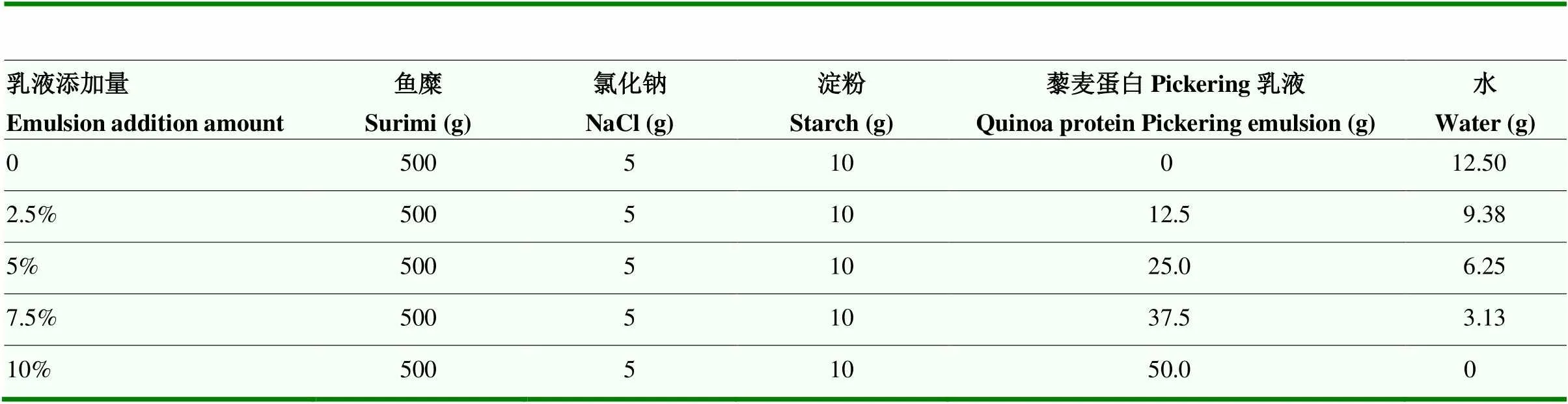
表1 添加了藜麦蛋白Pickering乳液的鱼糜蛋白凝胶成分表
1.3.3 冻融循环 冻融循环参考文献[9],并稍作修改。鱼糜蛋白凝胶在-18℃的冰箱中冷冻,5 d后取出在4℃下解冻12 h,如此循环3次。
1.3.4 冻融前后凝胶质构的测定 将鱼糜蛋白凝胶切成1.5 cm×1.5 cm×1.5 cm的立方体,用TA-XT Plus质构仪测定其质构特性。测试参数为:P25探头,触发力5 g,测试前、测试中和测试后速度分别为1.0 mm·s-1、1.0 mm·s-1、1.0 mm·s-1,压缩比50%。
1.3.5 冻融前后凝胶色度的测定 将鱼糜蛋白凝胶切成1.5 cm×1.5 cm×1.5 cm的立方体,用色差仪CM-5测定鱼糜凝胶的L*、a*、b*值。其中L*表示样品的亮度,a*值表示颜色的红绿值,b*值表示颜色的黄蓝值。白度(W)按以下公式进行计算[13]:

1.3.6 冻融后凝胶的水分分布 取鱼糜蛋白凝胶1 g(解冻后)置于核磁管中,使用Carr-Purcell-Meiboom- Gill(CPMG )脉冲序列测样品中的横向弛豫时间T2,每份样品重复采集3次信号。测试后,对横向弛豫数据进行拟合,计算每个峰的顶点时间和峰面积,分析鱼肉蛋白凝胶中不同水分的比例[14]。
1.3.7 冻融后凝胶的汁液流失 记录冻融前每一个蛋白凝胶的质量(W1),将冻融3次后的蛋白凝胶称重,记录为W2。汁液流失的计算公式如下:
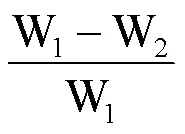
1.3.8 3次冷冻后凝胶的冰晶分布 将冷冻的鱼肉蛋白凝胶置于干冰上固定,切成5 mm的立方块并浸泡于溶液中(10%福尔马林,90%乙醇)以置换其中的冰晶并固定鱼糜凝胶中的蛋白质,24 h后嵌入溶解的鱼明胶中并被切成小块置于包埋介质中(FSC22),在干冰中冷冻并用薄片切片机切成5 μm的薄片,放置于载玻片上,使用1%的曙红溶液染色后用盖玻片盖上,置于显微镜下观察,通过Image J分析得出样品冰晶的平均直径、数目、总面积等参数[15]。
1.4 数据分析
采用IBM SPSS statistics 26软件对数据进行差异显著性分析,使用Origin 2019软件绘图。
2 结果
2.1 冻融前后凝胶的质构
图1可以看出,藜麦蛋白Pickering乳液的添加对鱼糜蛋白凝胶的回复力、弹性没有显著影响,但是对于凝胶的硬度和咀嚼度影响较大。随着乳液的添加,凝胶的硬度显著下降。当添加量增加到10%后,硬度和咀嚼度升高,可能是由于藜麦蛋白与肌原纤维蛋白交联产生二硫键导致[16]。3次冻融循环后,空白组与对照组的变化趋势出现差异。空白组在3次冻融循环后,硬度和咀嚼度下降,然而乳液添加量为2.5%—7.5%的鱼糜凝胶硬度反而比对照高。
2.2 冻融前后凝胶的色差
当藜麦蛋白Pickering乳液的添加量大于2.5%后,随着Pickering乳液添加量的增加,鱼糜蛋白凝胶冻融前后的亮度和白度逐渐提高,能够提高其消费者的接受度。当添加量为10%时,冷冻前的鱼糜凝胶亮度和白度分别为80.68和78.08,显著高于没有添加乳液的空白组(73.69和72.11)。另外,添加了藜麦蛋白Pickering乳液的鱼糜凝胶亮度和白度在冻融前后没有显著性差异,然而,没有添加乳液的鱼糜凝胶在经过3次冻融循环后,亮度和白度显著降低(表2)。表明藜麦蛋白Pickering乳液的添加,不仅提高了鱼糜凝胶的亮度及白度,也抑制了冻融循环引起的亮度值及白度值的下降,提高了鱼糜凝胶的冻融稳定性。
2.3 冻融前后凝胶的水分分布
低场核磁共振是测定鱼糜凝胶水分分布和组成最直接有效的方法,凝胶的水分状态直接影响其持水性进而影响鱼糜凝胶品质。弛豫时间T2反映鱼糜凝胶中氢质子受束缚力和自由度的大小,弛豫时间T2越长,氢质子受到的束缚力越小,即水分稳定性越差,越容易流动,且每个峰面积的比例表示鱼糜凝胶体系中不同状态水的含量[17]。
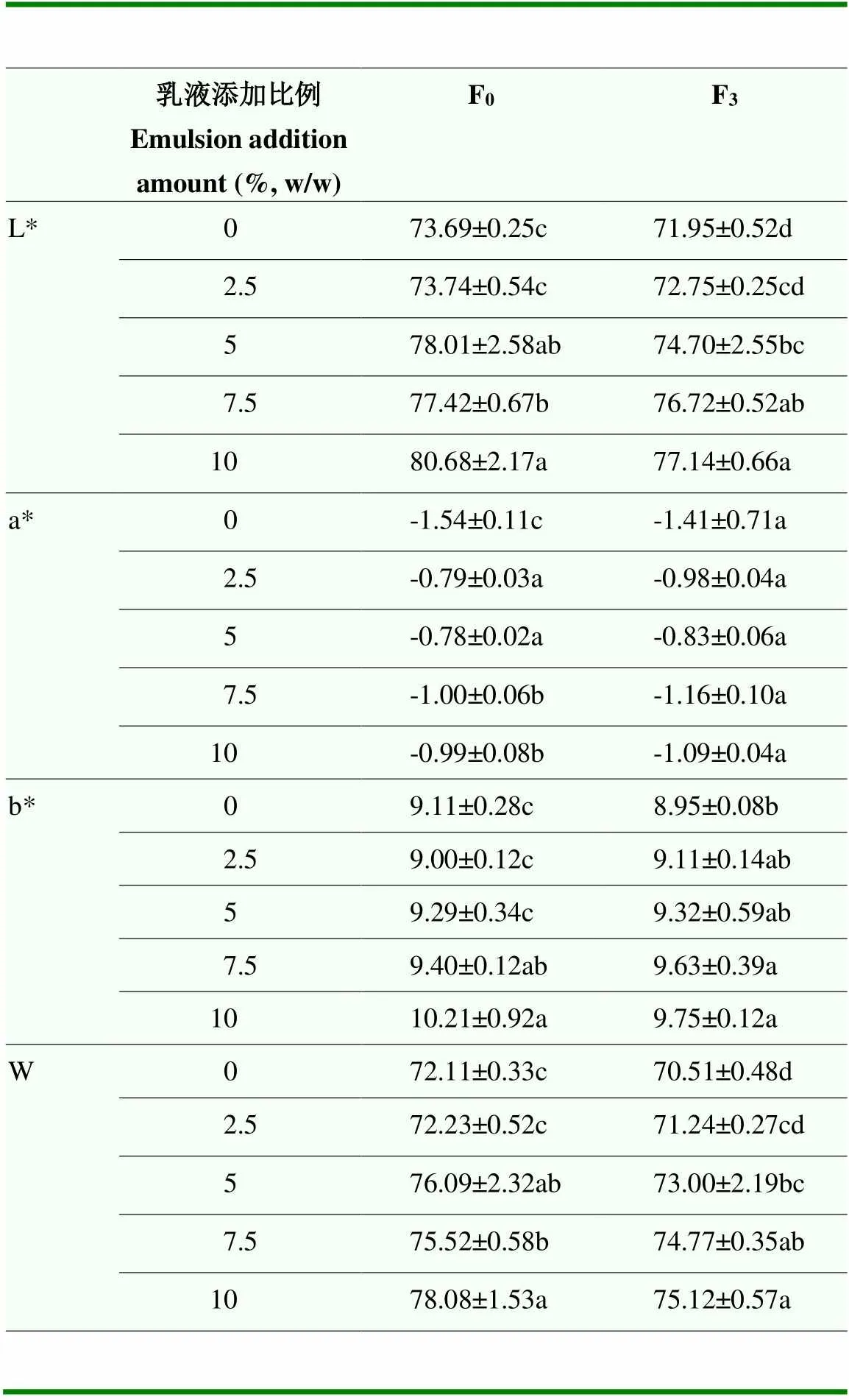
表2 藜麦蛋白Pickering乳液添加对鱼糜蛋白凝胶冻融前后色度的影响
F0代表冻融前凝胶,F3代表3次冻融循环后的凝胶。不同小写字母表示冻融前后不同添加量的鱼糜凝胶中色度指标的显著性差异(<0.05)。下同
F0represents surimi gel before freeze-thaw cycles, and F3represents surimi gel after freeze-thaw cycles. Different lowercase letters indicate significant differences of color properties among different groups before and after freeze-thaw cycles (<0.05). The same as below
由图2可知,弛豫时间T2在0—10 000 ms内出现3个峰值,T21(0—10 ms)表示与蛋白质等大分子紧密结合的水分,属于结合水;T22(10—300 ms)表示存在于凝胶三维网络结构中的水分,属于不易流动水;T23(300 ms之后)表示存在于凝胶三维网络结构外的水分,属于自由水[18]。从表3的数据发现,不同含量藜麦蛋白Pickering乳液的添加对冻融前鱼糜蛋白凝胶中不同水分的含量没有显著影响。
对比冻融循环前后各组的数据(表3),试验组和对照组鱼糜蛋白凝胶中结合水含量无显著性差异。然而,冻融后鱼糜凝胶中的不易流动水含量显著减少,自由水含量显著增加,说明冻融循环使鱼糜蛋白凝胶的不易流动水向自由水转化,水的流动性增加,持水力降低,造成了冻融后的汁液流失。当乳液添加量为7.5%和10%时,凝胶中不易流动水和自由水的含量没有显著性差异,而冻融后乳液添加量为7.5%的鱼糜凝胶中自由水含量(14.26%)显著低于乳液添加量为5%的鱼糜凝胶(17.40%)。

表3 藜麦蛋白Pickering 乳液添加对鱼糜凝胶冻融前后水分分布的影响
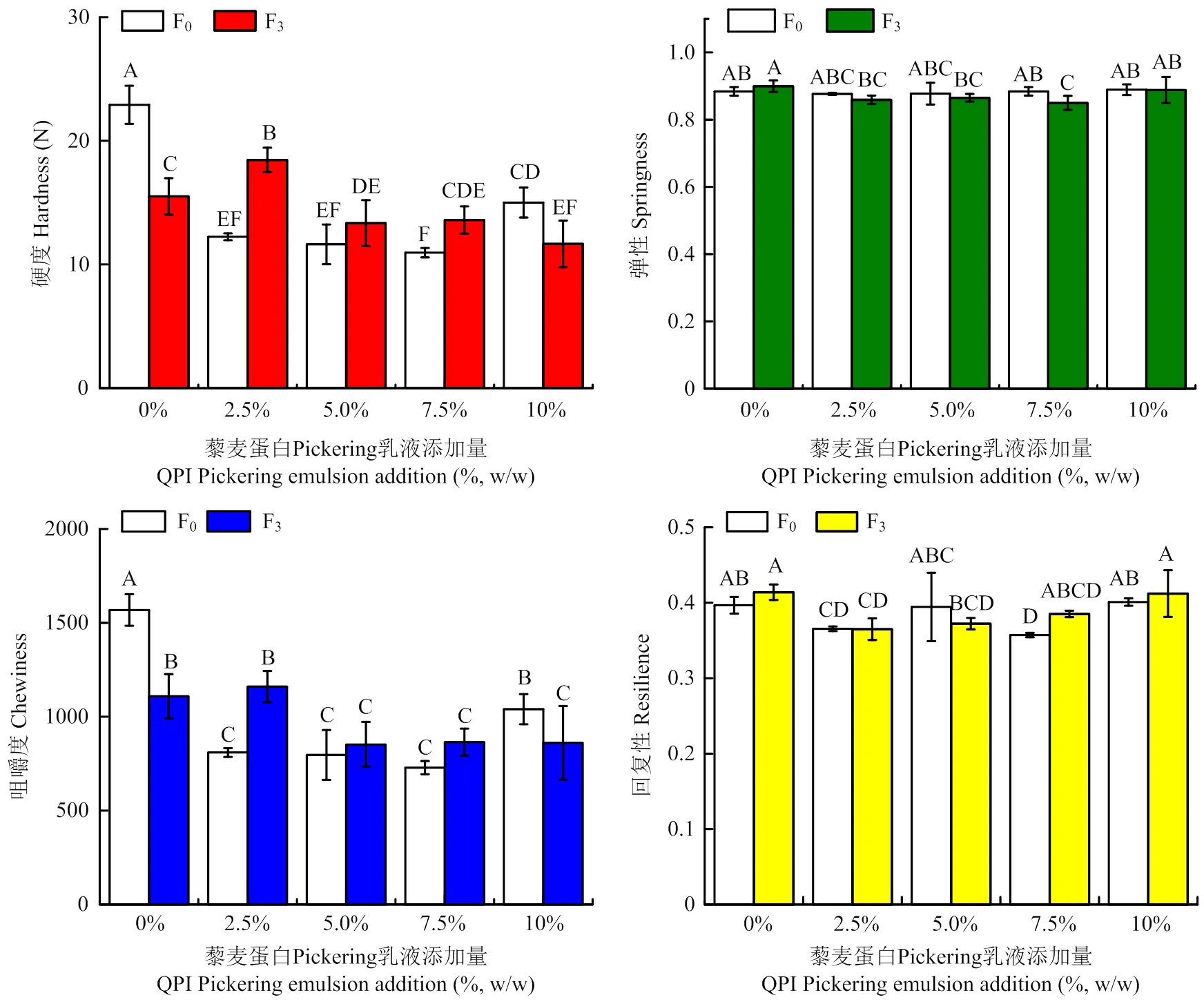
不同大写字母表示冻融前后不同添加量的鱼糜凝胶质构特性差异显著(P<0.05)。下同
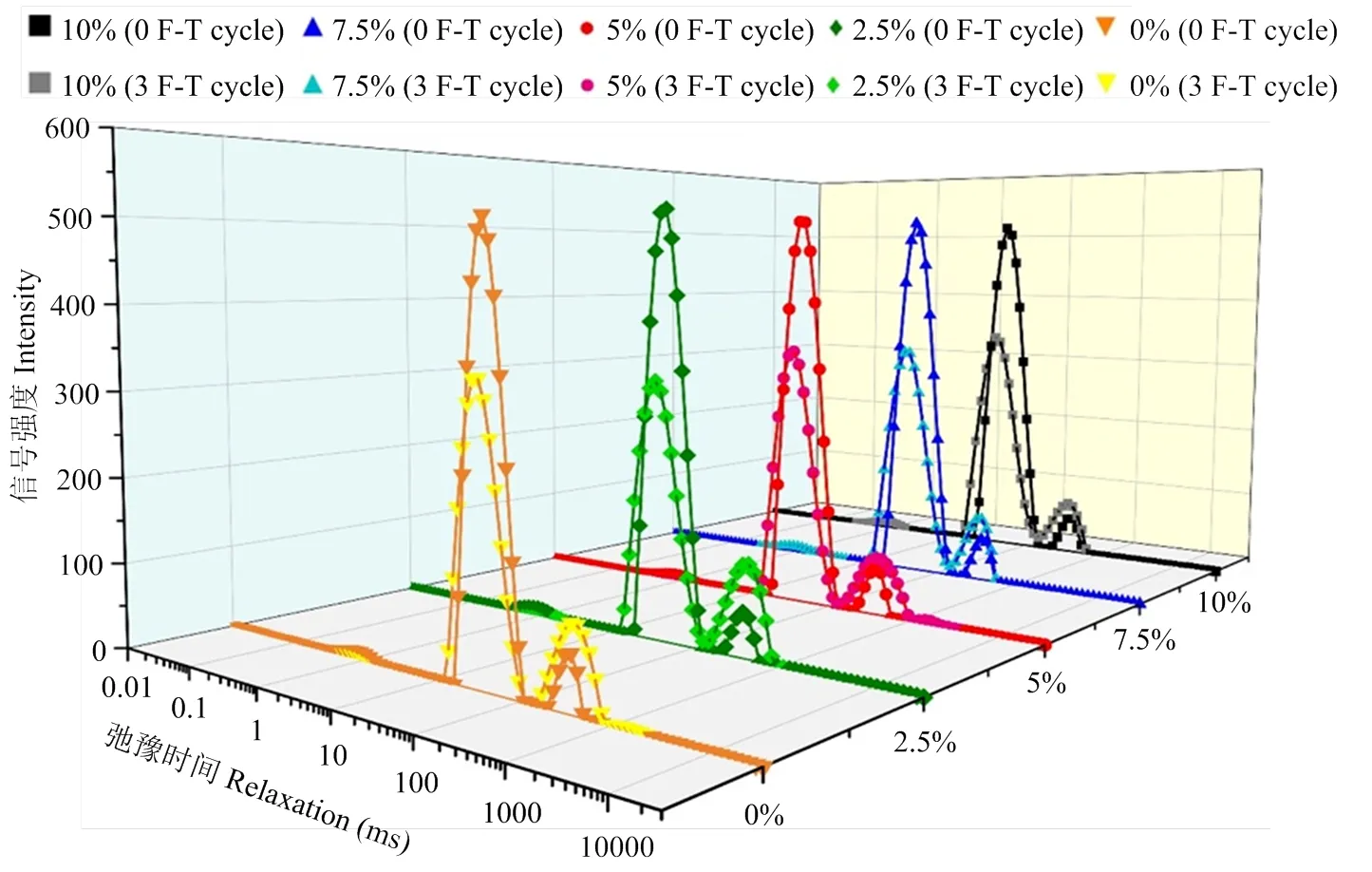
图2 鱼糜蛋白凝胶冻融前后的横向弛豫时间
图3显示藜麦蛋白Pickering乳液添加使鱼糜蛋白凝胶汁液流失显著降低,这与水分分布的结果相互对应,添加乳液后,凝胶中的不易流动水增加,自由水减少,进而降低了鱼糜蛋白凝胶反复冻融后的汁液流失,增强了鱼糜蛋白凝胶的保水性,降低了运输存储中温度变化导致的品质劣变,可以作为提升鱼糜凝胶制品冻融稳定性的新方法。
2.4 三次冷冻后凝胶中的冰晶分布
冰晶的尺度对于冷冻食品的品质十分关键,冰晶的快速生长及产生的膨胀压力会破坏肌肉组织的结构[19]。由图4可见,添加了藜麦蛋白Pickering乳液的鱼糜蛋白凝胶切片冰晶大小和分布与对照组存在明显差异。未添加乳液的对照鱼糜凝胶具有较大且不规则的冰晶,对肌原纤维蛋白造成一定程度的挤压。但随着藜麦蛋白Pickering乳液添加量从2.5%增加到10%时,鱼糜凝胶中的冰晶尺寸逐渐变小,且添加7.5%和10%藜麦蛋白乳液的鱼糜凝胶网络结构变得更加致密且均匀。ZHOU等[20]曾有类似报道,通过添加不同比例的脂肪作为填充剂能够改善肌原纤维蛋白的凝胶网络结构特性,网络结构更为致密。
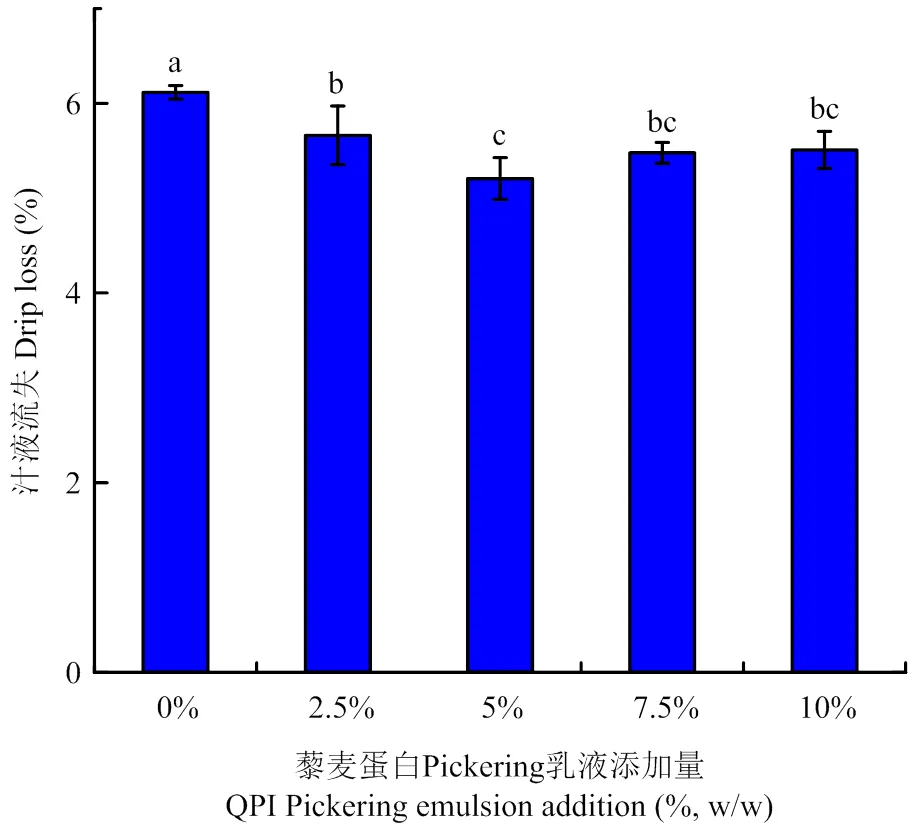
图3 藜麦蛋白Pickering乳液添加对鱼糜蛋白凝胶冻融后汁液流失的影响
未添加藜麦蛋白Pickering乳液的鱼糜蛋白凝胶的冰晶直径和总面积最大,分别为(8.79±0.05)μm和(242.50±2.81)μm2(<0.05)(表4),与显微镜图片中所观察的现象一致。
3 讨论
3.1 添加Pickering乳液影响鱼糜凝胶质构、颜色稳定性
LU等[21]研究表明花鲢鱼蛋白凝胶的硬度随着冷冻时间的延长先升高后降低,BUAMARD等[22]研究也表明在存储过程中,鱼糜凝胶的硬度和咀嚼度先上升后降低,可能因为在冷冻过程中二硫键的数量先升高后降低[21]。二硫键的形成使凝胶网络交联程度提高、硬度升高,然而随着冷冻时间增长,肌原纤维蛋白发生降解及碎片化,二硫键数量降低,凝胶的有序结构破坏,凝胶的硬度下降[21]。

图中比例尺为5 µm The scale bar in the graph is 5 µm
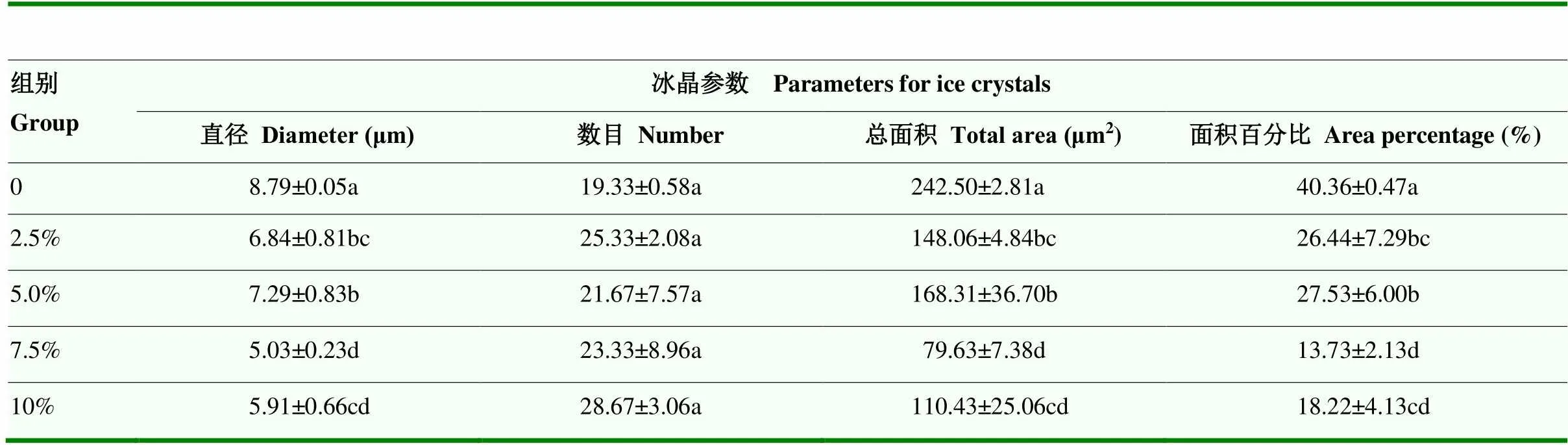
表4 藜麦蛋白Pickering乳液添加对鱼糜蛋白凝胶中冰晶分布的影响
Pickering乳液的添加减少了凝胶中冰晶的尺寸,降低了冰晶对肌肉蛋白的损害,减少了大冰晶生成引起的鱼糜凝胶中溶质浓度的升高,从而减少了溶质浓度升高引起的自由基的产生[23],减少了鱼糜凝胶中巯基的氧化及蛋白质的羰基化[18],延缓了肌原纤维蛋白质的氧化、变性及聚集[24],从而降低了凝胶质构的变化速率。值得一提的是,乳液添加量为10%的凝胶冻融3次后硬度下降,可能是因为乳液添加量大,油脂含量升高,在反复冷冻解冻过程中,油脂氧化产生的自由基数量增多,加速了硬度的变化速率。因此,从质构的结构分析,乳液的适宜添加量为2.5%—7.5%(w/w,乳液/鱼糜)。LI等[25]报道蛋白质变性的程度或凝胶的持水力会影响白度值。冻融循环引起的凝胶白度的降低归因于鱼肉蛋白变性引起的凝胶中自由水分的减少,使解冻后鱼肉的光反射降低。冻融循环后,加入藜麦蛋白Pickering乳液的鱼糜凝胶的白度值没有显著变化,说明Pickering乳液可以阻碍蛋白质的变性及凝胶中自由水分的减少。藜麦蛋白Pickering乳液的添加确实抑制了冰晶尺寸的增大,可以减小鱼肉肌原纤维蛋白质的变性程度,减少自由水的生成。
3.2 添加Pickering乳液影响鱼糜凝胶水分分布的稳定性
试验组和对照组鱼糜蛋白凝胶中结合水含量无显著性差异,是因为结合水与肌肉组织结合十分紧密,不易被脱去[26-27]。张诗雯等[28]研究表明冷冻过程会使不易流动水向自由水转变,削弱凝胶网络对水分子的束缚能力。与没有添加乳液的对照凝胶相比,藜麦蛋白Pickering乳液添加(>2.5%)显著增加了冻融后鱼糜凝胶中不易流动水的含量,且降低了自由水的含量,阻碍了冻融循环后不易流动水向自由水的转化,延缓了鱼糜凝胶持水力的降低,从而提高了鱼糜蛋白凝胶冻融后水分分布的稳定性。XU等[29]最新的研究也表明由蛋黄修饰的淀粉复合物乳化的高内向乳液在鸡肉凝胶中的添加增加了不易流动水且降低了流动水的含量,与本研究结果相吻合。这种现象可能是由于高内向乳液填充了鱼肉凝胶的网络结构,形成了更加紧密的结构,所以增加了鱼肉凝胶基质中的水分。因为10%的乳液添加对质构的负面影响,综合水分分布的结果得出乳液的适宜添加量为7.5%(w/w,乳液/鱼糜)。
3.3 添加Pickering乳液影响鱼糜凝胶的冰晶分布
冰晶的大小和均匀度对于冷冻食品的品质至关重要,冰晶的膨胀压力会对肌肉组织的结构造成不可逆转的损害[19]。随乳液浓度逐渐增加,鱼糜蛋白凝胶中冰晶的平均直径、总面积和面积百分比总体上呈下降趋势,在乳液添加量为7.5%和10%时冰晶的平均直径最小。因此,未添加藜麦蛋白Pickering乳液的鱼糜凝胶中冰晶颗粒大,对肌肉组织的损坏较大,导致了质构的变化速率快,使3次冻融后凝胶的硬度和咀嚼度显著低于冻融前。添加了藜麦蛋白Pickering乳液的鱼糜凝胶由于Pickering乳液的分布,导致冰晶颗粒减小,减小了对肌肉结构的破坏,可以延缓肌原纤维蛋白的变性及聚集,保持鱼糜凝胶的网络结构、保水性及质构,是提高鱼糜凝胶冻融稳定性的关键。
冰晶分布与水分分布的结果也相互对应,未添加乳液的鱼糜凝胶中形成的冰晶尺寸最大,解冻后自由水含量也越高。ZHANG等[30]也报道,冷冻-解冻-再冷冻会增加冰晶的尺度,造成对肌肉蛋白的损害、自由水的释放和汁液流失。然而当乳液添加量为7.5%— 10%时,凝胶中冰晶尺寸减小,自由水含量最低。结合质构、色度、水分分布等结果,藜麦蛋白Pickering乳液在鱼糜凝胶的最适添加量同样为7.5%。
4 结论
藜麦蛋白Pickering乳液的添加可以减少冻融引起的鱼糜蛋白凝胶色度、水分分布的变化、延缓质构的变化速率、减小冰晶的尺寸、降低鱼糜凝胶冻融后的汁液流失,提高了鱼糜凝胶的冻融稳定性。藜麦蛋白Pickering乳液通过抑制冰晶尺寸的增大阻碍了鱼糜凝胶中不易流动水向自由水的转化,从而稳定了凝胶中的水分分布,降低了汁液流失,进而提高了鱼糜凝胶的冻融稳定性。研究结果为Pickering乳液在冷冻食品中的应用,提供了一定的理论基础。
[1] FENG J H, CAO A L, CAI L Y, GONG L X, WANG J, LIU Y G, ZHANG Y H, LI J R. Effects of partial substitution of NaCl on gel properties of fish myofibrillar protein during heating treatment mediated by microbial transglutaminase. LWT-Food Science and Technology, 2018, 93: 1-8. doi:10.1016/j.lwt.2018.03.018.
[2] FENG X, TJIA J Y Y, ZHOU Y G, LIU Q, FU C L, YANG H S. Effects of tocopherol nanoemulsion addition on fish sausage properties and fatty acid oxidation. LWT-Food Science and Technology, 2020, 118: 108737. doi:10.1016/j.lwt.2019.108737.
[3] JIA R, KATANO T, YOSHIMOTO Y, GAO Y P, NAKAZAWA N, OSAKO K, OKAZAKI E. Effect of small granules in potato starch and wheat starch on quality changes of direct heated surimi gels after freezing. Food Hydrocolloids, 2020, 104: 105732. doi:10.1016/j. foodhyd.2020.105732.
[4] TAN M Q, LIN Z Y, ZU Y X, ZHU B W, CHENG S S. Effect of multiple freeze-thaw cycles on the quality of instant sea cucumber: emphatically on water status of by LF-NMR and MRI. Food Research International, 2018, 109: 65-71. doi:10.1016/j.foodres.2018.04.029.
[5] 周纷. 大黄鱼加工副产物的白鲢鱼糜凝胶品质特性的研究[D]. 上海: 上海海洋大学, 2020.
ZHOU F. Study on the quality characteristics of silver carp surimi gel prepared with large yellow croaker processing by-product [D]. Shanghai: Shanghai Ocean University, 2020. (in Chinese)
[6] GAO W H, HUANG Y P, ZENG X A, BRENNAN M A. Effect of soluble soybean polysaccharides on freeze-denaturation and structure of myofibrillar protein of bighead carp surimi with liquid nitrogen freezing. International Journal of Biological Macromolecules, 2019, 135: 839-844. doi:10.1016/j.ijbiomac.2019.05.186.
[7] LIN J, HONG H, ZHANG L T, ZHANG C, LUO Y K. Antioxidant and cryoprotective effects of hydrolysate from gill protein of bighead carp () in preventing denaturation of frozen surimi. Food Chemistry, 2019, 298: 124868. doi:10.1016/j. foodchem.2019.05.142.
[8] MARÍN-PEÑALVER D, ALEMÁN A, MONTERO P, GÓMEZ- GUILLÉN M C. Gelling properties of hake muscle with addition of freeze-thawed and freeze-dried soy phosphatidylcholine liposomes protected with trehalose.LWT-Food Science and Technology,2018, 98: 46-53.
[9] 肖旭华. 米渣及米渣蛋白对鲢鱼糜凝胶特性和冻融稳定性的影响[D]. 武汉: 华中农业大学, 2014.
XIAO X H. Effects of rice dreg and protein isolate from rice dreg on the gel properties and freeze-thaw stability of silver carp surimi [D]. Wuhan: Huazhong Agricultural University, 2014. (in Chinese)
[10] QIN X S, LUO Z G, PENG X C. Fabrication and characterization of quinoa protein nanoparticle-stabilized food-grade Pickering emulsions with ultrasound treatment: interfacial adsorption/arrangement properties. Journal of Agricultural and Food Chemistry, 2018, 66(17): 4449-4457. doi:10.1021/acs.jafc.8b00225.
[11] ZHU Y Q, MCCLEMENTS D J, ZHOU W, PENG S F, ZHOU L, ZOU L Q, LIU W. Influence of ionic strength and thermal pretreatment on the freeze-thaw stability of Pickering emulsion gels. Food Chemistry, 2020, 303: 125401. doi:10.1016/j.foodchem.2019.125401.
[12] CEN K Y, YU X, GAO C C, FENG X, TANG X Z. Effects of different vegetable oils and ultrasonicated quinoa protein nanoparticles on the rheological properties of Pickering emulsion and freeze-thaw stability of emulsion gels. Journal of Cereal Science, 2021, 102: 103350. doi:10.1016/J.JCS.2021.103350.
[13] HAN K Y, FENG X, YANG Y L, WEI S M, TANG X Z, LI S S, CHEN Y M. Effects of camellia oil on the properties and molecular forces of myofibrillar protein gel induced by microwave heating. International Journal of Food Science & Technology, 2021, 56(11): 5708-5716. doi:10.1111/IJFS.15089.
[14] CAO Y, ZHAO L Y, HUANG Q L, XIONG S B, YIN T, LIU Z Y. Water migration, ice crystal formation, and freeze-thaw stability of silver carp surimi as affected by inulin under different additive amounts and polymerization degrees. Food Hydrocolloids, 2022, 124: 107267. doi: 10.1016/J.FOODHYD.2021.107267.
[15] JIA R, JIANG Q Q, KANDA M, TOKIWA J, NAKAZAWA N, OSAKO K, OKAZAKI E. Effects of heating processes on changes in ice crystal formation, water holding capacity, and physical properties of surimi gels during frozen storage. Food Hydrocolloids, 2019, 90: 254-265. doi:10.1016/j.foodhyd.2018.12.029.
[16] 徐祖东, 陈康, 涂丹, 王珏, 戴志远. 藜麦对鲷鱼鱼糜凝胶性能及挥发性风味的影响. 中国食品学报, 2020, 20(2): 212-220. doi: 10.16429/j.1009-7848.2020.02.026. (in Chinese)
XU Z D, CHEN K, TU D, WANG J, DAI Z Y. Effect ofon properties and volatile components of surimi gels from. Journal of Chinese Institute of Food Science and Technology, 2020, 20(2): 212-220. doi:10.16429/j.1009-7848.2020. 02.026. (in Chinese)
[17] 宋春勇, 洪鹏志, 周春霞, 陈艾霖, 冯瑞. 大豆油和预乳化大豆油对金线鱼鱼糜凝胶品质的影响. 食品科学, 2021, 42(8): 90-97. doi:10.7506/spkx1002-6630-20200820-275.
SONG C Y, HONG P Z, ZHOU C X, CHEN A L, FENG R. Effect of soybean oil and pre-emulsified soybean oil on the quality ofsurimi gel. Food Science, 2021, 42(8): 90-97. doi: 10.7506/spkx1002-6630-20200820-275. (in Chinese)
[18] NIAN L Y, CAO A L, CAI L Y, JI H W, LIU S C. Effect of vacuum impregnation of red sea bream (major) with herring AFP combined with CS@Fe3O4nanoparticles during freeze-thaw cycles. Food Chemistry, 2019, 291: 139-148. doi:10.1016/j.foodchem.2019. 04.017.
[19] ZHU S C, YU J H, CHEN X, ZHANG Q, CAI X X, DING Y T, ZHOU X X, WANG S Y. Dual cryoprotective strategies for ice-binding and stabilizing of frozen seafood: A review. Trends in Food Science & Technology, 2021, 111: 223-232. doi:10.1016/J. TIFS.2021.02.069.
[20] ZHOU L, YANG Y L, WANG J Y, WEI S M, LI S S. Effects of low-fat addition on chicken myofibrillar protein gelation properties. Food Hydrocolloids, 2019, 90: 126-131.
[21] LU H, ZHANG L T, LI Q Z, LUO Y K. Comparison of gel properties and biochemical characteristics of myofibrillar protein from bighead carp () affected by frozen storage and a hydroxyl radical-generation oxidizing system. Food Chemistry, 2017, 223: 96-103. doi:10.1016/j.foodchem.2016.11.143.
[22] BUAMARD N, BENJAKUL S. Effect of ethanolic coconut husk extract and pre-emulsification on properties and stability of surimi gel fortified with seabass oil during refrigerated storage. LWT-Food Science and Technology, 2019, 108: 160-167. doi:10.1016/j.lwt.2019. 03.038.
[23] ZHENG Y, ZHOU F, ZHANG L, WANG H L, WANG X C. Effect of different extent of protein oxidation on the frozen storage stability of muscle protein in obscure pufferfish (). LWT, 2020, 137: 110416. doi:10.1016/j.lwt.2020.110416.
[24] WALAYAT N, XIONG Z Y, XIONG H G, MORENO H M, NAWAZ A, NIAZ N, HU C, TAJ M I, MUSHTAQ B S, KHALIFA I. The effect of egg white protein and-cyclodextrin mixture on structural and functional properties of silver carp myofibrillar proteins during frozen storage.LWT-Food Science and Technology, 2021, 135: 109975.
[25] LI F F, WANG B, KONG B H, SHI S, XIA X F. Decreased gelling properties of protein in mirror carp () are due to protein aggregation and structure deterioration when subjected to freeze-thaw cycles. Food Hydrocolloids, 2019, 97: 105223. doi:10.1016/j.foodhyd.2019.105223.
[26] WANG Y Y, YAN J K, DING Y H, TAYYAB R M, MA H L. Effect of sweep frequency ultrasound and fixed frequency ultrasound thawing on gelling properties of myofibrillar protein from quick- frozen small yellow croaker and its possible mechanisms. LWT-Food Science and Technology, 2021, 150: 111922. doi:10.1016/J.LWT. 2021.111922.
[27] ZHANG M C, LI F F, DIAO X P, KONG B H, XIA X F. Moisture migration, microstructure damage and protein structure changes in porcine longissimus muscle as influenced by multiple freeze-thaw cycles. Meat Science, 2017, 133: 10-18.
[28] 张诗雯, 仪淑敏, 吕柯明, 李学鹏, 李远钊, 丁浩宸, 徐永霞, 米红波, 朱文慧, 励建荣. 水分含量对冻结金线鱼肉香肠品质的影响. 食品科学, 2019, 40(24): 21-26. doi: 10.7506/spkx1002-6630- 20190122-266.
ZHANG S W, YI S M, LÜ K M,LI X P, LI Y Z, DING H C, XU Y X, MI H B, ZHU W H, LI J R. Effect of moisture content on quality of frozensausages. Food Science, 2019, 40(24): 21-26. doi: 10.7506/spkx1002-6630-20190122-266. (in Chinese)
[29] XU L L, LÜ Y Q, SU Y J, CHANG C H, GU L P, YANG Y J, LI J H. Enhancing gelling properties of high internal phase emulsion-filled chicken gels: Effect of droplet fractions and salts. Food Chemistry, 2022, 367: 130663. doi:10.1016/J.FOODCHEM.2021.130663.
[30] ZHANG B, CAO H J, WEI W Y, YING X G. Influence of temperature fluctuations on growth and recrystallization of ice crystals in frozen peeled shrimp () pre-soaked with carrageenan oligosaccharide and xylooligosaccharide. Food Chemistry, 2020, 306: 125641. doi:10.1016/j.foodchem.2019.125641.
Effects of Adding Quinoa Protein Pickering Emulsion on Freeze- Thaw Stability of Fish Surimi Gel

College of Food Science and Engineering/Collaborative Innovation Center for Modern Grain Circulation and Safety/Key Laboratory of Grains and Oils Quality Control and Processing, Nanjing 210023
【Objective】Based on the freeze-thaw stability of quinoa stabilized Pickering emulsion, it was incorporated evenly into surimi to generate surimi gels in this study, and its feasibility to improve the freeze-thaw stability of fish protein gel was evaluated. This research aimed to prevent the deterioration of fish protein gel, caused by the temperature fluctuation during storage and transportation.【Method】Quinoa protein Pickering emulsion was prepared and distributed in surimi, followed by heating process to generate surimi gels. The surimi gels with different contents of Pickering emulsion and without emulsion were subjected to three freeze-thaw cycles, and then, the texture, color, water and ice crystal distribution and drip loss of surimi gels were measured. 【Result】The quinoa protein Pickering emulsion improved the lightness and whiteness of fish surimi gel, and inhibited the changes of color after freeze-thaw cycles. Meanwhile, the Pickering emulsion addition delayed the changes of hardness and chewiness of surimi gels during freeze-thaw cycles. It was found that quinoa protein Pickering emulsion had no effect on the moisture distribution of surimi gels before freeze-thaw cycles, but significantly increased the proportion of immobile water and decreased free water content in surimi gels after freeze-thaw cycles. Therefore, the drip loss of surimi gel was decreased by emulsion addition. Furthermore, the emulsion addition decreased the diameter of ice crystals formed in surimi gel, reduced the damage to muscle tissues, and decreased the free water content. 【Conclusion】The Quinoa protein Pickering emulsion weakened the adverse impact of freeze-thaw cycles on the color and textural properties, maintained the gel structure, and improved the freeze-thaw stability of fish surimi gel, which maintained its quality and nutritional value. Quinoa protein Pickering emulsion was promising to become an innovative antifreeze to be applied in frozen food.
quinoa protein; Pickering emulsion; freeze-thaw stability; protein gel
2021-08-15;
2022-01-12
国家自然科学基金(32001643)、江苏省自然科学基金(SBK2020040148)
冯潇,E-mail:fengxiao@nufe.edu.cn。通信作者汤晓智,E-mail:9120111004@nufe.edu.cn
10.3864/j.issn.0578-1752.2022.10.013
(责任编辑 赵伶俐)
