多囊卵巢综合征鼠类动物模型的构建
2022-06-27黄千千王娇剑宋殿荣
黄千千,王娇剑,宋殿荣
多囊卵巢综合征(polycystic ovarian syndrome,PCOS)是育龄期女性常见的生殖及内分泌代谢紊乱性疾病,发病率高达6%~12%[1]。该病的主要临床表现包括月经稀发或闭经、肥胖、不孕、多毛、痤疮和黑棘皮症等。据估计,高达85%的PCOS 患者在临床或生化上表现出高雄激素血症,50%~75%的患者黄体生成激素(luteinizing hormone,LH)升高,90%的患者血LH/卵泡刺激素(follicle-stimulating hormone,FSH)比值异常[2],70%的患者血脂异常,以及约70%的非肥胖型和95%的肥胖型PCOS 患者存在糖耐量受损和胰岛素抵抗[3]。PCOS 在组织病理学上主要表现为双侧卵巢体积增大,卵泡数量增多,呈多囊样改变,超声下可见卵巢间质增多、回声增强[4]等。
PCOS 临床表现高度异质,发病机制复杂,涉及遗传、生殖、内分泌代谢及环境等多种因素。为了更好地深入研究PCOS,学者们依据PCOS 的内分泌及代谢指标分别利用恒河猴、牛、羊、鼠等哺乳动物设计了多种PCOS 模型,其中大鼠和小鼠因体型小、繁殖周期短、具有较稳定的动情周期,对于实验研究既经济又方便,成为目前建立PCOS 模型最常用的实验动物。综述近年来国内外基于鼠类建立的PCOS动物模型的研究进展。
1 基于PCOS 病因学特点建立的模型
临床调查显示,PCOS 发病具有高度的家族聚集性,大约有60%~70%PCOS 患者的女性子代在青春期和性成熟期出现PCOS 症状,其中高雄激素血症是最具遗传性的表型特征[5]。Barker[6]认为这可能是因为胎儿暴露在母体子宫内高雄激素环境刺激下,致使其成年后某些基因突变所致。因此,当母体宫内环境产生相应变化时,后代有极高概率出现PCOS 相关症状。
1.1 产前雄激素化(prenatally androgened)造模法 研究显示,PCOS 女性体内雄激素水平比正常女性高3 倍[7],而在妊娠期间,高水平的雄激素会对胎盘类固醇生成和营养物质运输产生负面影响,从而增加妊娠并发症的发生风险。瑞典的一项调查显示,PCOS 患者子代被诊断为PCOS 的风险是非PCOS 女性子代的5 倍(aHR=5.12,95%CI:3.17~8.26)[8],因此,妊娠期宫内高雄激素环境暴露可能是PCOS 患病的一个重要原因。产前雄激素化能让子代大鼠在成年期也表现出PCOS 类似的生殖和代谢症状。产前雄激素化造模法主要通过对鼠不同孕龄阶段皮下或肌内注射雄激素进行诱导。Moore 等[9]在雌鼠孕晚期予以双氢睾酮(dihydrotestosterone,DHT),子代小鼠表现出血清雄激素水平升高、动情周期不规律、生育能力下降以及与人PCOS 相似的卵巢形态改变。Wu 等[10]对孕16 d 和19 d 的大鼠皮下注射丙酸睾丸酮(testosterone propionate,TP),发现出生后的大鼠动情周期失去规律,排卵前卵泡及黄体数目变少,卵巢呈多囊样改变,性激素表现为睾酮、LH 以及孕酮水平升高。另有研究发现,对敲除雄激素受体的小鼠进行产前雄激素化诱导不会导致高雄激素血症、动情周期不规律或卵巢形态改变,这表明雄激素受体信号传导可能是产前雄激素化诱导PCOS 鼠类模型的重要途径[11]。产前雄激素化造模法常用于诱导非肥胖型PCOS 模型,但不适合进行下丘脑-垂体-卵巢(hypothalamic pituitary-ovarian,HPO)轴的内分泌相关机制研究。
1.2 产前抗苗勒管激素(AMH)造模法产前AMH造模法是通过在妊娠晚期提高母体AMH 水平来实现的。有研究表明,AMH 水平与雄激素水平呈正相关[12],AMH 升高会使母体内睾酮水平增加3 倍,从而模拟人PCOS 妊娠期宫内高雄激素环境。Tata 等[13]对孕鼠注射重组人AMH 0.12 mg/(kg·d),发现雌鼠产前体内AMH 水平过量可成功诱导子代雄激素水平过高,从而在成年期出现类似人PCOS 的生殖和神经内分泌症状,如动情周期紊乱、稀发排卵、LH 升高和生育能力下降等,且由于体质量较正常孕鼠无明显变化,可适用于研究非肥胖型PCOS。
2 基于PCOS 内分泌代谢特点建立的模型
PCOS 作为一种生殖障碍性及内分泌代谢异常疾病,与HPO 轴、性激素及胰岛素水平等密切相关。当患者体内雄激素水平过剩、HPO 轴调节功能紊乱、胰岛素水平异常时,均会导致PCOS 的发生。根据这些特点,常见的建立PCOS 动物模型的方法有雄激素造模法、雌激素造模法和胰岛素造模法等,不同模型的内分泌激素水平和卵巢组织学存在一定差异。见表1。
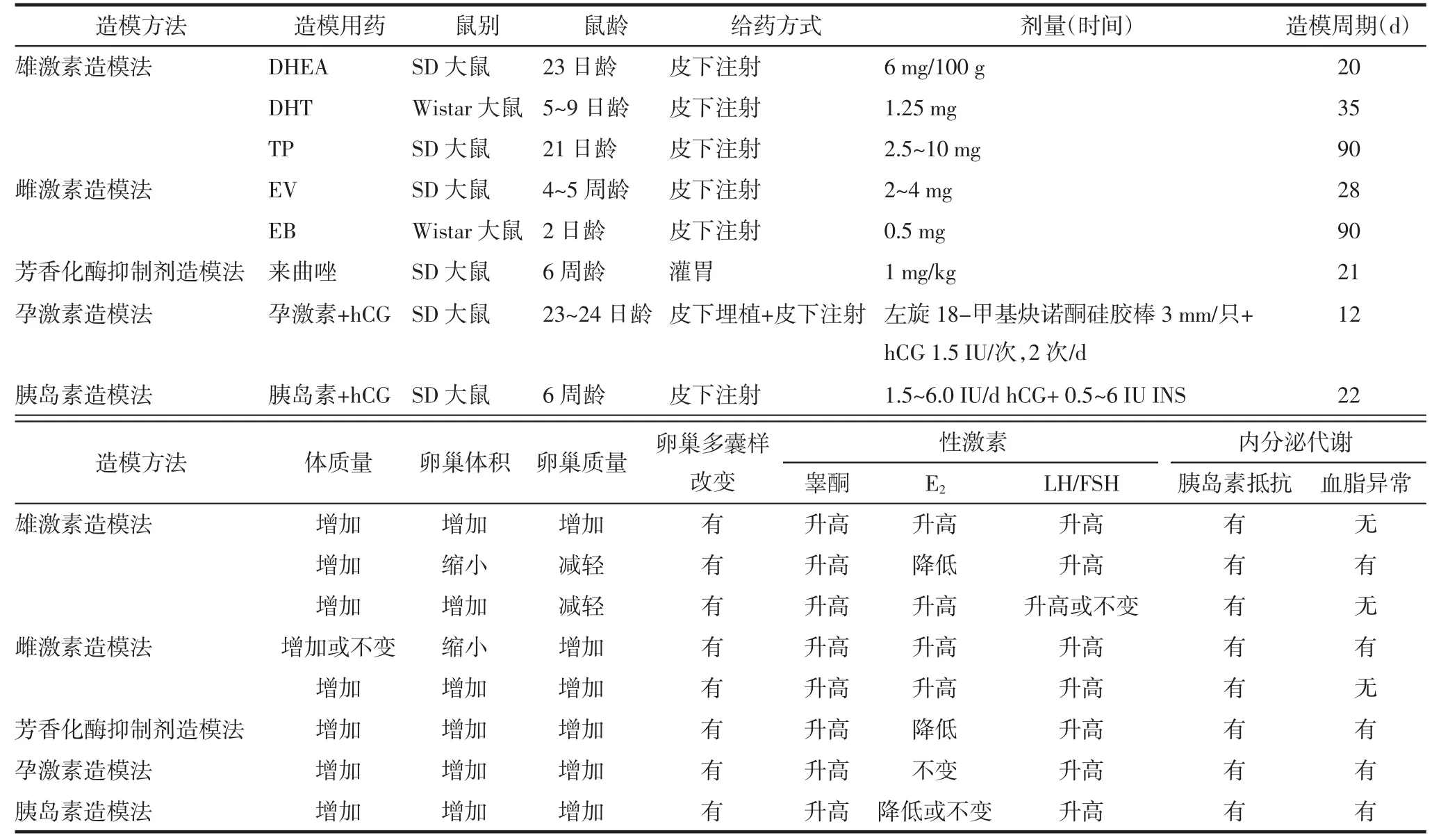
表1 基于内分泌代谢特点建立PCOS模型的特征比较
2.1 雄激素造模法高雄激素血症是PCOS 的主要表现之一。有研究显示,啮齿类动物体内循环雄激素水平升高会阻碍卵泡成熟和导致囊肿形成。因此,给予外源性雄激素可被用于诱导PCOS 动物模型,常见的雄激素造模法包括DHEA 造模法、TP 造模法和DHT 造模法。
2.1.1 DHEA 造模法DHEA 是女性青春期体内首个出现的雄激素,也是第一种用于动物诱发PCOS的药物,其属于肾上腺雄激素类,是合成各种性激素的过渡中间产物。当通过外源性途径增加体内DHEA 水平致使雄烯二酮水平升高时,雌酮和睾酮也随之升高,从而引起高雄激素血症,出现卵泡发育不佳、排卵障碍以及卵巢多囊样改变等症状[14]。Lee等[15]早在1991 年就通过对大鼠皮下注射DHEA 成功诱导出了PCOS 模型。张晓薇等[16]复制该法对23日龄雌性SD 大鼠连续20 d 每百克体质量皮下注射DHEA 6 mg(模型组)和注射用大豆油剂0.2 mL(对照组),结果显示模型组的体质量和卵巢体积及质量均明显增加,并见较多囊状扩张的卵泡,其卵泡内卵母细胞或放射冠消散,颗粒细胞层减少,血清DHEA、睾酮、雌二醇水平显著增加,FSH、LH 水平稍低或不变,同时血糖及胰岛素水平也明显升高。DHEA 诱导的PCOS 动物模型选用未性成熟的雌性大鼠,较早出现持续和稳定的无排卵现象,因此适合于PCOS 生殖方面的研究,也可用于病因、病理机制的研究。但该模型的囊性卵泡膜细胞层较薄,而人类患者的囊性卵泡膜细胞层较厚[17],有所差异。而且造模药物为DHEA,模型体内升高的DHEA 难以区分是内源性还是外源性的雄激素,以及DHEA 不溶于水剂,所溶油剂容易在注射部位形成硬结影响药物吸收。
2.1.2 TP 造模法高雄激素环境中垂体对下丘脑的刺激不敏感,致使LH 持续性分泌,FSH 的促排卵作用由于雌激素持续分泌产生负反馈效应受到抑制,因此出现排卵障碍等PCOS 相关症状[14]。盛哲津等[18]对5~6 日龄雌性BALB/c 小鼠颈背部皮下注射溶于中性茶油的TP 溶液1 mg/d,结果显示模型小鼠卵巢闭锁卵泡增多,明显呈多囊样改变,血清游离睾酮水平高于正常小鼠,LH、FSH 和孕酮水平降低,而胰岛素水平升高。Azeemuddin 等[19]对9 日龄雌性Wistar大鼠给予溶于橄榄油的TP 溶液1.25 mg/d,模型组出现睾酮升高、体质量增加、动情周期不规则及胰岛素抵抗等PCOS 相关表现。TP 诱导的PCOS 模型生殖特征和代谢特点与人PCOS 接近,适用于代谢方面研究。但这种模型的卵巢质量和体积比正常卵巢小,不适合形态学研究。
2.1.3 DHT 造模法DHT 是睾酮在体内非芳香化的代谢产物,有较高的雄激素活性,能减少颗粒细胞的数量和降低芳香化酶的活性,导致雌激素合成减少和卵泡闭锁[14]。Gao 等[20]选用21 日龄雌性SD 大鼠连续给药DHT,大鼠出现体质量增加、卵泡闭锁、激素水平改变及代谢紊乱等症状。该模型适用于研究PCOS 生殖、代谢和病理生理方面的改变。但DHT 诱导的模型虽然会产生与人PCOS 相近的代谢紊乱表现,血脂却无异常,且该模型是通过持续的外源性DHT 维持诱导而成,而非内源性的高雄激素血症[21]。成年期持续给予低剂量DHT 也会引发相似的生殖功能障碍和代谢特征,包括胰岛素抵抗和胰岛β 细胞功能障碍等[22]。
2.2 雌激素造模法PCOS 患者普遍存在血清雌激素水平升高,基于这一特征,雌激素如EV、EB 常被用于在动物模型中诱导PCOS。因为高雌激素刺激会对下丘脑-垂体功能产生负反馈调节,导致HPO 轴功能紊乱,下丘脑神经元退化,垂体代偿性增生,致使垂体分泌的LH 升高,同时在雌激素持续刺激下垂体分泌FSH 受到强烈抑制,进而出现PCOS 典型特征[14]。Fazel Torshizi 等[23]选用体质量为(145±5)g 的雌性SD大鼠连续4 周皮下注射4 mg EV 建立PCOS 模型,结果显示模型组卵巢质量显著增加,囊性卵泡显著增多,黄体及不同发育阶段的卵泡减少,血清E2、睾酮、LH 的含量显著增加,空腹血糖、胰岛素及血脂水平明显升高。Anzai 等[24]选用2 日龄雌性Wistar 大鼠皮下注射0.5 mg EB,模型表现出不规则的动情周期、卵巢多囊样改变及无排卵。EV 诱导建立的PCOS 模型各项激素指标都与人PCOS 相近,可用于生殖内分泌失调相关的研究。但该模型长期使用雌激素,会导致HPO 轴功能紊乱,因此不适合用于PCOS 疗效评价方面的研究。
2.3 芳香化酶抑制剂造模法芳香化酶抑制剂是雌激素生物合成的关键限速酶之一,可有效阻止雄激素(睾酮和雄烯二酮)转换成雌激素(E2和雌酮),导致卵巢生成类固醇激素功能紊乱,从而维持高雄激素状态,进而引发PCOS 的无排卵和卵泡闭锁现象[25]。Kafali 等[26]率先采用来曲唑诱导PCOS 动物模型,对6 周龄发情周期规则的雌性SD 大鼠分别给予0.1,0.5,1 mg/kg 剂量的来曲唑灌胃21 d,诱导出不同程度PCOS 症状的动物模型。Lian 等[27]选取6 周龄雌性SD 大鼠,连续21 d 灌服溶于1%羧甲基纤维素的来曲唑1 mg/(kg·d),结果显示大鼠的动情周期失去规律性变化,卵巢表面白膜增厚,内见大量囊状扩张卵泡,颗粒细胞减少到2~3 层,雌二醇水平降低,LH、睾酮水平增高。该造模法卵巢形态、组织学改变及激素水平变化均与人PCOS 极为相似,是使用较多的模型之一。但是来曲唑诱导的PCOS 模型中观察到的主要特征可能不是高雄激素状态而是雌激素作用受损,因此并不适合研究雌激素水平较高的PCOS。另有研究发现,对成年期雌鼠给予来曲唑诱导会导致类似的PCOS 表型[28],但与用来曲唑诱导的青春期雌鼠不同,成年期雌鼠不会出现肥胖或胰岛素抵抗,因此该模型可用于研究非肥胖型PCOS。
2.4 孕激素造模法皮下埋植左旋18-甲基炔诺酮可抑制下丘脑-垂体-性腺轴功能,继而致使性激素水平低下,导致无排卵。hCG 生物学效能与LH 相似,是LH 的天然类似物,会引起雄激素升高抑制排卵,因此两者可联合用于PCOS 建模。Bogovich 等[29]在1989 年提出了孕激素联合hCG 造模法。朱辉等[30]对24 日龄雌性SD 大鼠皮下埋植左旋18-甲基炔诺酮硅胶棒3 mm,从27 日龄开始至36 日龄每日皮下注射1.5 IU hCG 2 次,共注射9 d,结果显示造模组大鼠卵巢质量增加,卵泡膜细胞增加而颗粒细胞减少,电子显微镜下可见卵泡膜细胞内很多脂滴,卵巢呈多囊状改变,血清孕酮、睾酮明显升高,而雌二醇和LH 无明显改变,LH/FSH 比值增高以及出现胰岛素抵抗。该模型所用皮下埋植剂释放恒定缓慢,作用持续时间长。但是其以避孕药为造模药物,不适合促排卵药物的药效研究。
2.5 胰岛素造模法PCOS 的发生和进展与胰岛素水平密切相关。高胰岛素血症会影响卵巢卵泡膜细胞LH 受体基因的表达,致使LH 分泌增多刺激雄激素合成从而提高雄激素水平。另一方面,雄激素水平升高会刺激内脏脂肪组织产生游离脂肪酸,从而产生胰岛素抵抗,且肝脏合成并分泌性激素结合球蛋白水平下降,从而导致雄激素水平升高[14]。本方法由Poretsky 等[31]率先提出,他们选择85 日龄雌性SD 大鼠皮下注射1.5 U hCG,并从第1~10 天给予0.5 IU/d逐渐加量到6.0 IU/d 的胰岛素,最终成功诱导出PCOS 模型。Hong 等[32]选用8 周龄雌性C57BL/6 小鼠给予中效胰岛素,第1~10 天从0.5 IU/d 逐渐增至6.0 IU/d,第11~22 天给予6.0 IU/d,并加用hCG 6.0 IU/d。研究显示大鼠体质量显著增加,卵巢体积及质量增加并呈多囊样改变,颗粒细胞减少,排列松散,卵母细胞消失,血清睾酮、E2、FSH、LH 及胰岛素水平明显升高。该模型可以用于PCOS 卵巢形态学和生殖内分泌变化的研究。不过由于造模试剂是外源性胰岛素,所以有关胰岛素抵抗方面的研究不适合用此模型。
3 基于PCOS 特定基因建立的模型
既往研究发现,PCOS 可能是一种多基因遗传疾病,数据显示PCOS 病因涉及241 种基因变异[33],基因缺陷会扰乱生化途径并导致卵巢功能障碍,因此,通过对特定基因进行编辑建立鼠类PCOS 模型是研究PCOS 发病机制的一种有效手段。目前国内外已对多个PCOS 相关基因进行研究,如雄激素合成及作用相关基因、性腺功能失调相关基因、胰岛素抵抗相关基因、肥胖相关基因以及慢性炎症相关基因等。
3.1 基于参与类固醇激素效应的基因建立的模型雄激素受体基因存在于X 染色q 臂上,是一个X 染色体连锁遗传基因,有11 个外显子,编码的蛋白质超过90 kb,共有3 个功能结构域,基因突变或结构破坏均会导致PCOS。当X 染色体失活时雄激素信号通路中断,导致雄激素水平升高,从而引起PCOS。而在PCOS 动物模型上应用雄激素受体拮抗剂可预防或逆转某些PCOS 表现,例如Ryan 等[34]对来曲唑诱导的PCOS 小鼠模型采用雄激素受体拮抗剂氟他胺治疗,小鼠可恢复正常发情周期,卵巢中囊状扩张卵泡数量减少,同时体质量也减轻。这说明雄激素受体信号传导在PCOS 发展中起着重要作用。实验证明,敲除雄激素受体的雌性小鼠模型失去规律动情周期,排卵数量和卵泡成熟率明显下降,黄体数量减少,卵巢呈多囊样改变。Caldwell 等[11]将雄激素受体敲除的小鼠模型与DHT 诱导的PCOS 小鼠模型相结合,在探究高雄激素血症对PCOS 的影响方面取得了重大成果。
3.2 基于参与卵巢和肾上腺类固醇生成的基因建立的模型类固醇生成酶包括芳香化酶,其属于复杂的细胞色素P450 家族,通常在类固醇转化中起重要作用,有助于雄激素转化为雌激素。细胞色素P450出现任何异常都会增加PCOS 进展的风险。当芳香化酶缺乏时会导致通路缺陷,从而停止转化,影响卵巢功能并使雄激素水平升高。PCOS 数据库中报告的芳香化酶基因包括CYP11A1、CYP11B2、CYP17A1、CYP19A1、CYP1A1、CYP21A2 和CYP3A7。而骨形态发生蛋白4(bone morphogenetic protein 4,BMP4)能通过调节类固醇生成酶(包括CYP11A、HSD3B2、CYP17A1 和CYP19A1)的表达,抑制卵泡膜细胞的雄激素合成,促进颗粒细胞的雌激素生成,因此BMP4基因敲除的雌鼠出现雄激素水平升高,雌激素水平下降[35],然而BMP4 对高雄激素血症的作用尚未明确。
3.3 基于参与促性腺激素作用和调节的基因建立的模型高水平的LH 可使体内雄激素增多,由于LH 升高的负反馈作用使FSH 减少,雄激素向雌激素的转化减少从而导致卵巢产生过量的雄激素,引起PCOS[36]。已有实验证实,LH 过表达的转基因小鼠模型表现为稀发排卵,卵巢病理改变,睾酮和E2水平升高,但是产生了与PCOS 无关的临床症状,如LH过剩导致的囊肿形成及卵巢肿瘤等[37]。
3.4 基于参与胰岛素作用和分泌的基因建立的模型下丘脑阿黑皮素原(proopiomelanocortin)神经元能调节能量平衡和葡萄糖稳态,并表达瘦素和胰岛素受体,当下丘脑中的胰岛素受体和(或)瘦素受体遭到特异性破坏会导致轻度肥胖、高瘦素血症和胰岛素抵抗。因此,雌鼠阿黑皮素原神经元中胰岛素受体和瘦素受体的特异性缺失可导致其出现PCOS 相关症状,如不规则的动情周期、排卵功能障碍、生育能力降低、雄激素和胰岛素水平升高、血脂异常及胰岛素抵抗等[38]。
4 其他造模法
4.1 持续光照造模法Baldissera 等[39]将雌性Wistar大鼠暴露于光照(光照度600 lux)环境中持续74 d,结果显示大鼠在持续光照后卵巢膜间质细胞增生,被膜变厚,卵巢呈多囊样变化,发情周期紊乱。但持续光照所建造的模型血清睾酮和LH 并未升高,与人PCOS 存在差异,且一旦转至正常光照周期环境,PCOS 特征可恢复正常。
4.2 抗孕激素RU486(米非司酮)造模法抗孕激素RU486 是一种合成类固醇。因为其对孕酮和糖皮质激素受体有拮抗作用,所以抗孕激素RU486 诱导出的动物模型能表现出与PCOS 患者相似的卵巢和激素变化。Ruiz 等[40]对Wistar 大鼠连续4 d 和连续8 d 注射抗孕激素RU486,模型大鼠均表现出无排卵、卵巢多囊样改变,血清LH、睾酮和E2水平升高。但是该模型未表现出与PCOS 相关的代谢紊乱症状,且易生成黄素化囊肿,因此还需要进一步研究来验证抗孕激素诱导的PCOS 模型。
4.3 链脲佐菌素(Streptozotocin)造模法链脲佐菌素被广泛用于诱导实验性1 型糖尿病,由于其对一定种属动物的胰岛β 细胞有选择性破坏作用,因此链脲佐菌素刺激可能会改变卵巢中的胰岛素信号通路,从而影响类固醇生成。Ryu 等[41]对雌鼠连续5 d腹腔注射低剂量链脲佐菌素(15 mg/kg),成功诱导小鼠出现PCOS 样表型,包括高雄激素血症、胰岛素抵抗、卵巢多囊样改变和不规则的发情周期等症状。该模型PCOS 特征与DHT 和DHEA 诱导的PCOS 模型近似,但无肥胖及其他明显的代谢紊乱表现,且方法简单、重复性好、成本低廉,适合于非肥胖型PCOS研究,但是不适用于神经内分泌相关的研究。
5 结语
以上综述了国内外目前比较常用的PCOS 模型建立方法,但是由于PCOS 具有高度异质性,目前尚无能够囊括PCOS 全部特征的标准动物模型,每种造模方法都不能完全模拟出PCOS 患者的表型特征。因此根据研究内容的需要和每个模型表现出的临床特征合理选择相应的造模方法至关重要。虽然目前对PCOS 动物模型的研究仍处于初步探索阶段,但随着对PCOS 的研究逐渐深入,相信终会寻求到一种更贴近人PCOS 特征的动物模型从而推动PCOS 发病机制及其疗效评价的研究。
