葡聚糖结合蛋白的原核表达及检测深部真菌感染的应用
2022-06-27朱李茹黄友明章宏祥周发友唐晓磊
朱李茹,黄友明,章宏祥,周发友,唐晓磊*
(1.湖北文理学院附属医院 襄阳市中心医院 医学检验部, 湖北 襄阳 441021;2.皖南医学院第二附属医院 转化医学中心, 安徽 芜湖 241000)
内源性和外源性的真菌侵袭并突破了机体的皮肤黏膜屏障,从而导致了深部脏器的感染统称为侵袭性真菌感染(invasive fungal infection, IFI),其发生概率呈上升趋势[1-2]。其主要原因大致为危险因素的增加和患者免疫力的低下,如肿瘤放化疗患者、人类免疫缺陷病毒感染群体、先天性免疫功能不全者等。抗生素的不规范使用也大大增加了侵袭性真菌感染的概率,中枢神经系统的真菌感染尤为凶险[3-4],且其诊断较为困难[5]。
临床通常以临床症状结合影像学、实验室检查为手段对其进行鉴别。最早实验室IFI检查手段,如真菌培养、涂片查找真菌病原体以及通过血清学实验查找;在2009年首次报道了PCR技术检测真菌的实验性研究[6]。但迄今真菌病原体的检出周期及检出率均不能满足临床的需求;此外,血清相关抗体的检查并不能够完全反映机体届时的感染状态。因此非培养的快速诊断实验室检测技术对IFI诊断更有意义。针对临床真菌类型,其标志物主要分为两类:酵母型真菌感染标志物[如:抗甘露聚糖抗体、抗酵母菌芽管抗体、核酸检测及(1,3)-β-D-葡聚糖检测]和曲霉菌感染标志物[如:半乳甘露聚糖、曲霉菌流式检测、曲霉菌核酸检测及(1,3)-β-D-葡聚糖检测]。因此,对真菌特异性抗原的检测临床主要以G试验为主[7]。然而饮食、药物、医疗操作以及标本质量均会对G-Test法检测结果产生较大的影响[8]。
鉴于以上所述,本研究通过基因克隆手段获得美洲鲎来源的葡聚糖结合蛋白(glucans binding protein, GBP)的葡聚糖结合活性片段,并以其为(1,3)-β-D-葡聚糖特异性配基,从而实现对临床体液标本中(1,3)-β-D-葡聚糖的定量[9]。旨在能够通过免疫学手段,克服其他外界因素对(1,3)-β-D-葡聚糖检测的影响,从而完成IFI辅助诊断。
1 材料与方法
1.1 研究对象和材料
1.1.1 研究对象: 筛选皖南医学院第二附属医院2017年2月至2019年10月期间IFI患者和健康体检人员各48名。清晨空腹用促凝管抽全血4 mL,3 500 r/min离心15 min收获血清,冷冻于-80 ℃冻存备用。侵袭性真菌感染患者纳入标准:1)近期有放化疗、激素类药物应用、侵入性治疗史、免疫抑制剂应用史,且伴有高热、寒战等显著感染症状;2)真菌培养和/或涂片呈阳性;3)G试验阳性4)白介素6(IL-6)或降钙素原(procalcitonin,PCT)至少1项阳性。符合上述任意3项者,临床确诊为侵袭性真菌感染[10]。本研究纳入48例IFI成年患者(男/女=15/9、年龄分布为29~73岁),其中36例来源于呼吸系统患者,9例来源于肿瘤放化疗患者;3例来源于烧伤患者。
1.1.2 试剂:pET30a-GBP252-668质粒合成于上海生物工程公司;大肠杆菌BL21(DE3)菌株由本实验室保存;(1,3)-β-D-葡聚糖(Elicityl公司);抗组氨酸标签单克隆抗体(北京中杉金桥生物公司);辣根过氧化物酶标记试剂盒、无蛋白封闭液、TMB显色液和终止液(济南泰天和生物公司);Ni-agarose纯化柱(QIAGEN公司);十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)凝胶制备试剂盒和卡那霉素(kanamycin,Kan)(北京索莱宝科技有限公司);蛋白分子质量marker和DNA梯度marker[赛默飞科技(中国)有限公司];苯甲基磺酰氟(PMSF)和蛋白酶抑制剂cocktail,异丙基-β-d-硫代半乳糖苷(isopropyl-β-d-thiogalactoside, IPTG)(阿拉丁生化科技股份有限公司);其余化学试剂(国药化工集团公司)。
1.2 方法
1.2.1 GBP252-668表达质粒的鉴定: 根据质粒信息,使用NedⅠ和HindⅢ双限制性快速内切酶对pET30a-GBP252-668酶切进行鉴定,总反应体积20 mL,体系如下:pET30a-GBP252-668质粒10 mL,NedⅠ和HindⅢ限制性内切酶各1 mL,10×缓冲液2 mL,dd H2O 6 mL;于37 ℃水浴10 min,95 ℃ 5 min加热终止反应,行1%琼脂糖凝胶电泳鉴定。同时将pET30a-GBP252-668质粒行测序鉴定。
1.2.2 GBP252-668蛋白的表达及纯化: 将表达质粒转入大肠杆菌BL21,42 ℃水浴90 s热冲击,通过卡那霉素(kanamycin, Kan)抗性LB固体培养基筛选并挑取阳性单克隆接种于液体LB培养基5 h后,加入IPTG浓度0.8 mmol/L,25 ℃ 诱导过夜;10 000×g,离心15 min获得菌体,预冷无菌PBS洗涤菌体2次,离心收集菌体。-80 ℃冻融2~3次,加入溶菌酶至终浓度10 mg/mL,4 ℃过夜, 超声裂菌10 min。4 ℃ 10 000×g离心30 min收集上清,行SDS-PAGE分离后考马斯亮兰染色鉴定。将裂解的上清与Ni-NAT纯化柱置于4 ℃混匀器上连续混匀2 h,期间加入苯甲基磺酰氟(phenylmethanesulfonyl fluoride, PMSF)和蛋白酶抑制剂Cocktail。结合后的Ni-NAT纯化柱依次分别使用咪唑缓冲液(含咪唑浓度20、30、50、80、200 mmol/L)进行洗涤、洗脱。洗脱液再次经SDS-PAGE分离后行考马斯亮兰染色鉴定。
1.2.3 GBP双夹心法的体系构建: 将获得的高纯度GBP252-668蛋白精确定量后行辣根过氧化物酶标记。以不同浓度的GBP包被和不同浓度的GBP-HRP进行检测。以含10% DMSO的PBS溶液为阴性对照;将(1,3)-β-D-葡聚糖用含10%二甲基亚砜磷酸盐缓冲液稀释至200 ng/L作为阳性对照。将测得的包被浓度(coatingconcentration, CC)和检测浓度(detection concentration, DC)构建的GBP252-668双夹心法用于人血清基质的检测,即以健康人血清作为阴性标本,以加入终浓度200 ng/L(1,3)-β-D-葡聚糖的健康人血清作为阳性标本,作6个复孔,验证本实验所建立的方法学的检测效能。
1.2.4 两种方法临床检测效能比对: 将96份人血清标本分别行GBP252-668双夹心法检测和G-Test检测。GBP252-668双夹心法同时设置5个浓度梯度:0、50、100、200和400 ng/L,作标准曲线。并对双夹心法与G-Test法测得的(1,3)-β-D-葡聚糖结果使用ROC曲线分析其检测效能。
1.3 统计学分析

2 结果
2.1 GBP表达质粒的鉴定
重组质粒pET30a-GBP252-668双酶切产物,两条条带分别依次位于1 000 bp与2 000 bp之间以及5 000 bp与6 000 bp之间,与插入目的基因大小(1 251 bp)和pET30a载体片段(5 422 bp)大小相符,见图1。测序结果与Genbank (编号为:NM_001314167.1)比对完全一致,无错配、突变。
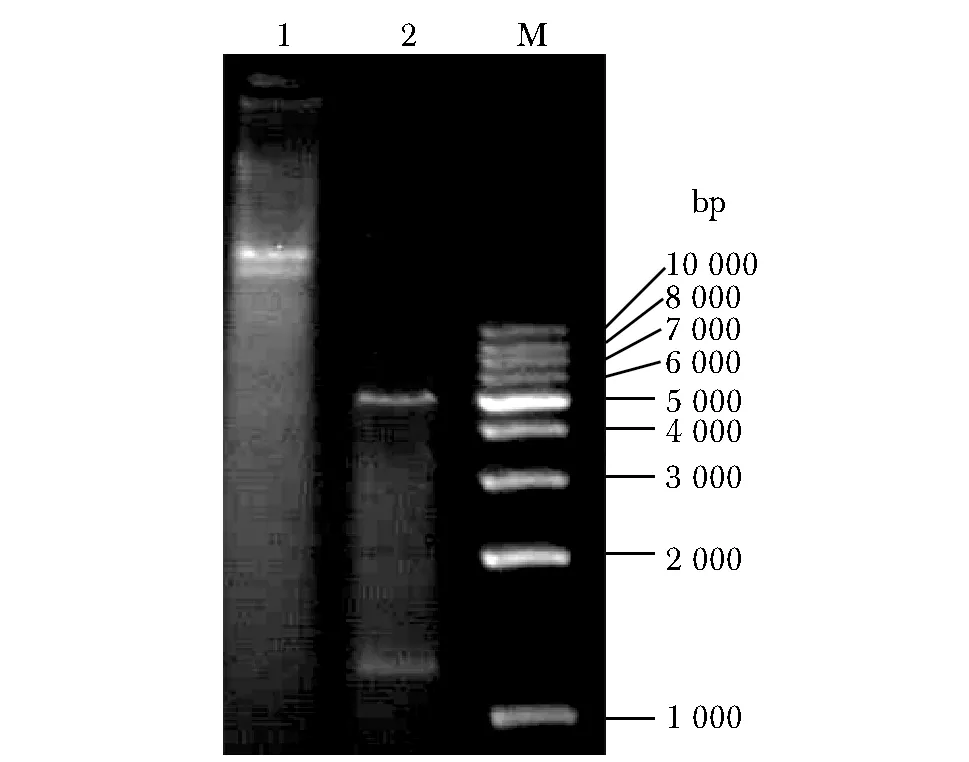
1.plasmid pET30a-GBP252-668; 2.plasmid pET30a-GBP252-668 was digested by restriction enzyme Ned Ⅰ and Hind Ⅲ; M.DNA marker图1 GBP重组表达质粒pET30a-GBP252-668的双酶切鉴定Fig 1 Identification of recombinant plasmid pET30a- GBP252-668 using restriction enzyme digestion
2.2 重组GBP252-668蛋白的表达及纯化
经IPTG诱导表达,在分子质量40 ku与50 ku之间有一条显著高表达蛋白条带,与预测重组目的蛋白分子质量46 774(约46.77 ku)相符(图2);经Ni-agarose纯化,获得了纯度较高的重组GBP蛋白(图3);经由抗-His标签单克隆抗体检测,在40 ku与50 ku之间有条带(图4)。

M.protein marker; 0.the E.coli BL21 containning recombinant plasmid pET30a-GBP252-668 was induced without IPTG; 1.the E.coli BL21 containning recombinant plasmid pET30a-GBP252-668 was induced with IPTG at 25 ℃ for 16 hours; 2.the E.coli BL21 containning recombinant plasmid pET30a-GBP252-668 was induced with IPTG at 37 ℃ for 16 hours; arrow indicated the recombinant target protein图2 SDS-PAGE分析重组GBP252-668蛋白的表达Fig 2 Analysis of recombinant GBP252-668 protein expression by SDS-PAGE
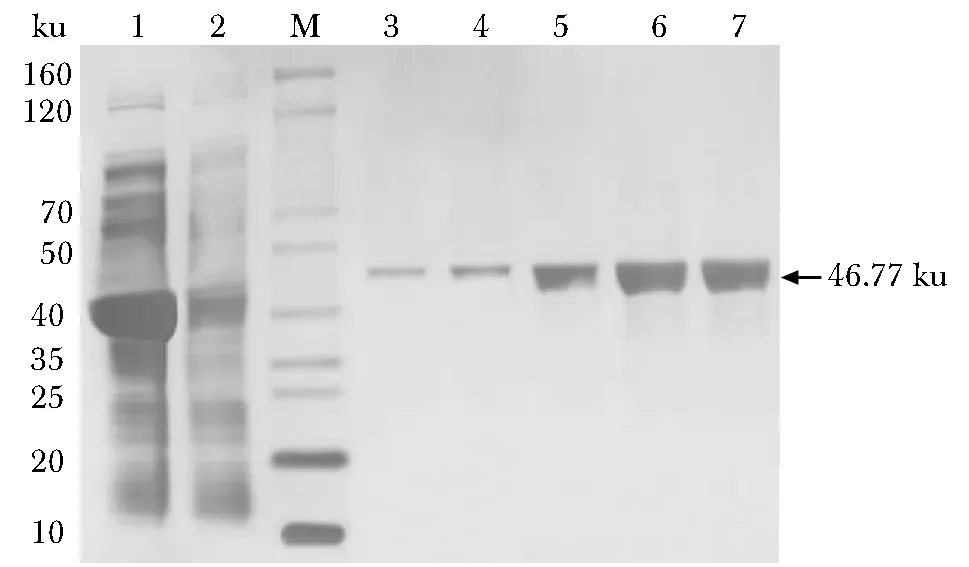
M.protein marker; 1.the supernatant of lysis bacteria with IPTG-induced at 25 ℃ for 16 hours; 2.the residual from lysis bacteria with IPTG-induced was affinity by Ni-agarose; 3, 4, 5, 6 and 7.the supernatant of Ni-agarose were washed with different concentrations of imidazole buffer in turn, 20, 30, 50, 80, and 200 mmol/L; arrow indicated the recombinant target protein图3 十二烷基硫酸钠聚丙烯酰胺凝胶电泳分析纯化的重组GBP252-668蛋白Fig 3 Analysis of purified recombinant GBP252-668 protein by SDS-PAGE

图4 免疫印迹法分析纯化的重组GBP252-668蛋白Fig 4 Analysis of purified recombinant GBP252-668 protein by Western blot
2.3 GBP双夹心法体系的构建
棋盘法显示,其最佳包被GBP浓度和HRP标记的GBP工作液分别为 0.8 g/L和1.6 g/L(表1);该方法对以人血清作为基质的阴性标本和阳性标本进行检测,数据显示其阳性标本与阴性标本吸光度值(absorbance,A)比值约为7,能够显著区分阴性与阳性(图5)。
2.4 两种方法的临床检测效能比对
通过制定标准曲线拟合算法,对待测标本中的(1, 3)-β-D-葡聚糖定量分析(图6);纳入48名IFI患者和48名健康人作为待测对象(表2);两种方法检测结果使用ROC曲线进行拟合,算得GBP双夹心法其灵敏度(sensitivity)和特异度(specificity)分别为91.67%(95%CI:80.02%~97.68%)和89.58%(95%CI:77.34%~96.53%);G试验的敏感性和特异性分别为91.67%(95%CI:80.02%~97.68%) 和79.17%(95%CI:65.01%~89.53%);GBP双夹心法ROC曲线面积为0.9282(95%CI:0.8679~0.9884);G试验的ROC曲线面积为0.9128(95%CI:0.8548~0.9695)(图7)。
3 讨论
近年来,临床深部真菌感染日益严重,真菌培养、涂片是IFI的实验诊断金标准,但由于周期较长且标本的获取不易或容易污染,因此以(1,3)-β-D-葡聚糖为标志物的G-Test目前应用更为广泛[11-13]。众所周知,(1,3)-β-D-葡聚糖是绝大多数真菌细胞壁的主要骨架成分(新型隐球菌属、毛口菌属除外),随着真菌的分裂生长及机体吞噬细胞的吞噬消化,其骨架成分被释放入血,对外周血中(1,3)-β-D-葡聚糖检测可以作为深部真菌感染的辅助诊断指标。目前G-Test法通过动态浊度的变化推算(1,3)-β-D-葡聚糖含量。而这一级联催化过程以及待测标本的质量严重影响检测结果。鉴于G-Test检测手段的不足,本研究通过克隆表达(1,3)-β-D-葡聚糖的特异性配基——GBP252-668蛋白,利用该配基与靶标(1,3)-β-D-葡聚糖的特异性识别与结合能力进行血清学检测,以评估机体侵袭性真菌感染状况。葡聚糖结合蛋白(GBP)为一类能够特异性结合葡聚糖的蛋白的统称。有研究表明不同物种来源的GBP能够高效识别并结合不同结构的葡聚糖[14]。在我们前期的预实验中发现,美洲鲎的GBP较之其他物种的GBP显示出较高的结合力。分析美洲鲎来源的GBP mRNA编码668个氨基酸肽链,其包含3个区域:第1位氨基酸到第20号氨基酸为信号肽;第27位氨基酸到第253号氨基酸为葡聚糖水解酶活性片段;第252位氨基酸到第668号氨基酸为葡聚糖活性结合片段。因此本研究纯化获得了重组GBP252-668 蛋白并构建双GBP夹心法检测系统,其具有高检测灵敏度、宽线性范围等特点。
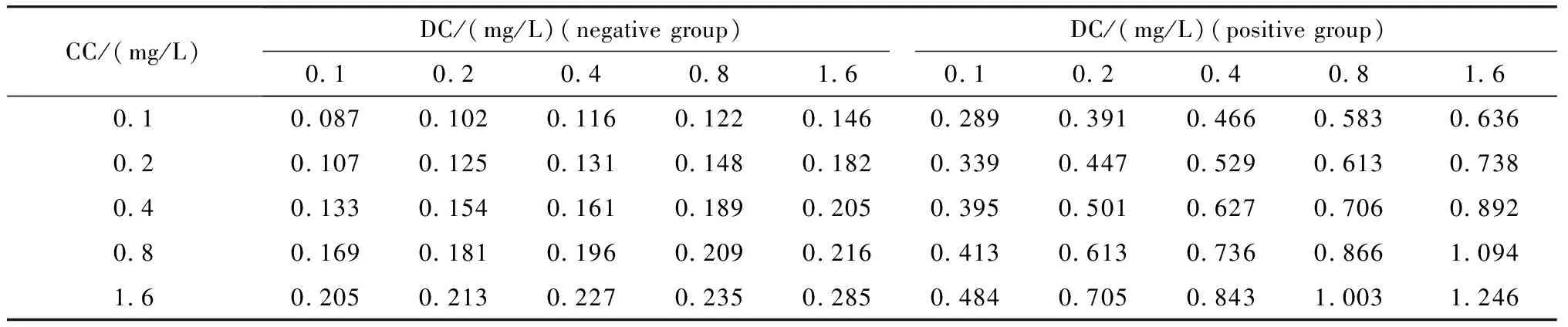
表1 棋盘法确立双GBP夹心法的包被和检测试剂工作浓度Table 1 Concentrations of GBP for coating and detection were established by chessboard method
表2 纳入研究对象的96名人员的基本信息比较Table 2 Comparison of basic information from 96 donors in this research
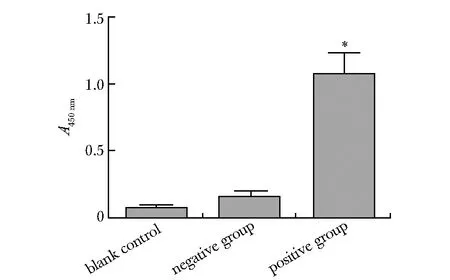
*P<0.01 compared with blank control图5 构建的GBP双夹心法对血清基质中(1,3)-β-D-葡聚糖的分析Fig 5 Analysis of (1,3)-β-D-glucans in serum matrix
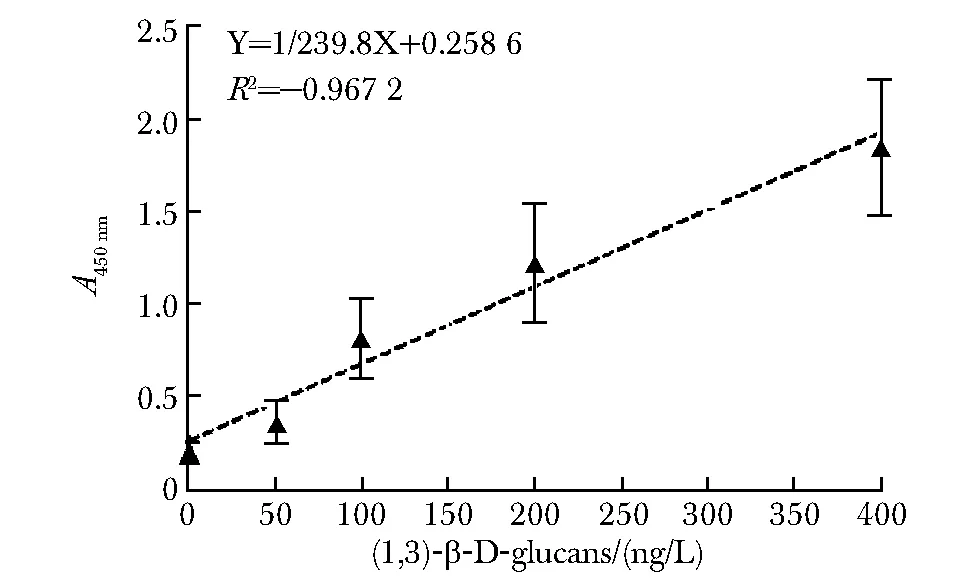
图6 GBP双夹心法测定血清 (1,3)-β-D-葡聚糖标准曲线Fig 6 Stander curve of (1,3)-β-D-glucans in serum using GBP sandwich method n=6)
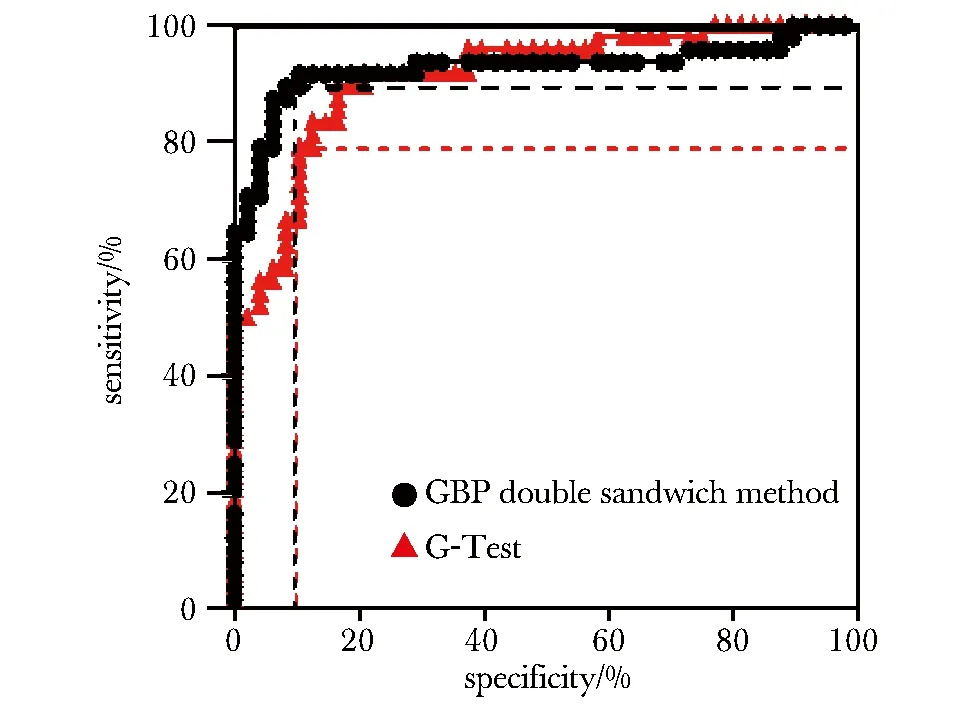
图7 两种方法对96例血清(1,3)-β-D-葡聚糖检测效能的ROC曲线Fig 7 ROC of two methods for (1,3)-β-D-glucans detection efficiency n=96)
本研究使用该方法和G-Test法对临床血清标本进行检测的性能比对,结果显示两种方法的灵敏度较为一致,而夹心法特异度高于临床现行的G-Test法。分析可能原因如下[8]:1)原理:夹心法的特异性优于级联催化法;2)血清标本的质量对夹心法影响较小;3)特定结构的靶标物质使配基法检测更为特异;4)本次探索的夹心法操作步骤简单,极大减少了操作过程中的误差。
(1,3)-β-D-葡聚糖作为目前深部真菌感染公认的标志物,其在临床确诊前提前5~10 d检测出阳性[15-16],且当病情恶化为严重脓毒症时,这一过程中该标志物的水平会持续升高。这一现象提示了对(1,3)-β-D-葡聚糖的动态监测,或可用于监测临床深部真菌感染的治疗效果。而本次研究所入选研究对象均为严重深部真菌感染的患者,其病程长短不一,因此本次无法精确评估该系统预测真菌感染的价值。本方法检测的入选研究对象(IFI患者和健康体检者),其灵敏度和特异度分别为91.67%(95%CI:80.02%~97.68%)和89.58%(95%CI:77.34%~96.53%),ROC曲线面积为0.9282(95%CI:0.8679~0.9884)。特异度高于本次检测的G-Test法。同比国外学者报道的G-Test法,均有所增高[17]。
综上所述,本研究初步实现了通过分子克隆技术模拟美洲鲎体内天然存在的特异性葡聚糖识别配基,并验证该重组配基具有识别、结合(1,3)-β-D-葡聚糖的能力,并应用于临床标本检测。本次实验所构建检测方法,有望开发为一种新型的侵袭性真菌感染的检测试剂盒,进而为临床IFI鉴别诊断提供数据支持。
