稳定表达CDC50A的卵巢癌细胞株的建立及鉴定
2022-06-27韩甜甜潘凌亚
韩甜甜,尹 婕,曾 靖,金 滢,李 艳,潘凌亚
(中国医学科学院 北京协和医学院 北京协和医院 妇产科 国家妇产疾病临床研究中心, 北京 100730)
卵巢癌是女性生殖系统恶性肿瘤中病死率最高的疾病[1]。尽管近几年生物信息学、分子基因学等各领域研究飞速进展,由此衍生了新型分子生物制剂,但是患者的复发率、生存率无明显改善[2]。这主要由于卵巢癌的异质性使得其在基因组学上表型复杂,难以统一其病因及发病机制之故[3]。
膜蛋白间的交联黏附、细胞膜转运体在胞外微环境、胞内调控等生物过程与肿瘤的发生发展、转移耐药具有一定的关联性[4],一些有关膜蛋白转运的研究已经在多种肿瘤包括前列腺癌、肾癌、乳腺癌等方面取得了进展[5]。本课题组验证了侧群细胞具有卵巢癌干细胞样生物学特性,并通过蛋白组学初步筛选出侧群细胞中显著上调的膜蛋白CDC50A[6]。CDC50A是由1 361个氨基酸组成的二级跨膜蛋白,较短的N端和C端位于细胞质内,胞外为较大的环形结构[7]。它是维持细胞膜磷脂分子的正确折叠以及转运至最终的亚细胞位置的重要蛋白[8-9]。有研究资料表明在卵巢癌中,P4型磷脂转移酶(type Ⅳ-P-type phospholipid transferases,P4-ATPases)与CDC50A形成膜蛋白转运体,导致顺铂耐药[9-10],故CDC50A与卵巢癌存在着必然的相关性,可能是卵巢癌干细胞表面标记蛋白。本研究建立了稳定表达CDC50A的细胞株,为今后实验奠定基础。
1 材料与方法
1.1 材料
MEMα培养基、DMEM细胞培养基(Gibco公司);胎牛血清(Hyclone公司);人卵巢癌细胞系SKOV3(中国医学科学院基础医学细胞中心);病毒包装质粒pCMV-VSVG和pCMV-Δ8.9、健康人胚胎肾细胞HEK-293T、大肠杆菌菌株DH5α/TOP10、质粒pLVX-IRES-GFP(原清华大学癌症与干细胞实验室郭伟教授赠予);克隆载体(EZ-TTMCloning Vector)、T载体快速链接试剂盒(北京康润诚业生物科技公司);EcoRⅠ、NotⅠ酶(MBI公司); PrimeSTAR HS DNA Polymerase、dNTPs(TaKaRa公司);T4DNA连接酶(Promega公司);DNA转染介质(PolyJetTMSignaGen公司);病毒浓缩液(上海依科赛生物制品有限公司);Polybrene聚凝胺、CHAPS(翌圣生物公司);Immobilon-P膜(Merck公司);兔抗Flag-tag多克隆抗体(华兴博创公司);ECL化学发光底物(Thermo公司);Alexa Fluor® 647 荧光素标记的兔抗人二抗、鼠抗β-actin单克隆抗体(Abcam公司);DAPI的荧光防淬灭封片剂(上海浩然生物公司)。
1.2 方法
1.2.1 细胞培养:HEK-293T细胞系以含10%胎牛血清的DMEM培养,SKOV3细胞系培养于含10%胎牛血清的MEMα培养基,置于37 ℃、5% CO2细胞孵箱中培养。
1.2.2CDC50A克隆及表达质粒的构建:根据HUGO基因命名委员会(HUGO Gene Nomenclature Committee,HGNC)发表的CDC50A(GENE ID:55754)转录变体1的序列设计引物(F:5′-GCGG AATTCGCCACCATGGCGATGAACTATAAC-3′;R:5′-GCCGCGGCCGCTTACTTATCGTCGTCATCCTTGTAA TCTCCTCCTCCAATGGTAATGTCAGCTG-3′),提取HEK-293T细胞总RNA,经反转录反应获得cDNA,通过PCR扩增CDC50A全长,反应条件为95 ℃预变性5 min;92 ℃变性30 s,50 ℃退火45 s,75 ℃延伸45 s,35个循环后72℃延伸3 min。然后将产物经1.2%琼脂糖凝胶电泳检测,采用DNA回收试剂盒从凝胶中回收目的片段。
将回收的基因片段与克隆载体相连接形成重组质粒,通过酶切鉴定,利用通用引物(CMV-F、IRES-R)进行测序,经测序验证的重组质粒与表达载体pLVX-IRES-GFP分别进行双酶切,加入T4DNA连接酶进行连接,将连接产物转化感受态大肠杆菌TOP10中,扩增后提取单克隆质粒,再次进行酶切鉴定,完成表达质粒pLVX-CDC50A-GFP的构建。
1.2.3 细胞转染:将1 μg表达质粒pLVX-CDC50A-GFP、3 μL DNA转染试剂与100 μL的DMEM培养液预混配置瞬时转染复合体,然后轻柔加入含HEK-293T细胞的培养基中。同法配置并转染空载质粒pLVX-IRES-GFP作为阴性对照组,未转染质粒的细胞作为空白对照组。48 h后观察转染效率。
1.2.4 慢病毒包装:以1∶1∶2的比例将病毒包装质粒pCMV-VSVG、pCMV-Δ8.9分别与拟整合的质粒pLVX-CDC50A-GFP或其空白对照质粒pLVX-IRES-GFP混合在DMEM中,通过DNA转染试剂形成复合物溶液,轻柔放入含HEK-293T细胞的培养基中,60 h后经低温离心收集病毒液。最后通过病毒浓缩液处理、PBS重悬后得到病毒原液。
测算病毒滴度:预先在6孔板中培养HEK-293T细胞,稀释病毒原液至10倍,利用Polybrene聚凝胺将慢病毒感染至细胞中。72 h后收集细胞,用流式细胞仪分析阳性细胞比例,计算病毒滴度(TU/mL)=细胞数目×感染细胞阳性率×稀释比例。
1.2.5 稳定表达细胞株的建立:将重组表达载体pLVX-CDC50A-GFP、空载体pLVX-IRES-GFP的病毒原液分别与MEMα培养液、Polybrene聚凝胺混匀配制感染复合体,分别均匀放入SKOV3细胞系培养基中。待病毒感染72 h后,在荧光显微镜下,观察绿色荧光激发比例。用胰蛋白酶消化细胞,经流式细胞仪分选带有绿色免疫荧光的阳性细胞后,对稳定转染病毒的SKOV3细胞株进行培养扩增。
1.2.6 免疫印迹:用CHAPS裂解膜蛋白,经低温离心收集上清液,BCA法定量,用金属浴将蛋白质变性。将蛋白质样品在标准条件下通过SDS-PAGE分离,电转移到Immobilon-P膜。以鼠抗人单克隆actin抗体(1∶5 000)加入抗体缓冲液(PBS含0.01% Tween20和0.1% BSA)作为内参,检测样品中兔抗Flag-tag多克隆抗体(1∶5 000),使用ECL化学发光底物检测信号。
1.2.7 免疫荧光:预先将SKOV3细胞株铺在盛有盖玻片的6孔板上。用4%多聚甲醛固定,0.3% Triton X-100溶液渗透细胞,5%羊血清PBS封闭以阻断抗体的非特异性结合。用兔抗Flag-tag多克隆抗体(1∶200)在4 ℃条件下孵育,最后用Alexa Fluor®647 荧光素标记的兔抗人二抗(1∶500)标记一抗。标记完成后,去除二抗,用荧光防淬灭封片剂封片。使用Zeiss LSM880超高分辨倒置共聚焦显微镜获取图像。
1.2.8 流式细胞学检测:用含有1%胎牛血清的PBS制备单细胞悬液,细胞计数,调整细胞浓度为1×106/100 μL。以未转染质粒的细胞作为阴性对照组。以最大吸光波长488 nm、最大反射波长525 nm检测绿色荧光细胞。
2 结果
2.1 鉴定表达质粒pLVX-CDC50A-GFP
克隆表达质粒经EcoRⅠ、NotⅠ双酶切后,可见与预期条带大小相符的单一条带(图1)。
2.2 pLVX-CDC50A-GFP质粒的蛋白表达
空载体对照组转染率为78.9%,重组CDC50A表达质粒的转染效率为50.8%(图2)。免疫印迹结果显示重组质粒可测得标签蛋白的表达,而空白对照组、阴性对照组则无表达(图3)。
2.3 稳定表达CDC50A的SKOV3细胞株检测及表达鉴定
利用流式细胞技术检测绿色荧光细胞比例,空载体组为94.9%,CDC50A稳定表达组为86.5%(图4)。通过免疫印迹技术定量检测到在50 ku处单一条带,而空白对照组中无条带显示。进一步通过免疫荧光技术分析可见CDC50A主要分布定位于细胞膜(图5)。

图1 pLVX-CDC50A-GFP表达质粒及酶切鉴定Fig 1 Expression and identification of pLVX-CDC50A-GFP plasmid

A.fluorescence microscopy(scale bar=50 μm); B.flow cytometry scatter plot图2 显微镜及流式细胞测量术检测表达质粒对HEK-293T细胞瞬时转染率Fig 2 Transient transfection rate of HEK-293T cells detected by microscopy and flow cytometry

图3 pLVX-CDC50A-GFP质粒中Flag标签蛋白特异性表达Fig 3 Specific expression of Flag-tag proteins of pLVX- CDC50A-GFP
3 讨论
CDC50A蛋白的跨膜结构具有疏水性,可溶性差,这对克隆后定性移位至细胞靶结构产生了负面影响[11]。故完成克隆并通过表达载体实现CDC50A在细胞膜上高表达是后续功能实验的基础。本文通过分子克隆技术获取了CDC50A表达载体,并成功构建了稳定表达的SKOV3细胞株,经过定性、定量、定位检测,证实获得的CDC50A蛋白表达稳定、特异。因此,此细胞株可作为研究CDC50A在SKOV3中作用的重要工具,为深入研究其与卵巢癌的相关性提供重要手段。
近年来,日本Tanaka实验室进行了一系列关于CDC50家族参与磷脂内翻酶的功能研究,发现在正常细胞中,CDC50家族蛋白定位在反面高尔基体上,发挥胞吞转运作用,当高尔基体膜泡生成障碍,囊泡堆积在反面高尔基上,功能蛋白转运障碍,导致质膜部分磷脂酰丝氨酸外翻,影响脂质双分子层的流动性,最终导致细胞出芽生殖受阻[12]。除了维持生理上的转运功能,研究还发现在多种肿瘤细胞系中,CDC50A的表达下调,使得胞质-胞膜转运体形成受阻,从而抑制了细胞对哌立福新的摄取[13]。目前尚无CDC50A在卵巢癌中作用的研究报道。有研究表明CDC50家族蛋白在维持细胞膜稳定性、参与胞吞胞吐等物质转运、完成信号交换等方面起到重要的生物学作用[9-10]。本研究发现SKOV3过表达CDC50A后,CDC50A蛋白集中分布在细胞膜上,进一步说明该膜蛋白亚细胞结构的分布靶向性,可能会影响细胞交联、胞内转运等重要的信号传导途径。因此,后续将在过表达CDC50A的SKOV3细胞株中,深入研究其发生发展及耐药作用。

A.fluorescence microscopy(scale bar=50 μm); B.flow cytometry scatter plot图4 SKOV3细胞株慢病毒载体感染率Fig 4 Infection efficiency of SKOV3 cell strain with lentiviral vector
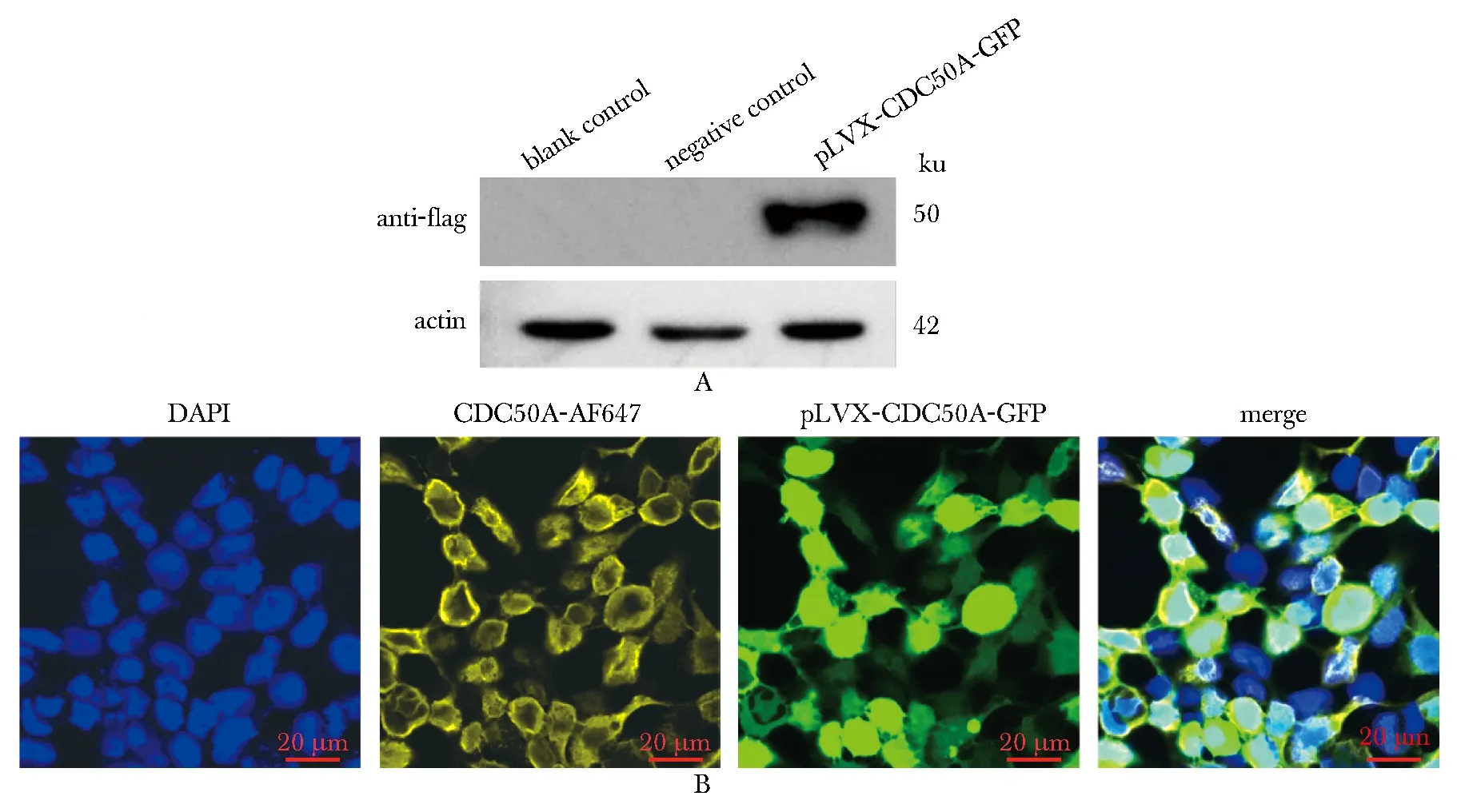
A.the single band in pLVX-CDC50A-GFP group compared with no finding in blank and negative groups by Western blot; B.blue nucleus, yellow cytomembrane located by immunofluorescence(scale bar=20 μm)
本实验主要局限性在于仅建立了一个细胞株,但作为前期实验,本实验完成了分子克隆及慢病毒包装,并证明其可在多种卵巢癌细胞系完成病毒载体感染,在原代细胞中完成悬浮感染。
