不同施肥措施对华北潮土区玉米田土壤固碳细菌群落结构多样性的影响
2022-06-25刘红梅海香安克锐张海芳王慧张艳军王丽丽张贵龙杨殿林
刘红梅,海香,安克锐,张海芳,王慧,张艳军,王丽丽,张贵龙,杨殿林
农业农村部环境保护科研监测所,天津 300191
土壤是陆地生态系统重要的有机碳库,土壤有机碳固存相关研究已成为全球农田生产力、生物多样性和固碳减排等相关领域研究的热点问题之一。根据政府气候变化专门委员会(IPCC)统计,全球每年的固碳潜力高达4.3 Pg CO2,其中90%来自土壤对大气CO2的固存(Smith et al.,2008)。增加土壤有机碳的固存量,既可提高土壤肥力,又可降低土壤CO2释放,促进农田土壤向大气CO2的“汇”转变(Karl-Heinz et al.,2017)。土壤对大气 CO2的固定主要是土壤自养微生物参与的同化过程(陈晓娟等,2014)。卡尔文循环是自养微生物同化CO2的最主要途径(Berg,2011),该过程中起关键作用的酶是 1, 5-二磷酸核酮糖羧化酶/加氧酶(RubisCO)。cbbL是RusbisCO的编码基因之一,具有高度保守性,常作为环境中卡尔文循环自养固碳微生物群落多样性的标记物(Nanba et al.,2004;刘琼等,2017),已被国内外学者应用到生物固碳分子生态学研究中(Tolli et al.,2005;高静等,2018;苏鑫等,2020)。
农田生态系统是陆地生态系统中受人为干扰最大同时也是固碳潜力最大的碳库之一(Simth,2004)。施肥通过改变土壤养分(李倩等,2018)而改变微生物群落结构和多样性(陆海飞等,2015;刘红梅等,2020),进而影响土壤微生物的 CO2的固定能力(陈晓娟等,2014)和作物产量(俄胜哲等,2018)。Yuan et al.(2013)通过功能基因cbbL分子标记技术发现,稻田土壤cbbL具有高的多样性,且其与碳同化速率呈显著正相关关系。土壤固碳酶(RusbisCO)活性高,表明土壤自养微生物同化 CO2的潜力高(陈晓娟等,2014)。Selesi et al.(2005)研究发现,施用化学肥料和混合堆肥后小麦田土壤cbbL基因群落组成和多样性发生了明显改变。Yuan et al.(2012)研究表明,长期施肥导致农田土壤碳同化自养种群结构产生了明显差异,固碳优势菌群也发生了相应变化。张双双等(2019)研究表明,土壤pH、有机碳、总氮等土壤因子是影响固碳细菌群落结构差异的主要影响因子。研究不同施肥措施下土壤固碳细菌群落变化和引起其变化的主控土壤理化因子,对明晰不同施肥措施下农田土壤固碳机制和农业可持续发展具有重要意义。
华北平原是我国主要的粮食主产区,以小麦/玉米轮作一年两熟制为主要种植制度,在保障我国粮食生产中起着重要作用。但该地区存在过量施氮现象,易造成氮素挥发损失、面源污染等环境问题,如何在合理施肥同时提高土壤固碳潜力需要科学数据支持。目前,长期不同施肥措施对华北农田土壤固碳细菌微生物群落结构多样性的影响还不明确。为此,本研究以农业农村部环境保护科研监测所武清野外科学试验站长期定位试验中小麦-玉米轮作农田为研究对象,利用Illumina MiSeq高通量测序技术,研究不同施肥措施对华北农田土壤卡尔文循环功能基因cbbL群落结构多样性的影响及与土壤理化性质间的关系,以期为提高土壤固碳潜力和农业可持续管理提供理论依据和数据支撑。
1 材料与方法
1.1 试验地概况
试验地位于农业农村部环境保护科研监测所武清野外科学试验站(39°21′N,117°12′E)。属温带半湿润大陆性季风气候,四季分明。年平均气温11.6 ℃,年均降水量520—660 mm,年平均无霜期为196—246 d。土壤类型为潮土。试验开始前土壤基本理化性质为:土壤全氮1.18 g·kg−1,全磷0.72 g·kg−1,全碳 10.83 g·kg−1,硝态氮 19.95 mg·kg−1,铵态氮 5.06 mg·kg−1,速效磷 18.6 mg·kg−1,pH 7.58。
1.2 试验设计及样品采集
自2010年开始长期试验,试验设6个施肥处理:对照A0(不施肥),单施有机肥A1(有机肥15 t·hm−2),氮肥减量配施有机肥 A2(有机肥 15 t·hm−2,N 基肥 55.2 kg·hm−2、追肥 36.8 kg·hm−2,P2O581.0 kg·hm−2,K2O 75.0 kg·hm−2),常量化肥配施有机肥 A3(有机肥 15 t·hm−2,N 基肥 117.3 kg·hm−2、追肥 78.2 kg·hm−2,P2O581.0 kg·hm−2,K2O 75.0 kg·hm−2),氮肥增量配施有机肥A4(有机肥15 t·hm−2,N基肥 172.5 kg·hm−2、追肥 115.0 kg·hm−2,P2O581.0 kg·hm−2,K2O 75.0 kg·hm−2),单施化肥A5(N 基肥 117.3 kg·hm−2、追肥 78.2 kg·hm−2,P2O581.0 kg·hm−2,K2O 75.0 kg·hm−2)。小区面积为 400 m2,各小区间隔50 cm,每个处理3次重复。有机肥由牛粪和鸡粪混合堆腐而成,氮含量为0.69%,P2O5含量为0.65%,K2O为0.38%。氮肥为尿素(N,46.4%),磷肥为过磷酸钙(P2O5,12%),钾肥为硫酸钾(K2O,50%)。每年 9月底玉米收获后,有机肥和磷钾肥全部作基肥和氮肥 60%作基肥在冬小麦播种时一次性施入,在小麦拔节期追施40%氮肥。6月初小麦收获后,有机肥和磷钾肥全部作基肥和氮肥 60%作基肥在夏玉米播种时一次性施入,玉米小喇叭口期追施40%氮肥。其他田间管理同一般大田生产。种植制度为典型的冬小麦-夏玉米轮作。
2019年9月底在玉米收获期采集土壤样品。用直径为5 cm土钻,在每个小区内按照“S”型取样法选取5个点,采集0—20 cm土壤样品,用冰盒带回实验室。去除根系、凋落物和其他杂质,将土壤样品分成两份,一份于−20 ℃冷冻保存,用于土壤微生物和速效养分分析;另一份土样室内自然风干,用于其他土壤理化性质测定。
1.3 土壤理化性质测定
土壤 pH 采用玻璃电极法(水土比为 2.5꞉1),土壤有机碳测定采用重铬酸钾外加热法,土壤全氮采用凯氏定氮法,土壤全磷采用钼锑抗比色法,土壤铵态氮和硝态氮含量采用 2 mol·L−1氯化钾溶液提取-流动分析仪(AA3,德国)测定,土壤速效磷采用碳酸氢钠提取-钼锑抗比色法(鲍士旦,2000)。土壤微生物量碳、氮采用氯仿熏蒸-K2SO4提取法测定(吴金水等,2006)。
1.4 土壤DNA提取、PCR扩增及MiSeq测序
土壤DNA提取采用Power Soil® DNA Isolation Kit试剂盒提取,称取0.5 g土样,提取步骤按试剂盒说明书进行。提取后的土壤总DNA用质量分数为 1%琼脂糖凝胶电泳进行检测,使用超微量分光光度计(NanoDrop 2000,德国)进行质检。采用Qubit 2.0 DNA检测试剂盒对提取的DNA进行精确定量,以确定PCR反应加入的DNA量。采用巢式PCR进行扩增,第一轮引物为cbbL-F(GACTTCA CCAAAGACGACGA)和cbbL-R(TCGAACTTGA TTTCTTTCCA),第二轮引物为cbbL-F(ACCAYCA AGCCSAAGCTSGG)和cbbL-R(GCCTTCSAGCTT GCCSACCRC)。使用梯度PCR仪(Eppendorf,德国)进行PCR产物的扩增。采用25 μL扩增反应体系,包含 12.5 μL 2×Taq Plus Master Mix,3 μL BSA(2 ng·μL−1),1 μL 正向引物(5 μM),1 μL 反向引物(5 μM),2 μL 模板 DNA和 5.5 μL ddH2O。第一轮扩增:94 ℃ 5 min,30 个循环(94 ℃ 30 s,52 ℃30 s,72 ℃ 60 s),最后72 ℃延长7 min。第二轮扩增:94 ℃ 5 min,20个循环(94 ℃ 30 s,52 ℃30 s,72 ℃ 60 s),最后72 ℃延长7 min。每个样本3个重复,将同一样本的PCR产物混合后,用2%的琼脂糖凝胶进行电泳检测,利用AxyPrep DNA凝胶回收试剂盒(AXYGEN公司)切胶回收 PCR产物,Tris-HCl缓冲液洗脱,质量分数为2%的琼脂糖电泳检测。使用Qubit 2.0荧光定量系统测定回收产物浓度,将等摩尔浓度的扩增子汇集到一起,混合均匀后进行测序。
1.5 高通量测序数据分析
测序由北京奥维森基因科技有限公司完成,利用Illumina MiSeq PE300平台上机测序。下机数据经过Trimmomatic和Flash软件预处理,去除低质量reads,然后根据PE数据之间overlap关系将成对的 reads拼接成一条序列。去除 tags两端的barcode序列及引物序列,去除嵌合体及其短序列等后得到高质量的 clean tags,拼接过滤后的 clean tags,在0.97相似度下利用Qiime和Vsearch软件进行可操作分类单元(Operational taxonomic unit,OTU)聚类分析。对比 GreenGenes数据库,对每个OTU进行物种注释。α多样性是对单个样品物种多样性的分析,基于OTU的结果,计算Chao1指数、观测值指数(Observed species)、谱系多样性指数(phylogenetic diversity,PD whole tree)和香农指数(Shannon)来进行生物多样性分析。
1.6 数据分析
应用SPSS 19.0统计软件进行单因素方差分析(one-way ANOVA),利用韦恩图比较样本间 OTU相似性,利用主成分分析(principal component analysis,PCA)比较不同处理土壤固碳细菌群落的差异,利用CANOCO 4.5软件对土壤固碳细菌优势菌属水平相对丰度与土壤化学性质冗余分析(redundancy analysis,RDA)。
2 结果与分析
2.1 不同施肥措施下土壤化学性质变化
长期不同施肥改变了土壤化学性质(表1)。5种施肥处理的pH值均显著低于对照A0(P<0.05)。A1、A2、A3和A4的总有机碳含量显著高于对照A0,A5的总有机碳含量显著低于对照A0(P<0.05)。5种施肥处理的土壤全氮和硝态氮含量均显著高于对照(P<0.05)。A2、A3和A5处理的铵态氮含量显著高于对照(P<0.05),A1和A4处理的铵态氮含量与对照 A0无显著差异(P>0.05)。A1、A2、A3和 A4的全磷和微生物量氮含量显著高于对照A0(P<0.05),A5的全磷、微生物量碳和微生物量氮含量与对照A0无显著差异(P>0.05)。

表1 不同施肥措施下土壤化学性质Table 1 Soil chemical properties in different fertilization treatments
2.2 不同施肥措施下土壤固碳细菌群落多样性
α多样性主要关注均匀生境下的物种数目(刘茗等,2021),适合本研究土壤固碳细菌多样性的描述。Chao1、Observed species和PD whole tree指数均可反映样品中群落的丰富度,其值越大表明样品中固碳细菌群落物种的丰富的越高。Shannon指数表示群落多样性,其值越大表明固碳细菌群落多样性越高。由图1可知,A1、A2、A3和A4处理的Chao1、Observed_species指数高于对照A0,A5处理的Chao1、Observed_species指数低于对照A0,但各处理间均无显著差异(P>0.05)。各处理的PD_whole_tree指数均无显著差异。A1和A3处理的 Shannon指数高于对照 A0,A4和 A5处理的Shannon指数低于对照 A0但各处理间均无显著差异(P>0.05)。土壤固碳细菌α多样性与土壤化学因子的相关性分析结果见表2。土壤固碳细菌Shannon指数与pH呈显著正相关(P<0.01),与土壤硝态氮含量呈极显著负相关(P<0.01)。表明影响土壤固碳细菌Shannon多样性指数的主要土壤环境因子是土壤pH和硝态氮含量。

表2 土壤固碳细菌群落α多样性与土壤化学因子之间的相关分析Table 2 Correlation analysis between soil CO2-assimilating bacterial α-diversity index and soil chemical properties

图1 不同施肥措施下土壤固碳细菌群落多样性Figure 1 Community diversity of CO2-assimilating bacteria in different fertilization treatments
2.3 不同施肥措施下土壤固碳细菌群落组成及相对丰度
在97%序列相似度水平下有12798个OTU,每个样品的OTU数量从504—575个不等。研究所得序列主要被归为3个门、4个纲和18个属。不同施肥措施下土壤固碳细菌群落在门、纲、属水平上的组成及相对丰度见图2。以门作为分类学水平,变形菌门Proteobacteria为cbbL微生物优势菌,各处理相对丰度92.83%—94.98%。A1、A2和A3处理的变形菌门相对丰度与对照A0相比无显著差异,A4和A5处理显著降低了变形菌门的相对丰度。以纲作为分类学水平,优势菌纲为γ-变形菌纲Gammaproteobacteria、α-变形菌纲 Alphaproteobacteria和β-变形菌纲Betaproteobacteria,相对丰度分别为 53.75%—65.80%、16.46%—25.89%和12.28%—18.54%。与对照A0相比,A2、A3、A4和A5处理显著降低了γ-变形菌纲相对丰度;A1处理的γ-变形菌纲相对丰度低于A0处理,但无显著差异。α-变形菌纲相对丰度,A2、A4和A5显著高于A0,A1和A3与A0无显著差异。β-变形菌纲相对丰度,A3显著高于 A0,A5显著低于A0,A1、A2和A4与A0无显著差异。

图2 不同施肥措施下土壤固碳细菌群落在门(a)、纲(b)、属(c)水平上的组成及相对丰度Figure 2 Soil CO2-assimilating bacteria community composition and relative abundance at phylum (a), class (b)and genus (c) level with different fertilization treatments
以属作为分类学水平,各处理均大于 2%的优势菌属有碱湖生菌属Alkalilimnicola(14.12%—19.34%)、碱螺菌属Alkalispirillum(6.91%—14.54%)、Brevirhabdus(4.18%—14.95%)、红杆菌属Rhodobacter(6.54%—9.27%)、Sulfurifustis(5.73%—7.03%)、Marichromatium(3.41%—6.32%)、Diploblechnum( 4.37%—6.41%)、Sulfuricaulis(2.54%—4.91%)和Thioalkalivibrio(2.87%—6.03%)。与对照A0相比,A1、A2、A3、A4和A5处理显著降低了Alkalispirillum和Thioalkalivibrio相对丰度,显著提高了Brevirhabdus相对丰度。A1、A2、A3、A4、A5处理的Sulfurifustis、Marichromatium和Sulfuricaulis相对丰度与对照A0相比均无显著差异。
2.4 不同施肥措施下土壤固碳细菌群落组间差异
PCA分析是指运用方差分解的方法,将不同数据组的差异反映在二维坐标图上,如果两个处理距离越近,则表示这两个样品的组成越相似。不同施肥处理之间有显著差异OTUs丰度的PCA图如图3所示,前两个主成分分别占细菌群落变异的31.36%和13.71%。A3、A4、A5位于主成分1右侧,而对照A0、A1和A2位于主成分1左侧。表明,A3、A4和A5处理有显著差异OTUs丰度组成相似,而A0、A1和A2处理有显著差异OTUs丰度组成相似。5个施肥处理差异OTUs与对照处理差别显著,且A3、A4和A5处理与对照A0、A1和A2处于不同排序区。说明连续 10年常量化肥配施有机肥、氮肥增量配施有机肥和单施化肥处理对土壤固碳细菌群落产生了显著影响。

图3 不同施肥处理固碳细菌群落结构的主成分分析Figure 3 Principal components analysis of the soil CO2-assimilating bacteria community structure in different fertilization treatments
2.5 固碳细菌群落结构与土壤理化因子的冗余分析
为进一步分析不同土壤理化因子对土壤固碳细菌群落结构的影响,选取土壤具有代表性的优势菌属(相对丰度平均值大于 2%)为物种变量、土壤理化性质为环境变量进行冗余分析(图4)。结果表明,第一排序轴和第二排序轴分别解释了76.9%和11.2%的变异,前两轴共解释了固碳细菌群落总变异的88.1%。第一排序轴与土壤pH呈正相关,与有机碳、全氮、全磷、铵态氮、硝态氮、微生物量碳和微生物量氮呈负相关;第二排序轴与有机碳、全氮、全磷、硝态氮、微生物量碳和微生物量氮呈正相关,与 pH、铵态氮呈负相关。土壤 pH(F=9.969,P=0.002)、全氮(F=10.775,P=0.002)、全磷(F=8.160,P=0.004)、硝态氮(F=21.608,P=0.002)、铵态氮(F=7.598,P=0.002)、微生物量碳(F=14.063,P=0.002)、微生物量氮(F=5.631,P=0.010)对土壤固碳细菌属水平达到显著影响,有机碳(F=3.124,P=0.062)对土壤固碳细菌属水平未达到显著影响。
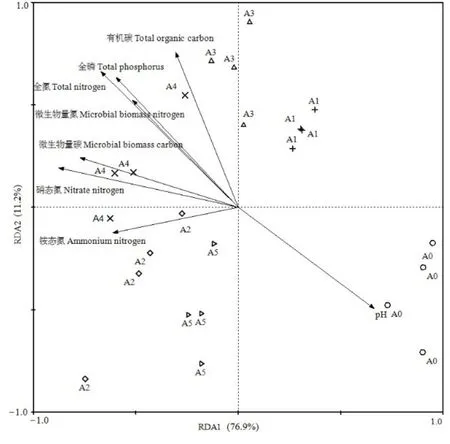
图4 土壤固碳细菌群落结构与土壤化学性质间的冗余分析Figure 4 Redundancy analysis between CO2-assimilating bacteria community structure and soil chemical properties
3 讨论
本研究利用Illumina MiSeq PE300高通量测序技术分析华北农田土壤固碳细菌多样性发现,长期单施化肥和氮肥增量配施有机肥的Shannon多样性指数低于不施肥对照。这与Qin et al.(2021)对贝加尔针茅草原长期高氮添加试验研究结果一致。Zhao et al.(2018)研究表明,土壤中高含量的有效氮会增加固碳微生物多样性。本研究结果与这一研究结论不一致。这可能是因为高氮添加导致土壤中可利用性氮素含量增多,导致喜氮微生物生长迅速。相关性分析表明,土壤固碳细菌Shannon多样性指数与硝态氮含量呈极显著负相关性,也说明了这一点。Huang et al.(2018)研究表明,水稻田土壤有效氮含量与cbbL细菌丰度有显著相关性。施肥对cbbL基因丰度的影响与种群变化规律不完全一致,与不施肥对照相比,单施有机肥、单施化肥及有机肥与化肥配施均可以提高OUTs丰度,特别是单施有机肥物种丰度最高。这是由于肥料施用后,土壤中的营养元素含量增加,土壤pH下降,土壤养分的有效性提高,为土壤中自养固碳细菌提供了所需的营养元素以及丰富的碳源和能源。Zhou et al.(2019)研究发现,连续28年氮添加试验,固碳微生物多样性与氮素添加量呈显著正相关关系。由于陆地生态系统环境异质性,因而不同环境中土壤固碳微生物多样性对不同氮添加水平、氮添加年限、地上植物群落组成的响应不一致。
不同长期施肥措施对土壤固碳细菌群落结构产生了显著的影响。本研究中所获得优势菌门为变形菌门,变形菌门在土壤中占最大比例,这与其他研究结论一致(Zhou et al.,2019;刘琼等,2017;苏鑫等,2020)。本研究发现,与不施肥对照相比,氮肥增施配施有机肥和单施化肥显著降低了变形菌门相对丰度,A1、A2、和A3处理的变形菌门相对丰度无显著变化。本研究中γ-变形菌纲Gammaproteo bacteria为土壤中的优势纲,这与苏鑫等(2020)在松嫩平原盐碱耕地研究结果一致。这可能是由于γ-变形菌纲细菌噬盐微生物较多,而本研究试验区土壤pH在8.19—8.71之间,适宜该微生物群落生长。本研究中,氮肥增量配施化肥和单施化肥处理显著提高了α-变形菌纲 Alphaproteo bacteria相对丰度。戴雅婷等(2017)研究也表明,在植被修复和长期施肥过程中α-变形菌纲的丰度不断上升。
本研究发现不同施肥处理的土壤固碳细菌群落差异显著,A1、A2、A3、A4和A5处理土壤固碳细菌群落结构与对照A0发生了显著变化,说明连续 10年施肥改变土壤固碳细菌生境条件,从而引起微生物群落结构的变化。常量化肥配施有机肥、氮肥增量配施有机肥和单施化肥处理的与不施肥对照、单施有机肥和氮肥减量配施有机肥之间差异显著。RDA分析可直接清楚的反应土壤环境因子对研究区土壤固碳细菌群落特征的影响。从 RDA结果判断驱动土壤固碳细菌变化的因子发现,土壤固碳微生物群落结构受pH、全氮、全磷、铵态氮、硝态氮、微生物量碳和微生物量氮含量的显著影响。pH可以通过 H+浓度改变土壤中营养元素的形态从而影响自养微生物类群(Stockdale et al.,2002;刘琼等,2017)。本研究发现,土壤有机碳对土壤固碳细菌群落结构无显著影响,这与Xiao et al.(2014)和刘琼等(2017)对水稻田的研究结果不一致。碳同化微生物对土壤特性和环境因子变化敏感,不同研究者研究结论不一致,推测可能是由于作物类型、土壤质地和施肥量不同造成的(Yuan et al.,2012;刘琼等,2017)。可见,有机碳对土壤固碳微生物的调控机制并不具有普遍性。本研究表明,有机肥和无机肥连续施用引起土壤 pH和养分变化是土壤固碳微生物群落和多样性变化的重要原因。不同施肥措施使得土壤环境养分发生了改变影响了对环境变化敏感的自养微生物的生长和代谢活动,从而导致了碳同化功能微生物种群结构的变化。
4 结论
(1)连续 10年过量施用氮肥配施有机肥和单施化肥处理降低了土壤固碳细菌Shannon多样性指数。土壤pH和硝态氮含量是影响土壤固碳细菌群落α多样性重要因素。
(2)连续 10年不同施肥措施下,华北平原农田土壤固碳细菌优势菌群相对丰度发生改变,这种改变在门、纲和属分类水平上均有体现。单施有机肥、氮肥减量配施有机肥未显著改变土壤固碳细菌群落结构,常量化肥配施有机肥、氮肥增量化肥配施有机肥和单施化肥显著改变土壤固碳细菌群落结构。
(3)连续 10年不同施肥措施下,显著改变了土壤理化因子,这些土壤环境因子的变化进一步影响了土壤固碳细菌群落结构,其中 pH、全氮、全磷、铵态氮、硝态氮、微生物量碳和微生物量氮含量的差异是影响固碳微生物群落特征形成的主要影响因子。
