三江源区高寒退化草甸土壤细菌多样性的对比研究
2022-06-25王英成姚世庭金鑫俞文政芦光新王军邦
王英成,姚世庭,金鑫,俞文政,芦光新*,王军邦
1.青海大学,青海 西宁 810016;2.南京信息工程大学,江苏 南京;3.中国科学院地理科学与资源研究所生态系统网络观测与模拟重点实验室/生态系统大数据与模拟中心,北京 100101
土壤微生物种类繁多,主要包括细菌、真菌、古菌、原生动物以及病毒等(Torsvik et al.,2001)土壤微生物是土壤生态系统的重要组成成分,在土壤养分循坏、土壤肥力维持和土壤固氮等方面都发挥着重要作用,而且对于环境变化十分敏感(Martiny et al.,2011;刘洋荧等,2017;王朱珺等,2018)。在草地生态系统中,土壤微生物物种之间彼此相互依赖、相互制约,同时又和各类环境因子相互作用、往复调控(赵轻舟等,2018)。土壤微生物群落受到各种环境因子的影响,包括植被群落、土壤特征、气候因子等(Gu et al.,2019),在草地生态系统中,草地类型(Wang et al.,2020)、草地退化(Che et al.,2019)等都会显著改变草地土壤微生物的群落结构。
三江源区地处青藏高原腹部,其独特的自然条件造就了该区域独特的草地生态系统,高寒草甸作为该区域的主体植被类型,近年来,由于全球性的气候变化、过度放牧等人为干预导致草地生态系统发生严重退化(Li et al.,2019;杨建平等,2004)。草地退化不仅引起地表植被群落发生显著的变化,同时也会显著影响土壤及地下微生物群落结构的改变。土壤是一个复杂的动态生物生态系统,它决定了陆地生态系统的植物生产力,并维持着生物地球化学循环(Wang et al.,2016;贺纪正,2013)。微生物对于土壤功能特别重要,尤其是在有机质分解和养分循环中(张卫信等,2020)。其中,土壤原核生物是土壤中数量最多、分布最为广泛的微生物类群,在土壤生态过程中发挥着重要的作用。原核生物作为指示环境变化的敏感指标,对于预测土壤养分和环境质量的变化具有重要作用。之前有研究发现,退化土壤中的一些原核生物对于植物生长有害,因为草地退化改变了它们的代谢(Olff et al.,2000)。因此,高寒草地土壤养分状况和植物多样性的变化可能导致微生物群落结构的变化,进一步导致生态系统的退化。
近年来,分子生物学技术的发展和新一代高通量测序等技术的突破克服了传统给微生物研究的局限性,极大的推动了微生物生态的发展(薛凯等,2019),越来越多的研究通过微生物这一微观生物来揭示生态系统中的各种变化。Hou et al.(2019)通过高通量测序技术评估不同生态系统恢复方法对细菌群落多样性的影响时,发现植被恢复后细菌群落多样性显著得到改善,且认为介导细菌群落多样性的主要取决于恢复退化草地的植被类型。Zhou et al.(2019)利用高通量测序技术对未退化、轻度退化、中度退化、重度退化和极度退化5个退化阶段土壤微生物群落的变化,结果发现在不同退化阶段土壤微生物的群落组成并没有很显著的差异,但是土壤微生物的群落结构差异显著,认为高寒草地退化对于土壤微生物的影响主要是通过介导土壤微生物群落的结构进而影响其功能。目前,很多关于退化草地的研究大多集中在微生物生物量、可培养微生物以及基因文库的构建等(杨希智等,2015;李海云等,2019),这些传统的方法对于我们解析地下微生物群落对草地退化的响应仍有所欠缺。因此,本研究采用巢式取样法涵盖足够多的样本量,并利用高通量测序技术手段全面的解析地下微生物群落多样性,能够很好地将我们所检测的微生物用来评估退化草地微生物群落变化。以此来探究在高寒草地退化过程中土壤原核生物的群落组成、多样性和结构变化,以期阐明并揭示在草地退化过程种土壤原核生物的变化规律,为我们进一步草地健康评价和退化草地恢复提供新的思考角度。
1 材料与方法
1.1 研究区概况
研究区位于青海省玉树州称多县珍秦乡,地理位置 33°21′35.04″N,97°20′37.38″E,平均海拔 4500 m,属寒温大陆性季风气候,冷季长,暖季短,年均温−6 ℃,无霜期较短,93—126 d左右。草地植被主要以高寒草甸为主,原生植被的主要优势种有高山嵩草(Kobresiapygmaea),矮嵩草(Kobresia humilis),紫花针茅(Stipapurpurea)等,土壤为高寒草甸土。
1.2 研究方法
1.2.1 样地设置与取样方法
本研究依据裸露地块地貌、草地植被群落特征以及草地的利用方式、强度选取两块典型的高寒草甸,即未退化草甸与退化草甸,采用巢氏取样法进行土壤样品的采集,即小样方嵌套在大样方内(图1)。本研究中,以中心取样区域(红点,面积为 8 m2)作为参考点,12块1 m2的采样区域以垂直交叉方式分别设置在距采样中心区域10、100、1000 m处(图1)。其中,中心采样区域包含17个土芯,每1 m2区域包含5个土芯。总共获得154个样本(2个采样区域×77个采样点)。于2019年8月12—13日,采用样方法随机用土钻钻取表层土壤(0—15 cm)二钻,剔除可见植物残体及土壤动物,封装于带有样品编号的样品袋中,一部分保存于实验室4 ℃冰箱用于理化性质参数测定,一部分保存于−80 ℃冰箱用于DNA提取。
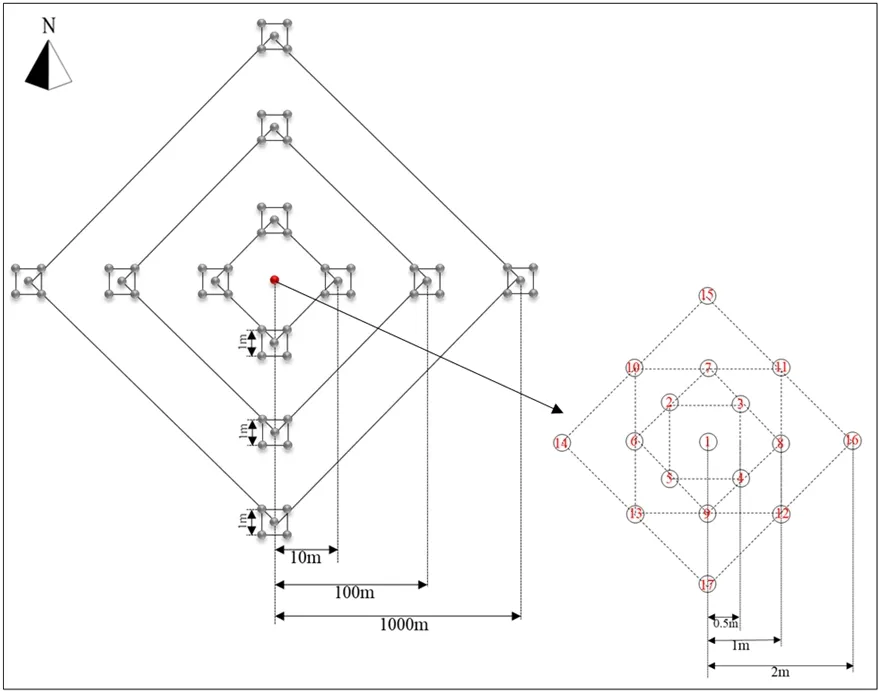
图1 采样设计图Figure 1 Sampling plan
1.2.2 土壤理化参数指标测定
土壤部分主要是测定土壤全氮、土壤硝态氮、土壤铵态氮、土壤有机质、土壤pH值,土壤水分、土壤电导率。土壤pH用显酸度计(PHS-3C)测得,水土比2.5꞉1。土壤全氮含量、有机质含量、铵态氮含量、硝态氮含量测定方法与姚世庭等(2021)方法一致。土壤水分、土壤电导率利用TDR 350仪器测定,重复3次,记录数据。
1.2.3 土壤微生物测定
将采集的土壤样品过 40目筛子预处理后,利用Mobio试剂盒(MOBIO Laboratories,Carlsbad,CA,美国)根据说明书从0.25 g土壤中提取总DNA(党宁,2020),采用通用引物515F和806R扩增土壤中的16S rRNA基因的V3—V4区,基于Illumina Miseq测序平台进行高通量测序。测序委托深圳美格基因公司进行测序。
1.3 数据分析
所有测序的原始数据均于中国科学院生态环境研究中心宏基因课题组构建的 Galaxy分析平台(http://mem.rcees.ac.cn:8080/)进行相关的分析(Feng et al.,2017;Zhang et al.,2017)。将所获得序列Reads根据标签被分配到不同的样品中并允许一个错配的发生,然后去掉标签和引物序列,使用FLASH步骤合并相同序列的正向和反向 reads(Magoc et al.,2011),使用Btrim对reads进行过滤(Kong,2011),保持平均质量分数大于20,16S最小长度为140 bp。任何带有简并碱基的序列都被删除,只保留16S长度在245—260 bp之间的reads,使用 Greengenes参考数据集作为嵌合体检测的参考,使用UPARSE(Edgar,2011)将序列聚类为可操作的分类单元(OTU),序列相似度阈值为97%。为了纠正样本误差,将所有的样本随机重抽到33159相同的reads数,重抽得到的OTU表进行后续的生物统计分析。
1.4 统计分析
采用ANOVA方差分析对土壤理化参数进行统计行检验,在P<0.05差异水平上检测是否有显著性差异。利用weighted UniFrac矩阵用于PCoA方法对两个采样地的土壤微生物群落的进化多样性的差异进行研究分析,利用 Bray-curtis矩阵用于NMDS非度量多维尺度分析来可视化群落组成的差异,利用基于Bray-curtis和Jaccard距离矩阵用于Dissimilarity test检验不同群落之间组成的差异。使用Mantel和Partial mantel test以及典范对应分析CCA来确定植被因子和土壤理化参数对于微生物群落差异的相对贡献。
2 结果与分析
2.1 高寒退化草甸植被群落结构差异分析
草地退化是一个复杂而长期的过程,草地退化最明显的标志是植被群落结构的变化,包括植被生产力、群落组成结构等。本研究对高寒退化草甸与未退化草甸植被群落结构的分析(表1),结果发现未退化草甸的植被盖度为87%,退化草甸的植被盖度为72%。草地退化显著降低植被物种数和地上生物量,退化草甸相比未退化草甸物种数减少了14.87%,地上生物量减少了19.47%。
结果显示(表1),在试验样地共有草本植物15科 23属 27种,其中种类最多的是菊科(Compositae),其次依次为莎草科(Cyperaceae)、蔷薇科(Rosaceae)、龙胆科(Gentianaceae)、石竹科(Caryophyllaceae)、唇形科(Lamiaceae)、玄参科(Scrophulariaceae)、豆科(Leguminosae)、禾本科(Gramineae)等。未退化草甸植被以高山嵩草(Kobresiapygmaea)为主要优势种,优势度为47.58%,次优势种为紫花针茅(Stipapurpurea)、重冠紫菀(Asterdiplostephioides)、矮生忍冬(Laniceraminuta),优势度分别为21.35%、14.17%、10.40%。退化草甸的主要优势种也是高山嵩草,优势度为41.97%。次优势种为紫花针茅、矮生忍冬、重冠紫菀、细叶亚菊(Ajaniatenuifolia)、高山唐松草(Thalictrumalpinum)、雪灵芝(ArenariakansuensisMaxim.)、苔草(Carexspp.)、麻花艽(Gentiana straminea),优势度分别为19.47%、16.34%、16.19%、16.69%、12.16%、11.72%、11.35%、10.23%。

表1 高寒退化草甸植被群落组成(重要值)及其植被特征比较分析Table 1 Comparative analysis of vegetation community composition (significance value) and vegetation characteristics in alpine degraded meadow
2.2 高寒退化草甸土壤理化参数的差异分析
未退化高寒草甸与退化高寒草甸的土壤理化存在显著的差异(表2)。从表2看到退化草甸的土壤全氮(TN)、有机质(OM)、土壤电导率(EC)显著低于未退化草甸,分别低 16.00%、35.38%、46.50%。土壤pH值则是显著高于未退化草甸,而土壤铵态氮(NH4+-N)、硝态氮(NO3−-N)、土壤水分(SM)并没有显著的差异。这些结果说明草地退化会对土壤理化性质产生显著的影响,且主要体现在土壤pH值和土壤有机质方面。
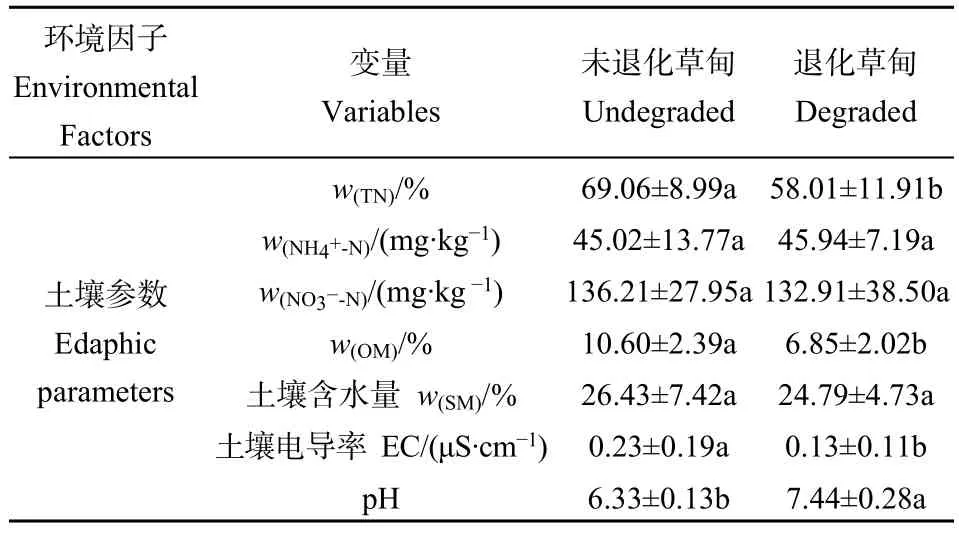
表2 高寒退化草甸土壤理化差异比较Table 2 The measured vegetation factors and edaphic parameters of undegraded and degraded alpine meadow
2.3 高寒退化草甸土壤细菌多样性分析
在三江源珍秦乡的未退化样地和退化样地的154个样本中,检测到土壤细菌2168457条序列,在97%的相似性水平下,154个样本得到71798种原核生物OTU(图2a)。通过韦恩图分析(图2b),发现土壤原核生物在未退化样地和退化样地共有3776个OTU,占总OUT的38.8%,退化样地独有的OTU有3658个,占总OUT的37.6%,未退化样地独有的OTU有2287个,占总OTU的23.5%。
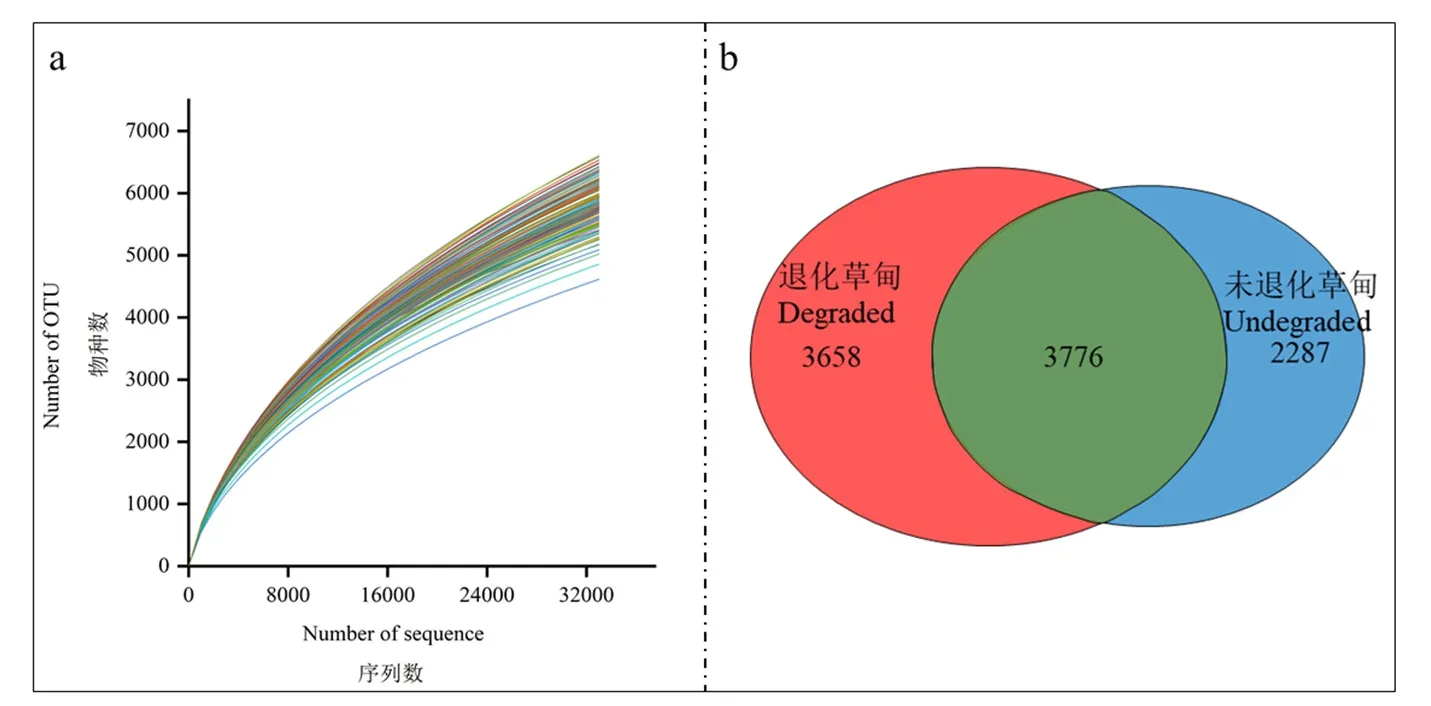
图2 高寒退化草甸土壤样品微生物OTU稀释性曲线和韦恩图Figure 2 Soil samples OTU dilution curve and Venn of alpine meadow degraded
对土壤细菌的α多样性进行分析,结果发现三江源区高寒退化草甸土壤细菌在两块样地之间存在显著差异(图3)。土壤细菌的物种丰富度指数(Observed Richness)、多样性指数(Shannon Index)、chao1指数都是未退化草甸显著高于退化草甸。

图3 高寒退化草甸土壤细菌α多样性分析Figure 3 α-diversity of soil bacterial of alpine meadow degraded
为了进一步探究土壤理化与土壤细菌多样性之间的相互关系,对细菌多样性与土壤理化性质进行了Pearson相关性分析(表3)。Pearson相关性分析表明土壤细菌α多样性与土壤理化之间的相关性相对较弱,在未退化草甸只有Simpson指数与铵态氮含量存在显著的负相关关系,而在退化草甸也仅只是Observed Richness与土壤电导率之间存在显著的负相关关系,这一结果说明草地退化导致的土壤理化的改变对于土壤细菌群落的多样性无显著影响。
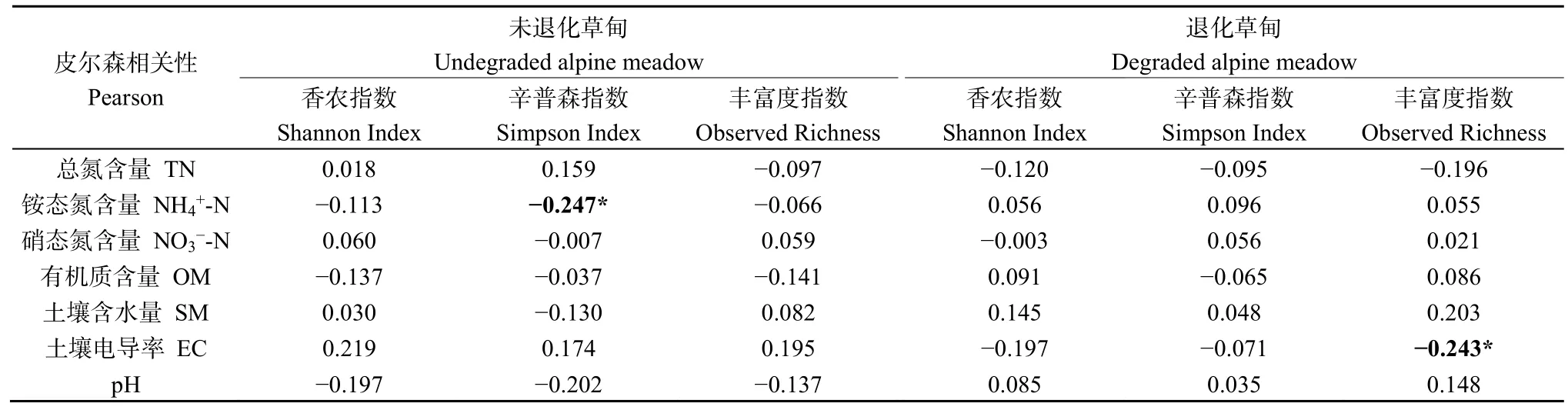
表3 高寒退化草甸土壤细菌α多样性与土壤理化相关性分析Table 3 The α-diversity of bacterial community correction with soil chemical in degradation meadow
2.4 高寒退化草甸土壤细菌群落组成
为了研究三江源区退化高寒草甸土壤细菌群落组成成分,使用 Greengene基因库对土壤细菌OTU进行注释,分别在门水平和属水平对土壤细菌组成成分进行比较(图4)。在门水平上(图4a),退化高寒草甸土壤细菌群落中变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)、拟杆菌门(Bacteroidetes)、疣微菌门(Verrucomicrobia)、奇古菌门(Thaumarchaeota)为主要优势菌门,其相对丰度超过 1%。在不同样地土壤中相对丰度最高的细菌菌门存在差异,如Actinobacteria和Bacteroidetes在退化草甸样地中的相对丰度高于未退化草甸样地,平均相对丰度分别为 25.02%,7.79%;而Verrucomicrobia在未退化草甸样地的相对丰度高于退化草甸样地,平均相对丰度为7.54%。土壤细菌属的研究表明(图 4b),在不同草甸样地土壤中可鉴定细菌属的总相对丰度比较均匀,平均相对丰度在39.72%。Spartobacteriageneraincertaesedis属在退化草甸和未退化草甸中相对丰度最高,分别为4.19%、6.42%。Nitrososphaera属在退化草甸中的相对丰度高于未退化草甸,为4.35%;Gaiella属在未退化草甸中的相对丰度高于退化草甸,为3.74%;其中,其他优势属Pseudonocardia、WPS-1genera incertaesedis、Gemmatimonas、Terrimonas在退化草甸和未退化草甸中相对丰度比较均匀,在1.11%—1.80%之间;Sphingomonas、Nocardioides、Arthrobacter属在退化草甸中相对丰度高于未退化草甸,分别为1.29%、1.04%、1.17%。
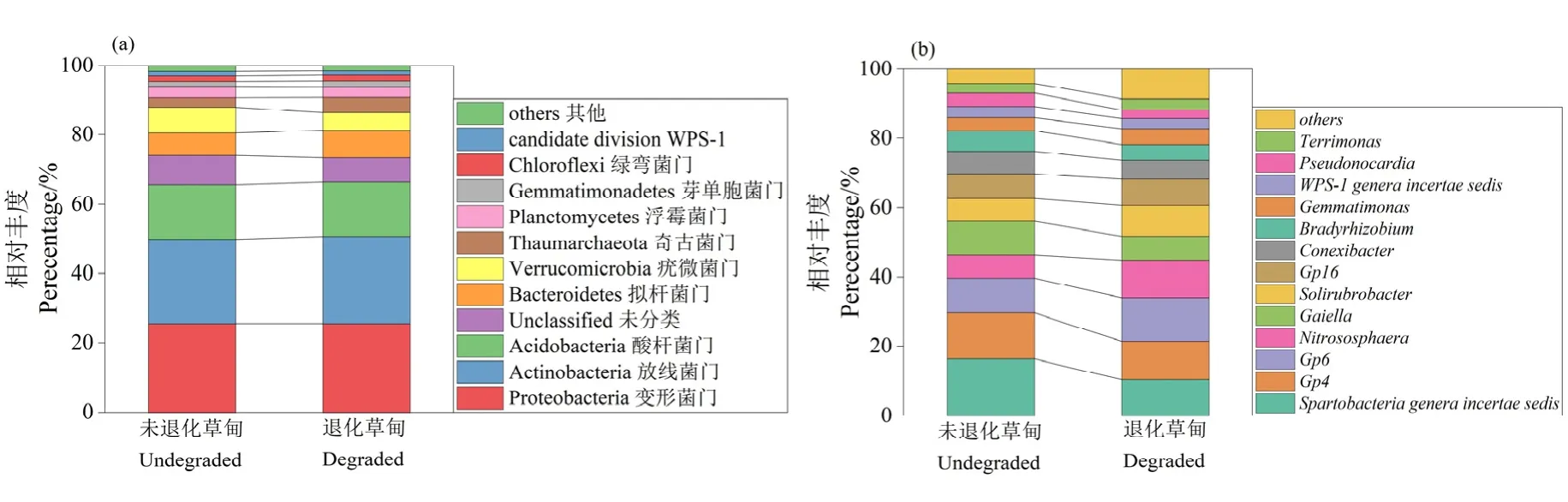
图4 高寒退化草甸土壤细菌群落组成Figure 4 Composition of soil bacterial community in alpine meadow degraded
2.5 高寒退化草甸土壤细菌群落结构
采用基于weighted UniFrac的PCoA方法对两个采样地的土壤细菌群落的进化多样性的差异进行研究分析;基于Bray-curtis距离矩阵的NMDS分析两个采样地的土壤细菌群落结构的差异,同时结合Bray Curtis距离和Jaccard距离的样本组间差异显著性检验(Dissimilarity)进行进一步验证(表4)。对两块样地土壤细菌PCoA的分析发现(图5a),主成分轴PC1可以解释24.26%的差异,PC2轴可以解释15.55%的群落差异,通过图5a看到,土壤细菌群落在两块样地的所有样本中能够明显区分,表明两块样地的土壤细菌群落存在明显的差异。
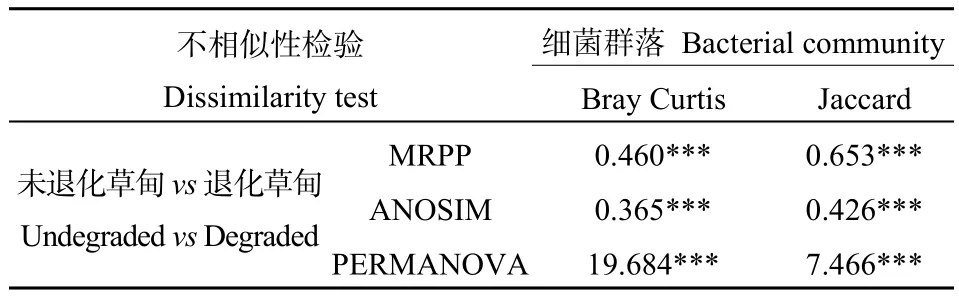
表4 高寒退化草甸土壤细菌群落的不相似性检验Table 4 Dissimilarity test of soil bacterial community in alpine meadow degraded
为了进一步研究高寒退化草甸土壤细菌群落 β多样性,基于Bary Curtis距离,利用NMDS方法对未退化高寒草甸和退化高寒草甸的土壤细菌群落β多样性进行分析。结果发现不同样地之间的土壤细菌存在显著的差异。基于Bray Curtis距离的土壤细菌群落NMDS图(图5b)可知,未退化高寒草甸与退化高寒草甸都可以明显区分,且未退化高寒草甸细菌群落内部更加聚集,而退化高寒草甸细菌群落内部比较松散,这些结果表明,高寒草甸退化会对土壤细菌群落结构产生显著的影响。Dissimilarity分析(表4)进一步表明土壤细菌群落在未退化样地和退化样地之间存在显著的差异。这一结果说明高寒草甸退化会改变土壤细菌群落的 β多样性。
2.6 土壤细菌群落与环境因子间的相互作用
土壤是土壤微生物的基质,土壤的理化性质和营养物质对于土壤中微生物的群落变化具有重要的作用,为了研究高寒退化草甸土壤细菌群落与土壤理化性质之间的相关关系,采用典范对应分析CCA方法对两块样地的土壤细菌群落与土壤理化性质进行相关关系分析(图 5c)。结果发现对于未退化高寒草甸样地和退化高寒草甸样地,土壤细菌群落与土壤总氮含量、硝态氮含量(有机质含量、pH值、电导率存在相关关系。Partial Mantel test检验结果(表5)进一步表明,对细菌群落影响最强的环境因子主要是土壤pH值、土壤有机质含量、土壤总氮含量。
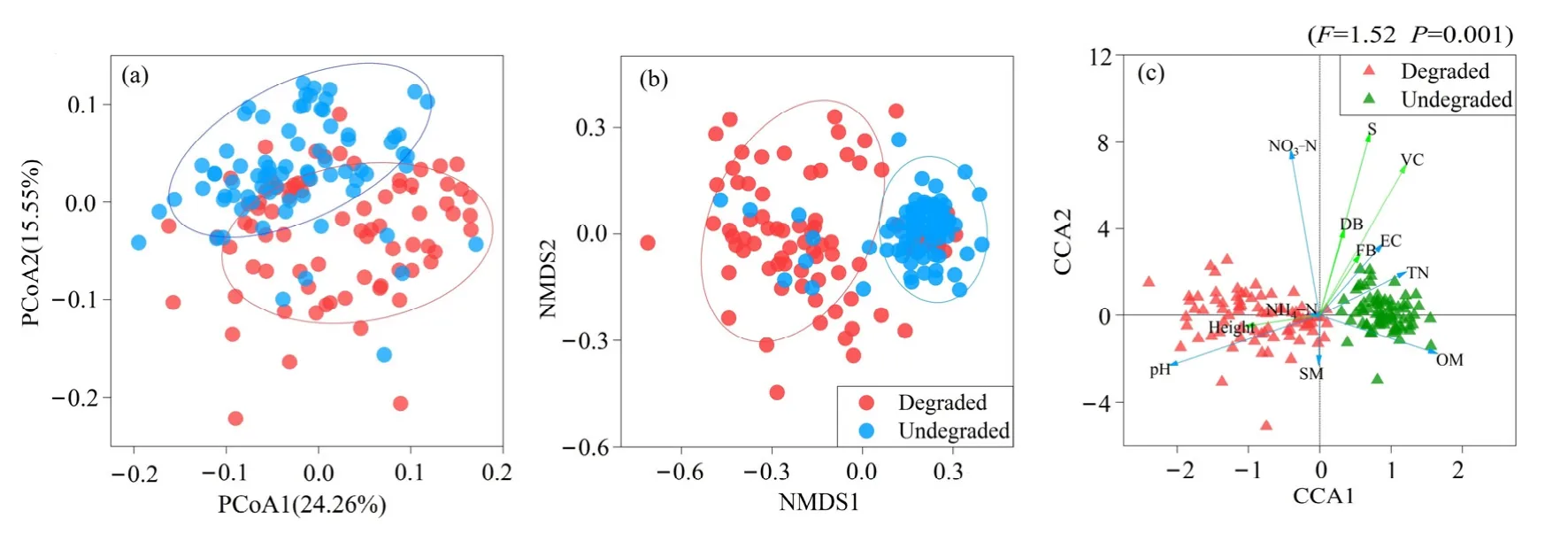
图5 高寒退化草甸土壤细菌群落结构和环境因子相关性Figure 5 Correlation between soil bacterial community structure and environmental factors in alpine degraded meadow
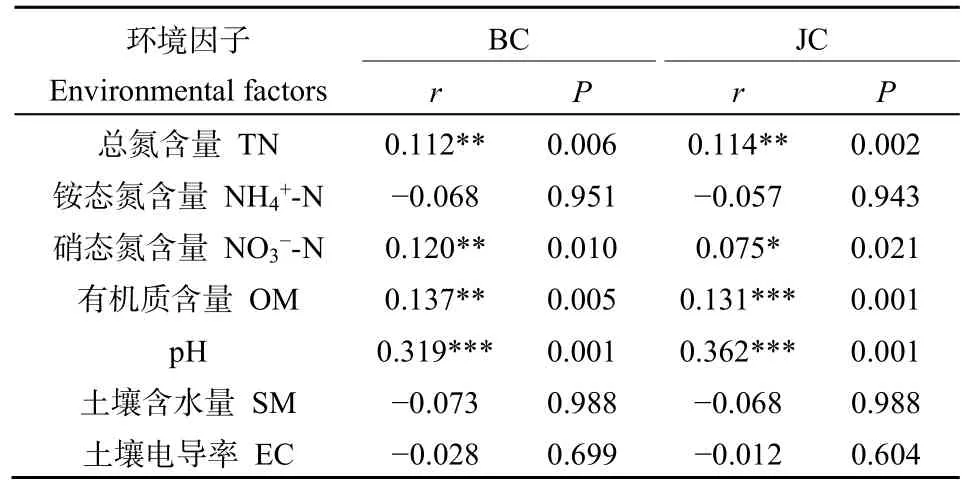
表5 土壤细菌群落差异与土壤理化的Partial Mantel检验Table 5 The correlation between the dissimilarity of soil bacterial communities and soil chemical using Partial Mantel test
3 讨论
3.1 高寒草甸退化对植被和土壤影响
草地土壤微生物在维持草地生态系统稳定中发挥着重要的作用,草地退化最直观的表现是影响地上植被群落,植被盖度和物种丰度的下降等,而土壤退化是草地退化的本质核心,土壤结构和营养组成的变化对于地下生物和地上的生物都会产生影响。本研究结果表明,草地退化显著降低了植被盖度、物种数和生物量,这与之前的研究一致(刘玉等,2013;陈乐乐等,2016),认为草地退化必然的后果是植被群落的改变,这可能与草地的放牧压力过大有关,由于家畜对优良牧草的采食,致使草地植被群落改变(李雪萍等,2020),同时鼠虫害也会影响植被群落的改变。同时,草地退化也会对土壤理化性质产生显著的影响,使得土壤更加贫瘠和向碱性化过渡(王英成等,2021)。
3.2 高寒草甸退化对土壤细菌群落多样性和物种组成影响
在草地退化过程中,全球环境的变化、放牧和土地利用方式的改变都会对土壤造成一定的影响进而影响到地下微生物的群落,在不同程度的退化草地,地下微生物的分布和群落也存在显著的不同(姚拓等,2006)。本研究结果发现,高寒草甸退化显著改变了土壤细菌群落的α多样性(图3)和β多样性(图5)以及群落组成(图4),这一结果与其他研究者对于青藏高原高寒退化草甸土壤微生物群落的研究相一致(Li et al.,2016;Zhou et al.,2019)。草地退化后,土壤细菌群落物种丰富度和多样性显著下降(图2),这可能是因为草地生态系统的逆向演替在一定程度上抑制了土壤细菌群落的生长和繁殖,进而导致土壤细菌群落多样性的减少。王启兰等(2007)研究认为高寒草地因其在低温条件下土壤冻结期长、通透性差等会对地下微生物群落活动产生较强的抑制作用,进而不利于土壤微生物的生长繁殖。另外,本研究发现随着高寒草甸的退化,土壤细菌在门水平和属水平上的群落组成会发生显著改变,其中,相对丰度较高的细菌群落菌门主要是变形菌门、放线菌门、酸杆菌门、拟杆菌门、疣微菌门、奇古菌门,这与多数对于高寒草地土壤微生物群落组成所得的研究结果基本一致(李海云等,2019)。有研究表明微生物的群落组成与微生物介导的生态功能有关(Bier et al.,2015;Che et al.,2015),根据本研究结果,推测高寒草甸的退化可能改变了微生物介导的生态功能,这一改变主要是通过改变微生物的群落组成实现而不是改变微生物的物种丰度。
3.3 高寒草甸退化土壤细菌群落与环境因子间的相互关系
土壤微生物群落的变化主要是因为土壤环境变量和其他活动的影响所造成的(Guo et al.,2018;Fan et al.,2020)。有研究表明,在草地生态系统中肥沃土壤的细菌含量是高于贫瘠土壤的,而这一变化主要是通过土壤中氮元素的调控所实现的(Bardgett et al,1997),草地退化引起的植被物种和生物量的减少,在一定程度上减少了凋落物和根源碳氮输入到土壤中,进而影响土壤微生物基质的有效性(Wu et al.,2014),因此,认为草地退化引起的植被物种组成和生物量的减少会对微生物群落产生影响。另一方面,草地退化使得高寒草甸的优势物种莎草科植被减少,这可能也是造成微生物变化的一个原因,已有文章报道植被物种对于微生物有选择性效应(Haney et al.,2015)。Guo et al.(2015)研究发现在高寒草地土壤微生物群落结构主要是受控于温度、土壤养分、水分和植被类型,Han et al.(2018)研究发现植被类型也是一个影响微生物群落结构变化的重要影响因子。但在高寒草地系统中,土壤原核生物与植被多样性之间的相关性较弱,而与土壤异质性存在较强的相关性,草地退化导致土壤性质的变化,进而显著影响土壤细菌群落,不同的微生物在生物地球化学循环中表现出不同的生态功能,而微生物群落结构可以显著影响生态过程(Allison et al.,2013)。本研究结果表明随着草甸的退化,土壤pH值会发生明显变化,且驱动退化高寒草甸土壤细菌群落的主要环境因子是土壤pH值(图5c)。这与其他研究结果一致,在多种土壤生态系统中pH值通常与细菌群落有显著的相关性,当土壤pH值偏离中性时,地下微生物群落便会受到环境胁迫压力,微生物多样性也因环境胁迫的选择而降低(Wang et al.,2017)。高寒草地退化过程中植被和土壤质地都会产生明显的变化,这种变化在一定程度会对地下土壤细菌群落产生一定的影响。综上可知,高寒草地退化不但引起地上植被群落和土壤质地的变化,也会显著影响土壤微生物群落结构发生变化,因此探究高寒草地退化过程中土壤微生物群落活动变化机制对于草地恢复具有重要意义。
4 结论
草甸退化对地上植被群落结构、土壤理化性质和土壤细菌群落多样性和结构都产生了显著的影响。其中,草地退化降低了土壤全氮、有机质和电导率含量,增加了土壤pH值。另外,草地退化显著降低了土壤细菌群落的α多样性,并改变了细菌群落物种组成和群落结构。土壤异质性对土壤细菌群落有一定的影响,驱动土壤细菌群落变化的主要环境因子是土壤pH值、有机质含量和总氮含量。
