植物生长调节剂对云南松苗木根系形态的影响
2022-06-25蔡年辉唐军荣李亚麒陈诗陈林许玉兰李根前
蔡年辉,唐军荣,李亚麒,陈诗,陈林,许玉兰,李根前
(1.西南林业大学西南地区生物多样性保育国家林业局重点实验室,云南 昆明 650224;2.西南林业大学西南山地森林资源保育与利用教育部重点实验室,云南 昆明 650224;3.云南省农业科学院热带亚热带经济作物研究所,云南 保山 678000)
平茬去顶是林木采穗圃营建的主要措施,通过打破植物的顶端优势,促进植物更好地利用光热资源并获取更多养分,最大限度地提高产量和改善品质[1]。但去顶减少植株光合器官叶的数量,导致光合碳同化能力短时间内受限,其增产的效果会部分受抑[2-3]。而植物生长调节剂可影响植物的生长发育,其研究报道较多[4-5]。根系是树木代谢最旺盛的组织[6],已有证据表明,地上部分的干扰如去叶对根系生长的影响存在种间差异[7],但目前对根系形态如何响应平茬(地上部分干扰)的了解仍然有限。平茬后植株地上(包括叶、枝、干)被剪取部分,光合器官减少,碳短时间供应不足的情况下根系生长响应存在种间差异[7]。吲哚乙酸(IAA)和6-芐基腺嘌呤(6-BA)分别作为生长素类和细胞分裂素类植物生长调节剂,对植物生长发育有着重要调控作用,也会改变植物体内细胞分裂素水平[8-9],植物生长调节剂的施用对平茬后植株根系生长的影响仍然不清晰。前期研究报道表明,施用植物生长调节剂可促进云南松苗木的生长[10-11]。张薇等[12]揭示了云南松苗木萌蘖受植物生长调节剂的影响,但从生物量分配及其根系形态可塑性方面来探讨平茬后云南松苗木响应的研究并不多[13],尤其是平茬后植株根系对植物生长调节剂响应的研究鲜见报道。鉴于此,本研究以云南松苗木为研究材料,通过对云南松苗木设定9个不同组合的植物生长调节剂喷施,统一平茬高度,研究吲哚乙酸(IAA)、6-苄胺基嘌呤(6-BA)对平茬后云南松苗木根系形态的影响,探讨云南松苗木对不同质量浓度IAA与6-BA配施的响应,以期为IAA与6-BA配施调控云南松苗木根系形态提供理论依据。
1 材料与方法
1.1 试验材料
试验用种采自云南省弥渡县云南松无性系种子园,于2018年3月在云南省弥勒县吉成园林苗圃培育苗木,单株移苗定植于育苗盆中(规格16 cm底径×20 cm高),基质为生土与腐殖土按1∶2混合而成,移苗后采用相同的水肥管理和栽培措施培育1 a,平茬前试验苗木平均苗高19 cm、平均地径20 mm,平茬高度设定10 cm(平茬高度是根据预试验的研究结果确定)。
1.2 试验设计
试验采用两因素三水平3×3完全随机区组设计,即IAA与6-BA共两因素各3个水平(表1中的下标分别用1、2、3示意),另外依据前期研究[10-11]及预试验结果确定喷施质量浓度,即高、中、低3个梯度,高为中的2倍、低为0(作为对照)[14],由表1所示,9个处理,每个处理40株,重复3次。配置好的IAA与6-BA溶液采用叶面喷施法,喷施时间为每日上午10:00—11:00,喷施以针叶浸湿并刚有液体下滴为宜[15-16](每个处理每个重复200 mL),每周喷施1次,连续喷施4周。
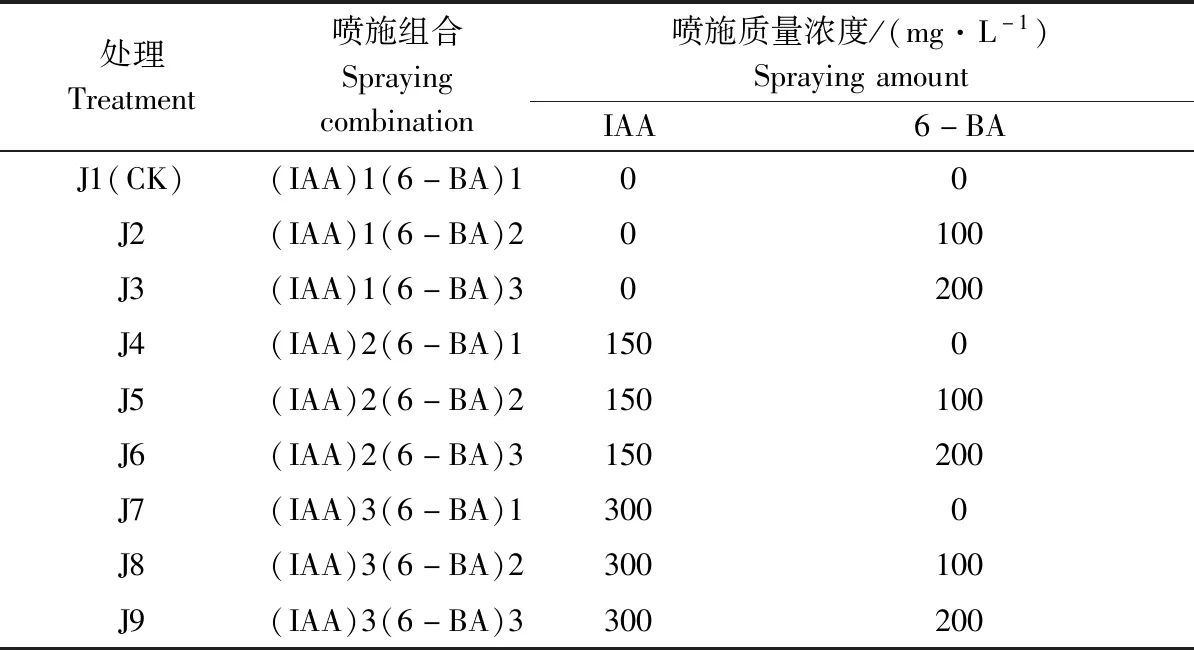
表1 IAA和6-BA处理组合Table 1 Different treatments of the plant growth regulators IAA and 6-BA for Pinus yunnanensis seedling
1.3 指标测定
经一个生长季后,于2019年12月从每个处理每个重复随机取3株[17],取样前测定苗高、地径,取样时将植株根系整体从盆中取出,避免损伤以保证其完整性,用剪刀将根系从根茎处剪下,将植株地上部分与地下根系分开[17],自来水冲去根系泥土并稍作晾干后,用直尺测量其主根长(0.01 cm),然后将根系放在Epson扫描仪中进行扫描,获得根系扫描图像后用WinRHIZO分析软件获取根系形态指标[5],包括总根长(TRL/cm)、根表面积(RSA/cm2)、根平均直径(RD/mm)和根总体积(RV/cm3)。最后,将植株的地上部分及扫描后的所有根系放入烘箱,其中根系分主根、侧根(含侧根上的支根),105 ℃杀青30 min后,于80 ℃烘至质量恒定,称取各部位(主根、侧根、地上部分)干质量即为生物量,精确至0.001 g,获得主根生物量(MRB/g)、侧根生物量(LRB/g)、地上部分生物量(AB/g)。
1.4 数据分析
通过根系扫描形态指标和生物量指标,计算根生物量(主根生物量+侧根生物量,RB/g)、主根生物量/侧根生物量(MRB/LRB)、根冠比(根生物量/地上部分生物量,AB/RB)、比根长(总根长/根系生物量,SRL/(cm·g-1))、比表面积(根面积/根系生物量,SRA/(cm2·g-1))、根组织密度(根系生物量/根体积,RTID/(g·cm-3))和根细度(总根长/根体积,RFN/(cm·cm-3))[17-19]。采用SPSS 17.0进行IAA、6-BA及其交互作用对根系形态生长影响效应的双因素方差分析,利用Duncan多重比较不同处理之间的差异显著性进行检验(a=0.05)[15,19],用Pearson线性相关系数进行相关性分析[15],用平均值±标准误差进行绘图[17]。异速生长关系以幂函数(Y=βXα)来描述,分析时转换为lgY=lgβ+α·lgX,其中:方程斜率α异速生长指数;β是回归常数;x、y为研究属性值即生物量[20-21]。采用标准化主轴回归分析(standardized major axis,SMA)计算方程的斜率α,并比较斜率之间及其与1.0的差异性[1,22],SMA分析采用R语言的SMATR模块完成[23-24]。利用EXCEL整理汇总数据。
2 结果与分析
2.1 IAA和6-BA对云南松苗木根系生长的变异来源分析
由表2可以看出,IAA和6-BA相互作用对云南松苗木的根表面积影响达极显著水平(P<0.01),对总根长、根总体积、侧根生物量和根生物量的影响达显著水平(P<0.05),而对其余指标均无显著相互作用(P>0.05)。从IAA单独喷施来看,对测定指标均无显著影响。从6-BA喷施单个因素来看,除根表面积外,6-BA对云南松苗木其余指标的影响均未达到显著水平。
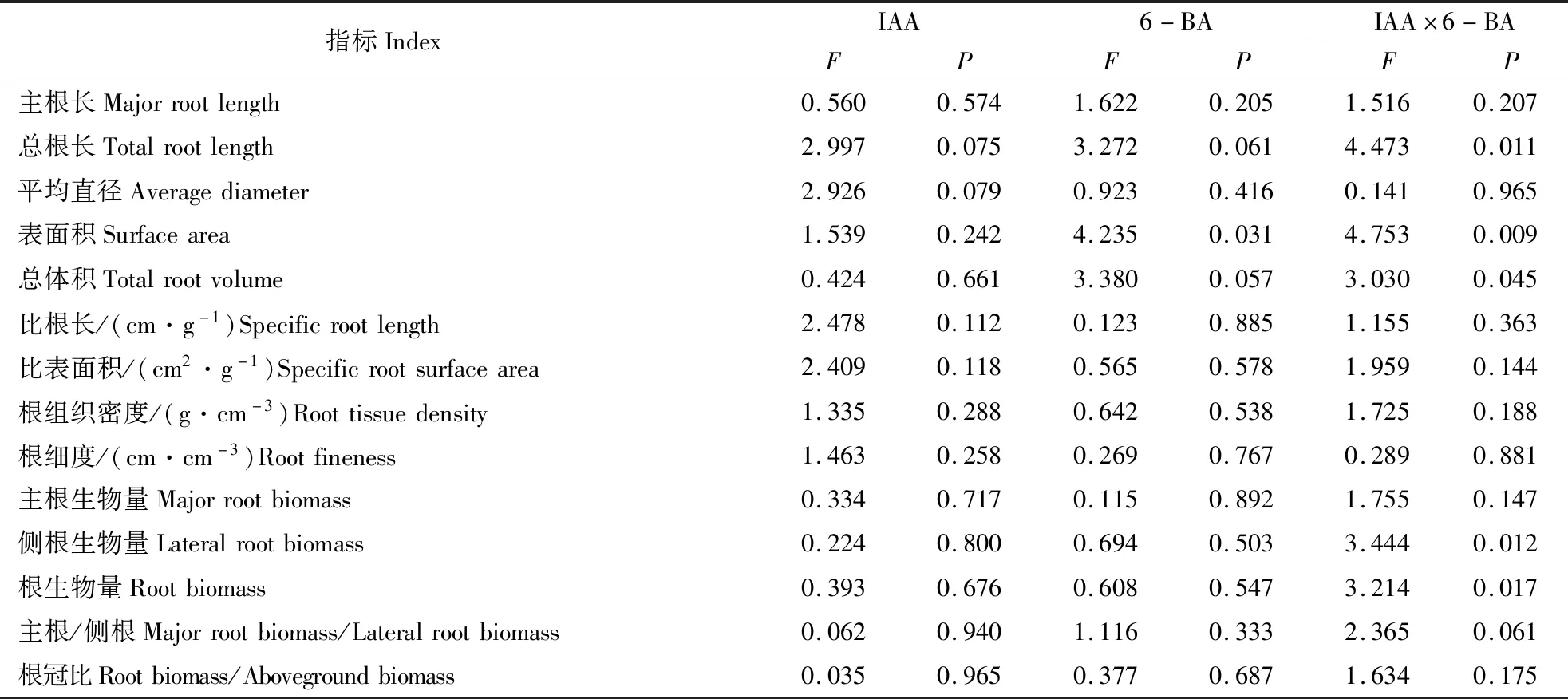
表2 IAA和6-BA对云南松苗木各测定指标影响的双因素方差分析Table 2 Two-way variance analysis of plant growth regulators IAA and 6-BA on the different determination index of Pinus yunnanensis seedlings
2.2 IAA和6-BA对云南松苗木根系形态生长的影响
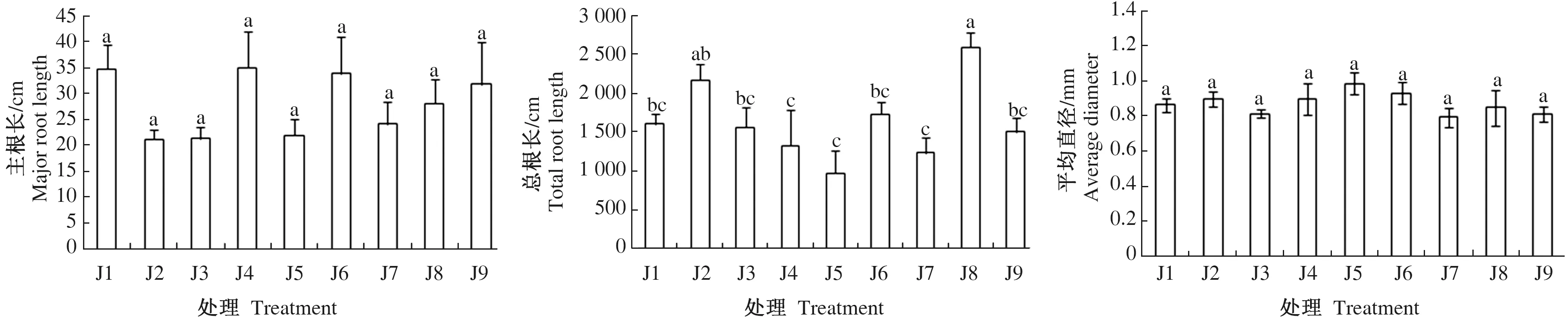
由图1可知,不同质量浓度的IAA和6-BA对云南松苗木主根长、平均直径和根细度的影响不显著(P>0.05)。总根长、表面积、总体积、比根长、比表面积在低质量浓度IAA和高质量浓度IAA情况下均随6-BA的质量浓度增加呈现先上升后下降的趋势,而在中质量浓度IAA浓度下随6-BA的质量浓度增加呈现先下降后上升的趋势,以J5最低,而J8和J2较高。根组织密度呈现相反的趋势,即在低质量浓度IAA和高质量浓度IAA情况下,随6-BA的质量浓度增加呈现先下降后上升的趋势,而在中质量浓度IAA下,随6-BA的质量浓度增加呈现先上升后下降的趋势,以J5最高,而J8和J2较低。总的来看,不同质量浓度IAA和6-BA的施用对云南松苗木根系形态有一定的影响,但不同处理的响应存在差异。
2.3 IAA和6-BA对云南松苗木根系生物量的影响
由图2可知,不同质量浓度IAA和6-BA对云南松苗木主根生物量和根冠比的影响不显著(P>0.05)。侧根生物量和根生物量均表现为低质量浓度IAA下随6-BA的质量浓度增加呈现逐渐下降的趋势,在中质量浓度IAA下随6-BA的质量浓度呈现逐渐上升的趋势,在高质量浓度IAA下随6-BA的质量浓度增加呈现先上升后下降的趋势,以J8最高,而J3和J7较低,其中J8与J3间有显著差异(P<0.05)。总的来看,不同质量浓度IAA和6-BA的施用对云南松苗木根系生物量的影响不明显。从结果还可知,主根生物量均低于侧根生物量,但主根生物量与侧根生物量在各处理间存在不同的变化趋势,其中主根生物量在不同处理间差异不显著,而侧根生物量表现为J8显著高于J3、J5和J7。侧根生物量的差异导致根生物量在不同处理间差异显著。从根冠比可以看出,地上部分生物量远远大于根生物量,根生物量占单株生物量1/4左右,且不同处理间的根冠比差异不显著。
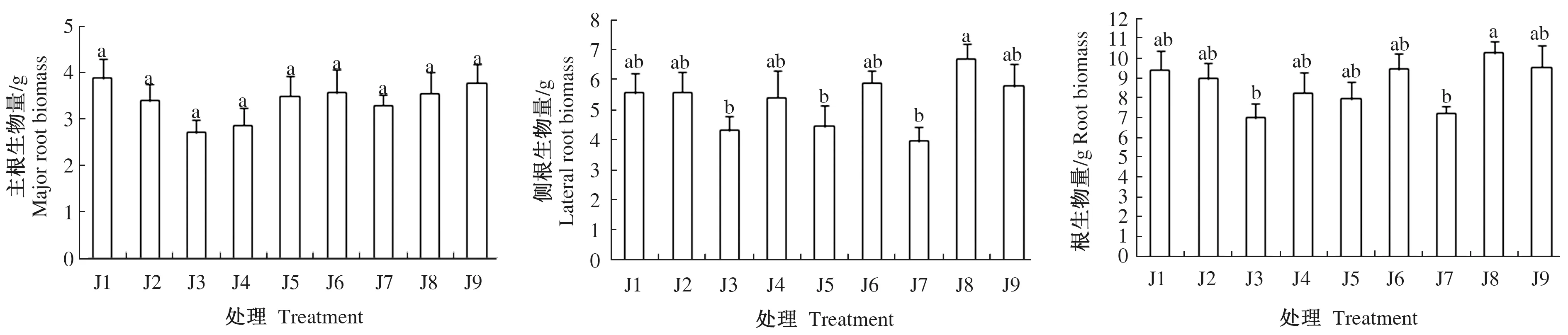
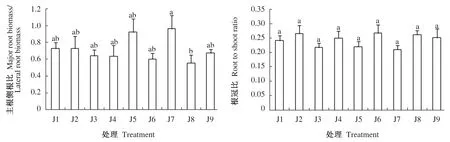
图2 IAA和6-BA对云南松苗木根系生物量的影响Fig.2 Effect on the root biomass allocation index of Pinus yunnanensis seedlings treated with different plant growth regulators IAA and 6-BA
2.4 IAA和6-BA施用下云南松苗木根系生物量间的异速生长关系
由表3可知,云南松苗木主根生物量与侧根生物量间呈等速生长关系,各处理异速生长指数并无显著差异,且存在共同斜率(0.904),沿共同斜率出现显著的负向移动。根生物量与地上生物量间、根生物量与单株生物量间呈现异速生长关系,其中J7和J9的根生物量与地上生物量间均为异速生长关系,J1、J4和J9的根生物量与单株生物量间均呈异速生长关系。从根生物量与地上生物量间、根生物量与单株生物量间异速生长指数来看,J1、J3、J4、J5和J9的均显著高于J7和J8。
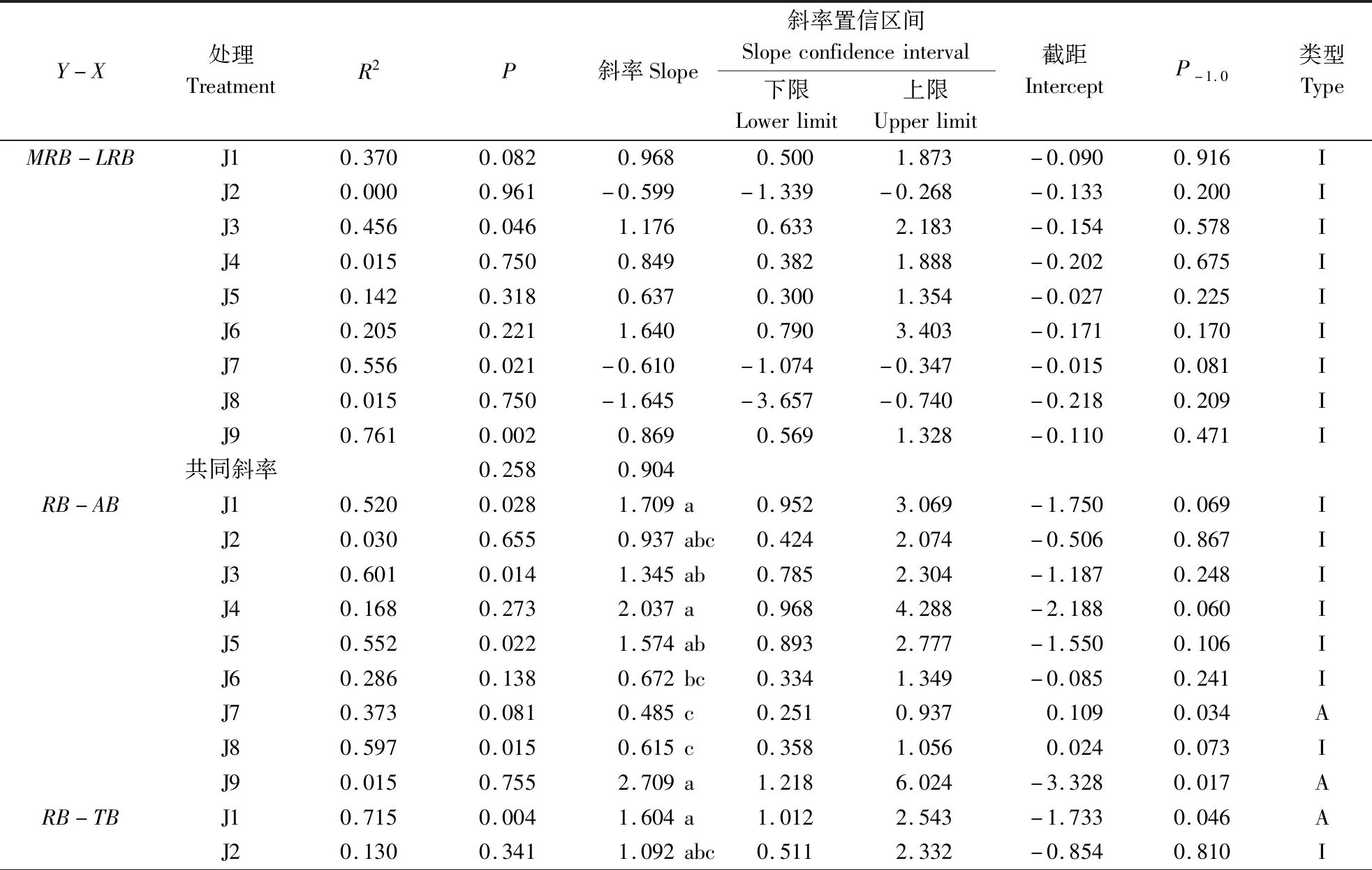
表3 云南松苗木根系生物量间的异速生长关系Table 3 The allometric relationship of root biomass of Pinus yunnanensis seedlings
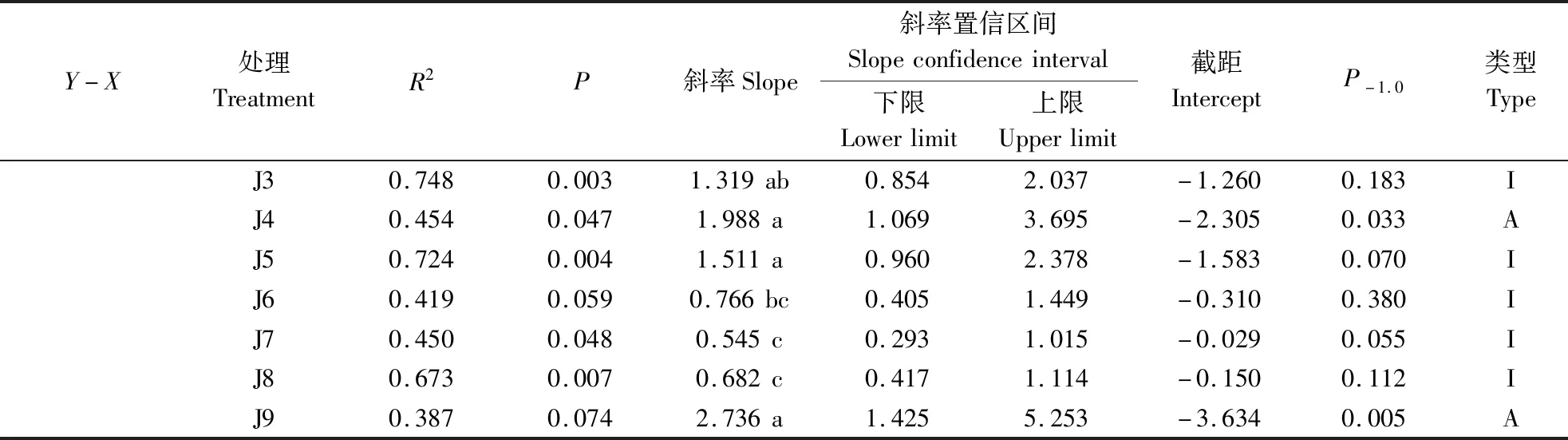
续表Continuing table
2.5 IAA和6-BA施用下云南松苗木根系指标间的相关性
施用IAA和6-BA后云南松苗木根系生长指标相关性分析表明(表4),主根长、总根长、平均直径、表面积和总体积根系形态指标中,除根长(主根长与总根长)与平均直径间呈负相关关系外,其它两两指标间均呈正相关关系,其中总根长与表面积和总体积间的相关性达极显著水平(P<0.01),即表面积和总体积随总根长的增加而增加。
从表4也可以看出,比根长、比表面积、根组织密度和根细度各两两间的相关性分析表明,除根组织密度和根细度间的相关性不显著外(P>0.05),其余两两间的相关性均达极显著水平(P<0.01),表现为比根长与比表面积间、比根长和比表面积与根细度间为极显著正相关,而比根长和比表面积与根组织密度间为极显著负相关,即比根长和比表面积增加的同时,根细度随之增加,而根组织密度降低,反之亦然。
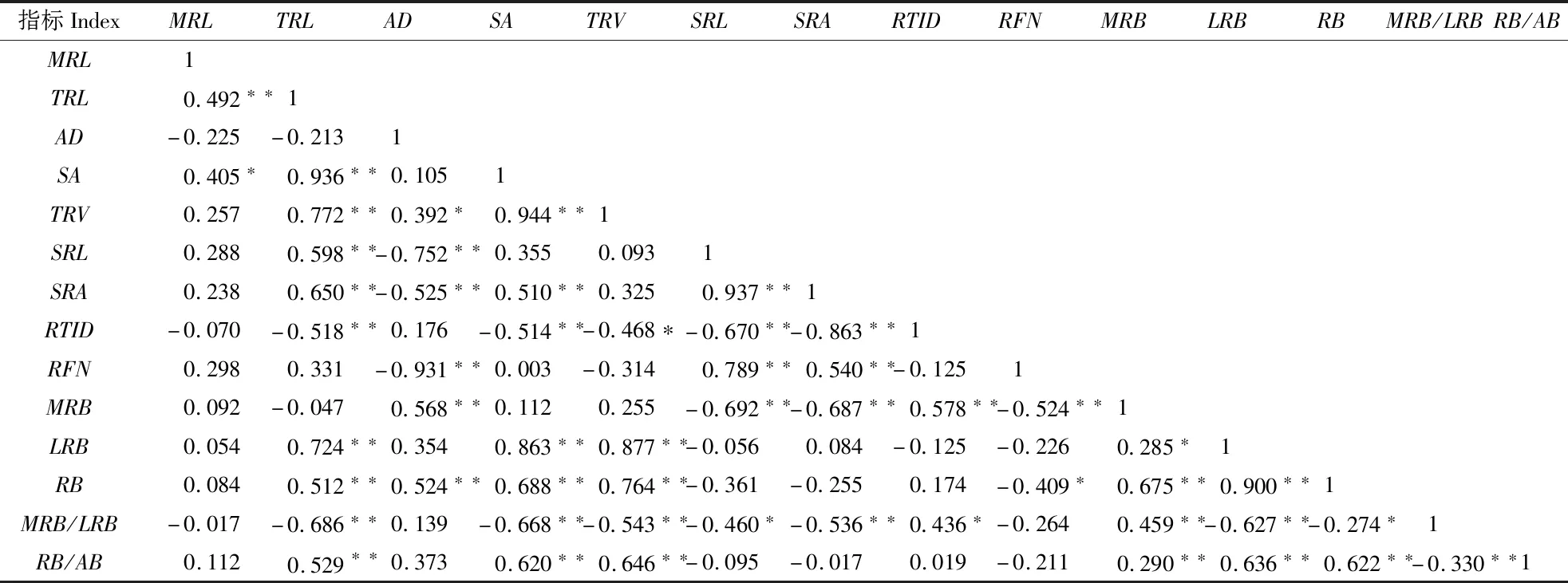
表4 云南松苗木根系生长各指标间相关系数Table 4 Correlation coefficient between root growth index of Pinus yunnanensis seedling
根生物量与根系形态指标间(主根长、总根长、平均直径、表面积和总体积)也存在正相关关系,其中根生物量与总根长、平均直径、表面积和总体积间为极显著正相关关系(P<0.01),即总根长增加,根系的表面积、总体积、比根长、比表面积等也随之增加,进而根生物量和根冠比也增加,反之亦然。相关性分析也表明,根系粗度(平均直径)与根生物量间也呈极显著正相关关系(P<0.01)。
3 结论与讨论
根系是植株吸收养分与水分的重要器官,其生长状况直接决定着植株吸收养分和水分的能力[17],其中,根长、表面积、总体积、直径及结合生物量的综合评价,如比根长、比表面积、根组织密度和根细度,是衡量根生长的重要指标[5,17]。本研究表明,在云南松苗木平茬后,不同处理间主根长、平均直径、根细度、主根生物量和根冠比无显著差异,而表面积、总体积、比根长、比表面积等根系形态表现出一定的差异,这可能是云南松苗木通过根系形态代表根系生物量或根冠比来响应IAA与6-BA的喷施,即根系形态的调整更敏感,这与云南松在不同种源干旱胁迫研究结果相同[13]。比根长和比表面积分别作为单位质量根系的长度和面积,可以表征根系生理与形态功能的重要指标[25],其增加可提高单位面积土壤中的根系生物量[26],是根系强化策略的一个形态指标并得到广泛应用[27],如高成杰等[13]用于分析干旱胁迫下云南松苗木的根系形态,揭示在干旱胁迫条件下各种源云南松幼苗根长、比根长、根表面积和比根面积在干旱胁迫下增加明显;荣俊冬等[26]用于分析施氮条件下的根系响应,表明氮素能促进根长、根表面积、根体积和根直径的增加。本研究中,J5的根系形态特征包括总根长、根表面积、总体积、比根长和比表面积显著低于J2和J8,即对于平茬后的云南松苗木;在中质量浓度的IAA下,不施用6-BA或施用高质量浓度的6-BA更有利于根系的生长。根细度是总根长与根体积的比值,其值变化可反映根的粗细[19,28]。从本研究来看,不同处理间的根细度无显著差异,同平均直径的变化趋势一致,表明施用植物生长调节剂没有改变根系的粗度,但根系的总长度发生变化,进而表面积、总体积及相关的比根长、比表面积、根组织密度等也发生改变。由此表明,根系生长对植物生长调节剂喷施的响应主要表现在根系的伸长生长。
根冠比是植株对土壤水分利用情况的生长状态指标之一[17]。由研究结果可以看出,不同处理间根冠比无显著差异,这可能是云南松苗木维持正常生长的资源分配策略,这样的根冠比在云南松其他研究中也有报道,李亚麒等[29-30]揭示不同生长等级间2 a生云南松苗木的根冠比间差异不显著,不受分级标准或分级数量所影响;汪梦婷等[31]研究表明不同家系间的2 a生云南松苗木根冠比也无显著差异。另一方面,本研究中的根冠比约为0.25,对比前期研究[29-34],本研究中根冠比增加,根系生长优势比较明显,这种分配可能是植株受胁迫情况下的一种响应策略,以利于根系获得更多的养分与水分,实现根冠补偿能力[17]。生物量最优分配理论认为,植物在某一资源成为限制性资源时,会优先将代谢产物分配给可以获得限制性资源的器官,如养分或水分受限时则优先分配到根[32,35]。因此,云南松苗木平茬后,根系的生长受限,将根系的投资增加,以增强植株对资源的竞争能力。与此同时,平茬后破除了云南松苗木的顶端优势,同时也减少了光合器官数量,短时间内可能导致光合碳同化能力受抑[1],进而影响地上部分的生长。云南松苗木地上部分平茬引起的损失在短时间内可能没有恢复,地上部分生物量降低,从而根冠比上升,而恢复时间的长短需要进一步跟踪测定。但相比其他树种[36-37],云南松苗木的根冠比低,生物量异速分配理论认为植物个体较小时,植株倾向于叶分配[38-39],从这个角度来看,2 a生苗木可能个体相对较小,因此将更多的资源分配给叶,以制造更多的有机物质来满足自身生长的需要[32],有限的证据显示地下生物量比例较低的树种地下组分生长对去叶更加敏感[7],由此推测,云南松低的根冠比可能是对地上植株平茬响应的原因之一,在其他研究中也表明去顶对地下构件生物量分配产生明显的影响[1],即植株可通过调节自身地上和地下生物量来适应环境变化[17]。
根系生物量分配策略是植物对环境响应的重要表现形式[17]。本研究中主根生物量均低于侧根生物量,且主根生物量在不同处理间差异不显著,而侧根生物量在不同处理间差异显著,根生物量在不同处理间也表现为显著差异。这可能是由于主根与侧根的功能不同,主根作为高级根,主要行使储存与运输功能[6],而侧根与土壤环境接触较为紧密,会因植株的生长需求及环境条件的改变发生可塑性变化[5,19,40-41]。不同处理主根长度没有显著差异,可能是由于云南松属于深根性植物[20],主根的生长需要达到一定程度后才能满足自身需要,而当达到相当的深度后便不再继续生长,而更多的资源分配到侧根或其他部分,表现为主根生物量、主根长度没有差异而侧根生物量、根生物量和总根长在不同处理间有差异。这样的差别也影响到根表面积和总体积,但平均直径不受影响,表现为不同处理间差异不明显。
各根系生长指标间存在着较强的相关性,但各指标间的相关性并非完全一致,云南松苗木主根发达,主根生长后引起总根长、根表面积、根体积等的增加,苗木彼此协同促进,根系形态改善促进干物质积累[5],即云南松苗木根系生物量(包括主根生物量、侧根生物量和根生物量)和根冠比也相应提高,但主根生物量的增长速度低于侧根生物量。同样,根生物量的增长速度也低于根体积的增长速度,导致根组织密度与大多数根系指标间呈负相关关系。根长(包括主根长和总根长)与平均直径间呈现负相关关系,表明资源有限的情况下,根系的伸长生长与加粗生长间是相互拮抗的[16,42]。本研究中,主根长的变化不明显,根系的伸长生长主要表现在侧根上,侧根长度增加可促进表面积、总体积、比根长、比表面积的增加,进而根生物量和根冠比也增加,表现为促进作用。总根长与进一步比较各根系生物量间的生长关系以判断异速生长轨迹是否发生改变[22],研究表明,各处理间侧根生物量与主根生物量间的关系均表现为等速生长关系,而根生物量与地上生物量、根生物量与单株生物量间的异速生长关系在各处理间表现不一致,其中J9表现为异速生长关系,表明高浓度的IAA和6-BA对促进根系干物质积累的相对速度较大,但不同处理间生长关系表现不一,推测IAA和6-BA根系可塑性的影响较为复杂,这种异速生长关系的不一致在云南松的研究也有报道[20,22,32]。本研究仅分析了云南松苗木平茬后施用IAA和6-BA对根系形态及其生物量的影响,而不同根序、细根的响应规律可能存在差异[40-41],且仅测定了根系形态指标,而形态指标的调控较为复杂[43-45],且研究结果是针对IAA与6-BA特定质量浓度喷施下的获得的,今后可继续开展相关研究,以进一步揭示根系形态的可塑性及其调控特征。
综上所述,在云南松苗木平茬后,施用不同质量浓度的IAA与6-BA各处理间主根长、平均直径、根细度、主根生物量和根冠比无显著差异(P>0.05),当IAA质量浓度为300 mg·L-1与6-BA质量浓度为100 mg·L-1配施时,云南松总根长、根表面积、根体积、比根长、侧根生物量和根生物量均较其他处理显著提高。不同处理没有改变云南松苗木主根生长(主根长和主根生物量)以及根冠比投资分配,对外界的响应集中体现在侧根生长上,且主根生长速度低于侧根生长速度,生物量投资上也体现主根生物量低于侧根生物量。云南松苗木根系指标间存在一定的相关性,彼此相互促进或拮抗,共同响应植物生长调节剂的添加。
